Physikalisches Institut der Universität Bayreuth
Werbung

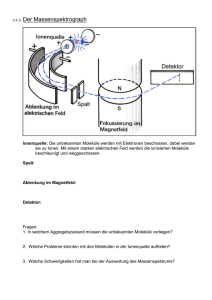
Physikalisches Institut der Universität Bayreuth PHYSIKALISCHES PRAKTIKUM FÜR FORTGESCHRITTENE FLUORESZENZ-KORRELATIONSSPEKTROSKOPIE Lehrstuhl Experimentalphysik 4 Inhalt Seite 1. Einleitung und Aufgabenstellung 2 2. Theorie 2 3. Gerätebeschreibung 5 4. Fluoreszenzfarbstoffe 6 5. Probenvorbereitung 7 6. Vorsichtsmaßnahmen 7 7. Aufgaben 8 8. Fragen zur Vorbereitung 10 9. Literatur 10 Version 5-2012 1. Einleitung und Aufgabenstellung Gegenstand dieses Praktikumsversuches sind die theoretischen Grundlagen, das Messprinzip, der Messaufbau und Anwendungen der konfokalen FluoreszenzKorrelations-Spektroskopie. Es soll vermittelt werden, welche Anforderungen an einen Versuchsaufbau zur Untersuchung von Einzelmolekülen in Flüssigkeiten zu stellen sind und welche Messgrößen zugänglich sind. Untersucht wird in diesem Versuch der Einfluss von Triplettzuständen auf das Fluoreszenzverhalten („Triplett Blinking“) und das Diffusionsverhalten von Fluoreszenzmarkierten Polymerkügelchen (Beads) als Funktion der Teilchengröße. Dazu muss zunächst der Strahlengang justiert und das Probenvolumen mit Hilfe des Farbstoff Rhodamin kalibriert werden. In Abhängigkeit der Anregungsintensität sollen Intensitätsänderungen in der Autokorrelationsfunktion mit Hilfe von Triplett-Blinking diskutiert werden. 2. Theorie A. Fluoreszenzkorrelationsspektroskopie Die Fluoreszenz-Korrelations-Spektroskopie (FCS) ist eine spektroskopische Technik zur Untersuchung von thermodynamischen und kinetischen Eigenschaften von Molekülen in (wässriger) Lösung. FCS basiert auf der Analyse von Intensitätsfluktuationen des Fluoreszenzsignals F(t). Diese Fluktuationen werden durch die zufällige Bewegung (Brownsche Bewegung) von Molekülen durch das Anregungsvolumen hervorgerufen (s. Abb. 1). Befindet sich ein Fluoreszenzmarkiertes oder autofluoreszierendes Molekül im Anregungsvolumen, so werden diese Moleküle zur Fluoreszenz angeregt und die emittierten Photonen können mit einem empfindlichen Detektor registriert werden (s. Abb. 2). Brownschen Bewegung Anregungsvolumen der Moleküle befindlichen ändert Moleküle sich ständig die und Aufgrund der Anzahl das der im detektierte Fluoreszenzsignal fluktuiert mit δF(t). Voraussetzung für die Auflösung dieser kleinen Intensitätsfluktuationen ist, dass das beobachtete System so klein wie möglich ist. 2 Dieses kann durch eine Minimierung des Anregungsvolumens (= konfokaler Aufbau) und durch sehr geringe Molekülkonzentrationen erreicht werden. Das detektierte Fluoreszenzsignal wird dann mit Hilfe einer Korrelationsanalyse statistisch ausgewertet. Die normierte Fluoreszenz-Autokorrelationsfunktion G(τ) läßt sich in Abhängigkeit von der Intervallzeit τ folgendermaßen ausdrücken: 2 G(τ) = ⟨δF(t) δF(t+τ)⟩/⟨F(t) ⟩ + 1 (1) Die zu analysierenden Intensitätsfluktuationen können durch die Diffusion der Moleküle, aber auch durch chemische Prozesse hervorgerufen werden, wobei allerdings die Diffusion der fluoreszierenden Moleküle durch das Anregungsvolumen die stärksten Fluktuationen induziert. Die mittlere Aufenthaltsdauer eines Moleküls im Anregungsvolumen wird dann durch die Zerfallszeit von G(τ) beschrieben, während die Amplitude G(0) umgekehrt proportional zur mittleren Anzahl der Moleküle N im Anregungsvolumen ist. G(0) = ⟨N⟩ -1 (2) Für frei diffundierende Teilchen kann Gl. (1) überführt werden in G( τ) = 1 + 1 ⋅ c⋅V 1 1 ⋅ 4D 1+ τ 1 + 4D τ 2 w z2 (3) wobei c der lokalen Konzentration im Beobachtungsvolumen V (V mit der lateralen Ausdehnung w und der axialen Ausdehnung z) entspricht. D ist die Diffusionskonstante. Ist z >2w (z>>w), so wird die Autokorrelationsfunktion von der Diffusion in lateraler Richtung dominiert, d.h. G( τ) ≈ 1 + 1 ⋅ c⋅V 1 4D 1+ τ w2 (4) Berücksichtigt man die unkorrelierte Untergrundfluoreszenz, so gilt: G( τ) = 1 + iB ⋅ <N> 3 1 1+ τ τD (5) 2 Fges − FUntergrund i = mit B ; Fges und FUntergrund sind die gemittelte Gesamt- bzw. Fges Untergrundintensität. Die charakteristische Diffusionszeit τD des Moleküls ist mit der Diffusionskonstante D verknüpft τD = w2 / 4D, (6) welche wiederum mit dem hydrodynamischen Radius r des beobachteten Moleküls verknüpft ist D = kT / (6πηr). (7) Bei bekannter lateraler Ausdehnung des Beobachtungsvolumens kann daraus die Diffusionskonstante der fluoreszierenden Objekte bestimmt werden. Die Zusammenhänge zwischen Autokorrelationsfunktion, Diffusionkonstante und Beobachtungsvolumen sind in Rigler et al. sowie in Schwille / Haustein (s. Kap.8 Literaturhinweise) zu finden. Abb. 1: Prinzip der Fluoreszenz-Korrelations-Spektroskopie (Abb. aus http://www.zeiss.de ) . 4 Abb. 2. Prinzip eines konfokalen Fluoreszenzaufbaus zur Fluoreszenz-KorrelationsSpektroskopie (Abb. aus http://www.zeiss.de) 3. Gerätebeschreibung Als Anregungslichtquelle für das Experiment steht ein Argon-Ionenlaser (λ=488 nm) zur Verfügung. Die selektive Beobachtung der rotverschobenen Fluoreszenz erfolgt durch den Einsatz geeigneter optischer Filter, die gezielt das Anregungslicht unterdrücken. Als Detektor steht eine empfindliche Photodiode zur Verfügung (MPD, PicoQuant), deren Signal mit einem Diskriminator über eine Zählkarte (P7882, FastComTec) von einem Computer aufgezeichnet werden kann. In Abb. 3 ist der schematische Aufbau eines solchen Mikroskops dargestellt. 5 Abb. 3 Schematischer Aufbau eines konfokalen Mikroskops zur FluoreszenzKorrelations Spektroskopie. 4. Fluoreszenzfarbstoffe Es steht der Farbstoff Rhodamin 6G zur Verfügung, dessen Absorptionsspektrum im Versuchsraum aushängt. Weiterhin benötigt werden fluoreszierende Polymerkügelchen (Nanopartikel, FluoSpheres®, Molecular Probes). Diese sind mit dem Fluoreszenzfarbstoff "Yellow green" gefärbt. Die Materialien sind im Chemielabor des Lehrstuhls EP IV vorhanden. In Abb. 4 und 5 sind die Anregungsspektren und die Emissionsspektren von Rhodamin 6G sowie des Farbstoffs Yellow Green dargestellt. 6 Abb.4 Absorptions- und Emissionsspektrum von Rhodamin 6G in Wasser. Abb.5 Anregungs- und Emissionsspektrum von Yellow Green. Schematisch sind der Durchlassbereich von Filter OG530, sowie die Wellenlänge des ArgonIonenlasers dargestellt. 5. Probenvorbereitung Die Farbstoffe und die Nanopartikel werden unter Anleitung des Betreuers in verschiedenen Konzentrationen in Millipore - gefiltertem Wasser gelöst. Dabei ist darauf zu achten, dass die Konzentration der Lösung so eingestellt wird, dass nicht mehr als ca. 100 Partikel oder Moleküle im Beobachtungsvolumen vorhanden sind. 7 6. Vorsichtsmaßnahmen SEHR WICHTIG: Beim Arbeiten mit dem Laser muss darauf geachtet werden, dass nie ein Reflex oder gar der direkte Strahl ins Auge trifft. • Dazu ist das Tragen von Uhren und Ringen etc. nicht gestattet. • Ebenfalls darf man sich nie mit dem Kopf über die Apparatur beugen. 7. Aufgaben 7.1 Justage • Optische Achse: Ein Laserstrahl ist entlang einer vorgegebenen optischen Achse auszurichten. Dazu steht ein "Übungsaufbau" mit einem He-Ne Laser zur Verfügung. • Pinhole: Das Pinhole des konfokalen Aufbaus ist lateral (xy-Richtung; senkrecht zur optischen Achse) zu justieren. • Fokus: Dazu OD3 Filter in den Strahlengang vor dem Detektor einsetzen. Dann werden auf einer CCD Kamera die Rückreflexe des Lasers vom Probenplättchen gesucht. Der Fokus des Mikroskops wird auf den "oberen" (d.h. der der Probe zugewandte Seite des Probenplättchens) Reflex eingestellt. VORSICHT: das Objektiv nicht gegen die Probe fahren. Danach wird der Reflex auf die ausgeschaltete Photodiode abgebildet, diese wird in xy-Richtung justiert. Im letzten Schritt wird die Photodiode eingeschaltet und in xyz Richtung justiert. 8 7.2 Kalibrierung In diesem Arbeitsschritt wird die laterale Ausdehnung des konfokalen Volumens bestimmt und die relativen Konzentrationen unterschiedlicher Proben desselben Farbstoffes ermittelt. • Dazu werden 3 Proben mit unterschiedlicher Konzentration von Rhodamin 6G vermessen. • Mittels eines Piezotisches wird die Probe um 50 μm auf das Objektiv zugefahren. • Die optischen Filter müssen für die Messung der Fluoreszenz angepasst werden. • Die Autokorrelationsfunktion wird gemessen und mit Gleichung (5) gefittet, daraus erhält man die laterale Ausdehnung des konfokalen Volumens und die relativen Konzentrationen der Proben. Achtung: Beim Wechseln der Probe muss der Fokus jeweils neu eingestellt werden (siehe Schritte „Fokus“ unter 7.1 und „Piezotisch“ unter 7.2). • Abschätzung des Volumenparameters r0 (Def. siehe Lit. Schwille / Haustein): Der konfokale Volumenparameter r0 kann theoretisch mit Hilfe der Breite (FWHM) der zentralen Intensitätsverteilung einer Airy-Funktion (genähert mit einem Gaußprofil) berechnet werden. Er ist mit dem experimentell erhaltenen Wert für Rhodamin 6G zu vergleichen und die Unterschiede sind zu diskutieren. 7.3 Leistungsabhängigkeit Für unterschiedliche Anregungsintensitäten (100:W bis 1 mW in Schritten von 100:W) ist die Autokorrelationsfunktion zu bestimmen. Änderungen in der Amplitude und in der Form sind in Abhängigkeit der Zahl der angeregten Moleküle und unter Berücksichtigung von triplet blinking zu diskutieren. Ebenso ist der Einfluss der Anregungsintensität auf die Photonenzählrate pro Molekül zu diskutieren. 9 7.4 Bestimmung der Diffusionskonstante Es werden farbstoffgelabelte Polymerbeads unterschiedlicher Größe vermessen. Dazu muss die Anregungsleistung reduziert werden (Graufilter mit ca. OD 3 - 4 in den Anregungsstrahlengang einsetzen). Auch hier muss zunächst der Fokus wieder neu eingestellt werden ( s.o.). Aus der Anpassung von Gleichung (5) an die Autokorrelierte erhält man – bei bekannter lateraler Ausdehnung des konfokalen Volumens - die Diffusionskonstanten der Polymerbeads. 8. Fragen zur Vorbereitung 1. Erläutern Sie das Prinzip eines konfokalen und eines Weitfeld-Mikroskops. 2. Welche Parameter des Mikroskops bestimmen seine Auflösung? 3. Was beschreibt die „Point Spread Function“? 4. Wie funktioniert ein Laser? 5. Erläutern Sie das Prinzip der Fluoreszenzspektroskopie. 6. Was sind die Grundlagen der Fluoreszenz-Korrelations-Spektroskopie (FCS)? Welche Parameter sind mit dieser Technik experimentell direkt zugänglich? Stellen Sie außerdem die Unterschiede zwischen FCS und der „Dynamic Light Scattering“-Methode (DLS) dar. 7. Wie läßt sich aus der Diffusionskonstante eines Moleküls dessen Durchmesser bzw. die Molekülmasse bestimmen? 9. Literatur • P. Schwille, E. Haustein, „Fluorescence Correlation Spectroscopy“ (als PDF unter http://www.praktika.physik.uni-bayreuth.de/fcs_schwille.pdf) • H. J. Galla, „Spektroskopische Methoden in der Biochemie“, Kapitel 5, S. 46ff (wird ausgehändigt) 10 • R. Rigler, Ü. Mets, J. Widengren, P. Kask, „Fluorescence correlation spectroscopy with high count rate and low background: analysis of translational diffusion“, Eur. Biophys. J. (1993), 22, 169. • D. Madge, E. L. Elson, W. W. Webb, „Fluorescence Correlation Spectroscopy. II. An Experimental Realization“, Biopolymers (1974), 13, 29. • http://www.probes.com (Literatur zu den FluoSpheres) 11