1_Einleitung
Werbung

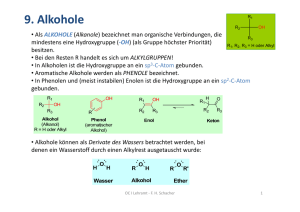
Organische Chemie I OC I Lehramt ‐ F. H. Schacher 1 Organisatorisches • Kontakt: Felix H. Schacher IOMC, Lessingstr. 8, Raum 122 Email: felix.schacher@uni‐jena.de • Termine: Vorlesung: Freitag 12‐14 Uhr Hörsaal, Humboldtstraße 8 Klausur: 11.07.2016 08‐10 Uhr Hörsaal, Humboldtstraße 8 • Skript: http://www.chemgeo.uni‐jena.de/ IOMC, Lehre Organische Chemie I (Lehramt) (C‐LA‐I) OC I Lehramt ‐ F. H. Schacher 2 Organisatorisches ‐ Termine 07.04.2017 Einleitung 14.04.2017 Karfreitag 21.04.2017 Alkane 28.04.2017 Cycloalkane 05.05.2017 Stereoisomerie 12.05.2017 Halogenalkane / Substitution 19.05.2017 Eliminierung / Alkene 26.05.2017 entfällt 02.06.2017 Alkene / Alkine 09.06.2017 Aromaten I 16.06.2017 Aromaten II 23.06.2017 Alkohole 30.06.2017 Ether 07.07.2017 Amine / Fragen 11.07.2017 Klausur (Dies academicus) OC I Lehramt ‐ F. H. Schacher 3 Bücher Schmuck 29,90 € Vollhardt 89,90 € Brückner 79,99 € OC I Lehramt ‐ F. H. Schacher 4 Begriff: Organische Chemie 18. Jahrhundert: Isolierung von Reinstoffen 1769: Weinsäure 1773: Harnstoff 1806: erstmalig „Organische Chemie“ für Stoffe aus Organismen Jakob Berzelius („vis vitalis“) 1828: Synthese von Harnstoff aus Ammoniumcyanat Friedrich Wöhler „Paragdigmenwechsel“ 1800‐1882 OC I Lehramt ‐ F. H. Schacher http://wikipedia.org 6 Begriff: Organische Chemie + Jena Friedlieb Ferdinand Runge Studium Medizin + Chemie (u.a. Jena) Promotion 1819 (Jena) Beschreibung von: 1794‐1867 Anilin Phenol Koffein Bakelit OC I Lehramt ‐ F. H. Schacher http://wikipedia.org 7 Organische Chemie heute „Verbindungen, die Kohlenstoff enthalten“ Medikamente Lebensmittel‐ Zusatzstoffe Kunststoffe Farbstoffe OC I Lehramt ‐ F. H. Schacher 8 Periodensystem der Elemente OC I Lehramt ‐ F. H. Schacher 9 Chemische Bindung Das bindende Elektronenpaar ist nicht gleichmäßig zwischen den Atomen verteilt unsymmetrische Bindung ein Dipol liegt vor Atombindung Die Bindungspolarisation wird durch δ+ und δ‐ symbolisiert (Partialladungen). Unpolar Polar ΔEN = 0 ΔEN = 0 ... 1,7 Beispiele • Wasserstoff EN=2,1 H • Methan H • Sauerstoff EN=3,5 • Chlormethan H EN=2,1 C H H EN=2,5 H C EN=3,0 Cl H OC I Lehramt ‐ F. H. Schacher EN=2,5 10 Darstellung organischer Moleküle • Die Summenformel gibt die Anzahl der verschiedenen Atome im Molekül an. • Die Strukturformel gibt an, wie die Atome miteinander verbunden sind. LEWIS‐Formeln (Valenzstrichformeln) Schreibweise zur Darstellung organischer Moleküle. Regeln zum Aufstellen von LEWIS‐Formeln: 1. Zeichnen des Molekülgerüstes 2. Ermittlung der Anzahl der Valenzelektronen 3. Aufteilen der Bindungselektronen(‐paare) nach Oktettregel 4. Ermitteln der Formalladungen OC I Lehramt ‐ F. H. Schacher 11 Darstellung organischer Moleküle Summen‐ Formel LEWIS‐Formel (Valenzstrich‐Formel) Skelett‐Formel Name Methan Ethen Protonierter Acetaldehyd n‐Propanol typische Elemente OC I Lehramt ‐ F. H. Schacher 12 Weitere Begriffe • Struktur ... jegliche Ordnung (Organisation) von Teilchen, z.B. Atomen Moleküle ... sind aus Atomen aufgebaut Verbindung ... besteht aus der gleichen Sorte von Molekülen • Formel ... beschreibt die Zusammensetzung nach Art und Anzahl der Atome im Molekül (Summenformel) bzw. gibt an, wie die Atome im Molekül untereinander verbunden sind (Strukturformel bzw. Konstitutionsformel) Skelettformel ... verkürzte Darstellung organischer Moleküle • Konstitutionsisomere ... besitzen die gleiche Summenformel, aber unterschiedliche Strukturformeln Beispiel: C2H6O OC I Lehramt ‐ F. H. Schacher 13 Molekülorbitale a) ‐Orbitale Durch „Endüberlappung“ zweier einfach besetzter Atomorbitale. Die Elektronendichte ist auf der Kernverbindungsachse lokalisiert. H–H H–C C–C ‐Bindung C–Cl ‐Bindung b) ‐Orbitale Durch seitliche Überlappung zweier einfach besetzter Atom‐ orbitale. Die Elektronendichte ist ober‐ und unterhalb der Kernverbindungsachse lokalisiert. C=C OC I Lehramt ‐ F. H. Schacher Pearson Studium, P. Bruice, Organische Chemie, 5. Aufl., 2007 14 Hybridisierung • Kohlenstoff besitzt im Grundzustand die Elektronen‐ konfiguration 1s2, 2s2, 2p2. • Von den 4 Valenzelektronen liegen 2 als Elektronenpaar (2s2) und 2 frei (ungepaart, 2p2) vor. Theoretisch wäre Kohlenstoff zweibindig – mit einem Bindungswinkel von 90°... Oktettregel könnte nicht erfüllt werden! Experimentell: Kohlenstoff ist vierbindig! (z. B. Methan, Bindungswinkel = 109°) Methan: Stab‐, Kugel‐Stab‐ und Kalottenmodell Lösung: HYBRIDISIERUNG OC I Lehramt ‐ F. H. Schacher 15 Hybridisierung a) sp3‐Orbitale Durch Hybridisierung eines s‐ und dreier p‐Orbitale entstehen vier sp3‐Hybridorbitale. Ein sp3‐Orbital ist energieärmer als ein p‐Orbital, aber energiereicher als ein s‐Orbital. Hybridorbitale gleicher Art sind entartet (energetisch gleichartig)! OC I Lehramt ‐ F. H. Schacher Pearson Studium, P. Bruice, Organische Chemie, 5. Aufl., 2007 16 Hybridisierung b) sp2‐Orbitale Durch Hybridisierung eines s‐ und zweier p‐Orbitale entstehen drei sp2‐Hybridorbitale. c) sp‐Orbitale Durch Hybridisierung eines s‐ und eines p‐Orbitales entstehen zwei sp‐Hybridorbitale. OC I Lehramt ‐ F. H. Schacher Pearson Studium, P. Bruice, Organische Chemie, 5. Aufl., 2007 17 Hybridisierung – Bindungsmodelle Kohlenstoff : Einfachbindung Ethan (C2H6) 154 pm Ethen (C2H4) Kohlenstoff: Doppelbindung 134 pm OC I Lehramt ‐ F. H. Schacher Breitmaier/Jung, Organische Chemie, 4. Auflage 2001 18 Hybridisierung Ethin (C2H2) Kohlenstoff : Dreifachbindung • Überlappung zweier sp‐Hybridorbitale und zweimal zwei p‐Orbitalen. 120 pm OC I Lehramt ‐ F. H. Schacher 19 Hybridisierung Zusammenfassung: Bindungstypen zwischen Kohlenstoffatomen Bindung sp3 sp2, pz sp, py, pz + z + y + z 109,5° 120° 180° Bindungslängen [pm] 154 134 120 Bindungsenergie [kJ*mol‐1] 331 620 812 ja nein nein Bindende Orbitale Bindungstyp Winkel zw. den Bindungen freie Drehbarkeit um C‐C OC I Lehramt ‐ F. H. Schacher 20 Mesomerie Der Begriff Mesomerie (Resonanz) wird angewendet, wenn eine chemische Struktur (Molekül, Übergangszustand) nicht durch eine einzige Valenzstrichformel (LEWIS‐Formel) – in diesem Falle auch Grenzformel oder Grenzstruktur genannt – befriedigend beschrieben werden kann. • Es existieren zwei oder mehrere Strukturen eines Moleküls oder Ions mit identischer Atom‐, aber unterschiedlicher Elektronenanordnung (NICHT Struktur). • Der verwendete Mesomeriepfeil (↔) ist KEIN Gleichgewichtspfeil ( )! Mesomere Grenzstrukturen stehen in keinem chemischen Gleichgewichtsverhältnis. RESONANZSTRUKTUREN MÜSSEN GÜLTIGE LEWIS‐STRUKTUREN SEIN! Beispiel: 2O O O ! Da Resonanzformeln hypothetischer Natur sind, lassen sich die ihnen entsprechenden Spezies weder beobachten noch isolieren! OC I Lehramt ‐ F. H. Schacher Resonanzhybrid 21 Mesomerie Regeln für Resonanzformeln bei Nicht‐Equivalenten Grenzformen: 1. Größtmögliche Anzahl von Elektronenoktetts 2. Negative Ladungen am Atom mit der größten, positive Ladungen am Atom mit der geringsten EN 3. Möglichst geringe Ladungstrennung 4. Oktettregel kann Ladungstrennung erzwingen OC I Lehramt ‐ F. H. Schacher 22 Klassifizierung organischer Verbindungen a) Nach dem MOLEKÜLGERÜST (acyclisch, carbocyclisch, heterocyclisch). b) Nach FUNKTIONELLEN GRUPPEN. Funktionelle Gruppen (FG) sind Atome oder Gruppen von Atomen, die das chemische Verhalten organischer Verbindungen prägen und bei chemischen Umsetzungen (Reaktionen) eine Schlüsselfunktion einnehmen. OC I Lehramt ‐ F. H. Schacher 23 Oxidationsstufen Regeln zur Bestimmung der Oxidationszahlen: 1) Die Bindungselektronen eines jeden Atoms werden dem elektronegativeren Bindungspartner zugeordnet. 2) Besitzen beide Bindungspartner die gleiche Elektronegativität, so werden jedem die Hälfte der Bindungselektronen zugeordnet. Damit erhalten die Atome einer C‐C‐Bindung immer den Wert Null (0). 3) Anschließend wird die Ladung des betreffenden Atoms ermittelt. Sie wird als Oxidationszahl mit römischen Ziffern angegeben; negative Oxidationszahlen erhalten ein Minus‐Vorzeichen, positive ein Plus‐ Vorzeichen. 4) Hilfsregel: Fluor hat immer –I, Sauerstoff –II und Wasserstoff +I Wichtige Elektronegativitätswerte: C: 2.5 H: 2.1 O: 3.5 N: 3.0 Cl: 3.0 OC I Lehramt ‐ F. H. Schacher 24 Reaktionspartner Radikal: Teilchen mit mind. einem ungepaarten Elektron Nucleophil: Elektronenpaar‐Donator Anion oder Gruppe mit freiem Elektronenpaar oder elektronen‐ reicher Π‐Bindung Elektrophil: Elektronenpaar‐Akzeptor Kation mit einer Elektronenlücke oder Gruppe mit positiver Polarisierung 25 Reaktionen, Kinetik, Thermodynamik Organisch‐Chemische Reaktionen können meist einem von sieben Hauptreaktionstypen zugeordnet werden: • ADDITION A + B C • ELIMINIERUNG C A + B • SUBSTITUTION A‐B + C A‐C + B • KONDENSATION A + B C + D • UMLAGERUNG • ISOMERISIERUNG • REDOXREAKTION A B A B A B OC I Lehramt ‐ F. H. Schacher D ... kleines Molekül (H2O o. HX) 26 Reaktionsmechanismus Als Reaktionsmechanismus bezeichnet man die genaue Abfolge aller Elementarschritte innerhalb einer chemischen Reaktion, d.h. die Abfolge in der bei der Umwandlung des Eduktes in das Produkt Bindungen gebrochen und neu geknüpft werden. Beispiel: OC I Lehramt ‐ F. H. Schacher 27 Reaktive Zwischenstufen • In der organischen Chemie treten häufig reaktive Zwischenstufen auf. • Diese sind i.d.R. nicht isolierbar, jedoch nachweisbar (Spektroskopie). • Reaktive Zwischenstufen können zu ungewünschten Nebenreaktionen führen. Häufige reaktive Zwischenstufen: a) b) c) d) e) Carbokationen Carbanionen Radikale Carbene Radikal‐Ionen z.B. R3C+ z.B. R3C:‐ z.B. •CR3 z.B. :CR2 z.B. (R2C=O•)‐ OC I Lehramt ‐ F. H. Schacher 28 Reaktive Zwischenstufen Hybridisierung reaktiver Zwischenstufen: OC I Lehramt ‐ F. H. Schacher 29 Carbokationen (Carbeniumionen) • Carbeniumionen besitzen an einem C‐Atom eine positive Ladung (R3C+) (6 statt 8 Valenzelektronen). • Trigonale, planare Struktur (sp2‐hybridisiertes Kation). • Stabilisierung durch +I‐Effekt von Alkylgruppen (Elektronen‐Donoren), Hyperkonjugation (Delokalisierung von Bindungselektronen) und mesomere Effekte. • Carbokationen werden gebildet durch: • SN1‐Reaktionen • Zerfall von Diazonium‐Ionen • Addition eines Protons an z.B. Alkene • Folgereaktionen von Carbokationen: • Reaktionen mit einem Nucleophil (SN1) • Abspaltung eines Protons (E1) • Umlagerungen • Anlagerung an eine Mehrfachbindung OC I Lehramt ‐ F. H. Schacher 30 Carbokationen (Carbeniumionen) Hyperkonjugation STABILITÄT von Carbokationen: methyl < primär << sekundär < tertiär < allyl < benzyl REAKTIVITÄT von Carbokationen: methyl > primär >> sekundär > tertiär > allyl > benzyl OC I Lehramt ‐ F. H. Schacher Volhardt/Shore, Organische Chemie, 4. Auflage, 2006 31 Carbanionen • Carbanionen besitzen an einem C‐Atom eine negative Ladung (R3C:‐)(Elektronenoktett). • Tetraedrische Struktur (sp3‐hybridisiertes Anion). • Carbanionen werden gebildet durch: • Deprotonierung (Verhalten als Säure) durch starke Basen (z.B. BuLi, NaNH2) • Entfernung einer positiven Abgangsgruppe (z.B. R‐Li) • Folgereaktionen von Carbanionen: • Abspaltung einer negativen Abgangsgruppe (z.B. X‐) Bildung von Mehrfachbindungen (E1) • Reaktion mit einem Elektrophil STABILITÄT von Carbanionen: methyl > primär > sekundär > tertiär ACIDITÄT von Kohlenwasserstoffen: Alkane < Alkene < Alkine OC I Lehramt ‐ F. H. Schacher 32 Radikale • Radikale sind Teilchen mit einem oder mehreren ungepaarten Elektronen (•CR3). • Fast planare Struktur. • Stabilisierung durch +I‐Effekt, Hyperkonjugation (Alkylradikale) und Mesomerie (Allyl‐, Benzyl‐ und Phenylradikale). • Schwächere Stabilisierung durch Alkylsubstituenten als bei Carbeniumionen. • Radikale werden gebildet durch homolytische Spaltung von C‐H‐, C‐C‐ oder C‐X‐Bindungen. Hyperkonjugation STABILITÄT von Radikalen: methyl < primär < sekundär < tertiär OC I Lehramt ‐ F. H. Schacher 33 Carbene • Carbene sind Teilchen mit einem neutralen, zweibindigen C‐Atom (:CR2) (Elektronensextett). • Zwei elektronische Zustände sind möglich: Singulett‐ und Triplett‐Carben‐Struktur. Beispiel: Carben (Methylen) aus Diazomethan. OC I Lehramt ‐ F. H. Schacher 34