9_Alkohole
Werbung
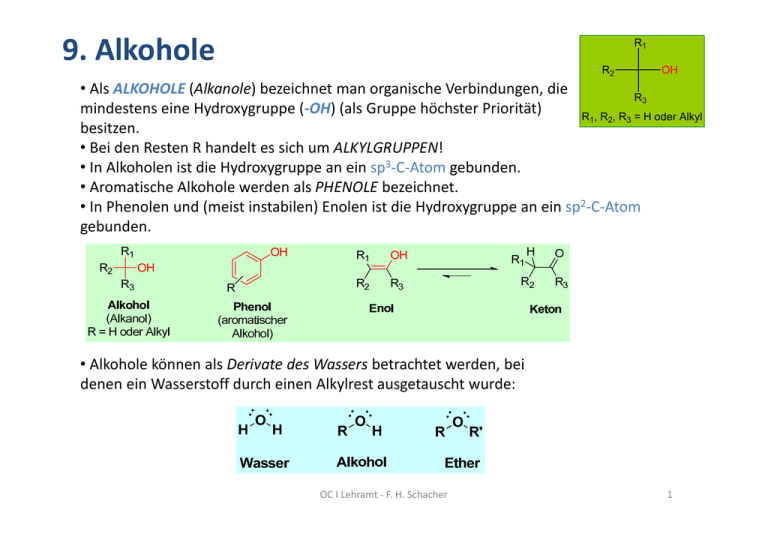
9. Alkohole R1 R2 OH • Als ALKOHOLE (Alkanole) bezeichnet man organische Verbindungen, die R3 mindestens eine Hydroxygruppe (‐OH) (als Gruppe höchster Priorität) R1, R2, R3 = H oder Alkyl besitzen. • Bei den Resten R handelt es sich um ALKYLGRUPPEN! • In Alkoholen ist die Hydroxygruppe an ein sp3‐C‐Atom gebunden. • Aromatische Alkohole werden als PHENOLE bezeichnet. • In Phenolen und (meist instabilen) Enolen ist die Hydroxygruppe an ein sp2‐C‐Atom gebunden. • Alkohole können als Derivate des Wassers betrachtet werden, bei denen ein Wasserstoff durch einen Alkylrest ausgetauscht wurde: OC I Lehramt ‐ F. H. Schacher 1 Allgemeines • Die einwertigen Alkanole bilden die homologe Reihe: CnH2n+2O • Unverzweigte Alkohole sind von C1 (Methanol) bis C11 (Undecanol) flüssig, längerkettige Alkohole sind fest. • Ab C3 existieren Konstitutionsisomere (Propan‐1‐ol, Propan‐2‐ol (Isopropanol)). Einteilung der Alkanole: a) Alkylierungsgrad: primäre, sekundäre und tertiäre Alkohole b) Anzahl der Hydroxygruppen: (Mono‐), Di‐, Tri‐, ... , Polyalkohole (Polyole). OC I Lehramt ‐ F. H. Schacher 2 Struktur, Bindung, Eigenschaften C‐OH‐Bindung • polar (Dipolmoment), etwas stärker (435 kJ/mol) als eine C‐H‐ Bindung (410 kJ/mol) resultierendes Diplomoment Struktur und Orbitale • C‐O‐H Bindung ist gewinkelt (ca. 110° in Alkoholen). • Alkohole können (wie Wasser) Wasserstoffbrückenbindungen ausbilden (ca. 21 kJ/mol). höhere Siedepunkte der Alkohole ggü. Alkanen und Halogenalkanen. • Alkohole gehören zu den protischen Lösungsmitteln. OC I Lehramt ‐ F. H. Schacher 3 Struktur, Bindung, Eigenschaften Wasserstoffbrückenbindung Löslichkeit in Wasser • OH‐Gruppe ist polar und hydrophil. • Alkylgruppe ist unpolar und hydrophob. C1 – C3 Alkohole sind sehr gut wasserlöslich (polarer Charakter überwiegt). C4 – C5 Alkohole sind mäßig wasserlöslich. C6 und größere Alkohole sind nicht wasserlöslich (unpolarer Charakter überwiegt). Vergleich der Siedepunkte Alkan Kp* Halogenalkan Kp* Alkohol Kp* Methan ‐161 Chlormethan ‐24 Methanol 65 Ethan ‐89 Chlorethan 12 Ethanol 78 Propan ‐45 Chlorpropan 16 Propanol 97 Butan ‐0,5 Chlorbutan 78 Butanol 118 Pentan 36 Chlorpentan 108 Pentanol 128 Polarität und Wasserstoffbrücken‐ bindungen verursachen hohe Siedepunkte der Alkohole! *Kochpunkt in °C 4 http://www2.chemie.uni‐erlangen.de/projects/vsc/chemie‐mediziner‐neu/funktgruppen/bilder/alkohole2.gif Alkohole als Säuren + Basen • Alkohole können durch starke Basen deprotoniert und durch starke Säuren protoniert werden sie sind Säure‐Base‐AMPHOTERE! Beispiele: OC I Lehramt ‐ F. H. Schacher 5 Nomenklatur + wichtige Vertreter • Nomenklatur für Alkanole: • Name des Alkans plus Endung ‐ol. • Position der Hydroxygruppe vor dem Alkanstamm oder vor der Endung (z.B. 2‐Propanol oder Propan‐2‐ol). • Cyclische Alkanone erhalten zusätzlich die Vorsilbe Cyclo‐. • Position der Substituenten möglichst niedrig! • TRIVIALNAMEN! Beispiele: OC I Lehramt ‐ F. H. Schacher 6 Synthesen • Wichtige Synthesemethoden sind: a) Technische Alkoholsynthesen (Methanol und Ethanol) siehe auch Reaktionen der erwähnten Stoffklassen OC I Lehramt ‐ F. H. Schacher 7 Synthesen b) Alkoholische Gärung • Biochemischer Prozess, bei dem Kohlenhydrate (hauptsächlich Glucose) zu Ethanol und Kohlendioxid abgebaut werden. • Spaltung der Kohlenhydrate erfolgt durch Enzyme, die zum Beispiel in Hefe enthalten sind. • Hauptsächlich zur Gewinnung von Trinkalkohol und Bioethanol. • Maximaler Alkoholgehalt durch Gärung ca. 20 %. • Anreicherung des Alkohols durch Destillation. Typische Alkoholgehalte • Brot: bis 0,3 % Vol. • Apfelsaft: bis 0,4 % Vol. • alkoholfreies Bier: bis 0,5 % Vol. • Sauerkraut: 0,5 % Vol. • Traubensaft: bis 0,6 % Vol. • reife Banane: bis 1 % Vol. (durchschnittlich 3 ml) • reifer Kefir: bis ca. 1 % Vol. • Bier •Leichtbiere: 1–3,5 % Vol. •Vollbiere: ca. 3–5 %, meist um 5 % Vol. •Starkbiere: 6–12 % Vol. • Weine: 7–14 %, Vol. Apfelwein: ca. 5,5–7 % Vol. • Liköre: ca. 15–75 % Vol., meist unter 30 % Vol. • Spirituosen: ca. 30–80 % Vol., meist ca. 40 % Vol. OC I Lehramt ‐ F. H. Schacher 8 Synthesen c) Hydratisierung von Alkenen OC I Lehramt ‐ F. H. Schacher 9 Synthesen d) Hydroborierung von Alkenen (siehe Kapitel 6) e) Reduktion von Carbonylen f) Alkylierung von Carbonylen (Grignard) OC I Lehramt ‐ F. H. Schacher 10 Synthesen g) Nucleophile Substitution an Halogenalkanen • Nucleophile Substitution (mit ‐OH) an geeigneten Halogenalkanen (primär und sekundär) führt zu Alkoholen. • Geeignet für die Synthese „komplizierter“ Alkoholstrukturen – zuerst Halogenieren, dann Substitution zum Alkohol. Beispiel: Br + OH- OH - BrBenzylbromid Benzylalkohol OC I Lehramt ‐ F. H. Schacher 11 Reaktionen Säure‐Base‐Amphoter • Polare C‐OH‐Bindung: Partiell positives Kohlenstoffatom, partiell negatives Sauerstoffatom. • Amphoterer Charakter ermöglicht Bildung von Alkyloxonium‐ und Alkoxid‐Ionen. • Vielfältige Folgechemie an diesen Zwischenstufen. • Oxidierbarkeit des Alkohol‐C‐Atoms. Substitution der OH Gruppe (durch Halogenide) Dehydratisierung !Umlagerungen! Veresterung Veretherung (WILLIAMSON) Oxidation OC I Lehramt ‐ F. H. Schacher 12 Reaktionen Wichtige Reaktionen der Alkohole ‐ Übersicht I: Aldehyde O C C H Alkene C C Ketone Alkylhalogenide R OH C X Ester O C C O C O C C C Carbonsäuren Ether O C C O H C O C OC I Lehramt ‐ F. H. Schacher 13 Reaktionen Wichtige Reaktionen der Alkohole ‐ Übersicht II: + Folgechemie OC I Lehramt ‐ F. H. Schacher 14 Nukleophile Substitution (Halogenide) Substitution mit Halogenwasserstoff (X = (Cl), Br, I) • Alkyloxonium‐Ionen von primären Alkoholen lassen sich durch Nucleophile ersetzen (SN2‐Mechanismus). • Sekundäre und tertiäre Alkyloxonium‐Ionen bilden leicht Carbenium‐Ionen. (Stabilität der gebildeten Carbenium‐Ionen: Allyl, Benzyl > tert. > sek. >> prim.) • Die Carbeniumionen reagieren nach SN1‐ (z.B. Halogenierung) oder E1‐Mechanismen (s. Dehydratisierung) weiter. • Nebenreaktionen: Eliminierungen, Umlagerungen OC I Lehramt ‐ F. H. Schacher 15 Dehydratisierung • Erhitzen von (sekundären und tertiären) Alkoholen mit Mineralsäuren führt zur Bildung von Alkenen (säurekatalysierte Dehydratisierung). • Verläuft über Carbenium‐Zwischenstufen (E1‐Mechanismus). • Häufig Verwendung von Säuren, deren Anionen (konjugierte Basen) keine Nucleophile sind (H2SO4, H3PO4). • Unsymmetrische Alkohole ergeben Produktgemische. • Carbenium‐Ionen können Umlagerungsreaktionen eingehen. • Weitere mögliche Nebenreaktion: Polymerisation der Alkene (im Sauren). 16 Veresterung • Die Umsetzung von Alkoholen mit Carbonsäuren führt zu Carbonsäureestern (Carboxylaten, Alkanoaten). Meist säurekatalysiert (Mineralsäure). • Formal wird der Wasserstoff der Carbonsäure durch einen Alkylrest (bzw. Arylrest) ersetzt. O R O Veresterung OH Carbonsäure + HO R' Alkohol R O R' Verseifung Carbonsäureester + H2O W asser Wichtigste Reaktion der Alkohole! OC I Lehramt ‐ F. H. Schacher 17 Veretherung • Die Deprotonierung von Alkoholen bzw. Phenolen durch starke Basen (Na, NaNH2) liefert Alkoxid‐Ionen (Alkoholate) bzw. Phenolate. Diese können mit Halogenalkanen zu Ethern umgesetzt werden (WILLIAMSON‐Ethersynthese). • Alternative: Alkohole in Gegenwart von „nichtnucleophilen“ Säuren erhitzen: OC I Lehramt ‐ F. H. Schacher 18 Oxidation Übersicht: primärer Alkohol H R C H [O] sekundärer Alkohol H R C OH R' R" R C OH R' [O] tertiärer Alkohol [O] OH H C O R Aldehyd R [O] HO C O R Carbonsäure C O R' Keton keine Reaktion • Oxidationsmittel: CrO3, Na2Cr2O7 in H2SO4/H2O • Die Oxidation von primären Alkoholen ist nur schwer auf der Stufe der Aldehyde zu stoppen meist Weiteroxidation zu Carbonsäuren (im Wässrigen)! OC I Lehramt ‐ F. H. Schacher 19 Phenole (Carbolsäuren) • Als PHENOLE bezeichnet man aromatische Alkohole – sie tragen mindestens eine Hydroxygruppe am aromatischen Ring. • In Phenolen ist die Hydroxygruppe an ein sp2‐C‐Atom gebunden. • Phenole sind i.d.R. Feststoffe. • Die OH‐Gruppe (+M, ‐I) ist ein aktivierender, ortho‐ und para‐dirigierender Substituent. Keto‐ und Enolform des Phenols • Durch die Resonanzenergie des Aromaten ist die Enolform stabiler! Phenole sind Säure‐Base‐Amphotere • Phenole können von starken Säuren protoniert und von (starken) Basen deprotoniert werden! OC I Lehramt ‐ F. H. Schacher 20 Phenole (Carbolsäuren) • Phenole (pKa = 8‐10) sind deutlich saurer als Alkohole (pKa = 15‐18)! Das Phenolat‐Anion ist mesomeriestabilisiert: Die negative Ladung kann über das gesamte aromatische System delokalisiert werden! • Phenole sind deutlich schwächer basisch als Alkohole (Phenyloxomium‐Ionen sind stärker sauer (pKa = ‐7) als Alkyloxonium‐Ionen (pKa = ‐2 ‐ ‐4)). • Elektronenziehende Substituenten können sich an der Resonanz beteiligen und stabilisieren das Phenolat‐Ion zusätzlich stärkere Acidität des Phenols. • Elektronenschiebende Substituenten verringern die Acidität. OC I Lehramt ‐ F. H. Schacher 21 Phenolsynthesen a) HOCK‐Phenolsynthese – Cumol‐Hydroperoxid‐Verfahren OC I Lehramt ‐ F. H. Schacher 22 Phenolsynthesen b) Verkochen von Aryldiazoniumsalzen OC I Lehramt ‐ F. H. Schacher 23 Alkohole in der Industrie • Methanol und Ethanol sind wichtige C1‐ bzw. C2‐Bausteine und finden Anwendung in vielen chemischen Herstellungsverfahren. • Methanol: Synthese Formaldehyd und Essigsäure, Lösungsmittel, Brennstoff. Sehr giftig! 50 Mio. Tonnen • Ethanol: Trinkalkohol, Brennstoff (Bioethanol, E85), Desinfektionsmittel, Ausgangstoff für viele Chemikalien 36 Mrd. Liter (40% Getränke / Chemie – 60% Treibstoff) (90% davon USA + Brasilien) • 2‐Propanol (Isopropanol): Lösungs‐ und Reinigungsmittel, Desinfektionsmittel (toxisch, wird aber nicht über die Haut absorbiert). • Ethan‐1,2‐diol (Ethylenglykol): Frostschutzmittel • Phenol: früher Antiseptikum, Arzneimittelsynthesen, Phenolharze OC I Lehramt ‐ F. H. Schacher 24