Aufgaben - chem.uni-potsdam
Werbung

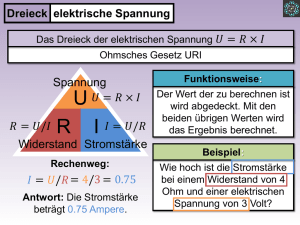
Universität Potsdam Professur für Physikalische Chemie Grundpraktikum Physikalische Chemie Dr. B. Kallies, 02.06.2000 Verdampfungsenthalpie von Wasser Durch Zufuhr einer bekannten Wärmemenge q zu einer siedenden Flüssigkeit entsteht Dampf, dessen Menge nach Kondensation gemessen werden kann. Aus den Meßdaten kann die Verdampfungsenthalpie ∆VH für die Siedetemperatur der Flüssigkeit berechnet werden. Aufgaben Bestimmen Sie experimentell die elektrische Energie U · I · t, die einer siedenden Wassermenge als Wärme zugeführt wird. die Masse an Kondensat, die in der Zeit t aus dem abgeleiteten Dampf gebildet wird. Berechnen Sie die molare Verdampfungsenthalpie ∆VH des Wassers bei seiner Siedetemperatur. die Verlustleistung (Verlustwärme je Sekunde) der Versuchsapparatur. Grundlagen des Versuchs Für die Umwandlung einer Flüssigkeit in Dampf bei konstanter Temperatur wird eine bestimmte Energiemenge benötigt, die auch latente Wärme genannt wird. Diese Energiemenge wird als molare Verdampfunsenthalpie bezeichnet, wenn sie sich auf ein Mol der Flüssigkeit / des Dampfes bezieht und die Verdampfung bei konstantem Druck erfolgt. Im Versuch wird Wasser in einer gegen die Atmosphäre offenen Destillationsapparatur durch eine elektrische Heizung zum Sieden erhitzt. Durch Messung der Stromstärke I, der Spannung U, und der Zeit t kann die durch die Heizung verbrauchte elektrische Energie festgelegt werden, die der der Flüssigkeit zugeführten Wärmemenge entspricht. Die während der Zeit t im stationären Zustand entwickelte Dampfmenge wird kondensiert und gewogen. Durch Wärmeleitung und -strahlung verursachte Wärmeverluste können rechnerisch annähernd eliminiert werden. Vorbereitungsfragen 1. Wie ist die molare Verdampfungsenthalpie definiert? Welches Vorzeichen hat sie? 2. Wie ändert sich die Temperatur des Systems siedende Flüssigkeit / Dampf, wenn ihm kontinuierlich Wärme zugeführt wird? 3. Skizzieren Sie das Phasendiagramm von Wasser und kennzeichnen Sie den Bereich, in dem dieser Versuch im Praktikum ausgeführt wird! 4. Warum ist die molare Verdampfungsenthalpie des Wassers größer als die des Benzens? 5. Stellen Sie die Abhängigkeit der Zustandsgröße Enthalpie eines reinen Stoffes von der Temperatur grafisch dar, und kennzeichnen Sie Schmelz- und Verdampfungsenthalpie! 6. Formulieren Sie das Kirchhoffsche Gesetz für die Phasenumwandlung flüssig/gasförmig des Wassers! Welche Größen benötigen Sie zur Umrechnung von ∆VH bei 398 K auf ∆VH bei 300 K? 7. Welchen Einfluß hat der Druck auf die Größe der molaren Verdampfungsenthalpie? 8. Definieren Sie folgende Größen: elektrische Arbeit, elektrische Leistung! Versuchsdurchführung a) Geräte Verdampfungsapparatur mit Dewargefäß, Heizquelle (z.B. 300-W-Tauchsieder), Liebig-Kühler, regelbare Spannungsquelle (Wechselstrom), 2 Vielfachmeßgeräte, 4 Erlenmeyerkolben (50 ml) mit Stopfen, kleines Becherglas, Analysenwaage, Stoppuhr 1 b) Reagenzien destilliertes Wasser c) Arbeitsablauf Dewargefäß mit destilliertem Wasser füllen, so daß der Tauchsieder ausreichend eintaucht Vielfachmeßgeräte als Voltmeter (Meßbereich 250 V Wechselspannung) und Amperemeter (Meßbereich 2.5 A Wechselstrom) anschließen, Drehwiderstand der Spannungsquelle bis zum Anschlag nach links drehen die Schaltung durch den Praktikumsleiter abnehmen lassen Kühlwasserzufuhr einschalten Spannungsquelle einschalten, mittels Drehwiderstand am Amperemeter eine Stromstärke von 1.2 A einstellen Wasser zum Sieden bringen, bis das Kondensat gleichmäßig abtropft Erlenmeyerkolben leer wägen, Kondensat während 300 Sekunden in Erlenmeyerkolben auffangen, wägen, Doppelbestimmung ausführen Während der Messung Anzeigeschwankungen der Vielfachmeßgeräte beobachten und notieren In der angegebenen Weise sind Doppelbestimmungen der Kondensatmasse bei Stromstärken von 1.2 A bis 0.6 A in Abständen von 0.1 A auszuführen. Wenn sich die Kondensatmassen zweier Messungen bei gleicher Stromstärke stark unterscheiden, ist eine dritte Bestimmung durchzuführen. Da die Wassermenge im Dewargefäß während des Versuchs abnimmt, ist periodisch der Wasserstand zu kontrollieren und gegebenfalls bei ausgeschalteter Spannungsquelle Wasser nachzufüllen. d) Meßprotokoll I, A U, V Messung 1 Masse Kolben leer, g Messung 2 Masse Kolben + Kondensat, g Masse Kolben leer, g Masse Kolben + Kondensat, g 1.2 1.1 .. e) Arbeitsschutz Das Dewargefäß ist ein Vakuummantelzylinder, der vor Spannungen und Stoß zu schützen ist (Implosionsgefahr). Beim Abnehmen und Aufsetzen des Verschlußstopfens Schutzbrille tragen! Achten Sie darauf, daß der Tauchsieder vollständig in die Flüssigkeit taucht, und nehmen Sie ihn nur bei ausgeschalteter Spannungsquelle aus dem Wasser! 2 Auswertung Die durch die Heizung verbrauchte elektrische Energie ist gleich der dem Wasser zugeführten Wärmemenge U·I·t=q (1) Dabei ist U die Spannung in Volt, I die Stromstärke in Ampere, t die Zeit in Sekunden, und q die Wärmemenge in J. Die zugeführte Wärmemenge ist der produzierten Stoffmenge Kondensat proportional. Der Proportionalitätsfaktor ist die molare Verdampfungsenthalpie: q = ∆ VH · n + C (2) C ist die Verlustwärme in der Zeit t, die keinen Beitrag zur Verdampfung des Wassers leistet, wenn die Messung in einem thermisch schlecht isolierten System erfolgt. Erfolgt die Kondensatnahme immer über den gleichen Zeitbereich (im Versuch 300 s), kann man davon ausgehen, daß C eine Konstante ist. Dann kann man ∆VH als Steigung der Geraden q = f(n) mittels linearer Regression oder grafischer Auswertung erhalten. Die Verlustwärme ist über den Achsenabschnitt zugänglich. Die Verlustleistung ergibt sich nach Division der Verlustwärme durch die Zeit t. Als Fehler der molaren Verdampfungsenthalpie und der Verlustwärme sind die Fehler der Regressionskoeffizienten anzugeben. Diskussion der Ergebnisse Fehlerbetrachtung Schätzen Sie die Beträge folgender experimenteller Fehler: Zeitmessung, Tropfenfehler (Kondensat), Wägung, Ablesegenauigkeit der elektrischen Meßgeräte und ihre Anzeigeschwankungen! Vergleichen Sie Ihr Ergebnis mit dem Literaturwert (∆VH = 40.68 kJ/mol bei 100 °C) und diskutieren Sie, welche Fehlerquellen eine positive, welche eine negative Abweichung von diesem Wert verursachen! Berechnen Sie den Einfluß auf ∆VH anhand zweier Meßwerte des Versuchs, wenn Stromstärke und Spannung durch Netzschwankungen um 5% unsicher sind! Interpretation des Ergebnisses Vergleichen Sie die molaren Verdampfungsenthalpien von Wasser mit der anderer bei Zimmertemperatur flüssiger Substanzen (z.B. Ethanol, Diethylether, Benzen)! Geben Sie Ursachen für Unterschiede an! Stellt die von Ihnen bestimmte Größe die molare Standardverdampfungsenthalpie von Wasser dar? Begründen Sie Ihre Antwort! 3