Poster - context
Werbung
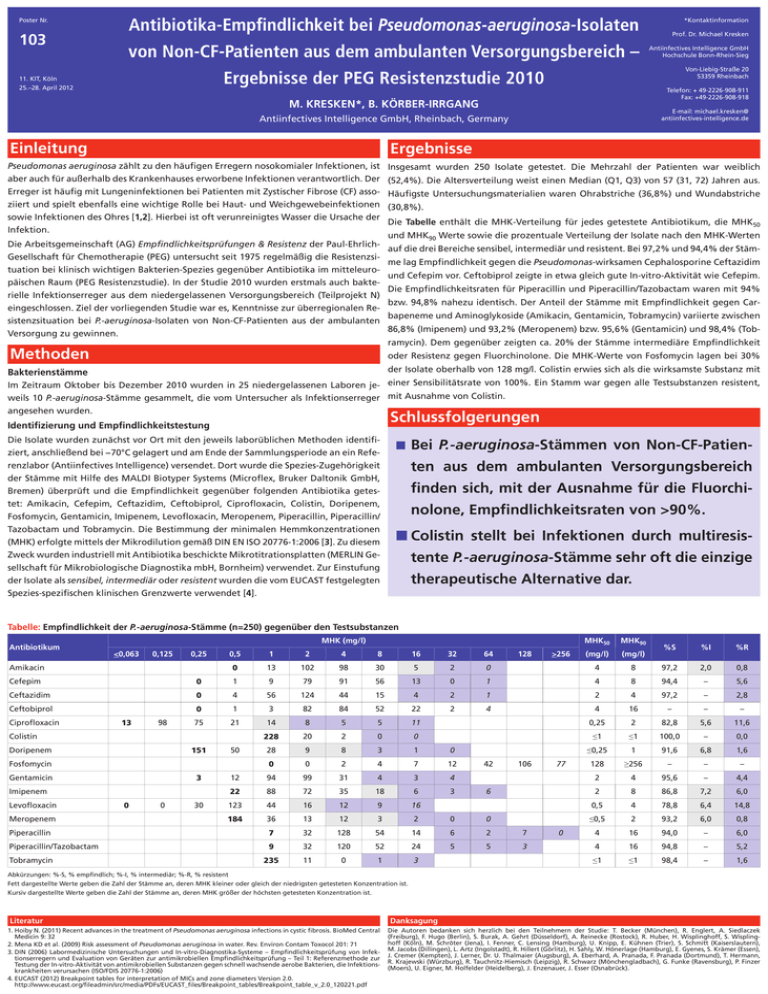
Poster Nr. 103 *Kontaktinformation Antibiotika-Empfindlichkeit bei Pseudomonas-aeruginosa-Isolaten von Non-CF-Patienten aus dem ambulanten Versorgungsbereich – Prof. Dr. Michael Kresken Antiinfectives Intelligence GmbH Hochschule Bonn-Rhein-Sieg Von-Liebig-Straße 20 53359 Rheinbach Ergebnisse der PEG Resistenzstudie 2010 11. KIT, Köln 25.–28. April 2012 Telefon: + 49-2226-908-911 Fax: +49-2226-908-918 M. KRESKEN*, B. KÖRBER-IRRGANG E-mail: michael.kresken@ antiinfectives-intelligence.de Antiinfectives Intelligence GmbH, Rheinbach, Germany Einleitung Ergebnisse Pseudomonas aeruginosa zählt zu den häufigen Erregern nosokomialer Infektionen, ist aber auch für außerhalb des Krankenhauses erworbene Infektionen verantwortlich. Der Erreger ist häufig mit Lungeninfektionen bei Patienten mit Zystischer Fibrose (CF) assoziiert und spielt ebenfalls eine wichtige Rolle bei Haut- und Weichgewebeinfektionen sowie Infektionen des Ohres [1,2]. Hierbei ist oft verunreinigtes Wasser die Ursache der Infektion. Insgesamt wurden 250 Isolate getestet. Die Mehrzahl der Patienten war weiblich Die Arbeitsgemeinschaft (AG) Empfindlichkeitsprüfungen & Resistenz der Paul-EhrlichGesellschaft für Chemotherapie (PEG) untersucht seit 1975 regelmäßig die Resistenzsituation bei klinisch wichtigen Bakterien-Spezies gegenüber Antibiotika im mitteleuropäischen Raum (PEG Resistenzstudie). In der Studie 2010 wurden erstmals auch bakterielle Infektionserreger aus dem niedergelassenen Versorgungsbereich (Teilprojekt N) eingeschlossen. Ziel der vorliegenden Studie war es, Kenntnisse zur überregionalen Resistenzsituation bei P.-aeruginosa-Isolaten von Non-CF-Patienten aus der ambulanten Versorgung zu gewinnen. (52,4%). Die Altersverteilung weist einen Median (Q1, Q3) von 57 (31, 72) Jahren aus. Häufigste Untersuchungsmaterialien waren Ohrabstriche (36,8%) und Wundabstriche (30,8%). Die Tabelle enthält die MHK-Verteilung für jedes getestete Antibiotikum, die MHK50 und MHK90 Werte sowie die prozentuale Verteilung der Isolate nach den MHK-Werten auf die drei Bereiche sensibel, intermediär und resistent. Bei 97,2% und 94,4% der Stämme lag Empfindlichkeit gegen die Pseudomonas-wirksamen Cephalosporine Ceftazidim und Cefepim vor. Ceftobiprol zeigte in etwa gleich gute In-vitro-Aktivität wie Cefepim. Die Empfindlichkeitsraten für Piperacillin und Piperacillin/Tazobactam waren mit 94% bzw. 94,8% nahezu identisch. Der Anteil der Stämme mit Empfindlichkeit gegen Carbapeneme und Aminoglykoside (Amikacin, Gentamicin, Tobramycin) variierte zwischen 86,8% (Imipenem) und 93,2% (Meropenem) bzw. 95,6% (Gentamicin) und 98,4% (Tobramycin). Dem gegenüber zeigten ca. 20% der Stämme intermediäre Empfindlichkeit Methoden oder Resistenz gegen Fluorchinolone. Die MHK-Werte von Fosfomycin lagen bei 30% Bakterienstämme der Isolate oberhalb von 128 mg/l. Colistin erwies sich als die wirksamste Substanz mit Im Zeitraum Oktober bis Dezember 2010 wurden in 25 niedergelassenen Laboren je- einer Sensibilitätsrate von 100%. Ein Stamm war gegen alle Testsubstanzen resistent, weils 10 P.-aeruginosa-Stämme gesammelt, die vom Untersucher als Infektionserreger mit Ausnahme von Colistin. angesehen wurden. Schlussfolgerungen Identifizierung und Empfindlichkeitstestung Die Isolate wurden zunächst vor Ort mit den jeweils laborüblichen Methoden identifiziert, anschließend bei −70°C gelagert und am Ende der Sammlungsperiode an ein Referenzlabor (Antiinfectives Intelligence) versendet. Dort wurde die Spezies-Zugehörigkeit der Stämme mit Hilfe des MALDI Biotyper Systems (Microflex, Bruker Daltonik GmbH, Bremen) überprüft und die Empfindlichkeit gegenüber folgenden Antibiotika getestet: Amikacin, Cefepim, Ceftazidim, Ceftobiprol, Ciprofloxacin, Colistin, Doripenem, Fosfomycin, Gentamicin, Imipenem, Levofloxacin, Meropenem, Piperacillin, Piperacillin/ Tazobactam und Tobramycin. Die Bestimmung der minimalen Hemmkonzentrationen (MHK) erfolgte mittels der Mikrodilution gemäß DIN EN ISO 20776-1:2006 [3]. Zu diesem Zweck wurden industriell mit Antibiotika beschickte Mikrotitrationsplatten (MERLIN Gesellschaft für Mikrobiologische Diagnostika mbH, Bornheim) verwendet. Zur Einstufung der Isolate als sensibel, intermediär oder resistent wurden die vom EUCAST festgelegten Spezies-spezifischen klinischen Grenzwerte verwendet [4]. Bei P.-aeruginosa-Stämmen von Non-CF-Patien- ten aus dem ambulanten Versorgungsbereich finden sich, mit der Ausnahme für die Fluorchinolone, Empfindlichkeitsraten von >90%. Colistin stellt bei Infektionen durch multiresistente P.-aeruginosa-Stämme sehr oft die einzige therapeutische Alternative dar. Tabelle: Empfindlichkeit der P.-aeruginosa-Stämme (n=250) gegenüber den Testsubstanzen Antibiotikum MHK (mg/l) <0,063 0,125 0,25 Amikacin 128 >256 MHK50 MHK90 (mg/l) (mg/l) %S %I %R 0,5 1 2 4 8 16 32 64 0 13 102 98 30 5 2 0 4 8 97,2 2,0 0,8 Cefepim 0 1 9 79 91 56 13 0 1 4 8 94,4 – 5,6 Ceftazidim 0 4 56 124 44 15 4 2 1 2 4 97,2 – 2,8 Ceftobiprol 0 1 3 82 84 52 22 2 4 4 16 – – – 75 21 14 8 5 5 11 0,25 2 82,8 5,6 11,6 228 20 2 0 0 ≤1 ≤1 100,0 – 0,0 28 9 8 3 1 0 ≤0,25 1 91,6 6,8 1,6 0 0 2 4 7 12 128 ≥256 – – – 12 94 99 31 4 3 4 2 4 95,6 – 4,4 22 88 72 35 18 6 3 2 8 86,8 7,2 6,0 123 44 16 12 9 16 0,5 4 78,8 6,4 14,8 184 36 13 12 3 2 0 0 ≤0,5 2 93,2 6,0 0,8 Piperacillin 7 32 128 54 14 6 2 7 4 16 94,0 – 6,0 Piperacillin/Tazobactam 9 32 120 52 24 5 5 3 4 16 94,8 – 5,2 235 11 0 1 3 ≤1 ≤1 98,4 – 1,6 Ciprofloxacin 13 98 Colistin Doripenem 151 50 Fosfomycin Gentamicin 3 Imipenem Levofloxacin Meropenem Tobramycin 0 0 30 42 106 77 6 0 Abkürzungen: %-S, % empfindlich; %-I, % intermediär; %-R, % resistent Fett dargestellte Werte geben die Zahl der Stämme an, deren MHK kleiner oder gleich der niedrigsten getesteten Konzentration ist. Kursiv dargestellte Werte geben die Zahl der Stämme an, deren MHK größer der höchsten getesteten Konzentration ist. Literatur 1. Hoiby N. (2011) Recent advances in the treatment of Pseudomonas aeruginosa infections in cystic fibrosis. BioMed Central Medicin 9: 32 2. Mena KD et al. (2009) Risk assessment of Pseudomonas aeruginosa in water. Rev. Environ Contam Toxocol 201: 71 3. DIN (2006) Labormedizinische Untersuchungen und In-vitro-Diagnostika-Systeme – Empfindlichkeitsprüfung von Infektionserregern und Evaluation von Geräten zur antimikrobiellen Empfindlichkeitsprüfung – Teil 1: Referenzmethode zur Testung der In-vitro-Aktivität von antimikrobiellen Substanzen gegen schnell wachsende aerobe Bakterien, die Infektionskrankheiten verursachen (ISO/FDIS 20776-1:2006) 4. EUCAST (2012) Breakpoint tables for interpretation of MICs and zone diameters Version 2.0. http://www.eucast.org/fileadmin/src/media/PDFs/EUCAST_files/Breakpoint_tables/Breakpoint_table_v_2.0_120221.pdf Danksagung Die Autoren bedanken sich herzlich bei den Teilnehmern der Studie: T. Becker (München), R. Englert, A. Siedlaczek (Freiburg), F. Hugo (Berlin), S. Burak, A. Gehrt (Düsseldorf), A. Reinecke (Rostock), R. Huber, H. Wisplinghoff, S. Wisplinghoff (Köln), M. Schröter (Jena), I. Fenner, C. Lensing (Hamburg), U. Knipp, E. Kühnen (Trier), S. Schmitt (Kaiserslautern), M. Jacobs (Dillingen), L. Artz (Ingolstadt), R. Hillert (Görlitz), H. Sahly, W. Hönerlage (Hamburg), E. Gyenes, S. Krämer (Essen), J. Cremer (Kempten), J. Lerner, Dr. U. Thalmaier (Augsburg), A. Eberhard, A. Pranada, F. Pranada (Dortmund), T. Hermann, R. Krajewski (Würzburg), R. Tauchnitz-Hiemisch (Leipzig), R. Schwarz (Mönchengladbach), G. Funke (Ravensburg), P. Finzer (Moers), U. Eigner, M. Holfelder (Heidelberg), J. Enzenauer, J. Esser (Osnabrück).