OC 3 - Stereochemie
Werbung

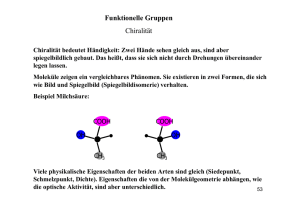
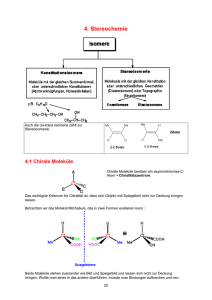
OC 3 - Stereochemie Allgemeine Hintergründe Folie Nr. 2 Einführung • 3-dimensionale Anordnung (relativ/absolut) in der realen Welt sind extrem wichtig Bild rechts: http://de.wikipedia.org/wiki/Pfefferminz, 9.10.2013, 21:53. Bild links: http://www.pharmawiki.ch/wiki/index.php?wiki=Kuemmel, 9.10.2013, 21:13. Voraussetzung • • • • • • • • • • Folie Nr. 3 Isomere Enantiomere Diastereomere Epimere Konstitution Konfiguration Konformere/Rotamere Tautomere Racemat Absolute Konfiguration : CIP (R/S) Fischer (D/L) Folie Nr. 4 Literatur Allgemein • • R. Brückner, Organische Reaktionen, Stereochemie, Moderne Synthesemethoden, Spektrum F. A. Carey, R. J. Sundberg, Organische Chemie, Wiley-VCH Spezialfälle • E. L. Eliel, S. H. Wilen, Stereochemistry of Organic Compounds, Wiley Interscience Bild rechts: http://www.organische-chemie.ch/buecher/besprechungen/3827411890.shtm, 9.10.2013, 22:04. Bild mitte: http://www.amazon.de/Organische-Chemie-Ein-weiterf%C3%BChrendes-Lehrbuch/dp/3527292179, 9.10.2013, 22:09. Bild links: http://www.amazon.de/Stereochemistry-Organic-Compounds-Ernest-Eliel/dp/0471016705, 9.10.2013, 22:06. Folie Nr. 5 Nachtrag zur Isomerie • Valenzisomerie: Isomerie durch Umgruppierung von Molekülteilen, Spezialfall der Konstitutionsisomerie ( - und -Elektronen sind beteiligt; pericyclische Reaktionen) Cope-Umlagerung: Folie Nr. 6 Symmetrie-Elemente Diskrete Moleküle, keine Festkörper • Inversionszentrum: i • Spiegelebene: m • Drehachse: Cn C1® trivial C2® chiral C3® chiral wenn alleiniges Symmetrieelement Folie Nr. 7 Optische Aktivität/Chiralität Wichtig: chiral ¹ optisch aktiv Drehsinn ist eine Eigenschaft des Gesamtmoleküls und nicht von Molekülfragmenten Folie Nr. 8 Axiale Chiralität „Nicht identische, paarweise Anordnung von Substituenten um eine Achse“ Weitere C2-Sym. Molekülklassen: Atropisomere Spiroverbindungen Folie Nr. 9 Konfigurationsbestimmung CIP-Zusatzregel aR (früher Ra, R) egal welche Blickrichtung ! aR aS Folie Nr. 10 (aS)-BINOL aR Rezept: • • • Hinweis: ab 2015 soll P/M verwendet werden aS ® P aR ® M Newman-Projektion CIP Priorität (2®3) aS (entgegen Uhrzeigersinn) aR (im Uhrzeigersinn) Folie Nr. 11 Planare Chiralität faciale Belegung einer Seite ® Chiralität (nicht auf sterogene Achsen oder Zentren zurückführbar) * pR 2 pR 1 3 [2,2]-Paracyclophan Rezept: * Leitatom : direkt an Atom aus Chiralitätsebene gebunden 1,2,3 : die ersten drei Atome in der Ebene Weg & Reihenfolge nach CIP pR : im Uhrzeigersinn pS : gegen Uhrzeigersinn Folie Nr. 12 Aren-Komplexe 5 1 Rezept: F 2 2 1 6 OCH3 CrCO3 Fe • Cl • • Fe > F > C-2 >C-5 1 2 F Cr > Cl > C-2 > C-6 (S) 5 Fe drehen Cl Cl 6 1 2 Cr Cr (R) 6 2 C-1 mit höchter Priorität suchen CIP Benennung analog zu sterogenen Zentren Folie Nr. 13 Helicale Chiralität Helices in DNA, Peptide, Polyethylenglycole… 4 1 3 2 3 2 4 1 P : im Uhrzeigersinn M : entgegen Uhrzeigersinn (M)-( )-Hexahelicen 1 3 4 2 (P)-(+)-Hexahelicen 1 3 2 4 Sterogene Einheit auf syn-periplanare Anordnung zurückzufühern Folie Nr. 14 Merkweise: linke Hand: P Bild Helix: http://de.wikipedia.org/wiki/Helix, 9.10.2013, 22:51. Bild Hand: Privatbesitz von Anna-Rebekka Schneider. rechte Hand: M Folie Nr. 15 Propellerartige Moleküle Stereodiskreptoren bleiben immer gleich wegen PropellerGeometrie Folie Nr. 16 Topizität von Seiten Stereoselektive Reaktionen: wichtig von welcher Seite der Angriff erfolgt Betrachtung von Halbräumen der Moleküle Vorder- und Rückseite identisch homotop Vorderseite: Si Rückseite: Re enantiotrope Seite diastereotope Seiten heterotop Folie Nr. 17 Prochiralität Hanson 1966 (eingeführt) Izumi 1977 (verfeinert) Prochirale Liganden sind Moleküle, welche durch Transformation zu chiralen Molekülen werden z.B. OH 5 H 1 4 2 3 5 Prochiralitätszentren (axial/äquatorial) pro R Folie Nr. 18 Prochirale Seiten Halbräume: durch Additionsreaktionen an sp2 Chiralitätszentren Bezeichung über Re/Si Si (Z) –1,2-Dichlorethan (Spiegelung) (E)-1,2-Dichlorethan (Drehung) Folie Nr. 19 Topologische Beziehung homotop heterotop • • • • topologisch äquivalent identische Umgebung enantiotop • • Pro-S/pro-R Re/Si Topologisch nicht äquivalent verschiedene Umgebung diastereotop prochiral