- Mettler Toledo
Werbung
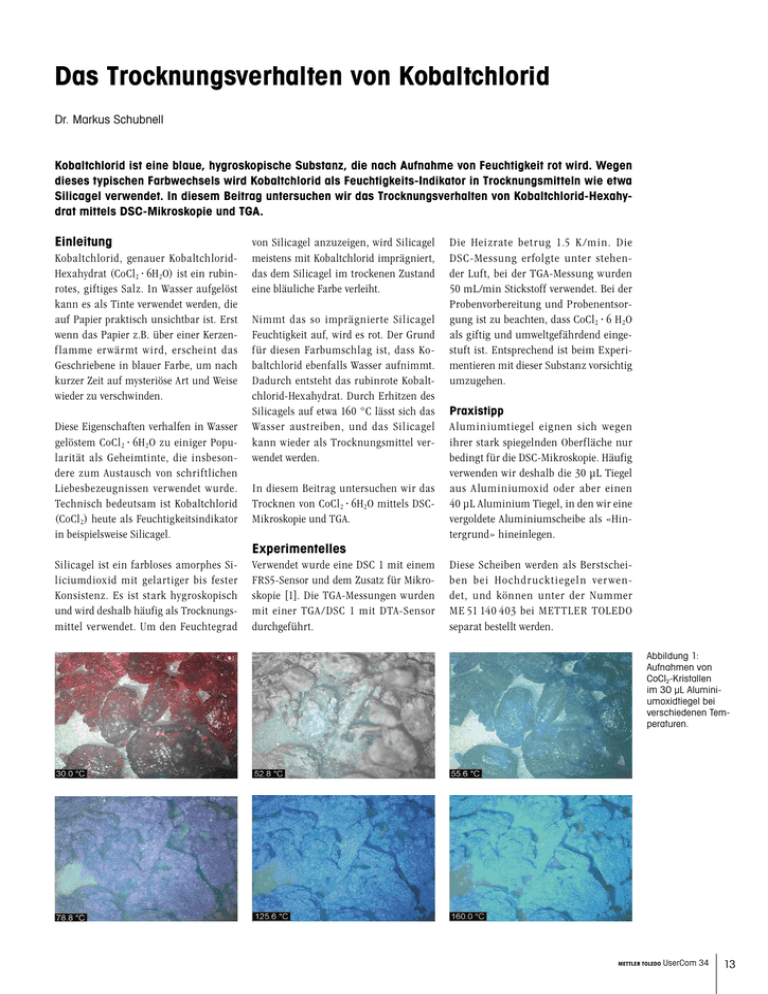
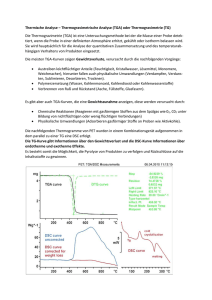
Das Trocknungsverhalten von Kobaltchlorid Dr. Markus Schubnell Kobaltchlorid ist eine blaue, hygroskopische Substanz, die nach Aufnahme von Feuchtigkeit rot wird. Wegen dieses typischen Farbwechsels wird Kobaltchlorid als Feuchtigkeits-Indikator in Trocknungsmitteln wie etwa Silicagel verwendet. In diesem Beitrag untersuchen wir das Trocknungsverhalten von Kobaltchlorid-Hexahydrat mittels DSC-Mikroskopie und TGA. Einleitung Kobaltchlorid, genauer KobaltchloridHexahydrat (CoCl2 6H2O) ist ein rubinrotes, giftiges Salz. In Wasser aufgelöst kann es als Tinte verwendet werden, die auf Papier praktisch unsichtbar ist. Erst wenn das Papier z.B. über einer Kerzenflamme erwärmt wird, erscheint das Geschriebene in blauer Farbe, um nach kurzer Zeit auf mysteriöse Art und Weise wieder zu verschwinden. Diese Eigenschaften verhalfen in Wasser gelöstem CoCl2 6H2O zu einiger Popularität als Geheimtinte, die insbesondere zum Austausch von schriftlichen Liebesbezeugnissen verwendet wurde. Technisch bedeutsam ist Kobaltchlorid (CoCl2) heute als Feuchtigkeitsindikator in beispielsweise Silicagel. Silicagel ist ein farbloses amorphes Siliciumdioxid mit gelartiger bis fester Konsistenz. Es ist stark hygroskopisch und wird deshalb häufig als Trocknungsmittel verwendet. Um den Feuchtegrad von Silicagel anzuzeigen, wird Silicagel meistens mit Kobaltchlorid imprägniert, das dem Silicagel im trockenen Zustand eine bläuliche Farbe verleiht. Nimmt das so imprägnierte Silicagel Feuchtigkeit auf, wird es rot. Der Grund für diesen Farbumschlag ist, dass Kobaltchlorid ebenfalls Wasser aufnimmt. Dadurch entsteht das rubinrote Kobaltchlorid-Hexahydrat. Durch Erhitzen des Silicagels auf etwa 160 °C lässt sich das Wasser austreiben, und das Silicagel kann wieder als Trocknungsmittel verwendet werden. In diesem Beitrag untersuchen wir das Trocknen von CoCl2 6H2O mittels DSCMikroskopie und TGA. Experimentelles Verwendet wurde eine DSC 1 mit einem FRS5-Sensor und dem Zusatz für Mikroskopie [1]. Die TGA-Messungen wurden mit einer TGA/DSC 1 mit DTA-Sensor durchgeführt. Die Heizrate betrug 1.5 K /min. Die DSC-Messung erfolgte unter stehender Luft, bei der TGA-Messung wurden 50 mL/min Stickstoff verwendet. Bei der Probenvorbereitung und Probenentsorgung ist zu beachten, dass CoCl2 6 H2O als giftig und umweltgefährdend eingestuft ist. Entsprechend ist beim Experimentieren mit dieser Substanz vorsichtig umzugehen. Praxistipp Aluminiumtiegel eignen sich wegen ihrer stark spiegelnden Oberfläche nur bedingt für die DSC-Mikroskopie. Häufig verwenden wir deshalb die 30 μL Tiegel aus Aluminiumoxid oder aber einen 40 μL Aluminium Tiegel, in den wir eine vergoldete Aluminiumscheibe als «Hintergrund» hineinlegen. Diese Scheiben werden als Berstscheiben bei Hochdrucktiegeln ver wendet, und können unter der Nummer ME 51 140 403 bei METTLER TOLEDO separat bestellt werden. Abbildung 1: Aufnahmen von CoCl2-Kristallen im 30 μL Aluminiumoxidtiegel bei verschiedenen Temperaturen. METTLER TOLEDO UserCom 34 13 Die Messungen mit Kobaltchlorid wurden in einem 30 μL Tiegel aus Aluminiumoxid durchgeführt. Applikationen Ergebnisse In Abbildung 1 sind einige während dem Aufheizen der Probe gemachte Aufnahmen dargestellt. Der abgebildete Ausschnitt ist in Wirklichkeit etwa 1.5 x 2.3 mm gross. Die Probe zeigte anfangs die für das Hexahydrate charakteristische rötliche Färbung. Die Probe wird dann immer heller bis bei etwa 53 °C schlagartig ein Farbwechsel auftritt. Bei noch höheren Temperaturen sind weitere Farbänderungen erkennbar: so ändert die Farbe der Probe zwischen 100 °C und 120 °C Abbildung 2: DSC-Signal und mittlere Bildhelligkeit von CoCl2 6H2O in Abhängigkeit von der Temperatur. Abbildung 3: TGA/DSC-Messungen von Kobaltchlorid. von lila nach blau, und bei 160 °C ist die Probe hellblau. Um diese Unterschiede zu quantifizieren, kann für jedes Bild eine mittlere Helligkeit berechnet werden. Daraus ergibt sich eine Kurve für die mittlere Bildhelligkeit in Abhängigkeit von der Temperatur. Diese Helligkeitskurve ist zusammen mit der DSCMesskurve in Abbildung 2 dargestellt. Die eingetragenen Nummern entsprechen den Bildern gemäss Abbildung 1. Die DSC-Kurve (blaue Kurve in Abbildung 2) zeigt bis etwa 80 °C einen breiten endothermen Peak, dem ein scharfer Peak bei 53 °C (Onset) überlagert ist. Ab 104 °C und 130 °C sind 2 weitere endotherme Peaks zu erkennen. Die Helligkeit der Bilder (rote Kurve in Abbildung 2) nimmt zunächst langsam zu. Bei etwa 53 °C reduziert sich die Helligkeit schlagartig. Anschliessend nimmt sie in verschiedenen Stufen wieder zu. Es ist offensichtlich, dass den beiden unterschiedlichen Kurven die gleichen physikalisch-chemischen Effekte zu Grunde liegen. Die Probe verliert von Beginn an Wasser, wobei die Verdunstungsrate mit zunehmender Temperatur grösser wird (Kurve wird zunehmend endotherm). Bei etwa 53 °C ändert das Material seine Kristallstruktur, was zu dem markanten Farbumschlag bzw. dem schmalen endothermen Peak auf der DSC-Kurve führt. Betrachtet man die Bilder der Probe um 53 °C genauer, erkennt man auf der Oberfläche der Pulverkörner kleine Wassertröpfchen. Das bedeutet, dass als Folge der fest-festUmwandlung zumindest ein Teil des verbleibenden Kristallwassers aus dem Kristallgitter an die Kristalloberfläche ausgetrieben wurde. Durch das Abtrocknen der Kristallite ändert sich deren Farbe kontinuierlich. Dieser Prozess ist bei etwa 80 °C beendet. Die beiden stufenartigen Änderungen in der Helligkeit bzw. die beiden breiten endothermen Peaks auf der DSC-Kurve sind ebenfalls auf die Abgabe von noch gebundenem Kristallwasser zurückzuführen. Um diese Interpretation der DSC-Messungen zu belegen, wurde mit einer TGA/DSC auch das Gewicht einer Kobaltchlorid-Hexahydrat-Probe in Abhängigkeit von der Temperatur gemessen. Die entsprechenden Ergebnisse zeigt Abbildung 3. Die rote Kurve ist die Gewichtsverlustkurve, die blaue Kurve deren erste Ableitung und die grüne Kurve das DSC-Signal, welches mit der TGA/DSC gemessen wird. Man erkennt, dass die Probe bereits ab Raumtemperatur Wasser abgibt. Ab etwa 100 °C und 120 °C treten zwei weitere Gewichtsverluststufen auf. Die quantitative Auswertung der Stufen ergibt, dass Kobaltchlorid-Hexahydrat die 6 Wassermoleküle stöchiometrisch im Verhältnis von 4 zu 1 zu 1 abgibt. Kobaltchlorid kann somit sowohl als Hexahy- 14 METTLER TOLEDO UserCom 34 drat, als Dihydrat oder als Monohydrat vorkommen. Betrachtet man die erste Ableitung der Gewichtskurve, so stellt man fest, dass bei der Temperatur, bei der auf der DSC-Kurve die fest-fest Umwandlung beginnt, die Geschwindigkeit der Gewichtsabnahme kurzzeitig schneller zunimmt (siehe Pfeil in der Abbildung 3). Dies lässt sich durch das früher erwähnte Austreiben des Kristallwassers auf die Kristalloberfläche während der fest-fest Umwandlung erklären: Wasser auf den Kristallen verdunstet rascher als Wasser, das durch Diffusion zuerst an die Oberfläche gelangen muss. Aus diesem Grunde nimmt die Gewichtsverlustrate kurzzeitig stärker zu. Schlussfolgerungen Bei der DSC-Mikroskopie werden neben einer DSC-Kurve mit einer Kamera gleichzeitig Bilder der Probe aufgenommen, mit denen visuell erkennbare Veränderungen dokumentiert und festgestellt werden können. Es kann dabei unterschieden werden zwischen: • farblichen Änderungen als z.B. Folge von chemischen Reaktionen (Zersetzung) oder Polymorphie, und • Änderungen der «Geometrie» z.B. als Folge von Schmelzen/Fliessen, Schrumpfen, Bewegungen der Probe während Glasumwandlungen oder festfest-Umwandlungen, Rissbildung etc. Diese Effekte führen auf der DSC-Kurve zu mehr oder weniger deutlichen Peaks, die sich zusammen mit der Bildinformation häufig zweifelsfrei physikalischchemischen Vorgängen zuordnen lassen. Die DSC-Mikroskopie ist damit ein sehr nützliches Hilfsmittel zur Interpretation von DSC-Messkurven. References [1] M. Schubnell, Thermochromism of HgI2, UserCom 26, 21–22. Einleitung Im DMA-Schermodus werden zwei identische Proben zwischen den drei Scherbacken des Scherprobenhalters eingespannt. Die beiden äusseren Backen sind in der Einspannvorrichtung fixiert, während die oszillierende Kraft auf die mittlere Backe einwirkt. ­ Der Schermodus ist vielseitig anwendbar auf viele Materialien unterschiedlichster physikalischer Eigenschaften und Geometrien, wie weiche Elastomere, harte Verbundwerkstoffe, viskose Flüssigkeiten, Pulver, Kunststofffolien, etc.. Es folgen einige allgemeine Richtlinien: •Geometrie der Proben •Werkzeuge zur Herstellung der Proben •Einspannen und Vordeformation •Einsetzen in die Einspannvorrichtung •Messungen unterhalb Raum­ METTLER TOLEDO UserCom 34 15