Grenzflächenprozesse und Elektrodenstruktur
Werbung

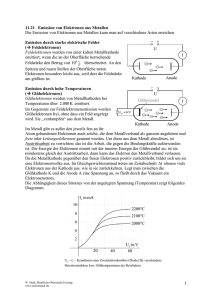
24.10.2011 / Heinz Wenzl Grenzflächenprozesse und Elektrodenstruktur Die an der Grenzfläche stattfindende Reaktion (anodenseitig Bildung von n Ionen im Elektrolyten und n "freien" Elektronen in der Aktivmasse, kathodenseitig Verbrauch von m Ionen aus dem Elektrolyten und m Elektronen aus der Aktivmasse) kann nicht an der ganzen Oberfläche stattfinden, da das aufgebaute elektrische Feld Reaktionen in unmittelbarer Nähe hemmt. Für die Anode einer Lithium-Ionen-Zelle: Die Bewegung eines Lithium-Ions aus dem Graphitgitter muss gegen das sich bereits durch andere Ionen gebildete lokale Potential erfolgen und die dafür erforderliche Arbeit (Lithium-Ion aus Abstand unendlich muss in das lokale Potential bewegt werden) wird nicht mehr durch das chemische Potential des Lithiums in Graphit gedeckt. Die Ionendichte auf der Anode ist somit begrenzt. Gleiches gilt für die Kathode. Die gebildeten Ionen unterliegen einem starken elektrischen Feld 1V/nm = 109 V/m). Im thermodynamischen Gleichgewicht ist die Zahl der sich bildenden und wieder zurückverwandelnden Elektronen gleich (Austauschstromdichte). Vereinfachtes Bild: 1. Graphit, der Lithium enthält, ein Lithium-Atom pro C6- Ring 2. Entladung: Lithium-Ionen werden durch den Elektrolyten von der Anode zur Kathode transportiert und die Elektronen durch die Last von der Anode zur Kathode. 3. Die Lithium-Atome in Graphitringen, die sich nicht unmittelbar an der Grenzfläche zum Elektrolyt befinden, müssen durch das Graphit an die Oberfläche "diffundieren". Die Ionentransportgeschwindigkeit im Graphit ist somit ein limitierender Faktor für die Entladegeschwindigkeit. 4. Die Kapazität der Elektrode ist proportional zur Zahl der C6-Ringe. Was passiert, wenn die Anode aus einem "Graphiteinkristall" bestehen würde? Bei der Anfangsreaktion werden Graphitringe unmittelbar an der Grenzfläche ihr Lithium abgeben – das Lithium-Ion hat nur einen ganz kurzen Weg. Das Elektron muss durch den ganzen Graphit bis zum Stromkollektor transportiert werden. Am Ende der Entladung wird der Graphitring am Stromkollektor entladen. Der Lithiumtransportweg ist lang. Der Elektronenpfad verändert sich nicht, da ja erst bei Übertritt des Lithiums in den Elektrolyten das Elektron frei wird. 5. Die Ionen verteilen sich gleichmäßig im Graphit, wenn die Stromdichten klein genug im Vergleich zum Ionentransport im Gitter sind. 6. Eine Verkürzung des Weges kann nur erreicht werden, wenn die Graphitkristalle klein werden und das Lithium in alle Richtungen den Graphit verlassen kann. Das bedeutet aber, dass der Graphitkristall von allen Seiten von Elektrolyt umgeben sein muss, und gleichzeitig jeder Graphitkristall über eine Elektronen leitende Struktur mit dem Stromkollektor verbunden ist. 7. Es muss somit eine Struktur vorhanden sein, die sowohl Elektronen als auch Ionen leitet. Je besser die Leitfähigkeit, desto geringer sind die Spannungsverluste bei der Ladung und Entladung. Die Elektrodenstruktur muss somit eine Mischstruktur von Ionen und Elektronen leitendem Material sein, wobei die Elektronenleitung von der makroskopischen Elektroden/Elektrolytgrenzfläche bis zum Stromkollektor alle Kristallite einschließen muss, und die Ionenleitung im Elektrolyten von Kristalliten unmittelbar am Stromkollektor bis hin zum Elektrolytreservoir zwischen den beiden Elektroden reichen muss. Die Graphitkristallite müssen sowohl Elektronen als auch Ionen leitend sein. Bei Ladung verläuft der Prozess umgekehrt. Durch die Ladeenergie (Einprägen eines Stroms gegen das thermodynamische Gleichgewicht) werden dem Graphit Elektronen zugeführt, die durch Ionen aus dem Elektrolyt ausgeglichen werden. Wenn der Ladestrom gering ist, dann befinden sich die Ionen im Gitter immer in einer Gleichverteilung. Das Graphit nimmt in seinem Volumen zu, bis das Graphit voll beladen ist. Vollbeladen ist ca. C6Li0,9. Wenn kein Lithium mehr im Graphit ist, dann wird der folgende Ladevorgang erschwert, so dass "entladenes" Graphit ca. 0,1 Lithium hat: C6Li0,1; Es gibt somit keine feste Molekülstruktur sondern eine Einlagerung in einen Kristallverbund: Interkalation. Reaktionsgleichung Die beiden Reaktionen auf der Kathode und Anode sind durch das, über den Elektrolyten transportierte Ion miteinander gekoppelt. In Entladerichtung Anodenseitig: A → C + n Ion + n Elektronen Kathodenseitig; B + m Ionen plus m Elektronen → D Summe: A+ B → C + D A, B, C und D können Atome, Moleküle oder mehrere Moleküle/Atome sein. Die Eigenschaften von A und C und B und D bzgl. Kristallstruktur, Volumen, elektrischer Leitfähigkeit, thermischer Leitfähigkeit und Kapazität usw. können sehr unterschiedlich sein. Bei Interkalationsreaktionen ist der Unterschied gering, bei Rekonstitutionsmechanismen aber erheblich.