Übung zur Vorlesung „Organische Chemie I“ (SS 2012)
Werbung
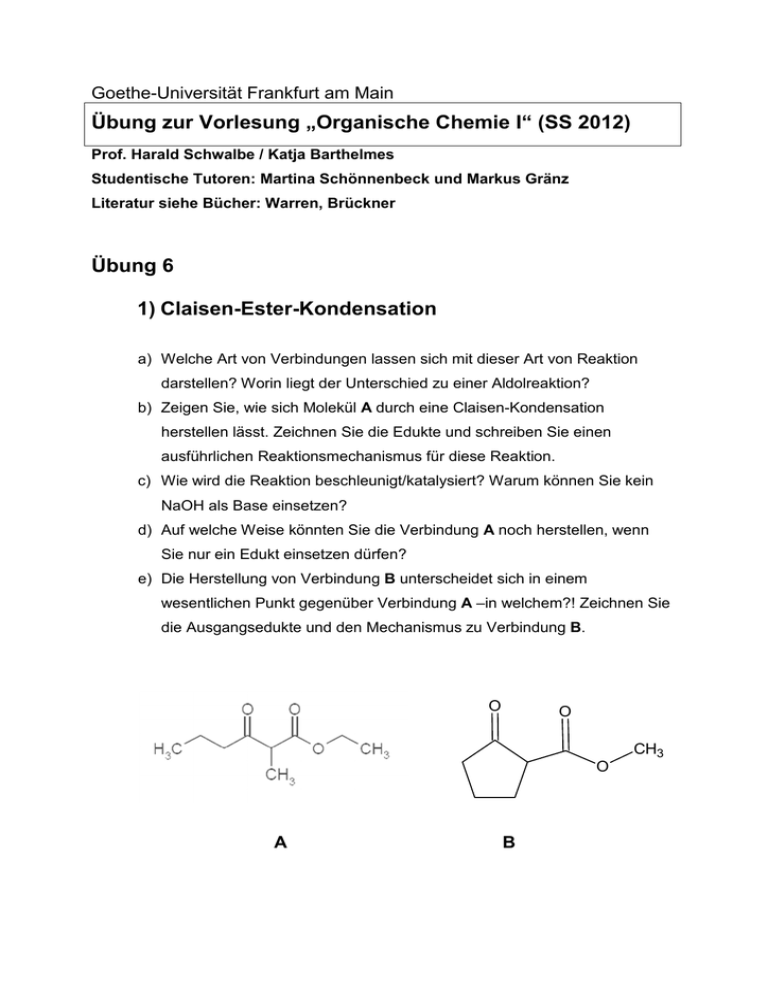
Goethe-Universität Frankfurt am Main Übung zur Vorlesung „Organische Chemie I“ (SS 2012) Prof. Harald Schwalbe / Katja Barthelmes Studentische Tutoren: Martina Schönnenbeck und Markus Gränz Literatur siehe Bücher: Warren, Brückner Übung 6 1) Claisen-Ester-Kondensation a) Welche Art von Verbindungen lassen sich mit dieser Art von Reaktion darstellen? Worin liegt der Unterschied zu einer Aldolreaktion? b) Zeigen Sie, wie sich Molekül A durch eine Claisen-Kondensation herstellen lässt. Zeichnen Sie die Edukte und schreiben Sie einen ausführlichen Reaktionsmechanismus für diese Reaktion. c) Wie wird die Reaktion beschleunigt/katalysiert? Warum können Sie kein NaOH als Base einsetzen? d) Auf welche Weise könnten Sie die Verbindung A noch herstellen, wenn Sie nur ein Edukt einsetzen dürfen? e) Die Herstellung von Verbindung B unterscheidet sich in einem wesentlichen Punkt gegenüber Verbindung A –in welchem?! Zeichnen Sie die Ausgangsedukte und den Mechanismus zu Verbindung B. O O CH3 O A B 2) Michael-Addition a) Die Michael-Addition des Enolates von 2-Methylcyclohexanon an 1-Phenyl2-propenon kann zu 1 oder zu 2 führen. Wie kann man die Reaktion in die eine oder in die andere Richtung lenken? Formulieren Sie den Reaktionsmechanismus. b) Worin liegt der Unterschied zu einer Aldolreaktion? c) Welches ist das thermodynamische, welches das kinetische Produkt? d) Welche Base eignet sich zur Erzeugung des Enolates? e) Welche Konkurrenzreaktion ist möglich? 3) Diels-Alder-Reaktion a) Wenn Sie Cyclopentadien käuflich erwerben liegt es zum Teil wie oben aufgezeigt vor. Was ist damit passiert? Um welche Namensreaktion handelt es sich hierbei? b) Beschreiben Sie den Mechanismus der in a) stattgefundenen Reaktion. c) Welches Prinzip führt zu den unterschiedlichen Konformationen? d) Welche Molekülorbitale sind an der Reaktion beteiligt? e) Erinnern Sie sich an die Konstruktion der HMOs nach Frost-Musulin für Cyclopentadienyl?! Wie müssen die beteiligten Molekülorbitale im Falle von Cyclopentadien aussehen? Zeichnen Sie die Reaktion/Übergangszustand der beteiligten Molekülorbitale. d) Welches der Produkte wird bevorzugt gebildet? Wie kann das eine in das andere Produkt umgeformt werden? 4) Antwort gesucht Richtig Falsch Höher substituierte Doppelbindungen sind stabiler Die Claisen-Ester-Kondensation funktioniert auch mit zwei Aldehyden Bei der Michaeladdition werden 1,6-Dicarbonylverbindungen geknüpft Bei der Dieckmann-Kondensation können auch 6-Ringe geknüpft werden NaOEt ist eine gute Base für eine Claisen-Esterkondensation 1,3-Dicarbonylverbindungen können über eine ClaisenEsterkondensation oder über eine Aldoladdition hergestellt werden Wittigreagenzien werden durch Reaktion von Triphenylphosphin mit einem Halogenalkyl/-aryl synthetisiert. Das Dien greift immer mit seinem HOMO an Diels-Alder-Reaktionen sind [2+2]-Cycloadditionen Bei der Diels-Alder-Reaktionen spielen die trans stehenden Substituenten eine entscheidende Rolle Stabilisierte Ylide führen zu E-konfigurierten Doppelbindung Doppelbindungen in einem Molekül können über eine Wittigreaktion oder über eine Aldolreaktion mit anschließender Aldolkondensation hergestellt werden