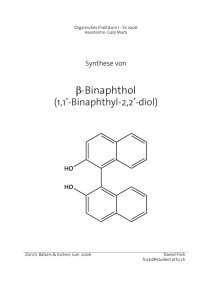
Seminar zum Praktikum Anorganische Chemie III Seminar zum
Werbung

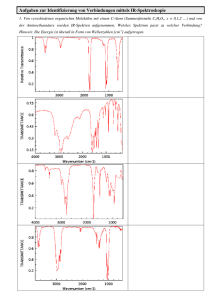
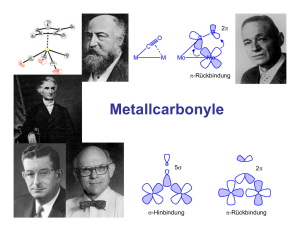
Seminar Seminar zum zum Praktikum Praktikum Anorganische Anorganische Chemie Chemie III III Metallorganische Chemie Dr. J. Wachter IR-Teil1 www.chemie.uni-regensburg.de/Anorganische_Chemie/Scheer/lehre.html www.chemie.uni-regensburg.de/Anorganische_Chemie/Wachter/lehre.html 1H-NMR-Spektren der pseudotetraedrischen CpFe-Komplexe Räumlich getrennte Liganden ⇒ Spektren nullter Ordnung H H H H 4.6 H CH3 OC OC H H 5.42 H Mo O C PPh3 H OC OC H Fe 0.1 CO H H H H Fe H H CO -5.55 CH3 δ(C5H5) = 4.42(d) ppm, 2J(H-P) = 1.24 Hz; δ(CH3) = 2.30(s) ppm, δ(C6H5) = 7.40(m) ppm IR-Spektroskopie von Übergangsmetallkomplexen 1 Allgemeines 1.1 1.2 1.3 1.4 1.5 2 3 4 Charakteristische Gruppenfrequenzen Bindungsarten von CO-Liganden Ladungseinflüsse in Metallcarbonylen Symmetriebetrachtungen Molekülsymmetrie und Bandenzahl Beispiele zur empirischen Anwendung Halbverbrückende („semibridging“) CO-Liganden Metallnitrosylkomplexe Literatur: C. Elschenbroich, Organometallchemie, 4. Auflage 2003 Angegebene Originalliteratur 1 Allgemeines Infrarot-Aktivität: Hängt ab von der periodischen Änderung des Dipolmoments eines Moleküls oder einer Gruppe im elektrischen Feld IR-Intensität: Ist proportional zum Quadrat der Dipolmomentänderung an der Gleichgewichtsstellung (In Atomgruppierungen mit hohem Dipolmoment sind die Änderungen groß) Beispiel: C=O- versus C=C-Gruppen Raman-Aktivität: Eine Schwingung ist RA-aktiv, wenn sich während der Schwingung die Polarisierbarkeit des Moleküls ändert (Raman-Streuung) 1.1 Charakteristische Gruppenfrequenzen Element-Wasserstoff-Bindungen (f = Kraftkonstante) Al-H-Valenzschwingung in AlH3⋅Lutidin Weitere Beispiele für Gruppenfrequenzen (cm-1) Element-Sauerstoff-Bindungen Andere C O C=O N=O P=O S=O 2143 1750 1600 1250 1200 C N C=N P=S As=S M=S 2100 1650 650 460 500 M=O 950 M-Hal >370 Messbereich der Praktikums-FT-IR Spektrometer 7500 – 400 cm-1 CH- und CC-Schwingungen im Cyclopentadienylring Ring (C-C) C-H-Valenz CCH-Deformation IR-Spektrum von Ferrocen Relativ linienarm, Symmetriebedingt ν1, ν2, ν3,4 δ P. L. Stanghellini et al., Inorg. Chem. 1997, 36, 382: Vibrational study of (η5-C5H5) metal complexes Modellrechnungen mit Gaussian03: HF-Methode, Basissatz: STO-3G IR-Spektrum von Diacetylferrocen Niedrigere Symmetrie als in Ferrocen Polare C-O-Gruppe Substanzklassen im Praktikum AC III oder: Warum IR-Spektroskopie? • Metallcarbonylkomplexe mit M = Fe und Mo M− −C≡ ≡O-Streckschwingung ist ca. 40-mal intensiver als ketonische C=O-Absorption! Wichtige Information • Aromaten-Sandwichkomplexe Nur C− −H- und C− −C-Absorptionen, hohe Symmetrie Relativ wenig Information • Eduktverbindungen Zum Teil sehr luftempfindlich Beispiel: (C5H5)Fe(CO)2Cl (KBr) 1.2 Bindungsarten von CO-Liganden (CO-Streckschwingung in cm-1) Weitere Informationen aus IR-Spektren: • Bindungsordnung C-O und M-C • Kraftkonstanten C-O und M-C • Winkel zwischen CO-Gruppen Binäre Metallcarbonyle - Übersicht Nichtsymmetrische CO-Brücke halbverbrückend – semibridging – ein Spezialfall Berechnung von Winkeln im M(CO)2-Fragment 2θ = 79° 2 θ = 121° 1.3 Ladungseinflüsse in Metallcarbonylen Bindungsmodell: Hin- und Rückbindungsynergismus σ-Donor-Bindung ("Hinbindung") Μ Ο C Μ(σ) CΟ(5σ) π-Akzeptor-Bindung ("Rückbindung") Μ Μ(π) C O BO M-C BO C-O ν(CO) BO M-C BO C-O ν(CO) CΟ(2π) Wichtig zum Verständnis von Ladungseinflüssen und Ligandeneigenschaften: Die Energie der CO Streckschwingung ist ein empfindliches Maß für die Elektronendichte am Metallatom. Einfluss der Ladung auf die CO-Streckschwingung Synergismus von Hin- und Rückbindung Referenzmolekül Cr(CO)6: ν(CO): ca. 2000 cm-1 BO (C-O) ca. 2.7 Positive Ladung: π Μ σ C Ο C Ο Beispiel [Mn(CO)6]+ ν(CO): 2100 cm-1 π Negative Ladung: Beispiel [V(CO)6]ν(CO): 1860 cm-1 Μ σ ν(CO)-Absorptionen (cm-1) in isoelektronischen Hexacarbonylkomplexen (nach H. Willner, F. Aubke, Angew. Chem. 109 (1997) 2506) [Ti(CO)6]2- [Mn(CO)6]+ [V(CO)6]- [Fe(CO)6]2+ Cr(CO)6 2000 Erweiterbar auf: Zr, Nb, Mo, Tc (?), Ru Hf, Ta, W, Re, Os [Ir(CO)6]3+ Alles Oktaeder, Punktgruppe !