Seminarfolien "Strukturen einfacher Moleküle"
Werbung
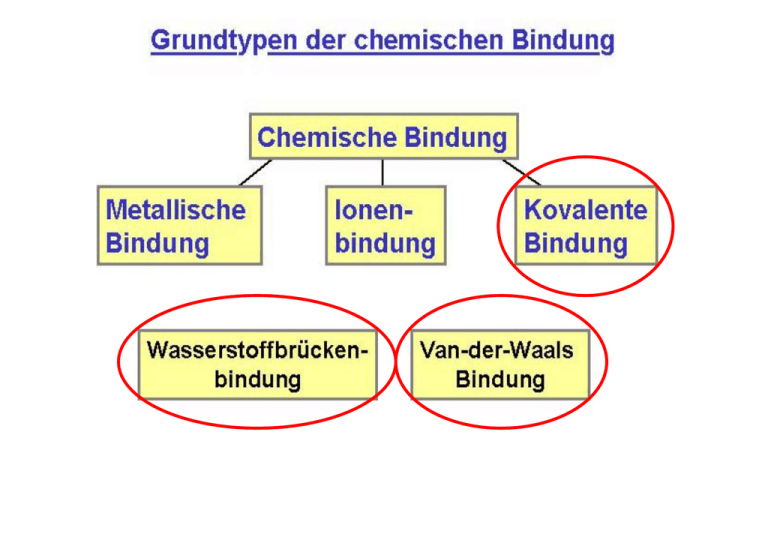
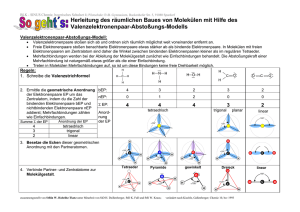
Elektronegativität – Trends im Periodensystem Hybridisierungskonzept – sp, sp² und sp³-Hybride Hybridisierungskonzept – Einbeziehung von d-Orbitalen VSEPR-Modell valence shell electron pair repulsion Entwickelt zur Vorhersage der Struktur von kovalenten Verbindungen. Folgende Annahmen gelten: • Die Elektronenpaare einer Verbindung (freie+bindende Elektronenpaare) nehmen eine Geometrie ein, die ihren Abstand maximiert. • Auf diese Weise entstehen Polyedergrundstrukturen und geben somit die räumliche Gestalt des Moleküls vor. • Die Abstoßung zwischen Elektronenpaaren ist dabei unterschiedlich stark. Es gilt: Abstoßung frei-frei > frei-bindend > bindend-bindend • Mehrfachbindungen werden wie Einfachbindungen behandelt, haben aber noch abstoßendere Wirkung als freie Elektronenpaare. MO-Schema einfacher 2-atomiger Moleküle σ∗ π∗ 2p π σ σ∗ Bindungsordnung= 0.5*[(Zahl e- in bindenden Orbitalen) (Zahl e- in antibindenden Orbitalen)] 2s ΑΟ σ ΜΟ ΑΟ Beispiel Stickstoff N2 σ∗ π∗ 2p π σ σ∗ 2s σ N2 Beispiel Sauerstoff O2 σ∗ π∗ 2p π σ σ∗ 2s σ O2 Beispiel Fluor F2 σ∗ π∗ 2p π σ σ∗ 2s σ F2 Vergleich der MO-Schemata Elektronenmangelverbindungen Elemente der 13. Gruppe haben oftmals Probleme mittels kovalenter Verbindungen ein Elektronenoktett zu erreichen. Ein typisches Beispiel ist Bor. • Bor in ionischen Verbindungen, z.B. B2O3: 2x B3+ und 3x O2-. Bor besitzt somit ein Elektronenoktett und [He]-Konfiguration. • Bor in kovalenten Verbindungen, z.B. BH3: H B H H Nur ein Elektronensextett Elektronenmangelverbindungen Welche Art von kovalenten Bindungen kann Bor in Bor-WasserstoffVerbindungen eingehen ? Elektronenmangelverbindungen Welche Art von kovalenten Bindungen kann Bor in Bor-WasserstoffVerbindungen eingehen ? Elektronenmangelverbindungen Lösung: Zwei Moleküle BH3 dimerisieren unter Ausbildung von zwei BHB-2-Elektronen-3-Zentren-Bindungen => Oktett verwirklicht. H H H B H H B H H = H H B B H H H MO-Schema von Monoboran MO-Schema von Diboran Wasserstoffbrückenbindungen • werden zwischen Wasserstoffatomen und stark elektronegativen Atomen mit freien Elektronenpaaren gebildet • Bindungsenergie etwa 50 kJ/mol (echte kovalente Bindungen liegen im Bereich von einigen 100 kJ/mol). Die Kristallstruktur von Eis ergibt sich im Wesentlichen aus H-Brücken !