Powerpoint-Präsentation
Werbung

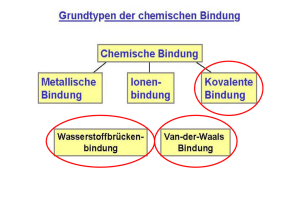
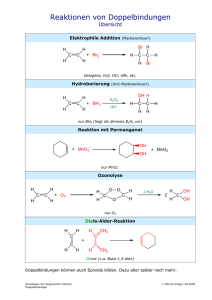
27. III. Hauptgruppe: B, Al, Ga, In, Tl Übersicht 1. Einleitung 2. Chemie des Bors 3. Diboran (B2H6) der einfachste Bor-Wasserstoff 4. Höhere Bor-Wasserstoffe 1. Einleitung Kohlenstoff bildet Kohlenwasserstoffe (Alkane), z.B. H H C H H Methan H H C H H C H H Ethan H H H H C C C H H H H Propan Vorkommen: Ergas, Erdöl Bedeutung: Brennstoffe, Rohstoffe etc. Bor steht links vom Kohlenstoff Borwasserstoffe ? (B-H-Verbindungen) Eigenschaften ? Bedeutung ? Kohlenwasserstoffe (C-H-Verbindungen) 2. Chemie des Bors Kohlenstoff ist ein Nichtmetall ! Bor ist ein Nichtmetall ! Valenzelektronen Li Be B C N O F Kohlenstoff hat 4 Valenzelektronen Bor hat nur 3 Valenzelektronen ! Ne Bindigkeit von Kohlenstoff H 4x H C H H C C H H H Ne Kohlenstoff bildet vier Elektronenpaarbindungen Kohlenstoff erreicht ein Elektronenoktett Bindigkeit von Bor H 3x H B Ne B H H Bor sollte drei Bindungen bilden… … es erreicht dann aber nur ein Elektronensextett Bor entkommt dem Elektronenmangel a) durch Bildung von Doppelbindungen! F F F B B F Sextett F F Oktett b) durch Anlagerung von Lewis-Basen ! F F + B F F F BF3 Lewis-Säure F B F Lewis-Base BF4- F c) durch Ausbildung von Mehrzentrenbindungen ! Vergleiche BF3 mit BH3: F F H B B F monomer, stabil Doppelbindungen H H BH3 nicht stabil Doppelbindungen nicht möglich Das Experiment zeigt: BH3 dimerisiert zu Diboran: H H + B H H Monoboran, nicht faßbar H H H B B H H Oktett H B H H Diboran, B2H6 isolierbares Gas Bindungsverhältnisse in Diboran B2H6 Normale Elektronenpaarbindung (2-Elektronen-2-Zentren-Bindung) H H B H H B H H H B Mehrzentrenbindung (2-Elektronen-3-Zentren-Bindung) B B H Chemie des Bors kompakt Nichtmetall, 3 Valenzelektronen, dreibindig BX3-Verbindungen = Elektronensextett Behebung Elektronenmangel: a) Doppelbindungen (F) b) Anlagerung von Lewis-Basen (F-) c) Mehrzentrenbindungen (H, BORANE) F F F B F planares Dreieck F F B F tetraedrisch 3. Diboran, der einfachste Borwasserstoff farbloses, giftiges Gas kondensiert bei -93°C > 50° C Zersetzung verzerrt tetraedrisches Bor B-H: 120 pm B-H-B: 132 pm Diboran entzündet sich an der Luft: B2H6 + 3 O2 CH4 + 2 O2 B2O3 + 3 H2O CO2 + 2 H2O Synthese von Diboran erfordert Abwesenheit von O2 Handschuhkasten früher: 6 LiH2 2 BF3 + MgB Vakuumlinie Ether Ansäuern BB 2H 2H 66 + 6 LiF unbefriedigende quantitativ Ausbeute Diboran reagiert als Lewis-Säure H D H H 2x D B B 2x H H H B H H H ist ein Kompromiß H D ist besser H Lewis-Basen spalten das HMolekül ! B B Spaltung der B-H-B-Brücken ! H H H D Beispiel Hydrolyse 2 B(OH)3 + 6 H2 B2H6 + 6 H2O H H H H H B H H B O B H H EN: B 2.0 H 2.2 O 3.5 H H O 2Ox OH H H H B H 2x H H H H O H B O protisch H H - hydridisch H H H H + +O H H H HB B O etc. O H H + Nachweis der Borane B2H6 + 6 HO-H 2 B(OH)3 B2H6 + 6 CH3O-H 2 B(OCH3)3 + 6 H2 C O B C O O C Borsäuretrimethylester + 6 H2 Hydroborierung B2H6 + 6 H2C CH2 2 B(CH2CH3)3 Ethylen, ein Alken C C C B C C C Triethylbor, ein Organoboran (H.C. Brown, 1976 NPCh) Diboran kompakt •B2H6, einfachstes Boran, gasförmig •Struktur: Doppeltetraeder •Bindungsverhältnisse: 4 x B-H, 2 x B-H-B •Synthese: Vakuumtechnik •Reagiert als Lewis-Säure mit Lewis-Basen Spaltung der Mehrzentrenbindungen H2O ergibt B(OH)3 + H2, CH3OH ergibt B(OMe)3 + H2 Alkene liefern Organoborane (Hydroborierung) 4. Höhere Borane H H H C H H H C H H H H H C C C H H H H C2H6 H H H C3H8 H B B BH3 C H H CH4 H H B H H B2H4 H H B CnHn+2 B H H B H B3H5 BnHn+2 Borane der Reihe BnHn+2 haben Elektronensextett Borane der Reihe BnHn+2 sind nicht isolierbar ! Kombination der BnHn+2-Borane ! H H H H BH3 B H H H H B B B x2 H B2H 6 x2 x3 B4 H 8 B3H 9 B B H H B2H4 x3 H BnHn+2 bisher keine B3H5 x2 x3 BnHn+4 bisher 13 Stück B6H10 B6H12 B9H15 BnHn+6 bisher 11 Stück Strukturen und Strukturprinzipien ! BnHn+4 BnHn+6 B B B B B B B B B B B B B B B B Oktaeder ein Trigonpolyeder B5H9 (n=5) B4H10 (n=4) nido-Boran (Nestartig) arachno-Boran (Spinne) Bindung: Mehrzentrenbindungen, wie erwartet ! B B B B B B B B4H10 B Schlußbetrachtung Borane ? es gibt sie ! sie sind exotisch ! Eigenschaften ? durch den Elektronenmangel geprägt ! Bedeutung ? Keine neuen Brennstoffe ! Bindungstheorie ! Synthese !