VSEPR-Modell Arbeitsblatt: Molekulare Geometrie
Werbung

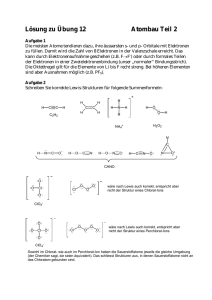
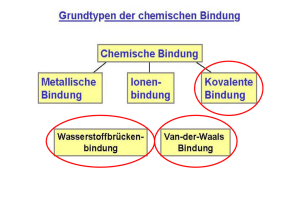
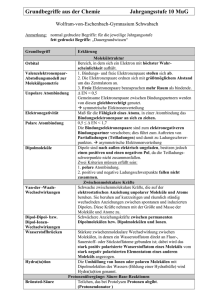
BLK - SINUS Chemie, bayerisches Schulset 4; Pilotschule: EvB–Gymnasium, Buckenhofer Str. 5, 91080 Spardorf Herleitung des räumlichen Baues von Molekülen mit Hilfe des Valenzelektronenpaar-Abstoßungs-Modells Valenzelektronenpaar-Abstoßungs-Modell: • • • • Valenzelektronenpaare stoßen sich ab und ordnen sich räumlich möglichst weit voneinander entfernt an. Freie Elektronenpaare stoßen benachbarte Elektronenpaare etwas stärker ab als bindende Elektronenpaare. In Molekülen mit freien Elektronenpaaren am Zentralatom sind daher die Winkel zwischen bindenden Elektronenpaaren kleiner als im regulären Tetraeder. Mehrfachbindungen werden bei der Ableitung der Molekülgestalt zunächst wie Einfachbindungen behandelt. Die Abstoßungskraft einer Mehrfachbindung ist naturgemäß etwas größer als die einer Einfachbindung. Treten in Molekülen Mehrfachbindungen auf, so ist um diese Bindungen keine freie Drehbarkeit möglich. Regeln: 1. Schreibe die Valenzstrichformel H H C H H N Summe Σ der EP Anordnung der EP 4 3 2 tetraedrisch trigonal linear H H O H C O O C bEP: 4 3 2 3 2 nEP: 0 1 2 0 0 Σ EP: 4 4 4 3 2 trigonal tetraedrisch Anordnung der EP O H H H 2. Ermittle die geometrische Anordnung der Elektronenpaare EP um das Zentralatom, indem du die Zahl der bindenden Elektronenpaare bEP und nichtbindenden Elektronenpaare nEP addierst; Mehrfachbindungen zählen wie Einfachbindungen. H planar linear 180° ≈109° 3. Besetze die Ecken dieser geometrischen Anordnung mit den Partneratomen. 120° O H 180° ≈109° C N H H H H ≈107° H O C gewinkelt Pyramide Dreieck linear O H ≈109° H H ≈107° H H zusammengestellt von StRin W. Habelitz-Tkotz unter Mitarbeit von StD H. Deißenberger, StD K. Full und StR W. Kraus; 180° O N H O H H C C H H ≈105° H Tetraeder 4. Verbinde Partner- und Zentralatome zur Molekülgestalt. ≈120° O H H ≈120° ≈105° H O C H verändert nach Kiechle, Gallenberger; Chemie 10, bsv 1993 H C O
![12. Lösungen "Halogene, Chalcogene" 1. [4] Flüssiges](http://s1.studylibde.com/store/data/011892250_1-9bb5cb925a6dee3c9c83d21342291151-300x300.png)