Musterlösung
Werbung

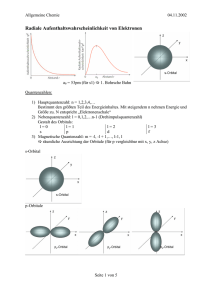
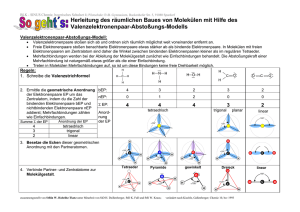
Seminar 2 Chemische Bindung Schlüsselbegriffe: Elektronegativität, Oktettregel, Wertigkeit, Ionisierung, ionische Bindung, Atombindung, koordinative Bindung, metallische Bindung, Wasserstoffbrückenbindung, van der Waals-Wechselwirkungen, Hybridisierung Aufgaben: 1. Beim Kalium ist die 2. Ionisierungsenergie etwa sieben Mal größer als die erste Ionisierungsenergie (3051 bzw. 419 kJ mol -1). Beim Calcium ist die 2. Ionisierungsenergie nur etwa doppelt so groß wie die erste (1145 bzw. 590 kJ mol -1). Warum ist der Unterschied beim Kalium größer als beim Calcium? Elektronenkonfigurationen aufschreiben: 19K: + 19K : 2+ 19K : 1s2 2s2 2p6 3s2 3p6 4s1 1s2 2s2 2p6 3s2 3p6 1s2 2s2 2p6 3s2 3p5 Elektron aus dem 3p6 entfernen 20Ca: + 20Ca : 2+ 20Ca : 1s2 2s2 2p6 3s2 3p6 4s2 1s2 2s2 2p6 3s2 3p6 4s1 1s2 2s2 2p6 3s2 3p6 Elektron aus dem 4s1 entfernen Die Ionisierungsenergie hängt von der Anziehungskraft F zwischen Kern und Elektron ab: F k z (k= Konstante; z= Kernaldungszahl). Sie sinkt mit steigendem Abstand r2 zum Kern 2. Ordnen Sie mit Hilfe der Elektronegativitäten die Bindungen nach zunehmender Polarität: C─S, C─O, C─Cl, C─H, C─N. Bindung Elektronegativität (C) Elektronegativität (Element) Differenz Reihenfolge C-S 2,55 2,58 0,03 5 C-O 2,55 3,44 0,89 1 C-Cl 2,55 3,16 0,61 2 C-H 2,55 2,20 0,35 4 C-N 2,55 3,04 0,49 3 3. Welchen Bindungstyp erwarten Sie bei der Kombination der Elemente C/H, Fe/O, K/F, N/O? Begründen Sie Ihre Wahl! Element 1 Element 2 ENW 1 ENW 2 Differenz Bindungstyp C H 2,5 2,1 0,4 Kovalent Fe O 1,8 3,5 1,7 Ionisch K F 0,8 4,0 3,2 Ionisch N O 3,0 3,5 0,5 Kovalent Differenz der Elektronegativitätswerte (ENW) > 1,7: ionisch Differenz der Elektronegativitätswerte (ENW) < 1,7: kovalent 4. Zeichnen Sie Valenzstrichformeln für die folgenden Moleküle einschließlich freier Elektronenpaare und eventuell nötiger Partialladungen: CH4, HCN, HCCl3, OCCl2, CO, SO42-, HCCH, HOOH, H3PO4, NO, H2CCCH2. Oktettregel beachten: Jedes Element möchte 8 Valenzelektronen haben. Nicht benötigte Elektronen in freien Elektronenpaaren unterbringen. Oktettregel wird ausgeweitet, sobald d-Orbitale verfügbar sind (ab der dritten Periode): Siehe Sulfat und Phosphorsäure. Ladungen prüfen: Anzahl der Elektronen gleich Hauptgruppennummer (Valentzelektronen) –> neutral, Unterschuss (positiv), Überschuss (negativ) 5. Nennen Sie die Unterschiede zwischen einer C─C-Einfachbindung und einer C=CDoppelbindung. C-C-Einfachbindung: sp3-Hybridisierung: Linearkombination aus einem s- und drei p-Orbitalen Bindungswinkel 109,5°, Tetraeder Bindungslänge 154 pm, 1,5 Å Freie Drehbarkeit um Bindungsachse C=C-Doppelbindung sp2-Hybridisierung: Linearkombination aus einem s- und zwei p-Orbitalen dadurch ein freies p-Orbital, das senkrecht zur Bindungsebene steht Bindungswinkel 120°, trigonal planar Bindungsabstand 134 pm, 1,34 Å Warum ist das Wassermolekül gewinkelt und Kohlendioxid linear gebaut? Sauerstoff (6 Valenzelektronen) baut zwei Einfachbindungen zu den beiden Wasserstoffatomen auf. 4 Valenzelektronen bleiben übrig, die 2 Elektronenpaare bilden. Elektronenpaare und Sauerstoff nehmen Positionen ein, in der sie den größten Abstand haben. Der Kohlenstoff im CO2 hat keine freien Elektronenpaare. 6. Welche molekularen Merkmale muss ein Molekül haben, um an Wasserstoffbrückenbindungen mit anderen Molekülen der gleichen Art teilzunehmen? Welche der folgenden Moleküle können Wasserstoffbrückenbindungen mit anderen Molekülen der gleichen Art eingehen: CH3F, CH3NH2, CH3OH, CH3Br? Vergleichen Sie die Siedetemperaturen von CH3OH und CH3Br und erläutern Sie den Unterschied! Wasserstoffhaltige Verbindungen mit polarisierbaren Atombindungen (-OH, -NH, COOH) wirken als Wasserstoff-Donor. Verbindungen mit freien Elektronenpaaren (C=O, F, R-OH) wirken als Wasserstoff-Akzeptoren. Schwache Wechselwirkung (ca. 20 kJ/mol) Bilden sich Wasserstoffbrückenbindungen? CH3F nein, kein H-Donor, H-Akzeptor ist vorhanden CH3NH2 ja CH3OH ja CH3Br nein, wie oben CH3Br Siedepunkt 3,56 °C, keine H-Brücken, es gibt kaum Wechselwirkungen zwischen den Molekülen, die überwunden werden müssen CH3OH Siedepunkt 65 °C; bildet H-Brücken, die überwunden werden müssen Mögliche Klausurfragen: 1. Welche Aussage trifft nicht zu? [X] A) Zentralteilchen und Liganden sind kovalent gebunden. falsch, da bei Komplexverbindungen eine koordinative Atombindung vorliegt. Die Elektronen der Bindung stammen von einem der beiden Bindungspartner (Ligand) [ ] B) Im Kochsalz liegt eine Ionenbindungen vor. [ ] C) Im Methylamin ist ein freies Elektronenpaar vorhanden. [ ] D) Im Chlormolekül gibt es mehrere freie Elektronenpaare. [ ] E) Im Cyclohexan sind alle Kohlenstoffatome sp 3-hybridisiert. 2. Welche Aussage trifft nicht zu? Für die Beschreibung eines Orbitals spielen folgende Begriffe eine Rolle: [ ] A) Negative Ladungswolke. [X] B) Ionisierungsenergie. Hat mit Orbitalen nichts zu tun. Spielt nur eine Rolle, wenn Elektronen aus dem Atom entfernt werden sollen. [ ] C) Elektronendichteverteilung. [ ] D) räumliche Symmetrie einer Ladungswolke. [ ] E) Aufenthaltswahrscheinlichkeit für ein Elektron.