A + e - Fachrichtung Chemie und Lebensmittelchemie
Werbung

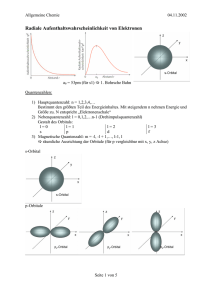
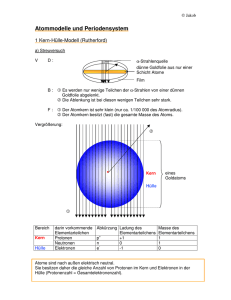
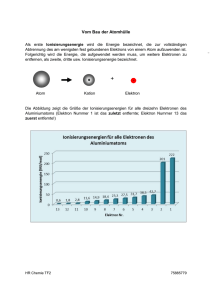
Fakultät Mathemathik/Naturwissenschaftensname, Professur für Anorganische Chemie I Brückenkurse Chemie Wintersemester 2015/2016 Atombau und chemische Bindung Was kann Chemie heute leisten? • Kampf gegen noch nicht behandelbare Krankheiten (Krebs, Aids) • Kampf gegen den Hunger der Welt (Düngemittel, Pflanzenschutz) • Sicherstellung unserer Energieversorgung (alternative Energiequellen) • Schonung wertvoller Rohstoffe (Erdöl, Erze, Kohle) • Umweltschutz (Recycling, Entgiftung, Stoffkreisläufe) • Erhöhung der allgemeinen Lebensqualität (neue Werkstoffe) Das Haus der Chemie Abgase Abwasser Baustoffe Brennstoffe Korrosion Kühlwasser Energietechnik Kernphysik Gentechnik Stoffwechsel Stoffwechsel Therapie Pharmazie Physik Biologie Medizin Düngemittel Futtermittel Pflanzenschutz Land- und Forstwirtschaft Ingenieurwesen Technische Chemie ChemischeThermodynamik Radiochemie Anorganische Chemie Lebensmittelchemie CHEMIE Physikalische Chemie Allgemeine Chemie Biochemie Polymerchemie Organische Chemie Die Chemie ist die Wissenschaft von den Stoffen und den stofflichen Veränderungen. Die Physik ist die Wissenschaft von den Zuständen und den Zustandsänderungen. Stoffliche Änderung - Zustandsänderung vorher ≠ nachher 2 Mg (s) + O2 (g) → 2 MgO (s) vorher = nachher Glühdraht Reinstoffe und Stoffgemische Stoffe Reinstoffe chemische Trennverfahren ∙ thermische Zersetzung ∙ Elektrolyse Verbindungen H2O Elemente Wasserstoff Sauerstoff Stoffgemische physikalische Trennverfahren ∙ dekantieren ∙ filtrieren ∙ destillieren ∙ extrahieren heterogene Stoffgemische Granit Milch homogene Stoffgemische Luft, Wein Messing Heterogene – Homogene Stoffgemische heterogenes Feststoff- Gemisch: Granit besteht aus Kristallen von Quarz (farblos), Glimmer (schwarz) und Feldspat (rosa-gelb) homogenes FlüssigkeitsGemisch: Scotch Whisky (7) (6) (5) (4) (3) (2) (1) heterogenes Flüssigkeits- Gemisch: (1) durch Extraktion von Gras grün gefärbtes Chloroform (2) farbloses Glycerin (3) mit Sudanrot gefärbtes Rizinusöl (4) Ethanol-Wasser-Gemisch farblos (5) gelber Lebertran (6) mit Methylenblau blau gefärbtes Methanol (7) Leichtbenzin farblos Stoffgemisch – Chemische Verbindung S - Pulver vermischen heterogenes Stoffgemisch Fe - Pulver chem. Reaktion chemische Verbindung Atomdefinitionen vor 2000 Jahren DEMOKRIT: gr. von atomos - unteilbar; unteilbarer Urstoff Alle Materie besteht aus kleinsten, nicht mehr teilbaren Teilchen „Nur scheinbar hat ein Ding eine Farbe, nur scheinbar ist es süß oder bitter; in Wirklichkeit gibt es nur Atome im leeren Raum.“ 1803 John Dalton: es gibt Stoffe, die nur aus einer Atomsorte bestehen. man nennt sie chemische Elemente (z.B. Gold, Sauerstoff, Eisen) die Atome haben unterschiedliche Massen 1913 Niels Bohr: ein Atom ist ähnlich aufgebaut wie ein Sonnensystem, d.h. um den massereichen Atomkern kreisen in großem Abstand die Elektronen Atomdefinitionen Das heutige Atombild: Atom besteht aus Atomkern und Atomhülle Kern ist positiv und die Hülle negativ geladen Atomkern trägt fast die gesamte Masse des Atoms aufgebaut aus Protonen und Neutronen fast 2000 mal schwerer als die Elektronen, aus der die Atomhülle besteht Proton hat die positive elektrische Ladung gleicher Wert wie die negative des Elektrons Neutron ist elektrisch neutral Wert der elektrischen Ladung des Protons oder Elektrons = Elementarladung Protonen und Neutronen zusammenfassend = Nukleonen …bestehen ihrerseits aus noch kleineren Teilchen, den Quarks Atomdefinitionen " Ein Atom ist der kleinste Baustein eines chemischen Elements, der ohne Verlust der typischen Eigenschaften dieses Elements nicht mehr geteilt werden kann. „ Das Atom Atomkern: sehr klein und schwer (99,8% der Atommasse ist Kernmasse!) positive Elementarladung (+1) Elektronenhülle: negativ geladene Elektronen (-1) bewegen sich um den Kern Teilchen Ladung Masse Proton Neutron Elektron +1 0 -1 1,00728u 1,00867u 0,00055u Vergleiche: Wäre ein Atom so groß wie ein Fußballstadion, hätte der Atomkern die Größe eines Marienkäfers. Alle 7 Milliarden Menschen, die z. Zt. auf der Erde leben, würden, wenn ein Mensch so groß wie ein Atom wäre, eine etwa 70 cm lange Kette bilden. Elementarteilchen Teilchen Neutron Proton Elektron Ladung keine Ladung eine positive Ladung + 1,6021·10-19 Coulomb eine negative Ladung - 1,6021·10-19 Coulomb Masse 1,67 · 10-24 g (1,00867 u) 1,67 · 10-24 g (1,00728 u) 9,11 · 10-28 g (0,00055 u) n fast gleiche Massen + – gleich große, entgegengesetzte Ladungen Das Atom Isotope ...sind Atome mit gleicher Protonenzahl, aber unterschiedlicher Neutronenzahl Isotopenzusammensetzung Ord. zahl PSE Element Nuklid bzw. Isotop 1H 1 Wasserstoff 6 Kohlenstoff 12C 7 Stick-stoff 14N 8 Sauerstoff 16O 2H Deuterium 3H Tritium 13C 14C 15N 17O 18O Masse Isotop/u Natürliche Häufigkeit /% 1,007825 2,01410 3,01605 99,984 0,0156 Spuren 12,00000 13,00335 14,0032 98,892 1,108 Spuren 14,00307 15,00011 99,635 0,365 15,99491 16,99913 17,99916 99,759 0,037 0,204 Relative Atommasse /u 1,008 12,011 14,0067 15,9994 Elektronenbahnen und Orbitale Orbital: Raum, der einem Elektron für seinen Aufenthalt zur Verfügung steht Quantenzahlen n = Hauptquantenzahl bezeichnet die „Schalen“ (1, 2, 3... oder K, L, M...), d.h. Größe des Orbitals l = Nebenquantenzahl charakterisiert Form des Orbitals (s: Kugel, p: Hantel, d: Rossette, f) ml = Magnetquantenzahl gibt Orientierung des Orbitals im Raum an ms = Spinquantenzahl bezeichnet die Spinrichtung (Eigendrehimpuls) des Elektrons Orbitale Elektronen in Orbitalen PAULI-Prinzip Elektronen eines Atoms müssen sich in mindestens einer Quantenzahl unterscheiden die 2 Elektronen eines s-Orbitals: antiparalleler Spin von +1/2 und –1/2 HUND´sche Regel Orbitale gleicher Energie immer erst mit einem einzelnen e- besetzt, dann mit einem antiparallelen zweiten e- aufgefüllt werden Nach Besetzung des 3p-Orbitals erfolgt aus energetischen Gründen die Besetzung des 4s-Niveaus vor dem 3d-Niveau. Eine Schale kann mit maximal 2n2 Elektronen besetzt werden. Eine definiert besetzte Elektronenhülle der Atome heißt Elektronenkonfiguration: Li 1s2 2s1 oder [He] 2s1 Ne 1s2 2s2 2p6 Na 1s2 2s2 2p6 3s1 oder [Ne] 3s1 Elektronenkonfig. der Elemente 1-10 H 1s 2s 2p ungepaarte Elektronen 1 Elektronenkonfiguration 1s1 He 0 1s2 Li 1 1s2 2s1 Be 0 1s2 2s2 B 1 1s2 2s2 2p1 C 2 1s2 2s2 2p2 N 3 1s2 2s2 2p3 O 2 1s2 2s2 2p4 F 1 1s2 2s2 2p5 Ne 0 1s2 2s2 2p6 [He] [Ne] Elektronen in Orbitalen Energetische Reihenfolge der Orbitale s- p- d- f-Orbitale Q 7s 1 2 3 s p d f P 6s 6p 5 O 5s 5p 5d N 4 N 4s 4p 4d M 3 M 3s 3p 3d 2 L 2s 2p 1 K 1s O 6p 5d 4f 6s Energie 0 6 5f P HQZ n NQZ l 5p 4d 5s 4p 3d 4s 3p 3s 2s 1s 2p K L 4f Periodensystem der Elemente Periodensystem der Elemente Periodensystem der Elemente 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 5d 6p 7s 6d 4f 5f Hauptgruppenelemente Lanthanoide, Actinoide Übergangsmetalle Edelgase Üben: Chlor Energie Q 5f P 7s Ac-Lr O 6p [Ne]3s23p5 5d 4f 6s 5p N 4d 5s 4p 3s 2s 1s 3p 2p K M 3d 4s L H Li Na K Rb Cs Fr La-Lu Be Mg Ca Sr Ba Ra Sc Ti V Cr* Y Zr Nb Mo La Hf Ta W Ac B Al Mn Fe Co Ni Cu* Zn Ga Tc Ru Rh Pd Ag Cd In Re Os Ir Pt Au Hg Tl C Si Ge Sn Pb N P As Sb Bi O S Se Te Po F Cl Br I At He Ne Ar Kr Xe Rn Das Element im Periodensystem Elektronegativität Ordnungszahl 9 Fluor F 4 18,998 Elementname Atommasse Elementsymbol Atomradien innerhalb einer Gruppe mit zunehmender Ordnungszahl weiter außen liegende Elektronenschalen besetzt → Anziehung auf die Elektronenhülle wird größer innerhalb einer Periode Atomradius ist das Ergebnis von Anziehung der Elektronen durch den Kern einerseits und der gegenseitigen Abstoßung der Elektronen andererseits Atomradien Atomradius Atomradius Metalle Nichtmetalle Ionisierungsenergie 2p 2s 1s Li Energie Energie Energie ...Mindestenergie in eV, die benötigt wird, um aus einem Atom ein Elektron zu entfernen: A A+ + e- 2s 1s 2p Li+ Ionisierungsenergie ...Mindestenergie in eV, die benötigt wird, um aus einem Atom ein Elektron zu entfernen: A A+ + e- I II III 1 H 2 Li 3 Na Mg Al 4 K 5 Rb Sr 6 7 IV V I nimmt ab I nimmt zu Be B C N Si P Ca Ga Ge As VI VII VIII He O F S Cl Ar Ne Se Br Kr In Sn Sb Te I Cs Ba Tl Pb Bi Po At Rn Fr Ra Xe Ionisierungsenergie Änderung der Ionisierungsenergie im PSE Edelgase IE ( eV ) 30 He 25 Ne 20 Ar N 15 Be H 10 C F P O Mg Si B 5 Na Li Al 5 10 Z Alkalimetalle 15 Ti Ca S Sc K 0 0 Cl 20 25 Ionisierungsenergie Änderung der Ionisierungsenergie im PSE 2s 1s 2p Bor 2s 1s 2p Ionisierungsenergie (eV) Energie Beryllium 30 He 25 20 Ne N H 15 Be 10 C 0 0 1 2 O Mg B Li 5 F 3 4 5 6 7 8 9 Z = Ordnungszahl Na 10 11 12 13 Ionisierungsenergie Änderung der Ionisierungsenergie im PSE 2s 1s 2p Sauerstoff 2s 1s 2p Ionisierungsenergie (eV) Energie Stickstoff 30 He 25 20 Ne N H 15 Be 10 C 0 0 1 2 O Mg B Li 5 F 3 4 5 6 7 8 9 Z = Ordnungszahl Na 10 11 12 13 Ionisierungsenergie 2s 2p Li+ I1 2s 2p 5,4 eV 1s Energie Energie Lithium I2 2s 75,6 eV 1s Li Li2+ 1s Li+ Li2+ 2p Ionisierungsenergie Zusammenfassung Ionisierungsenergie Reaktion der Alkalimetalle mit Wasser Schnittflächen der Alkalimetalle: Reaktivität nimmt zu 2 M + 2 H2O ⇆ 2 MOH + H2 (M = Li, Na, K) Elektronenaffinität ...Energiebetrag in eV, der für die Anlagerung eines Elektrons an ein Atom frei wird bzw. aufgewendet werden muss A + e- → A - 2p 2s 1s F -Energie Energie Energie A + e- A- + Elektronenaffinität (EA) 2s 1s 2p F- Elektronenaffinität ...Energiebetrag in eV, der für die Anlagerung eines Elektrons an ein Atom frei wird bzw. aufgewendet werden muss A + e- → A - A + e- A- + Elektronenaffinität (EA) EA nimmt zu I II III IV V VI VII VIII 1 H He ab F Ne 2 Li Be BEACnimmt N O 3 NaMgAl Si P S Cl Ar 4 K Ca Ga Ge As Se Br Kr 5 RbSr In Sn Sb Te I Xe 6 Cs Ba Tl Pb Bi Po At Rn 7 Fr Ra Elektronenaffinität Elektronenaffinität in kJ/mol 300 200 1s22s2 100 1s22s22p6 Be He 0 1s22s22p3 Ne N -100 H Li B Mg Ar P Na Al C O -200 Si Ca K S -300 -400 F 0 5 10 Cl 25 15 20 Ordnungszahl → Elemente der 2. Periode Elemente der 3. Periode halbbesetztes Orbital vollbesetztes Orbital Elektronegativität ...ist ein Maß für das Bestreben eines Elements, in einer Bindung die Elektronen an sich zu ziehen. Elektronegativitäten zweier unterschiedlicher Atome O H H ~ Polarität der Bindung Elektronegativität Elektronegativität Elektronegativität H 2,1 Li 1,0 Be 1,5 B 2,0 C 2,5 N 3,0 O 3,5 F 4,0 Na 0,9 Mg 1,2 Al 1,5 Si 1,8 P 2,1 S 2,5 Cl 3,0 Ge 1,8 As 2,0 Se 2,4 Br 2,8 Te 2,1 I 2,5 K 0,8 Rb 0,8 Eigenschaftsänderungen im PSE Zusammenfassung Eigenschaft Atomradius Metallcharakter Elektronegativität Elektronenaffinität (Betrag) Ionisierungsenergie Änderungen innerhalb einer Hauptgruppe ↓ Periode →