Radiale Aufenthaltswahrscheinlichkeit von Elektronen
Werbung
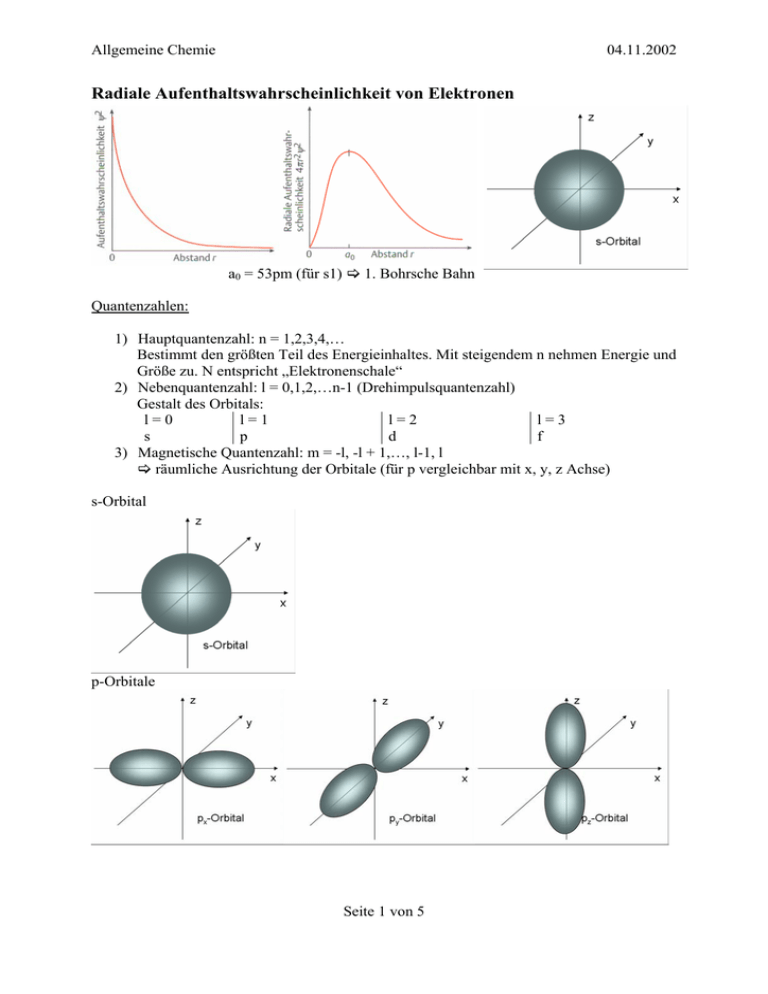
Allgemeine Chemie 04.11.2002 Radiale Aufenthaltswahrscheinlichkeit von Elektronen a0 = 53pm (für s1) > 1. Bohrsche Bahn Quantenzahlen: 1) Hauptquantenzahl: n = 1,2,3,4,… Bestimmt den größten Teil des Energieinhaltes. Mit steigendem n nehmen Energie und Größe zu. N entspricht „Elektronenschale“ 2) Nebenquantenzahl: l = 0,1,2,…n-1 (Drehimpulsquantenzahl) Gestalt des Orbitals: l=0 l=1 l=2 l=3 s p d f 3) Magnetische Quantenzahl: m = -l, -l + 1,…, l-1, l > räumliche Ausrichtung der Orbitale (für p vergleichbar mit x, y, z Achse) s-Orbital p-Orbitale Seite 1 von 5 Allgemeine Chemie 04.11.2002 d-Orbitale: Seite 2 von 5 Allgemeine Chemie 04.11.2002 Stern-Gerlach-Experiment: Beim Stern-Gerlach-Experiment wird Silber verdampft und anschließend durch ein magnetisches Feld geleitet. Ergebnis/ Beobachtung: Der Atomstrahl wird im Magnetfeld aufgespalten. Der Grund dafür ist, dass Silber ein Element mit ungerader Elektronenzahl ist. Dabei sind 46 der 47 Elektronen jeweils zwei Elektronen mit entgegen gesetztem Spin gepaart in einem Orbital und somit im Magnetfeld unbedeutend. Das überbleibende Elektron befindet sich alleine in einem Orbital und macht somit das Silberatom zu einem Mini-Magneten. In einem Silberschwarm werden 50% der 1 Atome ein ungepaartes Elektron mit s = + die andere Hälfte der Atome wird 2 1 dementsprechend mit s = - besitzen. Aus diesem Grunde wird der Atomstrahl auch 2 gespalten. 1 1 Elektronenspin: ↑+ ↓- > Spinquantenzahl s (ms) 2 2 Aufbauprinzip: 1) Füllung der Atomorbitale beginnt mit dem energetisch tiefsten Atomorbital (1s > 2s > 2p > 3s…) 2) Zwei Elektronen mit umgekehrtem Spin in jedes Atomorbital 3) Bei entarteten Atomornitalen (z.B. 2p): Regel nach Hund: bis zur Halbfüllung werden die entarteten Orbitale mit Elektronen gleichen Spins gefüllt Beispiele: H: 1s1 He: 1s2 Li: 1s2 2s1 Be: 1s2 2s2 B: 1s2 2s2 2p C: 1s2 2s2 2p2 N: 1s2 2s2 2p3 F: 1s2 2s2 2p5 Ne: 1s2 2s2 2p6 Ausnahmen: Cr: [Ar] 4s1 3d5 (nicht 4s2 3d4) Cu: [Ar] 4s1 3d10 (nicht 4s2 3d9) Seite 3 von 5 Allgemeine Chemie 04.11.2002 Elektronenkonfiguration von Ionen: − Na: 1s2 2s2 2p6 3s1 −e → Na+: 1s2 2s2 2p6 > [Ne] − Cl: 1s2 2s2 2p6 3s2 3p5 +e → Cl-: 1s2 2s2 2p6 3s2 3p6 > [Ar] Na + ½ Cl2 → NaCl Gang der Atomradien: Kovalenzradien Cl Cl 198pm > d/2 = r (Cl) = 99pm Bei Elementen einer Periode nehmen die Kovalenzradien ab, aufgrund der steigenden Kernladungszahl. Von oben nach unten steigen die Kovalenzradien. Bei Übergamgsmetallen tritt ein so genannter Abschirmungseffekt durch die d-Orbitale auf, welcher dazu führt, dass der Kovalenzradius zunimmt. Seite 4 von 5 Allgemeine Chemie 04.11.2002 Ergänzungen aus der Übung zur Allgemeinen Chemie: Ionisierungsenergie: Definition: Die Ionisierungsenergie entspricht der Energie, die nötig ist um einem Atom im Grundzustand dass schwächste gebundene Elektron zu entreißen. (> erste Ionisierungenergie) Symbolhaft dargestellt: A > A+; A>A Elektronenaffinität: Definition: Als Elektronenaffinität wird die Energie bezeichnet, die umgesetzt wird wenn ein Atom im Gaszustand ein Elektron aufnimmt. (>erste Elektronenaffinität) Symbolhaft dargestellt: A > A-; A+ > A; A2+ > A+ Seite 5 von 5