Teil 2 - Chemie Unibas
Werbung

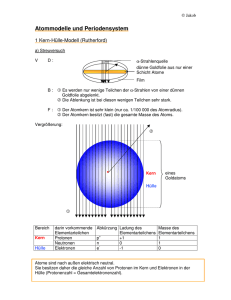
Der Aufbau der Atome und das Periodensystem Licht l*n = c Wellenlänge Lichtgeschwindigkeit (c = 3.00*108 ms-1) Frequenz (1Hz = 1 s-1) Elektrisches Feld Wellenlänge, l Farbe, Frequenz und Wellenlänge elektromagnetischer Strahlung Elektromagnetische Strahlung Frequenz, 1014Hz Wellenlänge, nm Röntgen- und g-Strahlung Ultraviolett Sichtbares Licht ≥ 103 10 ≤3 350 Violett Blau Grün Gelb Orange Rot 7.1 6.4 5.7 5.2 4.8 4.3 420 470 530 580 620 700 Infrarot Microwellen und Radiowellen 3.0 1000 ≤ 10-3 ≥ 3*106 Quantenmechanik: Elektromagnetische Strahlung wird in Form diskreter Energiepakete emittiert Lichtquanten oder Photonen E = h*n h = 6.63*10-34 Js / photon Planck-Konstante Die Struktur des Wasserstoffatoms Vollständiges Spektrum von H Die Frequenzen aller Linien des Spektrums folgen der Formel Ê1 1ˆ n = RH Á 2 - 2 ˜ Ë n1 n2 ¯ RH = 3.29*1015 Hz (Rydbergkonstante) ni : ganze Zahlen und n2 = n1+1, n1+2,... Jedes Photon wird von einem Atom emittiert und nimmt einen Teil dessen Energie mit. Energieabnahme des Atoms: DE n = DE/h Das Bohr‘sche Atommodell Das Elektron des H-Atoms bewegt sich auf wohldefinierten Kreisbahnen um den Kern! Nur bestimmte Bahnen sind erlaubt RH E = -h 2 with n = 1,2,3... n Die Energie ist am niedrigsten für n = 1 Grundzustand! Die Spektrallinien sind eine Folge von Uebergängen zwischen verschiedenen Bahnen! Die erlaubten Energiezustände nach Bohr Problem: alle Versuche das Modell auf kompliziertere Atome zu übertragen scheitern! Teilchen und Wellen Die de Broglie Beziehung Die Welle-Teilchen Dualität bzw. die Kombination von Wellenund Teilchencharakter sollte für alle Materie gelten! Jedes Teilchen hat Welleneigenschaften und seine Wellenlänge hängt von seiner Masse nach der de Broglie Beziehung ab: l= h Masse ¥ Geschwindigkeit Beispiele: † • Tennisball (100 g), der sich mit 65 km/h bewegt: l ≈ 10-33 m • Elektron, das sich mit 2000 km/s bewegt: l ≈ 3.6*10-10 m = 3.6 Å Die Unschärferelation (Heisenberg) h Dx ¥ ( m ¥ Dv ) ≥ 4p Kennt man die Position eines Teilchens der Masse m mit einer Genauigkeit Dx,† so muss die Unsicherheit über seine Geschwindigkeit mindesten Dv betragen! Folgen für das Bohr´sche Modell: Elektronen können sich nicht an einen wohldefinierten Ort auf einer Umlaufbahn befinden und sich mit wohldefinierter Geschwindigkeit bewegen! Die Wellenfunktion eines Elektrons In der Quantenmechanik spricht man von der Wahrscheinlichkeit, dass sich ein Teilchen an einem bestimmten Ort aufhält Mathematischer Ausdruck, der die Wahrscheinlichkeit des Aufenthalts eines Elektrons widergibt: Wellenfunktion y oder Atomorbital (Die Wahrscheinlichkeit ein Elektron an einem bestimmten Ort zu finden ist proportional zu y2 (Ladungsdichte) an diesem Ort) Das Elektron im Kasten (1D) Behandlung als hin- und zurücklaufende Welle vgl. schwingende Saite stehende Wellen 1 Wellenfunktion: Ê 2 ˆ 2 Ê npx ˆ Yn ( x ) = Á ˜ sinÁ ˜ Ë L¯ Ë L ¯ mit n = 1, 2, 3, ... † L Nur stehende Wellen mit nl = L sind möglich! 2 n 2h 2 erlaubte Energiewerte E n = 8mL2 † mit n = 1, 2, 3, ... In 2D: stehende Wellen eines Trommelfells! Die Atomorbitale des Wasserstoffs Schrödinger: jedes Atomorbital wird durch 3 Quantenzahlen Charakterisiert (= Zahl, die den Zustand eines Elektrons bezeichnet und den Zahlenwert einer Eigenschaft festlegt) Die Hauptquantenzahl n (n = 1, 2, 3,...) • Charakterisiert die Energie eines Elektrons • Alle Orbitale mit gleichem n gehören zur gleichen Schale • Bestimmt den mittleren Abstand vom Kern (Zunahme mit n!) Die Drehimpulsquantenzahl l (l = 0, 1, 2, ...n-1) • Gruppiert die Orbitale einer Schale in verschiedene Unterschalen • l = 0 1 2 3 4 ... s p d f g ... Die magnetische Quantenzahl ml (ml = l, l-1, ...-l+1, -l • Gibt das jeweilige Orbital in einer Unterschale an • Beispiel: l = 1: ml = 1, 0, -1 oder px, py, pz Die Spinquantenzahl ms (ms = +1/2, -1/2) • Eine genauere Analyse des Wasserstoffspektrums zeigt, dass die Spektrallinien nicht genau die Frequenzen aufweisen, die durch die Berechnung Schrödingers vorhergesagt werden • Elektronen verhalten sich in gewisser Hinsicht wie Kugeln, die um ihre eigene Achse rotieren Spin • Der Spin kann im oder gegen den Uhrzeigersinn sein Quantenzahl Symbol HauptNebenMagnetische Spin- n l ml ms Werte Bedeutung 1, 2, 3, ... 0, 1,..., n-1 l, l-1, ..., -l +1/2, -1/2 Bezeichnet Schale, gibt Energie an Bezeichnet Unterschale Bezeichnet Orbitale der Unterschale Gibt den Spinzustand an Schale 0 1 2 Unterschale s Unterschale p Unterschale d 0 +1 0 -1 +2 +1 0 -1 -2 s p d l= ml = Die s Orbitale sphärisch Wahrscheinlichkeit ´Elektronenwolke´ Grenzflächendiagramm: Radius Die p Orbitale ´hantelförmig´ pz z y Knoten Entfernung vom Kern y x Knotenebene y2 Entfernung vom Kern Wahrscheinlichkeit = 0 am Kern Die d Orbitale dz2 Die f-Orbitale Die Struktur von Mehrelektronen-Atomen Die effektive Kernladung • Aufgrund von Elektron-Elektron Abstossung hat eine p-Unterschale eine höhere Energie als eine s-Unterschale der gleichen Schale • Jedes Elektron wird durch die anderen Elektronen des Atoms von der Anziehung durch den Kern abgeschirmt effektive Kernladung ist niedriger als die tatsächliche! Energie Relative Energien der Schalen, Unterschalen und Orbitale in einem Mehrelektronenatom 4s p s 3p 3s 2p 2s 1s 3d d Pauli: Ausschlussprinzip • Auf einem Orbital haben höchstens zwei Elektronenplatz; die Spins dieser beiden Elektronen müssen gepaart sein. Verschiedene Elektronen eines Atoms unterscheiden sich in mindestens einer Quantenzahl Die Elektronenkonfiguration He 1s2 Geschlossene Schale = Schale, die die maximale Anzahl an Elektronen enthält, die durch das Pauli‘sche Ausschlussprinzip zugelassen sind. Li 1s2 2s2 Rumpfelektronen (wesentlich stärker gebunden) Das Aufbauprinzip Elektronenkonfiguration, die zur niedrigsten Gesamtenergie des Atoms führt! Reihenfolge, in der die Atomorbitale entsprechend dem Aufbauprinzip gefüllt werden. Zuordnung der Konfiguration eines Elements mit der Ordnungszahl z: 1. z Elektronen werden eines nach dem anderen entsprechend der Reihenfolge des Schemas in die Orbitale eingefüllt (nicht mehr als 2 pro Orbital) 2. Falls mehr als ein Orbital in einer Unterschale verfügbar ist, werden die Elektronen zunächst mit parallelem Spin in verschiedene Orbitale der Unterschale gefüllt (Hund‘sche Regel) Hilfreiches Modell: Atom besteht aus Edelgaskern, der von den Valenzelektronen (äusserste Schale) umgeben ist. Li N Si [He]2s1 [He]2s22p3 [Ne]3s23p2 Zahl der Valenzelektronen = Gruppennummer B 1s2 2s2 2px1 N 1s2 2s2 2px1 2py1 2pz1 1s2 2s2 2px2 2py2 2pz1 F Das Aufbauprinzip führt periodisch zu analogen Elektronenkonfigurationen und damit zu ähnlichen chemischen Eigenschaften Das Füllen der d-Orbitale Aufgrund gegenseitiger Durchdringung und Abschirmung haben die 4s Orbitale niedrigere Energie als die 3d Orbitale: Sc [Ar]3d14s2 Ti [Ar]3d24s2 Cr [Ar]3d54s1 Cu [Ar]3d104s1 Ausnahme: halbvolle oder volle Unterschalen haben niedrigere Energie! Eine Uebersicht der periodischen Eigenschaften Blöcke, Perioden und Gruppen p Block d Block f Block s Block Hauptgruppe, Nebengruppe, Seltene Erden, Periode = Hauptquantenzahl, repräsentative Elemente (Periode 2 und 3) Die Periodizität physikalischer Eigenschaften Atomradien (pm) Atomradius Atomradien (pm) Zunahme Abnahme Li 157 Be 112 B 88 C 77 N 74 O 66 F 64 Na 191 Mg 160 Al 143 Si 118 P 110 S 104 Cl 99 K 235 Ca 197 Ga 153 Ge 122 As 121 Se 117 Br 114 Rb 250 Sr 215 In 167 Sn 158 Sb 141 Te 137 I 133 Cs 272 Ba 224 Tl 171 Pb 175 Bi 182 Po 167 At ? Ionenradius Ionenradius ‚Anteil‘ am Abstand zwischen benachbarten Ionen in einem ionischen Festkörper Ionenradius Abnahme Li+ 58 Be2+ 27 B3+ 12 N3171 O2140 F133 Na+ 102 Mg2+ 72 Al3+ 53 P3212 S2184 Cl181 K+ 138 Ca2+ 100 Ga3+ 62 As3222 Se2198 Br196 Rb+ 149 Sr2+ 116 In3+ 72 Te2221 I220 Cs+ 170 Ba2+ 136 Tl3+ 88 Zunahme Zunahme Abnahme Vergleiche die Grösse der Ionen mit den zugehörigen Neutralatomen! Ionisierungsenergie = minimale Energie zur Entfernung eines Elektrons aus dem Grundzustand eines Atoms in der Gasphase E(g) E+(g) + e-(g) Benötigte Energie: I1 Die zweite Ionisierungsenergie eines Elements ist immer höher als seine erste!! Warum? Zunahme Zunahme H 1310 He 2370 5250 C 1090 2350 N 1400 2860 O 1310 3390 Ne F 1680 2080 3370 3950 Si 786 P 1060 S 1000 Ar Cl 1260 1520 Ga 577 Ge 762 As 966 Se 941 Br Kr 1140 1350 Sr 548 1060 In 556 Sn 707 Sb 833 Te 870 Xe I 1010 1170 Ba 502 966 Tl 812 Pb 920 Bi 1040 Po 812 Li 519 7300 Be 900 1760 Na 494 4560 Mg 736 1450 K 418 3070 Ca 590 1150 Rb 402 2650 Cs 376 2420 B 799 2420 3660 Al 577 1820 2740 At 920 Ra 1040 Elektronenaffinität = Energie, die frei wird, wenn ein Elektron zu einem Atom oder Ion eines Elements in der Gasphase zugegeben wird. E(g) + e-(g) Allgemein: E-(g) DHgain Elektronenaffinität wird nach oben rechts im PSE zunehmend exothermer! Warum nimmt die Elektronenaffinität von Kohlenstoff zu Stickstoff ab? H -73 He +48 C -122 N +7 O -141 +844 F -328 Ne +116 -43 Si -134 P -72 S -200 +532 Cl -349 Ar +96 Ca +29 Ga -29 Ge -116 As -78 Se -195 Br -325 Kr +96 Rb -47 Sr +29 In -29 Sn -116 Sb -103 Te -190 I -295 Xe +77 Cs -46 Ba +29 Tl -19 Pb -35 Bi -91 Po -174 At -270 Ra +68 Li -60 Be +48 Na -53 Mg +39 K -48 B -27 Al Elektronegativität Die Elektronegativität c eines Elements ist ein Mass für seine Anziehungskraft gegenüber Verbindung ist! c ≈ I + Eea H 2.2 Li 1.0 Be 1.6 B 2.0 C 2.6 N 3.0 O 3.5 F 4.0 Na 0.93 Mg 1.3 Al 1.6 Si 1.9 P 2.2 S 2.6 Cl 3.2 K 0.82 Ca 1.0 Ga 1.8 Ge 2.0 As 2.2 Se 2.6 Br 3.0 Rb 0.82 Sr 0.95 In 1.8 Sn 2.0 Sb 2.4 Te 2.1 I 2.7 Cs 0.79 Ba 0.89 Tl 2.0 Pb 2.3 Bi 2.0 Po 2.0 At 2.2 Trends der chemischen Eigenschaften Die s-Blockelemente • niedrige Ionisierungsenergie Metalle • basische Oxide • alle Verbindungen sind ionisch Bildung von Kationen Diagonale Beziehungen: Aehnlichkeiten der Eigenschaften diagonaler Nachbarn Li 1.0 Be 1.6 B 2.0 C 2.6 N 3.0 O 3.5 F 4.0 Na 0.93 Mg 1.3 Al 1.6 Si 1.9 P 2.2 S 2.6 Cl 3.2 Beispiele 6Li + N2 3Mg + N2 Be + 2H+ 2Al + 6H+ Be + 2 OH- + 2H2O 2Al + 2OH- + 6 H2O 2Li3N Mg3N2 Be2+ + H2 2Al3+ + 3H2 amphoter Be(OH)42- + H2 2Al(OH)4- + 3H2 Die p-Blockelemente • höhere Ionisierungsenergien weniger reaktiv als s-Blockelemente • rechte Seite des p-Blocks: hohe Elektronenaffinität Nichtmetalle, die Anionen bilden Die d-Blockelemente • alle d-Blockelemente sind Metalle (nach links : niedrige Ionisierungsenergien: hohe Reaktivität! nach rechts: höhere Ionisierungsenergien: inert) • alle d-Blockelemente bilden verschiedene Kationen mit unterschiedlichen Oxidationszahlen