1. Pauli-Prinzip
Werbung

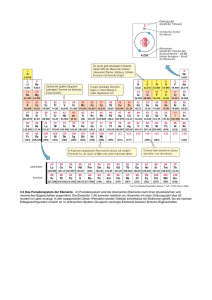
Vom Atombau zum Königreich der Elemente Wiederholung: Elektronenwellenfunktionen (Orbitale) Jedes Orbital kann durch einen Satz von Quantenzahlen n, l, m charakterisiert werden Jedes Orbital kann maximal 2 Elektronen aufnehmen, die sich jedoch in ihren Spin s unterscheiden müssen Die Hauptquantenzahl n bestimmt die Energie eines Orbitals Die Nebenquantenzahl l beschreibt den Bahndrehimpuls eines Elektrons. Sie bestimmt die Form des Orbitals l=0 l=1 l=2 i=3 (s-Orbital) (p-Orbital) (d-Orbital) (f-Orbital) radialsymmetrisch hantelförmig gekreuzte Doppelhantel rosettenförmig Die magnetische Quantenzahl m bestimmt die Ausrichtung des Orbitals unter dem Einfluß eines äußeren Magnetfeldes Auffüllen der Orbitale von Mehrelektronen-Atomen Alle neutralen Atome mit Z>1 enthalten Z Elektronen. Diese Elektronen werden nach bestimmten Regeln auf die Atomorbitale aufgeteilt. Unterschiede zum Wasserstoffatom Der Ausdruck für die potentielle Energie V in der Schrödingergleichung wird komplizierter - Eine größere Kernladungszahl Z impliziert eine stärkere Anziehungskraft - Bei mehreren Elektronen muß ihre gegenseitige Abstoßung berücksichtigt werden Die Form der Orbitale bleibt annähernd gleich, aber ihre Energie wird größer 1. Regel: In Mehrelektronensystemen gilt wegen der Einflüsse von Durchdringung und Abschirmung für die Orbitale einer Schale gewöhnlich die energetische Reihenfolge s < p < d < f Energetische Reihenfolge der Schalen und Unterschalen in einem Mehrelektronensystem Das Auffüllen der Elektronenschalen in einem Atom im Grundzustand wird im Wesentlichen durch zwei Regeln festgelegt: 1. Pauli-Prinzip Zwei Elektronen eines Atoms können nie in allen vier (n, l, m, s) Quantenzahlen übereinstimmen Orbitale können mit maximal 2 Elektronen mit entgegengesetzten Spin besetzt werden 2. Hundsche Regel Enthält eine Unterschale mehr als ein Orbital, dann werden zunächst Elektronen mit parallelem Spin auf die einzelnen Orbitale der Unterschale verteilt, bevor ein Orbital mit zwei Elektronen gepaarten Spins besetzt wird. Zweier-Periode Achter-Periode Für die Chemie sind nur die Valenzzustände (Außenelektronen) von Bedeutung, da sie für die Chemische Verbindung wesentlich sind. Von der Elektronenstruktur zum Periodensystem der Elemente Elektronenkonfiguration der Valenzschalen der Elemente Die chemischen Eigenschaften der Elemente ergeben sich aus der elektronischen Struktur ihrer äußersten Elektronenschale Wenn man die Elemente nach ihrer Atommasse hintereinander und dabei chemisch ähnliche Elemente untereinander anordnet, erhält man das PERIODENSYSTEM DER ELEMENTE Das „Periodensystem“ als Königreich mit Regionen, Landschaften, Regierung sowie innerer und äußerer Ordnung / Gesetzgebung 1. Die Geographie des Königreichs der Elemente Das Königreich besteht aus 118 bekannten Regionen, die man Elemente nennt. Sie bilden verschiedene Landschaften, darunter zwei Inseln (Wasserstoff und die Südinsel der Lanthanide und Aktinide) und 4 Küstenregionen. Landenge der Übergangsmetalle Die „Westliche Wüste“ besteht zusammen mit den Regionen der Südinsel aus meist grauen, metallisch glänzenden Regionen, die man „Metalle“ nennt. (92 von 118) Halogenide F, Cl, Br, J, At Die Halogenide bilden die bunteste Region des Königreichs. Es handelt sich um gasförmige (Fluor, Chlor), feste (Jod, Astat) und flüssige (Brom) Stoffe. In der Natur kommen sie oft assoziiert mit Alkalimetallen in Form ionischer Salze vor. Chalkogene O, S, Se, Te, Po Diese Regionen bilden, wenn sie mit anderen Regionen kooperieren, insbesondere Minerale und Erze und sind somit für den Aufbau der Erdkruste (O 46%) verantwortlich Die Regionen der Nordostküste: B, C, N, O, F, Ne In diesem Küstengebiet und seinem südlichen Hinterland befinden sich einige der biologisch wichtigen Regionen: Kohlenstoff, Stickstoff, Sauerstoff , Phosphor, Schwefel S C H Ö P Fe N Ostküste: Die „noblen“ Gase He, Ne, Ar, Kr, Xe, Ra Die Edelgase sind extrem reaktionsträge, d.h. sie gehen (bis auf Ausnahmen) keine Verbindungen mit sich selbst und anderen Elementen ein. Januskopfartige Regionen: Halbmetalle Die Halbmetalle sind Elemente und stehen im Periodensystem zwischen den Metallen und den Nichtmetallen. Sie können von der elektrischen Leitfähigkeit und vom Aussehen her weder den Metallen noch den Nichtmetallen zugeordnet werden. Alle Halbmetalle sind Feststoffe bei Normalbedingungen. Metalle, die in der Natur niemals gediegen vorkommen Alkalimetalle und seltene Erden: extrem hohe Reaktivität! Die Metalle der Landenge (Übergangsmetalle) Die ersten Regionen, die von Menschen in der Landenge entdeckt wurden, waren Kupfer und Zinn Bronzezeit , dazu kam noch Gold und Silber Münzmetalle Die Entdeckung von Eisen leitete die Eisenzeit ein. Durch die Erkundung der Regionen um das Eisen herum wurde Titan, Vanadium und Molybdän entdeckt, wodurch die Herstellung extrem widerstandsfähiger Stähle möglich wurde Industrielle Zeitalter Metalle der östlichen Savanne Al, Ga, Ge, In, Sn, Sb, Ti, Pb, Bi, Po Aluminium, Zinn und Blei sind extrem korrosionsbeständig gegenüber Wasser und anderen Stoffen chemische Totenstarre Die Geographie des Königreichs der Elemente auf einen Blick Nächstes Mal: Die Physische Geographie des Königreichs ...