Atommodelle und Periodensystem
Werbung
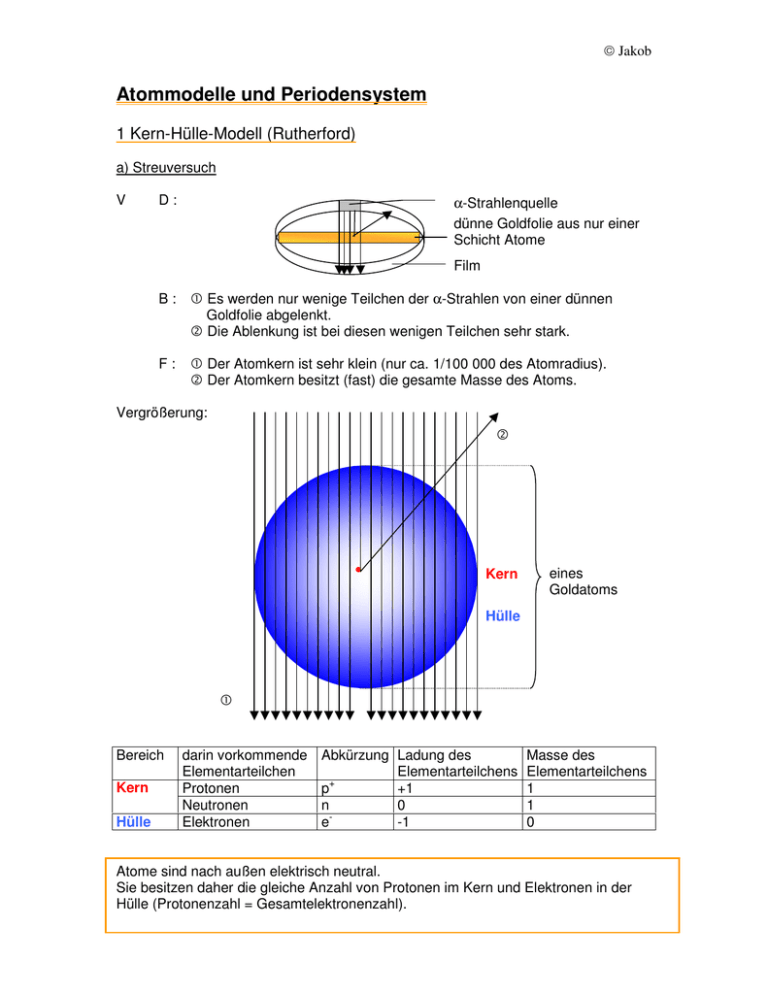
Jakob Atommodelle und Periodensystem 1 Kern-Hülle-Modell (Rutherford) a) Streuversuch V D: α-Strahlenquelle dünne Goldfolie aus nur einer Schicht Atome Film B: F: c Es werden nur wenige Teilchen der α-Strahlen von einer dünnen Goldfolie abgelenkt. d Die Ablenkung ist bei diesen wenigen Teilchen sehr stark. c Der Atomkern ist sehr klein (nur ca. 1/100 000 des Atomradius). d Der Atomkern besitzt (fast) die gesamte Masse des Atoms. Vergrößerung: d Kern eines Goldatoms Hülle c Bereich Kern Hülle darin vorkommende Elementarteilchen Protonen Neutronen Elektronen Abkürzung Ladung des Elementarteilchens + p +1 n 0 e-1 Masse des Elementarteilchens 1 1 0 Atome sind nach außen elektrisch neutral. Sie besitzen daher die gleiche Anzahl von Protonen im Kern und Elektronen in der Hülle (Protonenzahl = Gesamtelektronenzahl). Jakob b) Probleme • Die Elektronen müssten in den Kern stürzen. • Beim Erhitzen müsste ein kontinuierliches Spektrum abgegeben werden: Prisma weißes Licht alle Wellenlängen ⇐ kontinuierliches Spektrum 2 Schalenmodell (Bohr) a) Linienspektrum V Prisma D: rotes Licht Li nur eine Wellenlänge B: F: Linienspektrum ⇐ Linienspektrum statt kontinuierlichem Spektrum Nur eine Linie ist sichtbar im roten Bereich c d c Die Elektronen bewegen sich nur in bestimmten Abständen zum Kern d auf Kreisbahnen. Jede dieser Schalen entspricht einem Hauptenergieniveau: K, L, M, ... . Je größer die Schale, desto höher die Energie des Elektrons. Ein Elektron der äußersten Schale (= Valenzelektron) wird angeregt und wird auf die vorher unbesetzte nächsthöhere Schale geschossen. Beim Rückfall gibt es Licht von genau der Energie ab, die der Energie-Differenz der beiden Schalen entspricht. Nur die Energie eines Elektronenübergangs liegt hier im sichtbaren Jakob Bereich. Die Elektronen der äußersten Schale (= Valenzelektronen) bestimmen die chemischen Eigenschaften. Schalenmodell des Lithium-Atoms: nächsthöhere, unbesetzte M-Schale E Anregung Valenzschale, äußerste = energetisch höchste besetzte L-Schale Protonenzahl + Neutronenzahl Protonenzahl Elementsymbol 7 3 Li b) Probleme: • Erklärt nicht die maximale Elektronenbesetzung. • Erklärt nicht die Feinaufspaltung des Linienspektrums. 3 Orbitalmodell a) Feinaufspaltung des Linienspektrums V M D: Vergrößerung + Feinaufspaltung... p s L p s ... in Unterenergieniveaus = Orbitale Jakob B: F: c Serien von Spektrallinien c Die Schalen (= Hauptenergieniveaus) sind in Unterschalen (= Orbitale) unterteilt. Diese ergeben sich aus den Kombinationsmöglichkeiten bestimmter Quantenzahlen. Die maximale Elektronenbesetzung einer Schale ist 2n2. In der 2. Periode können maximal 8 Valenzelektronen auftreten. b) zusätzliche Informationen für die Kollegstufe • Die Hauptquantenzahl n bestimmt die Größe eines Orbitals (entsprechend einem bestimmten Energiegehalt). n = 1, 2, 3, ... • Die Nebenquantenzahl l bestimmt die Form eines Orbitals. Wichtig sind in der organischen Chemie das kugelförmige s-Orbital und das hantelförmige p-Orbital. l = 0, 1, ... (n-1) • Die magnetische Quantenzahl ml bestimmt die Anzahl und die räumliche Orientierung der Orbitale eines Typs. ml = -l, ..., 0, ..., +l • Die Spinquantenzahl s gibt die Ausrichtung des Elektrons in einem Orbital an. Es gibt zwei mögliche Werte: s = +1/2, -1/2 Hundsche Regel: Pauli-Verbot: Energiegleiche Orbitale werden zunächst einfach mit Elektronen besetzt. In einem Orbital können sich maximal zwei Elektronen aufhalten. Orbitale sind Orte, an denen die Aufenthaltswahrscheinlichkeit eines Elektrons sehr hoch ist. 4 Periodensystem der Elemente (PSE) a) Aufbau • Alle Atome mit der gleichen Protonenzahl gehören zum gleichen Element. • Die Elemente werden nach steigender Protonenzahl angeordnet. z.B. 1H, 2He • Die Eigenschaften der Elemente wiederholen sich in periodischen Abständen. b) Ionisierungsenergie, Elektronenaffinität und Elektronegativität • Alle diese Energien werden v.a. vom Atomradius bestimmt. • Die Definitionen der Ionisierungsenergie und der Elektronegativität beziehen sich auf einzelne Atome. Von den zwei Definitionen der Elektronegativität bezieht sich die erste auf einzelne Atome, sie erlaubt eine Vorhersage aufgrund des Atomradius. Die zweite Definition bezieht sich auf Nichtmetallatome in Verbindungen, sie erlaubt eine Vorhersage von auftretenden Bindungspolaritäten. In der Schule wird meist die zweite Definition der Elektronegativität gefragt! Jakob E Metallatom: Nichtmetallatom: Ionisierungsgrenze (vereinfachend bei beiden Atomen gleich dargestellt) Ionisierungsenergie (Ia) = Energie, die zugeführt werden muss, um ein Valenzelektron aus der Valenzschale zu entfernen. einzelnes Metall- oder Nichtmetallatom: Elektronenaffinität (Ea) = Energie, die frei wird, wenn ein Elektron der Valenzschale eines Atoms hinzugefügt wird. zwei Nichtmetallatome: E Elektronegativität (EN) EN = ½ (Betrag der Ia + Betrag der Ea) Elektronegativität (EN) = Bestreben eines Atoms, Bindungselektronenpaare anzuziehen. c) Hauptgruppen („Spalten“) • Die Hauptgruppennummer gibt die Zahl der Valenzelektronen an. • In einer Hauptgruppe wird von oben nach unten jeweils eine neue Schale besetzt. In einer Hauptgruppe nimmt der Atomradius von oben nach unten zu. Jakob c) Perioden („Zeilen“) • Die Periode gibt die Valenzschale an. • In einer Periode nimmt von links nach rechts die Protonenzahl zu. In einer Periode nimmt der Atomradius von links nach rechts ab. Hauptgruppe I II III IV V VI VII VIII 1 K 2 Periode / Schale L 3 M 4 N 5 O 6 P 7 Q e) Metalle und Nichtmetalle • Je größer der Atomradius, desto kleiner ist die Ionisierungsenergie. Metalle geben Elektronen ab. • Je kleiner der Atomradius, desto größer ist die Elektronenaffinität. Nichtmetalle nehmen Elektronen auf oder gehen Elektronenpaarbindungen ein. Jakob Hauptgruppe I II III IV V VI VII VIII 1 K 2 Periode / Schale L 3 M 4 N 5 O 6 P 7 Q f) Übersicht zu den Bindungstypen Beteiligte Elemente Bindungstyp Typische Stoffeigenschaft Metall-Metall Metallbindung silbriger Feststoff Metall-Nichtmetall Ionenbindung Weißer Feststoff Nichtmetall-Nichtmetall Elektronenpaarbindung farbloses Gas, farblose Flüssigkeit oder weißer Feststoff Die Edelgase (VIII. Hauptgruppe) sind nicht berücksichtigt, da sie normalerweise keine Verbindungen eingehen.











