Loesungsblatt_1
Werbung

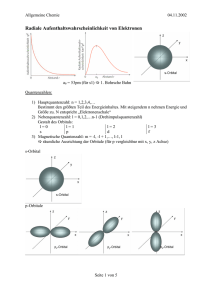
1 Aufbau und Struktur von organischen Verbindungen Prof. Dr. S. A. Sieber, Jun. Prof. Dr. S. F. Kirsch Übungssblatt 1: Bindungstypen und Orbitaltheorie Warm Up 1) Wodurch grenzt sich die Organische Chemie von der Anorganischen ab? Welches entscheidende Experiment verwischte die Grenzen dieser beiden Bereiche? Die org. Chemie beschäftigt sich ausschließlich mit Kohlenstoff und dessen Reaktionen, bzw. Reaktionen von Heteroatomen wie H, O, N, P, S, Cl, etc. an einem Kohlenstoffgrundgerüst. Ausnahmen der anorg. Kohlenstoffchemie sind Carbonate, Carbide und andere wie CO und CO2. Beide Teilbereiche wurden voneinander abgegrenzt unter der Annahme, dass die eine nicht aus der anderen hervorgehen könne. 1828 revolutionierten Friedrich Wöhlers Experimente diese Grundeinstellung, als er aus Ammoniumisocyanat durch Wärmezufuhr Harnstoff erhielt. Eine modernere Reaktion ist beispielsweise die Herstellung von Acetylen aus Calziumcarbit: CaC2 + H2O CaO + C2H2 Aufgaben 1) Bindungen i. Unterscheiden Sie 3 verschiedene Bindungstypen in organischen Molekülen. Welches Hauptcharakteristikum liegt der Unterscheidung zu Grunde? Definieren Sie für jede Bindungsart spezifische Merkmale tabellarisch. ii. Ordnen Sie die folgenden Moleküle einem Bindungstyp zu und finden jeweils ein weiteres Beispiel: CaO, CH4, C2H5-Br, HF, Li-C4H10, H2O, H3C-C6H6 Bindungstyp unpolar, kovalente Bindung polar, kovalente Bindung Ionische Bindung Faustregel ΔEN < 0,4 0,4 < ΔEN < 1,7 ΔEN > 1,7 Merkmale Teilen des Elektronenpaares durch beide Partner, Elektronentransfer entsprechend ihrer Elektronegativität. von einem Partner auf den anderen Ionisierung 2 Aufbau und Struktur von organischen Verbindungen Prof. Dr. S. A. Sieber, Jun. Prof. Dr. S. F. Kirsch Beispiel CH4, H3C-C6H6 C2H5-Br, HF, H2O CaO, Li-C4H10 weitere H2C=CH2 R-(C=O)-R‘ BrMg-CH3 Beispiele 2) Atomorbitale i. Was ist ein Atomorbital? Ein Atomorbital ist ein Bereich um den Atomkern herum, in dem eine 90 %ige Aufenthaltswahrscheinlichkeit für ein Elektron besteht. ii. Wie viele unterschiedliche s- und p-Orbitale gibt es und wie ist deren 3-dimensionale Struktur? Woran wird die Anzahl der jeweiligen Orbitale festgemacht? Schätzen Sie die Anzahl der unterschiedlichen d-Orbitale ab. s-Orbitale: 1 (s); p-Orbitale: 3 (px, py, pz) Die Anzahl der jeweiligen Orbitale ist abhängig von der Magnetquantenzahl (m), diese ist –l bis +l (Nebenquantenzahl). Für s-Orbitale ist das 0, also nur ein Zustand. Für p-Orbitale -1, 0, +1, also 3 mögliche Zustände. Für d-Orbitale -2 bis +2, also 5 mgl. Zustände: xy, xz, yz, x2-y2 und z2 3) Molekülorbitale i. Rekonstruieren Sie die Grundlagen der MO-Theorie, um zu entscheiden ob folgende Wechselwirkungen zur positiven Ausprägung eines Molekülorbitals führen: 1s mit pz, 1s2 mit 1s2, px mit px, px mit py, pz mit pz Aufbau und Struktur von organischen Verbindungen Prof. Dr. S. A. Sieber, Jun. Prof. Dr. S. F. Kirsch Lediglich Orbitale gleicher räumlicher Ausrichtung können miteinander Wechselwirken. Die Anzahl der Orbitale ist vor und nach der Ausbildung der Molekülorbitale gleich. Ebenfalls die Anzahl der Elektronen bleibt erhalten. 1s mit pz Ausbildung möglich, 1s2 mit 1s2 Ausbildung möglich , px mit px Ausbildung möglich, px mit py Ausbildung nicht möglich, da unterschiedliche räumliche orientierung, pz mit pz Ausbildung möglich ii. Versuchen Sie ausgebildete Molekülorbitale mit bindendem und antibindendem Anteil graphisch darzustellen. iii. Stellen Sie alle Molekülorbitale der sp2-Bindung im Ethenmolekül graphisch und energetisch dar. Machen Sie sich mit den Begriffen HOMO und LUMO vertraut. 3 Aufbau und Struktur von organischen Verbindungen Prof. Dr. S. A. Sieber, Jun. Prof. Dr. S. F. Kirsch Burnout 1) Skizzieren Sie die relevanten Molekülorbitale des Butadiens graphisch, indem Sie das Molekül vorteilhaft so zerlegen, dass es aus bereits bekannten Molekülorbitalen zusammensetzten können. 4