Übungsblatt 8: Alkohole und Eliminierungen
Werbung

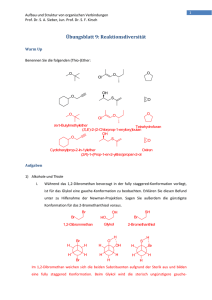
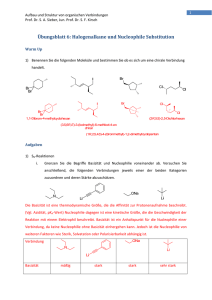
1 Aufbau und Struktur von organischen Verbindungen Prof. Dr. S. A. Sieber, Jun. Prof. Dr. S. F. Kirsch Übungsblatt8:AlkoholeundEliminierungen WarmUp Geben Sie die Strukturen zu den folgenden Alkoholen an: OH (1R,2S,5S)‐2‐Isopropyl‐5‐methylcyclohexanol (S)‐3‐Methylpent‐1‐en‐3‐ol (E)‐1,2‐Dibromo‐4,4‐dimethylpent‐1‐en‐3‐ol (7R)‐2‐sec‐Butylbicyclo[4.1.0]heptan‐7‐ol Spiro[4.4]non‐7‐en‐2‐ol OH Aufgaben 1) Alkohole i. Alkohole zeigen auf Grund ihrer Analogie zu Wasser ähnliche physikalische Eigenschaften, wie starke Polarität oder hohe Siedetemperaturen. Polyole wie zum Beispiel 1,2‐Ethandiol (Glycol) sind der Hauptbestandteil von Flugzeugenteisungsmittel. Warum findet man jedoch fast keine Verbindungen mit 2 Hydroxylgruppen an einem Kohlenstoff? Wie nennt man solche Verbindungen und warum sind sie in der Regel nicht stabil? Wie heißt die Regel, die eben diesen Sachverhalt klärt? Zu welcher Stoffklasse gehören die entstehenden Produkte? Wenn sich 2 Hydroxylgruppen an einem Kohlenstoffatom befinden, spricht man von Hydraten. Diese Verbindungen eliminieren häufig Wasser, wofür es 2 Hauptgründe gibt: Zum einen ist Wasser eine sehr stabile Verbindung, die in organischen Lösungsmitteln zudem selten 2 Aufbau und Struktur von organischen Verbindungen Prof. Dr. S. A. Sieber, Jun. Prof. Dr. S. F. Kirsch anzutreffen ist. Zum anderen wird die Eliminierung entropisch begünstigt, da 2 Teilchen aus Einem entstehen. Zuerst erkannt hat diese Tatsache Emil Erlenmeyer, nachdem die Erlenmeyer‐ Regel benannt ist. Bei der Eliminierung entstehen Aldehyde oder Ketone, je nach Art der Reste: 2) Eliminierungen i. Welche Verbindungen entstehen bei der folgenden Reaktion? Welche Reaktionstypen konkurrieren um die Bildung der Produkte? Hydroxidionen sind starke Basen und können Eliminierungen hervorrufen, jedoch kann ihre Nucleophilie auch zu einer SN2‐Reaktion führen. ii. Nennen Sie 3 Parameter, deren Einfluss entscheidend für die Art der ablaufenden Reaktion ist. Wie kann man diese ändern um die jeweils andere Reaktion zu begünstigen? Kriterium Nucleophile Substitution Eliminierung Nucleophilie der Base größere Nucleophilie geringe Nucleophilie sterischer Anspruch der Base geringe Hinderung starke Hinderung Temperatur niedrige bis moderate hohe Temperaturen Temperaturen 3 Aufbau und Struktur von organischen Verbindungen Prof. Dr. S. A. Sieber, Jun. Prof. Dr. S. F. Kirsch iii. Geben Sie die Produkte der folgenden E1‐Eliminierungen an und begründen Sie Ihre Entscheidung. OH H2SO4 T (H2O) H2SO4 T OH (H2O) H2SO4 T (H2O) OH OH H2SO4 T (H2O) OH H2SO4 T (H2O) H2SO4 T OH (H2O) Generell gilt bei E1‐Eliminierungen thermodynamische Kontrolle. Dabei wir das höher Substituierte Produkt gebildet (Saitzev‐Produkt). Die Stereoinformation geht verloren, weil ein kationisches Intermediat durchlaufen wird. Die 3. Reaktion eliminiert jedoch zum weniger substituierten Rest, weil die Triebkraft die erhöhte Stabilität im vergrößerten π‐System ist. 3) Umpolung i. Über Halogenalkane wissen Sie, dass diese als Akzeptoren für die Nucleophile Substitution dienen können. Nehmen Sie an, Sie haben einen Großteil Ihrer Zeit in einem Praktikum damit verbracht die gezeigte Verbindung herzustellen und stellen jetzt fest, dass Sie doch einen nucleophilen Donor benötigen. Wie können Sie das Molekül zu einem entsprechenden Donor umpolen? Geben Sie mindestens 2 Strategien an! 4 Aufbau und Struktur von organischen Verbindungen Prof. Dr. S. A. Sieber, Jun. Prof. Dr. S. F. Kirsch Burnout Ergänzen Sie in der folgenden Syntheseroute die Verbindungen A – D. nBuLi Br A Br2 B C H2SO4 T D (H2O) nBuLi Li Br2 Br H2SO4 T Br Br (H2O) Br Br