Chemie I
Werbung

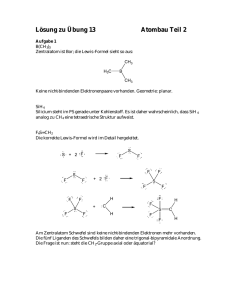
Lösung zu Übung 12 Atombau Teil 2 Aufgabe 1 Die meisten Atome tendieren dazu, ihre äussersten s- und p- Orbitale mit Elektronen zu füllen. Damit wird die Zahl von 8 Elektronen in der Valenzschale erreicht. Das kann durch Elektronenaufnahme geschehen (z.B. F→F-) oder durch formales Teilen der Elektronen in einer Zweielektronenbindung (unser „normaler“ Bindungsstrich). Die Oktettregel gilt für die Elemente von Li bis F recht streng. Bei höheren Elementen sind aber Ausnahmen möglich (z.B. PF5). Aufgabe 2 Schreiben Sie korrekte Lewis-Strukturen für folgende Summenformeln: H H C C H C C H C2H2 H H H H N H H O O H H H2 O2 NH4+ H C H N C O H O C N H O N C H C N O N O CHNO O O Cl Cl O O O wäre nach Lewis auch korrekt, entspricht aber nicht der Struktur eines Chlorat-Ions O ClO3 - O O Cl O Cl O O O O wäre nach Lewis auch korrekt, entspricht aber nicht der Struktur eines Perchlorat-Ions O ClO4Sowohl im Chlorat- wie auch im Perchlorat-Ion haben die Sauerstoffatome jeweils die gleiche Umgebung (der Chemiker sagt, sie seien äquivalent). Das schliesst Strukturen aus, in denen Sauerstoffatome nicht an das Chloratom gebunden sind. O O H O S O H H O S O H O O O O O O O O H weitere Isomere sind schreibbar; sie entsprechen aber nicht der Konstitution der Schwefelsäure. H2SO4 H S H O C HCO3- O H O C H H H C H H H H C H2CO2 H O H H C C H H C2H6O O H C2H4O2 H H C O H C O H H H H C O O H C O H H C O H C H C H C H O O H H H O O C C H H H C C H H H H H O O C H O H C O H H H O C C O H H O C H H H O C C O H H O H H C H C H H O C O H H CH3NO H H C N C H H O C N C2N2 O O C H N H H N H C H C H N N H H O H C N H H H H H O C O N C C C C N N N N N N C C N N C C diese Strukturen sind zwar mit dem Lewis-Formalismus kompatibel, entsprechen aber nicht stabilen Molekülen (vergl. Abschnitt "Hybridisierung") HNO3 O O H H N O Salpetersäure O O H O N H O N O O Persalpetrige Säure N O O O diese Strukturen sind zwar mit dem Lewis-Formalismus kompatibel, entsprechen aber nicht stabilen Molekülen Fazit: die Schreibbarkeit einer Lewis-Formel ist kein hinreichendes Kriterium für ein stabiles Molekül! Aufgabe 3 Chloratome haben 7 Valenzelektronen. Um ein Oktett zu erreichen, teilen sich zwei Chloratome an besten die Elektronen einer Bindung. So hat jedes Atom ein elektronisches Oktett. Chloratome dimerisieren daher bevorzugt unter Bildung von Chlormolekülen (Cl2). 2 Cl Cl Cl Eine analoge Überlegung führt auch zu F2, Br2 und I2. Aufgabe 4 NCl5 und OF6 können nicht gebildet werden (10 Valenzelektronen bei Stickstoff und 12 Valenzelektronen bei Sauerstoff). Cl N Cl Cl P Cl Cl F Cl Cl Cl Cl O N F P Cl Cl F (10 Valenzelektronen am Phosphoratom) Aufgabe 5 Bei der Beantwortung dieser Frage gehen wir von einer korrekten LewisFormel aus. CH2O H C O H Das Zentralatom C hat drei Liganden. Nichtbindende Elektronenpaare sind nicht vorhanden. Die Geometrie um das Zentralatom C ist trigonal planar. SO2 O S O O S O O S O Bei SO2 sind mehrere Resonanzformen (mesomere Strukturen) möglich. Für die Bestimmung der Geometrie müssen die beiden Sauerstoffatome und das nichtbindende Elektronenpaar am Schwefelatom berücksichtigt werden. Bei drei Liganden ergibt sich eine trigonal planare Geometrie. Da man aber das Elektronenpaar nicht sieht, erscheint SO2 einfach als gewinkeltes Molekül. S O O HCN H C N Das Zentralatom C hat zwei Liganden; nichtbindende Elektronenpaare sind am C-Atom nicht vorhanden. Die Geometrie von HCN ist daher linear. H3O+ Die korrekte Lewis-Struktur sieht so aus: H O H H Das Sauerstoffatom hat als Liganden drei Wasserstoffatome und ein nichtbindendes Elektronenpaar. Diese vier Liganden sind tetraedrisch angeordnet. H O H H H O H H Da man Elektronenpaare nicht sieht, ist H3O+ pyramidal. SnH4 Zinn steht im periodischen System unter Kohlenstoff und hat genau wie C vier Valenzelektronen. Die Bindung mit vier Wasserstoffatomen führt (wie bei CH4) zu vier kovalenten Bindungen. H H Sn H H Freie Elektronenpaare sind nicht vorhanden. Die vier Liganden um das Zentralatom (Sn) besetzen daher vier Ecken eines Tetraeders. H Sn H H H hinter der Papierebene vor der Papierebene AsH3 As steht im PS unterhalb von Stickstoff. Das Zentralatom As ist von drei Ligandatomen und einem freien (nicht-bindenden) Elektronenpaar umgeben. Die Anordnung der Liganden um das Zentralatom ist daher tetraedrisch. Da man aber das freie Elektronenpaar nicht „sieht“, ist die Geometrie des Moleküls pyramidal (analog NH3 oder PH3). IF4- I + F I F + F F F + F I I F F F + F F F + e F I - F I F F F F Hier ist das Zeichnen der Lewis-Formel im Detail angegeben. Das Iodatom hat 12 Valenzelektronen. Im IF4- hat das Zentralatom nun 6 Liganden (4 Fluoratome und 2 nichtbindende Elektronenpaare). Die Anordnung von 6 Liganden ist laut VESPR-Modell oktaedrisch. Damit nun die Abstossung zwischen den nichtbindenden Elektronenpaaren minimal sei, ist es am Besten, sie im Winkel von 180° anzuordnen. Die Fluorliganden bilden daher eine quadratisch planare Anordnung, in deren Zentrum das Iodatom liegt. F F F F F I I F F F OPCl3 oder P(O)Cl3 O Cl P O Cl Cl P Cl Cl Cl Auch hier sind mesomere Grenzstrukturen formulierbar. Das Zentralatom Phosphor ist von 4 Liganden umgeben; nichtbindende Elektronenpaare sind am Phosphoratom nicht vorhanden. Die resultierende Geometrie von Phosphoroxychlorid ist daher tetraedrisch. O P Cl Cl Cl NO2N N O O O O Zwei mesomere Grenzstrukturen möglich. Das Stickstoffatom hat drei Liganden: 2 Sauerstoffatome und ein Elektronenpaar. Die Geometrie von NO2- ist daher gewinkelt. IBr2Br Br I Br I Br Eine korrekte Lewis-Struktur ist links abgebildet. Die drei Elektronenpaare am Iodatom werden äquatorial angeordnet. Damit haben sie nur 120° Wechselwirkungen. Eine axiale Anordnung von Elektronenpaaren würde zu 90° Wechselwirkungen führen. IBr2- ist linear. AsCl+4 Cl Cl As Cl Cl Die vier Chlorliganden besetzen die Ecken eines Tetraeders, da am Zentralatom keine weiteren nichtbindenden Elektronenpaare vorhanden sind. Cl As Cl Cl Cl SbCl6Die 6 Ligandatome sind oktaedrisch um das Zentralatom angeordnet. Nichtbindende Elektronenpaare sind nicht vorhanden. Cl Cl Cl Cl Sb Cl Cl Cl Cl Sb Cl Cl Cl Cl