Zentralatom
Werbung
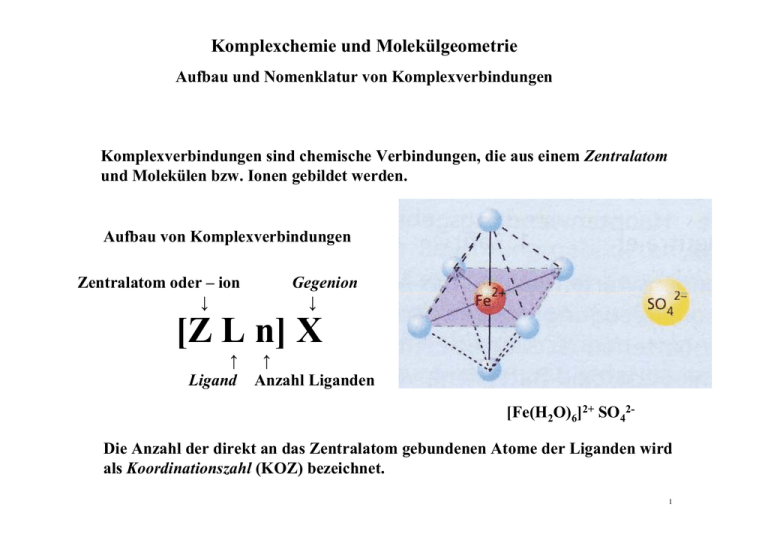
Komplexchemie und Molekülgeometrie Aufbau und Nomenklatur von Komplexverbindungen Komplexverbindungen sind chemische Verbindungen, die aus einem Zentralatom und Molekülen bzw. Ionen gebildet werden. Aufbau von Komplexverbindungen Zentralatom oder – ion ↓ Gegenion ↓ [Z L n] X ↑ ↑ Ligand Anzahl Liganden [Fe(H2O)6]2+ SO42Die Anzahl der direkt an das Zentralatom gebundenen Atome der Liganden wird als Koordinationszahl (KOZ) bezeichnet. 1 Komplexchemie und Molekülgeometrie Aufbau und Nomenklatur von Komplexverbindungen Komplexbindungen bei Nebengruppenelementen Unter Komplexbildung versteht man Verbindungen, die aus einem Zentralteilchen bestehen, um das mehrere andere Teilchen (Liganden) gelagert sind Das Zentralatom ist normalerweise ein Metallion, wie Fe2+, Fe3+, Cu2+, Ag+, Co3+, Ni, usw. Die darum herum angeordneten Liganden sind Teilchen mit mindestens einem freien Elektronenpaar, wie H2O, NH3, CO oder Ionen wie Cl-, CN-, NO2-, S2O32-. Aus der Summe der Ladungen der Liganden und des Zentralions ergibt sich die Ladung des Komplexes. 2 Komplexchemie und Molekülgeometrie Darstellung von Komplexverbindungen 1. Addition von Liganden am Zentralatom bzw. -ion. Ni2+ + 6 H2O [Ni(H2O)6]2+ 2. Substitution von Liganden an Zentralatomen bzw. –ionen [Cu(H2O)4]2+ + 4 NH3 [Cu(NH3)4]2+ + 4 H2O 3. Redoxreaktion an Zentralteilchen oder Liganden II II I III 2 [Cu(H2O)4]2+ + 10 CN 2 [Cu(CN)4]3- + 8 H2O + (CN)2 4. Kondensation CrO42- + H3O+ CrO3(OH)- + H2O 2 CrO3(OH)- [O3Cr – O – CrO3]2- +H2O 3 Komplexchemie und Molekülgeometrie Darstellung von Komplexverbindungen Bindungsverhältnisse von Komplexverbindungen Es kommen Ionen- und Atombindungen vor sowie alle Übergänge dazwischen. Alle Liganden besitzen mindestens ein freies Elektronenpaar, die zu Bindungselektronenpaaren zwischen dem Liganden und dem Zentralatom (ion) werden. Dabei bilden sich stabile Edelgaskonfigurationen aus. Sind die Liganden Ionen, ergeben sich Ion-Ion-Komplexe. Bsp.: Hexachloroplatinat(IV)-Anion [Pt(Cl)6]2-: Die Bindungskräfte zwischen den Ionen sind nicht gerichtet, die Chlorionen stoßen sich gleichmäßig ab es ergibt sich die regelmäßige räumliche Anordnung eines Oktaeders. Pt4+ befindet sich im Zentrum Statt Ionen können Zentralkation Dipolmoleküle mit ihrer negativen Teilladung angezogen werden. Dann entstehen Ion-Dipol-Komplexe. Bsp.: Hexaquamagnesium(II)-Kation [Mg(H2O6)]2+: Koordinationszahl 6 Wassermoleküle sind in den Ecken eines Tetraeders angeordnet (wie oben). Das Mg2+ -Ion ist im Zentrum. 4 Komplexchemie und Molekülgeometrie Darstellung von Komplexverbindungen Mehzähnige Liganden Liganden, die sich mit mehr als einem einsamen Elektronenpaar an der Auffüllung der Elektronenschalen des selben Zentralatoms beteiligen, nennt man mehrzähnig. Ein Ligand kann nur dann zwei oder mehr Koordinationspositionen am Zentralatom besetzen, wenn die dafür in Frage kommenden Elektronenpaare weit genug auseinander liegen. Die e- -Paare müssen deswegen an verschiedenen Atomen eines Liganden liegen. Bsp.: Ethylendiamin H2C CH2 H2N .. NH .. 2 Ethylendiamin geht über die einsamen Elektronenpaare beider Stickstoffatome koordinative Bindungen unter Ringbildung ein Chelatkomplexe (griech. Krebsschere) Chelate sind meist stabiler als Komplexe mit einzähnigen Liganden (bei gleichem Zentralion). H2C CH2 H2N .. NH .. 2 Z 5