Seminar zum Praktikum
Werbung

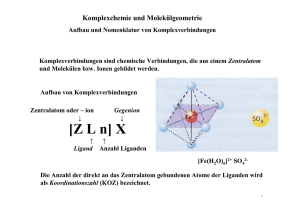
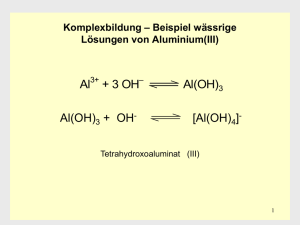
Wintersemester 2012/2013 Allgemeine Chemie – Basis Praxis Seminar zum Praktikum Anorganische Chemie – Basis Praxis Dr. Stephan Walleck Arbeitsgruppe AC I von Prof. Dr. Thorsten Glaser Raum: E3-141 e-Mail: [email protected] Modulaufbau Modul 21-M7: Anorganische Chemie – Basis Praxis 3 LP: Praktikum SoSe 2013 2 LP: Seminar WS 2012/13 Lehrbücher • Mortimer/Müller: „Chemie, Das Basiswissen der Chemie“ 10. Aufl., Thieme 2010, ~ 65 € • Riedel/Janiak: „Anorganische Chemie“ 8. Aufl., de Gruyter, Berlin 2011, ~ 75 € • Housecroft/Sharpe „Anorganische Chemie“ Pearson Studium, ~ 80 € • Huheey/Keiter/Keiter: „Anorganische Chemie“ 3. Aufl., de Gruyter, Berlin 2003, ~ 80 € • Holleman/Wiberg: „Lehrbuch der Anorganischen Chemie“ 102. Aufl., de Gruyter, Berlin 2007, ~ 94 € • Jander/Blasius: „Anorgansiche Chemie I“ 17. Aufl., Hirzel, Stuttgart 2012, ~ 40 € Inhaltsverzeichnis – Kapitel 1 1. Einführung in die Komplexchemie 1.1 Bedeutung von Metallen 1.2 Was ist ein Komplex? 1.3 Alfred Werner: Grundlagen der Komplexchemie 1.4 Koordinationszahl und Koordinationspolyeder 1.5 Bindungen in der Koordinationschemie 1.6 Oxidationszahlen 1.7 Nomenklatur von Komplexverbindungen 1.8 Komplexgleichgewichte 1.9 Chelatliganden und der Chelateffekt Bedeutung von Metallen • beinahe 3/4 aller chemischer Elemente sind Metalle • Stützpfeiler der modernen Gesellschaft • Nur selten elementar, viel häufiger kationisch vorkommend • aber nicht nur abiotisch am Aufbau der Erdkruste beteiligt, sondern auch biotisch von elementarer Bedeutung Quelle: http://images.zeit.de/wissen/201007/infografik-baustein.pdf 1.2 Was ist ein Komplex? Die einfachste Definition: Ein Komplex besteht aus einem Zentralatom (Z) und mehreren daran gebundenen Liganden (L). Die Definition nach HoWi: „Unter Komplexen (…) versteht man Moleküle oder Ionen ZLn, in denen an ein ungeladenes oder geladenes Zentralatom Z (…) entsprechend seiner Koordinationszahl (…) n mehrere (Anmerkung: nicht ein) ungeladene oder geladene, ein- oder mehratomige Gruppen L („Liganden“) (…) angelagert sind.“ 1.6 Die Oxidationszahl IUPAC: Die Oxidationszahl (oder auch Oxidationsstufe) ist ein Maß für die Oxidation eines Atoms in einer Verbindung. Dabei ist die Oxidationszahl definiert als die Ladung, die ein Atom hätte, wenn die Elektron unter folgenden, vereinbarten Voraussetzungen gezählt werden könnten: (1) Die Oxidationsstufe eines freien Elements ist Null. (2) Für ein einatomares Ion entspricht die Oxidationsstufe der Ladung. (3) Die Summe der Oxidationsstufen aller Atome eines Molekül ist Null; bei Ionen entspricht diese Summe der Gesamtladung des Ions. (4) Wasserstoffatome haben in den meisten Verbindungen eine Oxidationsstufe von +I, Sauerstoffatome von –II. 1.6 Die Oxidationszahl Kationisch Anionisch Komplex Koordinationszahl Liganden form. Oxidationsstufe des Zentralatoms [Co(H2O)6]2+ [Co(H2O)6]3+ [Fe(CO)5] [NiCl2(NH3)4] 6 6 5 6 6 H2O 6 H2O 5 CO 4 NH3, 2 Cl- II III 0 II [CoCl4]2−− 4 4 Cl− II [MnO4]− [FeF6]3[Mn(CO)5]- 4 6 5 4 O2−− 6 F5 CO VII III -I 1.7 Nomenklatur von Komplexverbindungen Formelschreibweise Formelschreibweise von von Komplexen Komplexen nach nach IUPAC: IUPAC: o Koordinationseinheit in eckige Klammern, ggf. Ladung als Exponent o Zentralatom vor Liganden o Anionische vor neutralen Liganden vor kationischen Liganden o Alphabetische Reihenfolge innerhalb der Ligandenklassen (Abkürzungen wie Formeln) o Mehratomige Liganden und Abkürzungen in runden Klammern o Oxidationsstufe als Exponent hinter dem Zentralatom Beispiele: Zentralatom Oxidationszahl Gesamtladung Liganden Cr Co Fe Pt III ? II ? 3+ 3? 0 6 H2O 6 Cl4 NH3, Cl-, Br2 NH3, Cl-, Br-, NO2-, H- 1.7 Nomenklatur von Komplexverbindungen Systematische Systematische Namen Namen von von Komplexen Komplexen nach nach IUPAC: IUPAC: o Liganden in alphabetischer Reihenfolge vor dem Namen des Zentralatoms (unabhängig von der Ladung!). o Angabe der Oxidationszahl (röm. Ziffern) des Zentralatoms oder der Gesamtladung (arab. Ziffern + Ladung) der Koordinationseinheit in runden Klammern hinter dem Namen des Zentralmetallatoms. o Namen anionischer Liganden enden auf –o, neutrale ohne den Ladungszustand bezeichnende Endung. o Neutralliganden werden in runde Klammer eingeschlossen (Ausnahmen: Ammin, Aqua, Carbonyl, Nitrosyl). o Anionische Komplexe erhalten die Endung –at nach dem lateinischen Namen des Zentralatoms. 1.7 Nomenklatur von Komplexverbindungen Namen Namen von von anionischen anionischen und und neutralen neutralen Liganden: Liganden: Formel Ligandenname Formel Ligandenname FClBrHO2S2(SH)(OH)(C2O4)2(SO4)2(CN)(NCO)(NCS)(NO3)(NO2)- Fluoro Chloro Bromo Hydrido Oxo, Oxido Thio, Sulfido Hydrogensulfido Hydroxido Oxalato Sulfato Cyano Cyanato Thiocyanato Nitrato Nitrito, Nitro H2O H2S CO CS N2 NH3 PH3 (CH3)3N (C6H5)3P NO Aqua Sulfan, Hydrogensulfid Carbonyl Thiocarbonyl Distickstoff Ammin Phosphan, Phosphin Trimethylamin Triphenylphosphin, ~an Nitrosyl 1.8 Komplexgleichgewichte Für Für die die Komplexbildung Komplexbildung und und die die Komplexstabilität Komplexstabilität gilt gilt das das Massenwirkungsgesetz: Massenwirkungsgesetz: Bruttostabilitätskonstante βn und individuelle Stabilitätskonstante Kn ← [ML ] M + n L→ n βn = K1• K2• … • Kn βn= [MLn] [M][L]n Üblicher Weise gilt: K1 > K2 > K3 > … > K n 1.9 Chelatliganden und der Chelateffekt Ein Einn-zähniger n-zähnigerLigand Ligandergibt ergibteinen einenstabileren stabilerenKomplex Komplexals alsnneinzähnige einzähnige Liganden Ligandenähnlicher ähnlicherEigenschaften. Eigenschaften.Die DieZähnigkeit Zähnigkeiteines einesLiganden Ligandenist istdie die Anzahl Anzahlder derDonoratome, Donoratome,die diean andas dasMetall Metallbinden. binden. Zweizähnige Chelatliganden Oxalat (ox) Triethylentetraamin (trien) dreizähnig vierzähnig sechszähnig Übungsaufgaben zum Kapitel 1 1. Benenne Sie entsprechend der Nomentklaturregeln die folgenden Komplexverbindungen: [Ni(H2O)6]SO4, [CoCl3(H2O)3], Na2[Fe(CO)4], Cs2[NiBr4], Na[Cr(NCS)4(NH3)2], Na[PtBrCl(NO2)(NH3)], [Pd(H2O)2(NH3)2][CuCl4] 2. Geben Sie folgende Komplexverbindungen in Formelschreibweise an: Pentaaminoxidovanadium(V)chlorid, Kaliumhexacyanoferrat(III), Hexaammincobald(III)chlorid, Kalium-dinatriumpentafluorocuperat 3. Geben Sie jeweils mindestens ein Beispiel für einen 2, 3, 4 und 6-zähnigen Chelatliganden. 4. Nennen Sie die wichtigsten Koordinationspolyeder zu den Koordinationszahlen 4, 5, 6 und 8. 5. Geben Sie die formalen Oxidationsstufen und die Valenzelektronenkonfiguration folgender Komplexe an: [V(H2O)6]4+, [Ti(H2O)6]3+, [V(H2O)6]3+, [Pd(NH3)4]2+, [Mn(CO)5H], [CuCl4]2-, Na[CrBrCl(NO2)2(NH3)2]