08.03.2005
Werbung

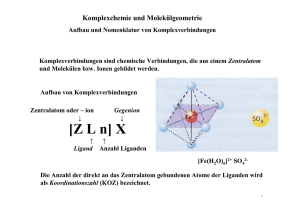
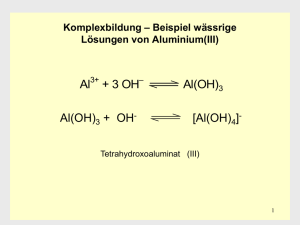
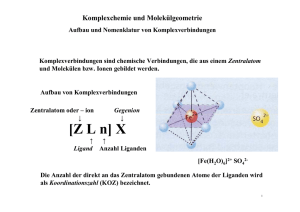
Protokoll Basismodul Chemie I, Praktikum: Komplexverbindungen; Komplexgleichgewichte Veranstalter: Dr. Ulrich Neuert Jörg Mönnich () Betreuer: Carolin, Christian Versuchstag: Dienstag, 08.03.2005 Komplexverbindungen; Komplexgleichgewichte Komplexverbindungen; Komplexgleichgewichte Einleitung Der Zusammenhalt von Atomen in Molek Bindung bezeic ülen und Kristallen wird als c hemische hnet. Diese entstehen prinzipiell nach bestimmten Gesetzmäßigkeiten, da sich bei Verb indungen die physikalischen und c hemischen Eigenschaften ändern. So lager n sich zu m Beis piel Atome dann zusammen, wenn dabei die Entropie z unimmt, also ein energi eärmerer Zustand erreicht wird. Es wird zwischen vier Bindungsarten unterschieden : Ionenbindung, Atombi ndung (kovalente Bindung), Metallbindung und Komplexv erbindungen. Ionenbindungen entstehen durch den Zusammenhalt entgeg en gesetzt geladener Ionen mi ttels elektrostatischer Kräfte; bei der Atombindung teilen sich zwei Atomkerne eine gemeinsam e Elektronenhülle. Bei Metallbindungen geben die Atome ihre Außenelektronen ab. Die entstehenden Metall-Ionen or dnen sich unter Einfluss der sie umgebende n Elektronen zu einem Gitter. Komplexverbindungen entstehen durch Anlagerung v on einem oder mehrerer Ionen oder Molekülen (den Liganden) um ein Z entralatom. Dieses Z entralatom kann ein Metall-Ion oder ein Metall-Atom sein. Die Bindung zwischen Zentralatom und Ligand kann als kovalent mit ionischem Ante il besc hrieben werden. Freie, a lso ungebundene Liganden verfügen über wenigstens ein Elek tronenpaar, welches sie dem Zentralatom zur Verfügung stellen kö nnen. Der Ligand wir kt damit als LewisBase und das Zentralatom als Lewis-S Zentralatom gebundenen Atom äure. Die Anzahl der direkt an das e nennt man die Koor dinationszahl. Ein charakteristisches Merkmal ist es, das sich die Liganden relativ leicht austauschen lassen und damit zu einer großen Vari abilität der Zusammensetzung führen. „Berühmte“ Komplexv erbindungen sind zum Beispiel das Hä moglobin oder das im letzten Ver such besc hriebene Chlorophyll. Viele Komplexe sind farbig u Änderung der Farbe deutet somit auf ei nd eine nen Ligandenaustausch hin. Auf diesen Tatsachen beruhen die im Folgenden Versuche und Ergebnisse. -1- Komplexverbindungen; Komplexgleichgewichte Material, Methoden, Messwerte I. Komplexe des Silbers 3-4 ml einer 0,1 molaren AgNO 3-Lösung werden mit verdünnt em Ammoniakwasser versetzt. Nach Bildung von Niederschlag wird bis zum Aufklaren der Lösung weiter Ammoniakwasser zugesetzt und auf drei Reagenzgläser verteilt. - Zur 1. Probe werden fünf Tropfen NaCl (0,1 m) gegeben - Zur 2. Probe werden fünf Tropfen KBr (0,1 m) gegeben. Nach Absetzen des Niederschlages wird dekantiert und der Niederschlag in Ammoniakwas ser gelöst. - Zur 3. Probe werden fünf Tropfen KI (0,1 m) gegeben. Nach Absetzen de s Niederschlages wird dekantiert und der Niederschlag in 5% Na 2S2O3-Lösung gelöst. Dazu wird 1 ml Natriumsulfid-Lösung gegeben. In der ersten Probe ist ein weiß er Nieders chlag zu er kennen. In der zweiten Probe bildet sich eine gräulich-milc hige Flüssigk eit und ein leicht gelblicher Niederschlag. Nach dem Dekantieren und Lös ung des Niederschlages ist die Lösung farblos un d klar. Die dritte Probe wird nach Zugabe v on KI zunächst milchig; man kann ein e Ausfällung eines gelblich en St offes erkennen. Nac h dem De kantieren und Lösung des Stoffes in Na 2S2O3 ergibt s ich eine farblose und klare F lüssigkeit. Set zt man dieser Flüssigkeit Natriumsulfid zu, fällt ein bräunlicher Stoff aus. II. Ligandenaustausch bei Kupferkomplexen 0,5 g Kupf er(II)chlorid werden in 3 ml Wasser gelöst, einige Spatelspitzen NaCl zugesetzt und danac h wieder mit Wasser ve rdünnt. 2 ml dieser Lösung werden mi t verdünntem Ammoniakwasser versetzt, bis eine klare Lösung entsteht. Löst man das CuCl 2 in Wasser, ergibt sich daraus eine hellblaue Flüssigk eit. Nach Zugabe v on NaCl färbt sich diese Flüss igkeit türkis. Nach dem Verdünnen mit Wasser ist eine erneute Hellblau-Färbung zu sehen. Versetzt man die Lös ung mit Ammoniakwasser, wird sie dunkelblau und klar. -2- Komplexverbindungen; Komplexgleichgewichte III. Ligandenaustausch bei Cobaltkomplexen 10 Tropfen 20%-iger C obaltchlorid-Lösung werden in ei nem Reagenzglas mit einer Spatelspitze Natriumchlorid v ersetzt und über einem Bunsenbrenner vorsichtig erhitzt. Nach dem Abkühlen wird das Reagenzglas in Eiswasser gestellt. Die Cobaltchlorid-Lösung mit NaCl ist zunächst rot. Nach dem Erhitzen färbt sie sich violett. Im Eisbad färbt sich die Lösung erneut rot. IV. Cobaltkomplexe als Feuchtigkeitsindikator Ein Tropfen Cobaltchlorid- Lösung wird auf ein Filterpapi er getropft und danach im Trockenschrank bei 50 °C getrocknet. Das Papier wird anschließend an der Luft liegen gelassen. Nach der Trocknung zeigt sich eine deutliche Blaufärbung. Lässt man das Papier a n der Luft liegen, wird diese Färbung heller. V. Nachweis von Magnesium mit Titangelb Es soll ein e MgCl 2⋅6H2O-Lösung hergestellt werden, di e 1 mg Mg/ml enthält. 10 ml davon werden mit 1 ml 0,05%-iger Tita ngelblösung und ansc hließend mit 10 ml verdünnter NaOH versetzt. Die Lösung ist nach Zugabe von Titangelb z unächst wässrig gelb. Nach Zugabe von NaOH ist ein Farbumschlag nach rosa zu erkennen. VI. Nachweis von Magnesium in Chlorophyll 10 g Spinat werden in 3 ml konz. Sa anschließend durch ein F lzsäure und 7 ml Wasser aufgekocht und ilter gegeben. Das Filtrat neutralisiert und auf 100 ml verdünnt. Mit 10 ml dieser wird mit verdünnter NaOH Lösung wird der Magnesiumnachweis mit Titangelb durchgeführt. Das Filtrat ist zunächs t grün-gelblich. F ührt man den Nachweis mit Titangelb durch, färbt sich die Lösung rötlich. -3- Komplexverbindungen; Komplexgleichgewichte VII. Komplexometrische Bestimmung von Calcium Ein 100 ml Messkolben mit einer unbekannt en Konzentration von Calc ium wird mit Wasser aufgefüllt. 10 ml der Lösung werden auf 100 ml ver dünnt. Nach dem Auflösen der zugesetzten Indikator-P uffertablette wird 1 ml konz. NH 3-Lösung hinzu gegeben. Anschließend wird mit EDTA (0,1 m) bis zum Farbumschlag titriert. Auswertung, Diskussion I. Zunächst die Reaktionsgleichungen: Probe 1: Ag+ + Cl- ' AgCl AgCl + 2 NH3 ' [Ag(NH3)2]+ + ClProbe 2: Ag+ + Br- ' AgBr Nach Zugabe von Ammoniakwasser: AgBr + 2 NH3 ' [Ag(NH3)2]+ + BrProbe 3: Ag+ + I- ' AgI Nach Zugabe von 5%-iger Na2S2O3: AgI + 2 S2O32- ' [Ag[S2O3)2]3Nach Zugabe von Natriumsulfid: 2 Ag+ + S2- ' Ag2S Silberchlorid (AgCl) und Silber bromid (AgBr) lösen sich nur mäßig, Silberiodid (AgI) nur wenig in konz. Ammoniakwasser. Zu er klären ist dies durch die verschiedenen Löslichkeitsprodukte. Die pK L-Werte von AgCl (9,96) und Ag Br (12,4) sind höher als die Komplexbildungst endenz, daher lösen sie si ch leichter. Bei AgI (16,0) ist das Löslichkeitsprodukt niedriger, daher löst es sich nicht so leicht. Erst nach Zugabe von Na2S2O3 ist die Komplexbildungst endenz höher als das Löslichkeitsprodukt, und das AgI löst sich. Führt man nun Natriumsulfi d hinzu, wird das Löslic niedriger und Ag2S fällt aus. II. Reaktionsgleichungen: -4- hkeitsprodukt Komplexverbindungen; Komplexgleichgewichte [Cu(H2O)6]2+ + 4 Cl- ' [CuCl4]2- + 6 H2O hellblau türkis [Cu(H2O)6]2+ + 6 NH3 ' [Cu(NH3)6]2+ + 6 H2O hellblau dunkelblau Komplexbildungen sind Gleichgewichtsreaktionen. Das Massenwirkungsgesetz muss also erfüllt werden. Fügt man Cl - hinzu, verschiebt sich das Gleichgewicht; bei Zugabe von H 2O verschiebt es s ich in die ander e Richtung. Während der in diesem Versuch ablaufenden Reaktionen findet i mmer wieder ein Ligandenaustausch statt, der die Umfärbungen verursacht. III. Reaktionsgleichung: [Co(H2O)6]2+ + 4 Cl- ' [CoCl4]2- + 6 H2O In diesem Versuch ist sehr gut z u erkennen, dass die Li gandenanlagerung an das Cobalt temperaturabhängig ist, da die Abkühlen im Eisbad gleich s Farben vor dem Erhitzen und nach dem ind. Nu r während die Lös ung eine relativ hohe Temperatur hat, ist si e violett. In diesem Zustand findet ein Li gandenaustausch statt; Chlor lagert sich an. Bei niedrigeren Temperaturen ist Wasser an das Cobalt angelagert. IV. Die unterschiedliche Färbung deutet unterschiedliche Liganden an hier wieder darauf hin, dass sich das Cobalt anlagern. Die Blaufärbung ist wie in Versuch III ein Indiz für die Anlagerung von Chlor, welches dur ch die Verdunstung des Wassers im Trockenschrank geschieh t. Legt man das getrock nete Filter an die Luft, so kann sich Wasser der Luftfeuchtig keit anlagern und es leichten Farbänderung. Die Luftfeuchte reicht jedoch nicht aus, um einen vollständigen Farbumschlag zu erzielen. V. Berechnung der benötigten Menge MgCl2⋅6 H2O: M(MgCl2⋅6 H2O) = 203,302 g/mol -5- kommt zu einer Komplexverbindungen; Komplexgleichgewichte Verhältnis MgCl2⋅6 H2O/Mg: 203,302 = 8,35 . Da diese Angabe sich auf g/Liter bezieht 24,305 und man 10 ml benötigt, wird der Wert du rch 100 geteilt. Somit kommt man auf 0,0835g, die benötigt werden, um die Lösung herzustellen. Die durch das T itangelb aus gelöste rote Färbung ist das Zeichen für einen Magnesium-Titangelb-Komplex. Somit ist dies der Nachweis für Magnesium. VI. Durch das Aufk ochen des Spinates mit HCl werden die Zellwände und - membranen zerstört, so dass nach Filtration das Chlorophy ll vorliegt. Dies erklärt auch die leichte grünliche F iltrats. Da der Chlorophyllkomple ärbung des F Magnesium als Zentralatom hat, bietet x sich hier wieder der in Versuch V durchgeführte Nachweis mit Titangelb an. VII. Bei den drei T itrationen zur Ermittlung des Durchschnittswertes wurden folgende Mengen EDTA verbraucht: 11,4 11,35 11,4 Durchschnitt 11,383 Berechnung des Calciumgehaltes: c = 0,1 mol/g EDTA n = c ⋅ V = 0,1⋅11,383 = 1,1383 mol M (Ca ) = 40, 078 g / mol ⇒ m = n ⋅ M = 1,1383 ⋅ 40, 078 ≈ 45, 622 g Dieser Wert muss w egen der Verdünnung mal zehn genommen werden. Daher befindet sich in dem Messkolben 456,62 g Calcium. Diese Art der Bestimmung ist möglich, da das Calc ium mit dem Indikator zunächst eine Komplexverbindung einge ht. Setzt man EDTA hinzu, Indikator, da der Komplex mit dem Indika verdrängt dieses den tor wenig er stabil ist, als der Calc EDTA-Komplex. Dur ch dies en Ligande naustausch kommt der Farbwechse zustande. -6- iuml