Rutherford (1920) and Chadwick (1932)
Werbung
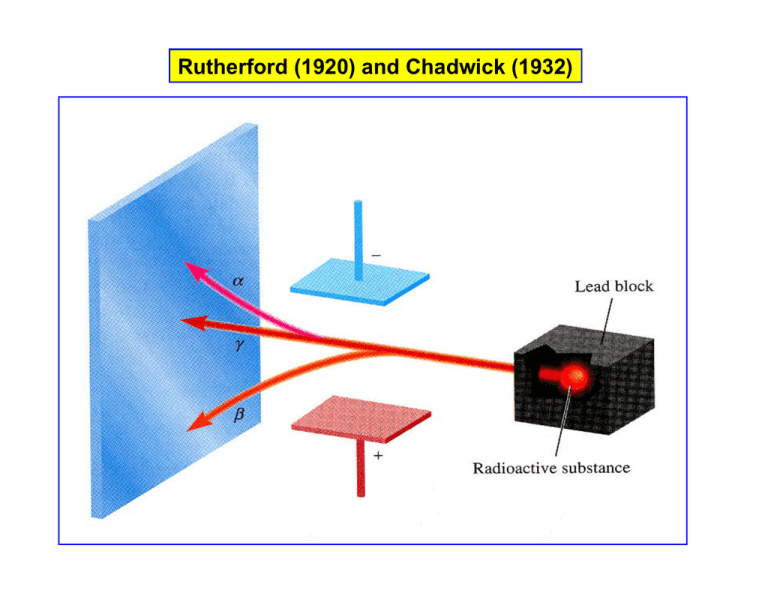
Rutherford (1920) and Chadwick (1932) N = N0 e-kt ln N = ln N0 - kt k = 0,693/t1/2 Die elektronische Struktur der Atome • Einheiten, Atomstruktur (subatomare Teilchen) • Isotope & Radioaktivität • Die Wellennatur des Lichts • Gequantelte Energien und Photonen • Linienspektren & das Bohr’sche Atommodell • Das wellenartige Verhalten von Materie • Quantenmechanik & Atomorbitale • Darstellung von Orbitalen • Mehr-Elektronen-Atome • Elektronenkonfigurationen …und das Periodensystem der Elemente Atom: 200-500 pm Atomkern: 0,01 pm Elektronische Struktur Kenntnisse aus Spektroskopie Energie ist gequantelt! „Welle“ Planck (ca. 1900) Wellenlänge: (cm) Wellenzahl: 1/ (cm-1) Frequenz: = c/ = s-1 c = 3 x 1010 cm s-1 = 3 x 108 m s-1 Energie: E = h = hc/ = J h = Planck Konstante = 6,626 x 10-34 J s Elektromagnetische Strahlung Spektroskopische Vorgänge E2 E 1 2 E1 1 Energie Aufnahme: Absorption E = E2 – E1 = h 2 Energie Abgabe: Emission E = E1 – E2 = -h Ein kontinuierliches Spektrum Spektroskopische Vorgänge E2 E 1 2 E1 1 Energie Aufnahme: Absorption E = E2 – E1 = h 2 Energie Abgabe: Emission E = E1 – E2 = -h Ein Emissions-Linienpektrum Verschiedene Emissions-Linienspektren Emissionsspektren der Edelgase Verschiedene Emissions-Linienspektren Das Wasserstoffspektrum Johann Jacob Balmer (Physicist, 1825 – 1899) Das Bohr-Atommodell 1. Das Elektron kann sich nur auf bestimmten Kreisbahnen aufhalten, die konzentrisch um den Atomkern angeordnet sind. Die Bahnen werden mit Buchstaben (K, L, M, N,.....) oder Zahlen (n = 1, 2, 3, 4,......) bezeichnet. 2. Für jede Bahn, hat das Elektron eine bestimmte Energie. Die Energie nimmt zu mit Zunahme in „n“ 3. Ein Elektron auf der innersten Bahn (Atom im Grundzustand) kann Energie aufnehmen und auf eine größere Bahn springen und einen höheren Energiezustand annehmen (Atom im angeregten Zustand) 4. Wenn das Elektron von einem angeregten Zustand auf einen innen liegenden Bahn springt, wird ein definierter Energiebetrag frei gesetzt und als Lichtquant emittiert. Das Wasserstoffspektrum Das Wasserstoffspektrum E Das Bohr-Atommodell Alle bewegten Teilchen besitzen Welleneigenschaften (de Broglie, 1920) Louis de Broglie (1892-1987) Die Schrödinger Gleichung (1926) …beschreibt die Welleneigenschaften eines Elektrons durch Position, Masse, Gesamtenergie und Potentielle Energie Erwin Schrödinger (1887-1961) Die Heisenberg-Unschärferelation Es ist grundsätzlich unmöglich von einem Objekt den genauen Aufenthaltsort (x) und den Impuls (mv) zu bestimmen (x).(mv) h/4 Werner Heisenberg (1901-1976) Dualistische Natur des Elektrons Elektron als „Teilchen“ oder „Welle“ Teilchen: Einstein (für Photonen) Welle: De Broglie E = mc2 (J) (kg.m2.s-2) E = h = hc/ (J) mc2 = hc/ = h/mc = h/mv (v = Geschwindigkeit eines Elektrons) Schrödinger Gleichung De Broglie (1924): Elektron als Welle ( = h/mv) Schrödinger (1926): Wellenmechanik Elektron = Energiewelle = Wolke negativer Ladung „Orbital“ Wellenmechanik: (Amplitude) Wahrscheinlichkeit: 2 Wahrscheinlichkeitsdichte Aufenthaltwahrscheinlichkeit n = sin(.n.x/d) n = 1, 2, 3, .... d = Länge der Saite n./2 = d (bei n = 2 ist d = ) Anzahl Knotenpunkte =n-1 = Amplitude 2 = Intensität = „Ladungsdichte“ R(r): Radiale Funktion “R”: Elektronendichte an verschiedenen Abständen vom Kern Radiale Wahrscheinlichkeitsfunktion 4πr2R2 beschreibt die Wahrscheinlichkeit das Elektron in einem best. Abstand vom Kern, summiert über alle Winkel, zu finden. Quantenzahlen Verschiedene Emissions-Linienspektren Die elektronische Struktur der Atome • Einheiten, Atomstruktur (subatomare Teilchen) • Isotope & Radioaktivität • Die Wellennatur des Lichts • Gequantelte Energien und Photonen • Linienspektren & das Bohr’sche Atommodell • Das wellenartige Verhalten von Materie • Quantenmechanik & Atomorbitale • Darstellung von Orbitalen • Mehr-Elektronen-Atome • Elektronenkonfigurationen …und das Periodensystem der Elemente px, py, pz dx2-y2, dz2, dxy, dxz, dyz n = 1, 2, 3, 4, ...... l = 0, 1, 2, ......... (n-1) m = 0, 1, 2, ....... l Anzahl = 2l + 1 n = 1, l = 0, m = 0 n = 1, l = 0, m = 0 n = 2, l = 0, m = 0 R(r): Radiale Funktion “R”: Elektronendichte an verschiedenen Abständen vom Kern Radiale Wahrscheinlichkeitsfunktion 4πr2R2 beschreibt die Wahrscheinlichkeit das Elektron in einem best. Abstand vom Kern, summiert über alle Winkel, zu finden. Quantenzahlen & Atomare Wellenfunktionen Y(,): Die Winkel-abhängige Funktion Y Beschreibt die Form des Orbitals sowie die Orientierung im Raum: Y(,) s, p, d Orbital Abhängig von l und m Wie ändert sich die Aufenthaltswahrscheinlichkeit von Punkt zu Punkt (im Raum) bei konst. Kernabstand? Quantenzahlen & Atomare Wellenfunktionen Quantenzahlen & Atomare Wellenfunktionen n = 2, l = 1, m = -1, 0, +1 Quantenzahlen & Atomare Wellenfunktionen Die s- und drei p-Orbitale: Elektronendichte auf den Achsen! n = 3, l = 2, m = -2, -1, 0, +1, +2 Elektronendichte auf den Achsen! dx2–y2 & dz2 Elektronendichte zwischen den Achsen in den entsprechenden Ebenen! dxy dxz dyz n = 4, l = 3, m = -3, -2, -1, 0, +1, +2, +3











