Falk Gastro-Kolleg Gesamter GI-Trakt Fragen zu HIV
Werbung
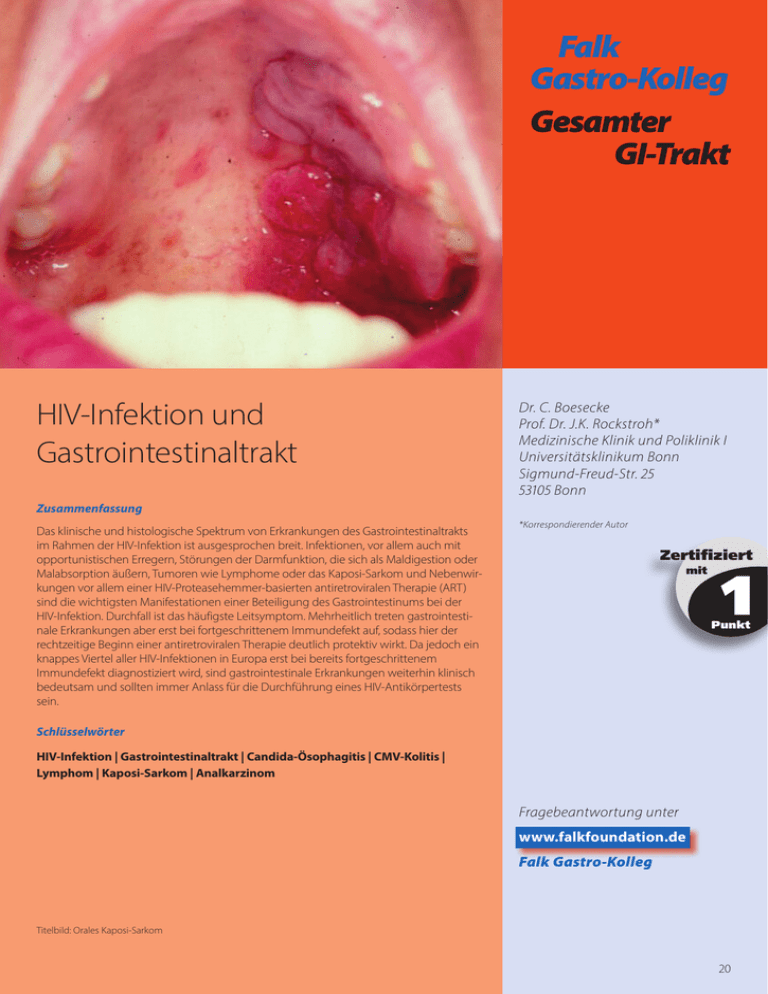
Falk Gastro-Kolleg Gesamter GI-Trakt HIV-Infektion und Gastrointestinaltrakt Dr. C. Boesecke Prof. Dr. J.K. Rockstroh* Medizinische Klinik und Poliklinik I Universitätsklinikum Bonn Sigmund-Freud-Str. 25 53105 Bonn Zusammenfassung Das klinische und histologische Spektrum von Erkrankungen des Gastrointestinaltrakts im Rahmen der HIV-Infektion ist ausgesprochen breit. Infektionen, vor allem auch mit opportunistischen Erregern, Störungen der Darmfunktion, die sich als Maldigestion oder Malabsorption äußern, Tumoren wie Lymphome oder das Kaposi-Sarkom und Nebenwirkungen vor allem einer HIV-Proteasehemmer-basierten antiretroviralen Therapie (ART) sind die wichtigsten Manifestationen einer Beteiligung des Gastrointestinums bei der HIV-Infektion. Durchfall ist das häufigste Leitsymptom. Mehrheitlich treten gastrointestinale Erkrankungen aber erst bei fortgeschrittenem Immundefekt auf, sodass hier der rechtzeitige Beginn einer antiretroviralen Therapie deutlich protektiv wirkt. Da jedoch ein knappes Viertel aller HIV-Infektionen in Europa erst bei bereits fortgeschrittenem Immundefekt diagnostiziert wird, sind gastrointestinale Erkrankungen weiterhin klinisch bedeutsam und sollten immer Anlass für die Durchführung eines HIV-Antikörpertests sein. *Korrespondierender Autor Zertifiziert mit 1 Punkt Schlüsselwörter HIV-Infektion | Gastrointestinaltrakt | Candida-Ösophagitis | CMV-Kolitis | Lymphom | Kaposi-Sarkom | Analkarzinom Fragebeantwortung unter www.falkfoundation.de Falk Gastro-Kolleg Titelbild: Orales Kaposi-Sarkom 20 HIV-Infektion und Gastrointestinaltrakt Einleitung Das klinische und histologische Spektrum von Erkrankungen des Gastrointestinaltrakts im Rahmen der HIV-Infektion ist ausgesprochen breit. Mehr als die Hälfte der HIV-infizierten Patienten entwickelt im Verlauf ihrer Erkrankung gastrointestinale Symptome. Die Beteiligung des Gastrointestinaltrakts bei der HIV-Infektion kann mitunter schwerwiegende Konsequenzen haben, denn die progressive Mangelernährung, die oft eine chronische Enteropathie oder Infektionen des Dünn- und Dickdarms begleitet, hat sich als ungünstiger unabhängiger Risikofaktor von HIV-Patienten herausgestellt. Infektionen, vor allem auch mit opportunistischen Erregern, Störungen der Darmfunktion, die sich als Maldigestion oder Malabsorption äußern, Tumoren wie Lymphome oder das KaposiSarkom und Nebenwirkungen vor allem einer HIV-Proteasehemmer-basierten antiretroviralen Therapie (ART) sind die wichtigsten Manifestationen einer Beteiligung des Gastrointestinums bei der HIV-Infektion. Durchfall ist das häufigste Leitsymptom. Ein Drittel der HIV-infizierten Personen entwickelt chronisch persistierende Diarrhöen, denen in etwa 40–70% der Fälle eine infektiöse Ursache zugrunde liegt. Gastrointestinale Infekte bei HIV-Patienten weisen einige Besonderheiten auf. Der Immundefekt führt dazu, dass Infektionen, die bei HIV-negativen Personen praktisch nicht beobachtet werden, zu schweren, therapeutisch kaum zu beeinflussenden Erkrankungen führen. Zu beachten ist auch, dass Infektionen mit bekannten enteritischen Erregern unter Einfluss eines Immundefektes einen deutlich virulenteren Verlauf nehmen, sodass z. B. eine SalmonellenInfektion über den Gastrointestinaltrakt rasch zu einem septischen Krankheitsbild führen kann. Mehrheitlich treten gastrointestinale Erkrankungen aber erst bei fortgeschrittenem Immundefekt auf, sodass hier der rechtzeitige Beginn einer antiretroviralen Therapie deutlich protektiv wirkt. Da jedoch ein knappes Viertel aller HIV-Infektionen in Europa erst bei bereits fortgeschrittenem Immundefekt diagnostiziert wird, sind gastrointestinale Erkrankungen weiterhin klinisch bedeutsam und sollten immer Anlass für die Durchführung eines HIV-Antikörpertests sein. Der folgende Beitrag gibt einen Überblick über die häufigsten gastroenterologischen Krankheitsbilder bei zugrunde liegender HIV-Infektion. Erkrankungen der Mundhöhle Orale Candidiasis Über 40% der Patienten mit einer unbehandelten HIV-Infektion weisen Befunde in der Mundhöhle auf. Die orale Candida-Mykose ist wohl die häufigste Infektion von HIV-­ infizierten Patienten. Sie stellt oft die erste klinische Erkrankung des Patienten dar und führt nicht selten zu der erstmaligen Durchführung eines HIV-Tests. Mundbrennen ist vielfach das erste Symptom, das bei einer oralen Candidiasis auftritt. Es kann beim Genuss gewürzter Speisen und Alkoholika besonders stark sein. Klinisch imponiert die oropharyngeale Candidiasis durch initial oberflächliche weißliche Beläge auf der Mundschleimhaut (Abb. 1). Die Läsionen können lokalinvasiv auftreten und zu Schleimhautulzerationen, lokaler Schmerzhaftigkeit und Schwierigkeiten beim Essen und Trinken führen. Häufig begleiten Mundwinkelrhagaden die orale Candidiasis. Eine orale Candidiasis kann in verschiedenen Stadien einer HIV-Infektion auftreten. Mit ihrem erstmaligen Auftreten tritt der Patient in das Stadium einer symptomatischen HIV-Infektion ein. Die orale Candidose ist im Wesentlichen eine Blickdiagnose. Meistens können mikro­ skopische Untersuchungen der plaqueartigen Veränderungen sowie die kulturelle Aufarbeitung von Abstrichen die gestellte Verdachtsdiagnose bestätigen. P Die orale Candida-Mykose ist wohl die häufigste Infektion von symptomatischen, bislang unbehandelten HIV-Patienten. Sie stellt oft die erste klinische Erkrankung des Patienten dar und führt nicht selten zu der erstmaligen Durchführung eines HIV-Tests. Die orale Candida-Mykose sollte schon wegen der bestehenden Gefahr der Ausbreitung in tiefere Bereiche des Intestinaltrakts behandelt werden. Mittel der ersten Wahl sind lokal wirksame orale Medikamente wie Nystatin oder Amphotericin. Im fortgeschrittenen Stadium der HIV-Infektion (Helferzellen < 200 absolut/µl) ist allerdings das klinische Versagen von Antimykotika mit nur topischer Wirkung charakteristisch. Fluconazol ist für die Behandlung der oralen oder ösophagealen Soorinfektion dann die Therapie der Wahl. Zwischen den oralen Pilzmedikamenten und anderen Arzneimitteln (insbesondere auch 21 HIV-Medikamente, s. http://www.hiv-druginteractions.org) bestehen multiple Wechselwirkungen, die entsprechende Dosisanpassungen notwendig machen können. Abb. 1 Orale Candidose bei einem HIV-Patienten Herpes-simplex-Virus (HSV)-Infektion Bei HIV-infizierten Patienten finden sich nicht nur gehäuft rezidivierende Herpes-Infektionen, sondern vor allen Dingen in der Regel ausgedehntere und persistierende HerpesLäsionen. Herpes-Gingivitis, Herpes-Stomatitis und Herpes-Pharyngitis stellen Komplikationen disseminierter Herpes-Infektionen dar. Zusätzlich zur Lokalbehandlung mit Aciclovir-Creme sollten Aciclovir-Tabletten (5 x 400 mg/Tag) und bei Ulzerationen und ausgedehntem Befall der Mundschleimhäute und des Pharynx sogar eine intravenöse Aciclovir-Therapie (10 mg/kg KG alle 8 Stunden) verabreicht werden. P Bei HIV-infizierten Patienten finden sich nicht nur gehäuft rezidivierende Herpes-Infektionen, sondern vor allen Dingen in der Regel ausgedehntere und persistierende Herpes-Läsionen. Orale Haarleukoplakie Als orale Haarleukoplakie (OHL) bezeichnet man weißliche, parallel zum Zungengrund verlaufende plaqueähnliche Auflagerungen, die unilateral oder beidseitig auftreten können (Abb. 2). Sie muss differenzialdiagnostisch von einer pseudomembranösen Candidiasis abgegrenzt werden. Im Gegensatz zur pseudomembranösen Candidiasis sind Haarleukoplakien nicht abwischbar. Mit Aciclovir (2 g/Tag für die Dauer von 14 Tagen) sind Therapieerfolge beschrieben worden, die auf dessen antivirale Wirkung gegen das EpsteinBarr-Virus (EBV) zurückgeführt werden. Eine OHL gilt unabhängig als Risikofaktor für eine raschere Progression einer HIV-Infektion und stellt eine absolute Indikation für den Beginn einer HIV-Therapie dar. P Als orale Haarleukoplakie (OHL) bezeichnet man weißliche, parallel zum Zungengrund verlaufende, plaque­ ähnliche, nicht abwischbare Auflagerungen. Abb. 2 Orale Haarleukoplakie 22 Erkrankungen der Speiseröhre Ösophaguserkrankungen kommen bei Patienten mit HIV-Infektion häufig vor. Etwa jeder dritte Patient hat im Verlauf seiner Erkrankung Symptome, die auf eine Mitbeteiligung der Speiseröhre deuten. Die häufigste Ursache ist eine infektiöse Ösophagitis. Seltener wurden Kaposi-Sarkome, Mykobakteriosen oder Neuropathien mit Motilitätsstörungen des Ösophagus beschrieben. Symptome können sein: Schmerzen beim Schlucken (Odynophagie), Schluckstörungen mit dem Gefühl des Steckenbleibens der Nahrung (Dysphagie) oder saures Aufstoßen mit einem retrosternalen, leicht brennenden Gefühl (Sodbrennen). Candida-Ösophagitis Etwa jeder zweite hospitalisierte Patient mit dem Vollbild AIDS hat eine makroskopisch und histologisch nachweisbare Candida-Ösophagitis. Über 80% dieser Patienten weisen gleichzeitig einen oralen Candida-Befall auf. Zusammen mit der Pneumocystis-jirovecii (carinii)-Pneumonie ist die Soor-Ösophagitis nach wie vor das häufigste AIDS-definierende Ereignis. P Zusammen mit der Pneumocystisjirovecii (carinii)-Pneumonie ist die Soor-Ösophagitis nach wie vor das häufigste AIDS-definierende Ereignis. Etwa die Hälfte der Patienten ist asymptomatisch. Etwa die Hälfte der Patienten ist asymptomatisch. Die anderen Patienten klagen vor allem über eine Dysphagie oder gelegentlich auch über zusätzliche retrosternale Schmerzen im Nüchternzustand, Übelkeit und Erbrechen. Nur 15% der Patienten haben bei nachgewiesener Soor-Ösophagitis keine typischen Beläge im Rachen. Der Nachweis typischer weißlicher, nur schwer abstreifbarer Beläge im Rachen zusammen mit Schluckstörungen oder auch retrosternalem Brennen ist diagnostisch (s. Abb. 3). Der objektive Nachweis kann über die Aufarbeitung bürstenzytologisch oder bioptisch entnommener Proben erbracht werden. Medikamente, die ausschließlich von der luminalen Seite wirken (Amphotericin oder Nystatin) werden bei einer Soor-Ösophagitis bei HIV in der Regel nicht eingesetzt, da sie nicht potent genug sind. Damit gibt es 2 Möglichkeiten der medikamentösen Therapie: 1) Medikamente (z. B. Imidazolderivate), die oral eingenommen werden und systemisch wirken (Ketoconazol, Fluconazol und Itraconazol), und 2) intravenös zu gebende, systemisch wirkende Substanzen (Amphotericin B, Fluconazol oder Miconazol). Normalerweise wird mit Fluconazol (100 mg p. o.) begonnen. Bei Niereninsuffizienz ist eine Dosisanpassung notwendig. Mit diesem Vorgehen erreicht man bei der Hälfte der Patienten nach 2 Wochen und bei knapp 80% nach 4 Wochen eine endoskopisch verifizierte Ausheilung. Die sekundäre Prophylaxe mit Fluconazol (100 mg/Tag) ist ebenfalls sehr effektiv. Abb. 3 Soor-Ösophagitis 23 Virus-Ösophagitis Die Zytomegalie-Virus (CMV)-Ösophagitis entsteht in der Regel über eine endogene Reaktivierung. Patienten mit AIDS haben zu 15% CMV-induzierte Ulzera. P Patienten mit AIDS haben zu 15% CMV-induzierte Ulzera. Das mit Abstand häufigste Symptom ist die Odynophagie. Weiterhin sollte immer nach Sehstörungen gefragt werden, da jeder vierte Patient auch eine CMV-Infektion des Auges (Retinitis) aufweist. Endoskopisch charakteristisch sind vorwiegend solitäre, aber auch multiple, unregelmäßige Ulzera. Biopsien sollten daher aus dem Ulkusgrund entnommen werden. Der histologische Befund typischer intranukleärer und intrazytoplasmatischer Einschlusskörper mit dem umgebenden Halo (Eulenaugenzellen) ist beweisend. Über 90% der Patienten mit aktivem CMV-Infekt haben keine nachweisbaren IgM-Antikörper. Eine augenärztliche Untersuchung sollte immer parallel vorgenommen werden. P Eine augenärztliche Untersuchung sollte immer parallel vorgenommen werden. Die Therapie der Wahl ist Valganciclovir, es sollte in der Regel für 3 Wochen gegeben werden. Das Medikament ist toxisch und kann zu Neutropenie (bis zu 40%), Thrombozytopenie (ca. 20%), Hautausschlag, Blutdruckabfall, Erbrechen und Kopfschmerzen führen. Der Nachweis einer CMV-Ösophagitis ist trotz der zur Verfügung stehenden therapeutischen Optionen ein schlechtes prognostisches Zeichen. Die Einleitung einer ART ist lebensnotwendig. Die Indikation zur Rezidivprophylaxe nach Abheilung der Ösophagitis ist umstritten, sollte jedoch erwogen werden. Bakterielle Infektionen des Ösophagus sind sehr viel seltener als Virusinfektionen. Ösophagus-Karzinome oder -Lymphome werden bei HIV-Patienten selten beobachtet. Erkrankungen des Magens Wie bei allen Organmanifestationen im Rahmen der HIV-Infektion sind Art und Inzidenz der HIV-assoziierten Erkrankungen des Magens abhängig vom Grad der Immundefizienz und der Risikogruppe, der der Patient angehört. Wegen der Besonderheiten der HIV-­ Infektion werden die Erkrankungen des Magens daher in entzündliche Erkrankungen und in maligne Erkrankungen unterteilt. Entzündliche Erkrankungen des Magens Unter den Virusinfektionen sind Zytomegalie-Virus (CMV)-Infektionen am häufigsten. Bei bis zu 5% der Patienten mit AIDS lassen sich aktive CMV-Infektionen nachweisen. Neben den systemischen Symptomen der CMV-Reaktivierung wie Fieber und Gewichtsverlust kommt es zu lokalen Organmanifestationen, die abdominelle Beschwerden wie Übelkeit, Erbrechen und Tenesmen verursachen. Die akute Blutung aus einem gastralen CMV-­ induzierten Ulkus ist selten. Bei 25% der Patienten besteht gleichzeitig eine CMV-Retinitis mit entsprechender Symptomatik. P Unter den gastralen Virusinfektionen sind Zytomegalie-Virusinfektionen am häufigsten. Bei Patienten mit einer Helferzellanzahl von > 100/µl kommt die klinisch relevante Reaktivierung der CMV-Infektion praktisch nicht vor. Die Diagnose wird endoskopisch in Verbindung mit der Histologie gestellt. Der histologische Befund intranukleärer und intrazytoplasmatischer Einschlusskörper mit umgebendem Halo (Eulenaugenzellen) ist beweisend. Der eindeutig und einfach zu diagnostizierende aktive CMV-Infekt der Augen ist daher häufig richtungsweisend für die Ätiologie von gastralen Ulzera. Die Therapie erfolgt auch hier mit Valganciclovir und sollte über mindestens 3 Wochen durchgeführt werden. Die Ansprechraten mit kompletten Remissionen bis zu 75% sind sehr gut. Bei den bakteriellen Infektionen stehen Salmonellen und Tuberkelbakterien im Vordergrund. Eine Tuberkulose- oder Salmonellenenteritis kann im Gegensatz zur atypischen Mykobakteriose in allen Stadien der HIV-Infektion auftreten. P Bei den bakteriellen Infektionen stehen Salmonellen und Tuberkelbakterien im Vordergrund. 24 Während es sich bei der Salmonelleninfektion um eine Infektion mit akuter Symptomatik handelt, ist der Verlauf der Erkrankung bei Infekten mit Mycobacterium tuberculosis und Mycobacterium avium deutlich protrahierter. Der Befall der Magenschleimhaut durch M. tuberculosis oder M. avium kann alle Wandschichten des Magens betreffen. Da die Infektion vorwiegend die Submukosa betrifft, sollten aus verdächtigen Läsionen viele und tiefe Biopsien entnommen werden. Die Erreger werden direkt durch die Ziehl-Neelsen-Färbung nachgewiesen. Bei Patienten mit Helferzellzahlen < 100/µl liegen beim Nachweis von säurefesten Stäbchen in den meisten Fällen atypische Mykobakteriosen vor. Der Nachweis von atypischen Mykobakterien im Stuhl kann zwar ein Anhalt für einen intestinalen Befall mit atypischen Mykobakterien sein, ist aber nicht beweisend. Folglich ergibt sich aus einer isoliert positiven Stuhlkultur ohne weitere Anhaltspunkte auch keine Therapieindikation. Die Prävalenz der Helicobacter-pylori (HP)-Infektion bei HIV-Patienten im Stadium AIDS wird altersabhängig zwischen 22% für 20–29-Jährige und 40% für 50–59-Jährige angegeben. Sie ist damit wegen des potenziell höheren Antibiotikaeinsatzes bei HIV-Patienten häufig sogar niedriger als in der gesamten Population. Maligne Erkrankungen des Magens Bei 50% der HIV-assoziierten extraintestinalen Lymphome liegt bereits primär ein Befall des Gastrointestinaltrakts vor. Ein isolierter Befall des Magens mit entsprechenden Symp­ tomen ist selten. Die Symptome sind wegen der starken Wachstumstendenz der Lymphome bei HIV meistens akut. Sehr häufig werden Stuhlunregelmäßigkeiten angegeben. Gastrointestinale Lymphome treten auch bei Patienten mit noch normalen oder nur leicht erniedrigten Helferzellzahlen auf. P Bei 50% der HIV-assoziierten extraintestinalen Lymphome liegt bereits primär ein Befall des Gastrointestinaltrakts vor. Bei jedem HIV-Patienten mit einem diagnostizierten Non-Hodgkin-Lymphom (NHL) sollte ein gastrointestinaler Befall ausgeschlossen werden, da die gastrale Manifestation bei HIV-assoziierten Lymphomen häufig ist. Wenn ein intestinaler Befall vorliegt, ist er für den klinischen Verlauf meistens entscheidend. Ein frühzeitiges Erkennen des intestinalen, insbesondere des gastralen Befalls, und das Ergreifen palliativer Maßnahmen, z. B. Chemotherapie oder chirurgische Eingriffe zur Vermeidung von Komplikationen wie der akuten Blutung, sind daher von entscheidender Bedeutung. Hierzu sollten eine Gastroösophagoduodenoskopie sowie eine Koloileoskopie mit multiplen Biopsien zur Feststellung der Ausdehnung des Lymphombefalls erfolgen. Auch eine Dünndarmdarstellung nach Sellink sollte durchgeführt werden. Die bei Non-Hodgkin-Lymphomen üblichen Staging-Untersuchungen wie Knochenmarkpunktion, Lumbalpunktion und Computertomografie sollten ebenfalls erfolgen. P Gastrointestinale Lymphome treten auch bei Patienten mit noch normalen oder nur leicht erniedrigten Helferzellzahlen auf. Die mittlere Überlebenszeit der Patienten mit HIV-assoziierten Non-Hodgkin-Lymphomen war früher mit 6–9 Monaten sehr gering. Durch die Verfügbarkeit effektiver ART hat sich dies deutlich verändert. Die Therapie sollte nach dem CHOP-Schema erfolgen. Das gastrale Kaposi-Sarkom (KS) spielt vor allem bei homosexuellen HIV-Patienten mit schlechtem Immunstatus (nicht-diagnostizierte HIV-Infektion, keine ART) eine wichtige Rolle. Bei 50% der Patienten mit kutanem KS findet sich ein viszeraler, häufig gastraler Befall. Das KS des Magens ist symptomarm. Eine gastrale Blutung aus einer KS-Läsion stellt eine Seltenheit dar. Die Histologie ist teilweise nur in 20% der nachgewiesenen KS-Patienten positiv. Bei nachgewiesenem intestinalem oder gastralem Befall sollte neben einer ART in 14-tägigen Abständen eine Therapie mit liposomalem Doxorubicin erfolgen. Nach 6 Zyklen Chemotherapie erfolgt dann eine Verlaufsbeurteilung, mit der über die Notwendigkeit der Fortführung einer Chemotherapie entschieden wird. Häufig lässt sich nach ART-Einleitung in Verbindung mit den ersten 6 Zyklen Chemotherapie eine Vollremission erreichen, die dann bei unter erfolgreicher antiretroviraler Therapie erreichter Immunrekonstitution und guter Erholung der Helferzellzahl auch ohne weitere Chemotherapie erhalten bleibt. 25 Erkrankungen des Dünn- und Dickdarms Bereits die sorgfältige Anamnese hilft, erkrankte Darmabschnitte näher zu lokalisieren. Bauchschmerzen, profuse Durchfälle mit hellen, großvolumigen Stühlen und ein starker Flüssigkeitsverlust deuten auf eine Erkrankung des Dünndarms hin. Kryptosporidien, Mikrosporidien oder enteropathogene Viren sind häufige Ursachen. Stuhldrang mit Absetzen von nur geringen Stuhlmengen, häufig verbunden mit Tenesmen und einer Hämatochezie deutet eher auf eine perianale Erkrankung, eine Virusinfektion des Kolons oder eine invasive bakterielle Kolitis hin. Für die weitere Diagnostik empfiehlt sich ein zweistufiges Vorgehen. Bei jedem HIV-Patienten mit Verdacht auf eine infektiöse Erkrankung des Gastrointestinaltrakts sollten zunächst folgende Untersuchungen durchgeführt werden: • • • • • Stuhlkultur auf Salmonellen, Shigellen und Campylobacter spp., Untersuchungen von frischem Stuhl auf Leukozyten, Untersuchungen zum Nachweis von okkultem Blut, Untersuchungen auf Clostridium-difficile-Toxin, Untersuchungen von mindestens 3 frischen Stuhlproben auf Wurmeier und Parasiten. P Bauchschmerzen, profuse Durchfälle mit hellen, großvolumigen Stühlen und ein starker Flüssigkeitsverlust deuten auf eine Erkrankung des Dünndarms hin. Kryptosporidien, Mikrosporidien oder enteropathogene Viren sind häufige Ursachen. Stuhldrang mit Absetzen von nur geringen Stuhlmengen, häufig verbunden mit Tenesmen und einer Hämatochezie, deutet eher auf eine perianale Erkrankung, eine Virus­ infektion des Kolons oder eine invasive bakterielle Kolitis hin. Bei der Stuhluntersuchung sollten frische Proben auf Isospora belli und Entamoeba histolytica untersucht werden, zusätzlich sollten modifizierte Färbungen zum Nachweis von säurefesten Stäbchen, von Kryptosporidien und Cyclospora spp. sowie eine modifizierte Trichromfärbung zum Nachweis von Mikrosporidien angefertigt werden. Falls diese Untersuchungen keine Diagnose erbringen und die Durchfälle weiter persistieren, muss die Ursache endoskopisch abgeklärt werden. Dabei empfiehlt sich zunächst die Durchführung einer Koloskopie, um potenziell behandelbare Ursachen wie eine pseudomembranöse Kolitis, eine CMV-Infektion des Dickdarms, M. avium-intracellulare-Infektion oder ein Kaposi-Sarkom bzw. ein Lymphom zu entdecken (Abb. 4). Gelegentlich helfen auch eine Computertomografie des Abdomens oder eine Dünndarmpassage weiter. Unter Umständen ist es nötig, die Diagnostik durch eine Ösophagogastro­ duodenoskopie mit Aspiration von Duodenalsaft und tiefen Dünndarmbiopsien zu ergänzen. Endoskopisch gewonnenes Biopsiematerial sollte nicht nur histomorphologisch untersucht werden, sondern auch mikroskopisch auf Viren, Pilze oder Mykobakterien. Bei etwa einem Drittel der Patienten ist mit Mehrfachinfektionen zu rechnen. Die Therapie verfolgt im Wesentlichen 3 Ziele: 1. Ausgleich eines eventuellen Dehydratationszustands und von Elektrolytstörungen, 2. Sicherstellung einer adäquaten Ernährung des Patienten, um einem weiteren Gewichtsverlust vorzubeugen, 3. Beseitigung der zugrunde liegenden Ursachen. Abb. 4 Unspezifische Kolitis bei HIV und nicht-aktiver Colitis ulcerosa 26 40% aller Patienten mit AIDS entwickeln eine manifeste Zytomegalie-Virus (CMV)-Infektion. Damit ist diese Infektion die häufigste Ursache für gastrointestinale Symptome bei HIV-infizierten Patienten. Das Zytomegalie-Virus verursacht eine nekrotisierende Entzündung der Kolonschleimhaut mit Diarrhöen, Abdominalschmerz, Gewichtsabnahme, Anämie, Meläna und Hämatochezien. Die Diagnose einer perianalen bzw. enterokolischen CMV-Infektion wird durch Biopsie und immunhistologische Untersuchung gesichert (Abb. 5). Weiterhin sichern virologische Untersuchungen (Abstrich bzw. Biopsie aus dem Ulkus oder/und Gewebekultur) die Diagnose. Ein toxisches Megakolon, eine schwere anorektale Blutung und eine Darmperforation indizieren die operative Intervention. Die medikamentöse Therapie besteht in der Einleitung einer ART und einer zusätzlichen Medikation mit Valganciclovir. Abb. 5 CMV-infizierte Kolonschleimhautzellen bei HIV Unter den bakteriellen Infektionen sind eine bakterielle Fehlbesiedlung sowie die Clos­ tridium-difficile-Infektion von den klassischen bakteriellen Infekten, z. B. durch Shigellen, Salmonellen oder Campylobacter, abzugrenzen. Eine bakterielle Fehlbesiedlung des Dünndarms kann durch eine 10-tägige Behandlung mit einem Breitbandantibiotikum, z. B. Tetrazykline, zuverlässig saniert werden. Bakterielle Enteritiden sollten bei HIV-infizierten Patienten auf jeden Fall bereits zu Beginn der Erkrankung, d. h. noch vor Erhalt eines Antibiogramms, antibiotisch behandelt werden. Bei HIV-infizierten Patienten erscheint Ciprofloxacin für die Behandlung von bakteriellen Darminfektionen besonders geeignet, da es gegen die meisten Erreger wirksam ist und zudem im Darm über Sekretionsprozesse angereichert wird. Eine Infektion des Darms mit M. tuberculosis spricht zzt. in Europa noch relativ gut auf die Behandlung mit einer klassischen Dreier- oder Viererkombination von Tuberkulostatika an. Lamblien kommen bei HIV-infizierten Patienten häufig vor, sind aber nur bei der Hälfte der Patienten mit einer Durchfallsymptomatik oder Steatorrhö verbunden. Die Standardtherapie der Lamblien-Infektion erfolgt mit Metronidazol (3 x 250 mg p. o.). Nach Ausschluss der oben genannten Ursachen für eine chronische Diarrhö ist auch an eine Nebenwirkung der ART zu denken. Prinzipiell kann eine Diarrhö bei fast allen antiretroviralen Medikamenten – insbesondere in der Anfangsphase – auftreten. Typische Symptome sind Völlegefühl, Appetitlosigkeit, Diarrhöen und Übelkeit bis hin zum Erbrechen. Weiterhin können Sodbrennen, abdominelle Schmerzen, Meteorismus und gelegentlich auch eine Obstipation auftreten. Diarrhöen können insbesondere unter Proteasehemmer-haltigen Kombinationstherapien auftreten, vor allem beim Einsatz des als Proteasehemmer-Booster verwendeten Ritonavir. In den meisten Fällen treten die 27 Symptome zu Beginn der Behandlung auf und lassen nach etwa 2–4 Wochen nach. Treten gastrointestinale Beschwerden unter länger bestehender ART erneut auf, sind andere Ursachen, wie z. B. eine Gastritis oder eine infektiöse Enteritis, wahrscheinlicher. Bei Proteasehemmer-assoziierten Diarrhöen sind Haferkleietabletten wirksam. Sie können gleichzeitig mit der ART eingenommen werden (Tagesdosis 1500 mg). Auch Kalzium in einer Dosierung von 2 x 500 mg/Tag (Kalziumcarbonat) kann helfen. Weil Kalzium viele Substanzen bindet, sollte es in einem mindestens 2-stündigen Abstand zur ART eingenommen werden. Reichen diese Maßnahmen nicht aus und lässt sich die ART nicht modifizieren, sollte die Darmmotilität mit Loperamid (anfangs 2–4 mg, dann jeweils 2 mg nach jedem Durchfallschub, maximal 16 mg am Tag) oder der Opiumtinktur gehemmt werden. Die Opiumtinktur (BTM-Rezept notwendig) lässt sich durch die Tropfenform recht gut dosieren. Begonnen wird mit ca. 5 Tropfen (maximal 15–20 Tropfen – Cave: bei Überdosierung Ileusgefahr). Erkrankungen der Anorektalregion Ein Drittel der HIV-infizierten Patienten, die der CDC-Gruppe III oder IV angehören, entwickelt auch ein proktologisches Krankheitsbild. Wie auch in der HIV-negativen Allgemeinbevölkerung sind Hämorrhoiden häufig. Im asymptomatischen Stadium der HIV-Infektion ist eine Hämorrhoidektomie ohne Risiko für die Wundheilung und den postoperativen Verlauf durchführbar. Für symptomatische Patienten müssen zunächst alle Möglichkeiten der konservativen Therapie des Hämorrhoidalleidens ausgeschöpft werden. Bei Patienten mit AIDS ist die rasche notfallmäßige Drainage von perianalen Abszessen von besonderer Bedeutung, da immer die Gefahr einer septischen Komplikation besteht (Fournier-Gangrän, Sepsis). Differenzialdiagnostisch ist bei dem klinischen Bild einer perianalen Inflammation an die Erstmanifestation eines extranodalen, perianal lokalisierten Non-Hodgkin-Lymphoms zu denken. Als Erstmaßnahme sollte die Punktion des entzündlichen Tumors erfolgen. Einerseits kommen typische Analfissuren häufig bei der größten Risikogruppe einer HIVInfektion, den Männern, die Sex mit Männern haben (MSM), wegen des anorezeptiven Geschlechtsverkehrs vor. Andererseits kann eine chronische Diarrhö ebenfalls eine solche Läsion verursachen. Sind durch eine konservative Therapie die Schmerzen in der Analregion nicht zu beheben und liegt kein durch Analverkehr verursachter Schaden des Sphinkterapparats vor, ist eine laterale Sphinkterotomie indiziert. Besteht der Verdacht auf eine Sphinkterläsion, sollte zuvor eine Manometrie des Analkanals vorgenommen und ggf. die Sphinkterotomie bei einigermaßen wirksamer konservativer Therapie unterlassen werden. Die Symptomatik der sehr häufigen Herpes-simplex-Virus (HSV)-Infektion beginnt 4–21 Tage nach einem anorezeptiven Geschlechtsverkehr mit heftigen Schmerzen in der Perianalregion, Tenesmen und perianalen Eiterabgängen. Ein quälender Pruritus ani ist rezidivierend vorhanden. Hinzu kommt ein schweres Krankheitsgefühl mit Fieber und Schüttelfrost. Das klinische Bild ist gekennzeichnet durch kleine Bläschen mit einem roten Rand und größeren Bläschen, die nach Ruptur zu einem Ulkus zusammenfließen. Auf eine sorgfältige Analhygiene ist zur Vermeidung von Superinfektionen unbedingt zu achten. Die medikamentöse Therapie besteht in der Gabe von 5 x 200–800 mg/Tag Aciclovir über 10 Tage zur Behandlung der akuten Infektion. Condylomata acuminata lassen sich ebenfalls gehäuft bei HIV-Infizierten finden. Erreger dieser auch Feigwarzen genannten hyperkeratotischen Hautveränderung sind humane Papilloma-Viren (HPV). Therapeutisch wird bei Patienten mit Kondylomen und HIV-Infektion folgendes Prozedere vorgeschlagen: Bei Patienten mit Beschwerden und mit asymptomatischer HIV-Infektion Behandlung der perianalen Warzen mit 5%igem Podophyllin, durch Elektrokoagulation, Laserbehandlung oder durch Exzision mit der Schere in Lokalanästhesie. Patienten mit fortgeschrittener HIV-Infektion sollten einer chirurgischen Behandlung unterzogen werden. Die Rezidivrate wird bei der Podophyllin-Behandlung mit 25% angegeben, nach Exzisionsbehandlung mit 5%. 28 Ursache eitrig-proktitischer Beschwerden können insbesondere bei HIV-positiven MSM zudem Infektionen mit Neisseria gonorrhoe („Tripper“) und Chlamydien sein. P Häufige Krankheitsbilder sind Hämorrhoiden, Analfissuren, Kondylome, Genitalherpes. Maligne Analtumoren Bei 70% der diagnostizierten Lymphome bei AIDS-Patienten handelt es sich um NonHodgkin-Lymphome der B-Zell-Reihe. Das Rektum ist hierbei das am zweithäufigsten betroffene Organ des Gastrointestinaltrakts. Die Diagnose eines anorektalen Lymphoms kann schwierig sein, da dieser anorektale Tumor wie ein periproktitischer Abszess imponiert. Daher gilt die Regel, dass jeder perianale Abszess bei einem HIV-Patienten biopsiert werden muss, um eine Verwechslung mit einem perianalen Lymphom auszuschließen. Die Therapie besteht in einer aggressiven Polychemotherapie. Die mittlere Überlebenszeit dieser Patienten liegt unter 12 Monaten. P Das Rektum ist das von einem Non-Hodgkin-Lymphom am zweithäufigsten betroffene Organ des Gastrointestinaltrakts. Die Diagnose eines anorektalen Lymphoms kann schwierig sein, da dieser anorektale Tumor wie ein periproktitischer Abszess imponiert. Das Risiko, ein Analkarzinom zu entwickeln, ist bei Homosexuellen 25–50-mal höher als bei Heterosexuellen. Eine virale Genese dieses Tumors scheint wahrscheinlich, da HPV in Zellen des Plattenepithelkarzinoms gefunden wurden. Die Symptomatik ist unspezifisch: Schmerzen in der Analregion, perianale Blutabgänge und ein tastbarer Tumor führen den Patienten zum Arzt. Die Diagnose wird bioptisch gestellt. Standard ist eine kombinierte Radio-/Chemotherapie (5-Fluorouracil, Mitomycin C, Bestrahlung). Häufig ist eine Anuspraeter-Anlage notwendig. Darüber hinaus ist die Prognose dieses Tumors bei HIV-Patienten schlecht, weshalb Condylomata acuminata bei HIV-positiven Patienten immer chirurgisch zu beseitigen und histologisch zu untersuchen sind. P HIV-Infizierte haben ein mehrfach erhöhtes Risiko für ein Analkarzinom. Erkrankungen des Pankreas Eine akute Pankreatitis wird vorwiegend bei Patienten im fortgeschrittenen Stadium einer HIV-Infektion angetroffen und kann bei 4–30% der stationär behandelten Patienten beobachtet werden. Dabei handelt es sich um eine Mitbeteiligung des Pankreas im Rahmen opportunistischer Infektionen, als Folge HIV-typischer Neoplasien oder toxischer Schädigung durch Medikamente oder durch die HIV-Infektion selbst. P Zu einer Pankreatitis kommt es im Rahmen opportunistischer Infektionen, als Folge HIV-typischer Neoplasien oder toxischer Schädigung durch Medikamente. Die klinische Präsentation der akuten Pankreatitis unterscheidet sich bei HIV-Patienten nicht von der anderer Patienten. Typisch sind heftige Schmerzen im Oberbauch. Die Therapie der akuten Pankreatitis bei HIV-Infizierten verfolgt im Wesentlichen folgende Ziele: • • • • • Elektrolyt- und Volumenersatz, Ruhigstellung des Organs, Schmerzbekämpfung, Erkennung und Behandlung von Komplikationen, Behandlung der zugrunde liegenden Ätiologie. Die medikamententoxische Schädigung des Pankreas spielt bei HIV-infizierten Patienten eine erhebliche Rolle. Sie wird im Wesentlichen durch die 3 Medikamente Pentamidin, Trimethoprim/Sulfamethoxazol und 2-3-Dideoxyinosin hervorgerufen. Pentamidin, das zur Behandlung einer Pneumocystis-jirovecii (carinii)-Infektion eingesetzt wird, ist sehr lipophil und reichert sich dadurch im Pankreasgewebe an. Diese Pankreatitis tritt typischerweise 1–3 Wochen nach Beginn einer Therapie mit Pentamidin auf. Häufig liegt gleichzeitig eine eingeschränkte Nierenfunktion vor, die zu höheren SerumPentamidin-Spiegeln führt und dadurch die Toxizität für das Pankreas erhöht. Das Absetzen der Pentamidin-Therapie ist die wichtigste Maßnahme. Unter einer solchen Therapie bildet sich das klinische Bild einer akuten Pankreatitis durch Pentamidin typischerweise innerhalb von 2 Wochen zurück. Trimethoprim/Sulfamethoxazol, das sowohl zur Therapie und zur Prophylaxe einer Pneumocystis-jirovecii (carinii)-Infektion als auch zur Prophylaxe einer ToxoplasmoseReaktivierung eingesetzt wird, kann ebenfalls Pankreatitiden auslösen. Da in der Regel 29 nach erneuter Gabe von Trimethoprim/Sulfamethoxazol wieder mit einer Pankreatitis zu rechnen ist, sollte der betroffene Patient dieses Medikament nicht mehr erhalten. Bei der antiretroviralen Behandlung mit dem nicht mehr häufig eingesetzten HIV-Medikament Didanosin können gelegentlich asymptomatische Erhöhungen der Amylase beobachtet werden. Nach Einführung des Medikaments zur antiretroviralen Therapie konnte bei etwa 2–10% der behandelten Patienten auch eine akute Pankreatitis beobachtet werden. Diese wies eine Mortalitätsrate von beinahe 10% auf. Die durch Didanosin ausgelöste Pankreatitis scheint dosisabhängig zu sein. Erste Symptome treten 1–4 Wochen nach Therapiebeginn auf. Didanosin sollte abgesetzt werden, sobald ein Anstieg der Amylase festzustellen ist. Erkrankungen der Gallenwege und der Leber Als seltene Komplikation kann es bei einer HIV-Infektion zu Veränderungen an den Gallenwegen kommen. 3 klinische Krankheitsbilder werden hierbei unterschieden: 1) die HIV-assoziierte Cholangiopathie, 2) eine akute Cholezystitis ohne Steinnachweis und 3) das sogenannte „vanishing bile duct“-Syndrom. Die Pathogenese dieser Gallengangsveränderungen ist nicht genau bekannt. Typischerweise gehen diese Krankheitsbilder jedoch auf eine Infektion mit dem Zytomegalie-Virus (20–65%) oder intestinale Parasitosen wie eine Kryptosporidiose oder eine Mikro­sporidiose zurück. Es wird aber auch angenommen, dass diese Veränderungen durch eine direkte Infektion der Gallenwegsepithelien mit HIV oder ein autoimmunes Geschehen durch eine Vaskulitis mit zirkulierenden Immunkomplexen induziert werden. Ein Teil der Veränderungen kann auch auf opportunistische Infektionen oder HIV-typische Malignome wie ein Kaposi-Sarkom oder ein Lymphom mit Infiltration in die peribiliären Lymphknoten zurückgeführt werden. Bakterielle Infektionen spielen dabei eine untergeordnete Rolle. Vereinzelt konnten allerdings HIV-typische Problemkeime wie Candida albicans, Salmonella typhimurium, Klebsiella pneumoniae oder Pseudomonas aeruginosa in der Gallenflüssigkeit nachgewiesen werden. P 3 seltene klinische Krankheitsbilder werden bei den Erkrankungen der Gallenwege bei HIV unterschieden: 1) die HIV-assoziierte Cholangiopathie, 2) eine akute Cholezystitis ohne Steinnachweis und 3) das sogenannte „vanishing bile duct“-Syndrom. P Die Pathogenese ist noch nicht gänzlich verstanden, aber auch hier scheinen opportunistische Erreger (CMV, Krypto- und Mikrosporidien) eine Rolle zu spielen. Bezüglich Lebererkrankungen bei HIV verweisen wir auf den gesonderten Beitrag „HIVInfektion und Leber“ im Falk Gastro-Kolleg 1/2011. Organüberschreitende Krankheitsbilder Zu den „klassischen“ HIV-assoziierten Neoplasien zählt man in erster Linie das epidemische Kaposi-Sarkom und maligne Non-Hodgkin-Lymphome, die insgesamt 95% der HIV-­ assoziierten Neoplasien ausmachen. Allen HIV-assoziierten Neoplasien gemeinsam sind ein schnelleres Wachstum und eine schnellere Disseminierung, ähnlich den Malignomen bei Patienten mit kongenitalen Immundefektsyndromen oder Immunsuppression nach Organtransplantation. Intestinale Manifestationen sind in dieser Patientengruppe häufig und stellen diagnostisch und therapeutisch besondere Aufgaben. P Bei HIV-Infektion sind das Kaposi-Sarkom und das Non-Hodgkin-Lymphom wesentliche organüberschreitende Malignome im Gastrointestinaltrakt. Das Auftreten eines Kaposi-Sarkoms stellt bei nachgewiesener HIV-Infektion ein AIDSdefinierendes Ereignis dar, unabhängig von der Lokalisation oder dem Alter des Patienten. Homo- und bisexuelle Männer sind 4-mal häufiger betroffen, bei Frauen tritt ein Kaposi-Sarkom deutlich seltener auf. Ätiologisch liegt eine Infektion mit dem humanen Herpesvirus 8 (HHV-8) zugrunde. Gastrointestinale Läsionen finden sich bei 30–50% der Patienten mit HIV-assoziiertem Kaposi-Sarkom. Ein ausgedehnter viszeraler Befall ist mit einer schlechten Prognose verbunden. Am häufigsten sind Mundhöhle, Gaumen, Zahnfleisch und Zunge befallen (30% der Patienten, Abb. 6). P Gastrointestinale Läsionen finden sich bei 30–50% der Patienten mit HIV-assoziiertem Kaposi-Sarkom. 30 Folgende Symptome und Befunde sind für das intestinale Kaposi-Sarkom typisch: • Symptome treten häufig erst spät im Krankheitsverlauf auf, • schnelles Sättigungsgefühl, Bauchschmerz, Diarrhö, Blutungszeichen, • Enteropathie mit Eiweißverlustsyndrom bei Verschluss der regionären Lymph­ abflusswege im Rahmen eines mesenterialen Lymphknotenbefalls, • Komplikationen: Obstruktion mit Ileussymptomatik durch ausgedehnte Tumoren oder zystische Formationen im Mesenterium, Perforation mit Peritonitis. Die Läsionen des Kaposi-Sarkoms sind makulopapulös. Die Farbe ist rot-violett, manchmal bräunlich. Sie sind häufig umgeben von einem gelben „Hof“, manchmal auch von Einblutungen. Zahlreiche Herde enthalten zentrale Ulzerationen. Erhabene Läsionen konfluieren häufig. Ein polypöses Wachstum wird selten beschrieben. Biopsien sind häufig falsch-negativ (nur ca. 23% positive Befunde). Therapeutisch wird liposomales Doxorubicin in einer Dosierung von 20 mg/m² in 250 ml Glukose 5% über 30–60 Minuten i.v. 2–3-wöchentlich verabreicht. Die mittlere Dauer bis zum maximalen Ansprechen auf die Therapie beträgt ca. 4 Wochen (2 Zyklen), die mittlere Remissionsdauer 3–4 Monate. Die unerwünschten Nebenwirkungen von liposomalem Doxorubicin sind Myelosuppression 72%, davon 40% Neutropenie WHO-Grad 4, Alopezie 50% (vollständig 10%), Stomatitis 18%, Übelkeit/Erbrechen 10–17% und Obstipation 13%; Hepatotoxizität tritt vereinzelt auf, die Kardiotoxizität ist noch nicht sicher evaluiert (empfohlene kumulative Gesamtdosis < 175 mg/m²). Eine antiretrovirale Therapie (ART) sollte auch während einer zytostatischen Chemotherapie beibehalten werden. Abb. 6 Mukosales Kaposi-Sarkom Non-Hodgkin-Lymphome treten bei HIV-Infizierten mit einer Häufigkeit von 1–15% auf, das ist 60-mal häufiger als in der Normalbevölkerung. Bei 3–5% der HIV-infizierten Patienten ist dies das AIDS-definierende Ereignis. Der Gastrointestinaltrakt ist bei 30–70% der Patienten befallen und stellt somit den häufigsten extranodalen Manifestationsort dar. Kofaktoren der Pathogenese sind virale Infekte (z. B. EBV, Herpes-Virus). P Der Gastrointestinaltrakt ist bei 30–70% der NHL-Patienten befallen und stellt somit den häufigsten extranodalen Manifestationsort dar. 31 Trotz großer Fortschritte im Bereich der Immunphänotypisierung und Molekularpathologie bleiben die konventionellen histologischen Kriterien mit Beurteilung zytomorphologischer Veränderungen und der Organdestruktion die Grundpfeiler der Diagnosestellung HIV-assoziierter Lymphome. HIV-assoziierte Non-Hodgkin-Lymphome sind in der überwiegenden Anzahl bei Diagnosestellung bereits disseminiert. In Ösophagus, Magen, Dünn- und Dickdarm präsentiert sich der Befall makroskopisch oft nur als Infiltration im Schleimhautniveau bzw. in Form atypischer Ulzerationen. Im anorektalen Bereich manifestiert sich der Befall ebenfalls meist ausgesprochen diskret. Kleine polypöse Läsionen, indurierte Schleimhautareale oder intramurale Schleimhautläsionen sind bei entsprechender Symptomarmut leicht zu übersehen. Ein Leberbefall ist häufig. Er tritt bei ca. 30% der Patienten mit gastrointestinalem Befall auf, kann jedoch auch solitär vorkommen. Primäre Manifestationen in den Gallenwegen, der Gallenblase, in Pankreas, Milz und Peritoneum sind selten anzutreffen. Endoskopische Verfahren sind die Basis der intestinalen Diagnostik. Probleme bei der histologischen Diagnosesicherung entstehen häufig aufgrund eines submukösen Lymphombefalls, sodass Biopsien falsch-negative Ergebnisse erbringen. Neben der üblichen Fixierung von Gewebeproben in Formalin sollte möglichst Frischmaterial kryokonserviert werden (-70°C) und einer detaillierten Immunphänotypisierung und molekulargenetischen Untersuchung zugeführt werden. Eine Korrelation mit bildgebenden Verfahren ist stets nötig (Abb. 7). Unklare Raumforderungen sollten einer sonografisch oder computertomografisch gesteuerten Biopsie zugeführt werden. Bei mangelnder Zugänglichkeit der Läsionen oder unklarer Befundkonstellation aufgrund der bisher genannten Verfahren ist auch eine Laparoskopie bzw. Laparotomie in Betracht zu ziehen. P Probleme bei der histologischen Diagnosesicherung entstehen häufig aufgrund eines submukösen Lymphombefalls, sodass Biopsien falsch-negative Ergebnisse erbringen. Die mittlere Überlebenszeit von Patienten mit HIV-assoziierten Non-Hodgkin-Lymphomen hat sich durch die Verfügbarkeit einer effektiven ART deutlich verbessert. Es gibt keine Hinweise, dass ein gastrointestinaler Befall mit einer schlechteren Prognose einhergeht. Abb. 7 Multiple vergrößerte intraabdominelle Lymphknoten bei HIV-assoziiertem NHL 32 Zu empfehlende Literatur Literatur 1 Lichterfeld M, Lorenz C, Nischalke HD, Scheurlen C, Sauerbruch T, Rockstroh JK. Decreased prevalence of Helicobacter pylori infection in HIV patients with AIDS defining diseases. Z Gastroenterol. 2002;40(1):11–4. 2 Lackner AA, Mohan M, Veazey RS. The gastrointestinal tract and AIDS pathogenesis. Gastroenterology. 2009;136(6):1965–78. 3 Rockstroh JK, Sauerbruch T, Spengler U. HIV und AIDS in der Gastroenterologie. München: Urban & Schwarzenberg;1997. 4 Boesecke C, Cooper DA. Toxicity of HIV protease inhibitors: clinical considerations. Curr Opin HIV AIDS. 2008;3(6):653–9. 5 Hoffmann C, Rockstroh JK. HIV 2012. Hamburg: Medizin Fokus Verlag;2012. 6 Brodt HR, Kamps BS, Gute P, Knupp B, Staszewski S, Helm EB. Changing incidence of AIDS-defining illnesses in the era of antiretroviral combination therapy. AIDS. 1997;11(14):1731–8. 7 Byakwaga H, Boesecke C, Emery S. Inflammation and gut permeability. J HIV Ther. 2009;14(3):57–60. 8 Slavik T. Human immunodeficiency virus-related gastrointestinal pathology: a southern Africa perspective with review of the literature (part 2: neoplasms and noninfectious disorders). Arch Pathol Lab Med. 2012;136(3):316–23. 9 European Guidelines for treatment of HIV infected adults in Europe. Version 6.1, November 2012. http://www.europeanaidsclinicalsociety.org/ 10 Reggiani Bonetti L, Losi L, Di Gregorio C, Bertani A, Merighi A, Bettelli S, et al. Cytomegalovirus infection of the upper gastrointestinal tract: a clinical and pathological study of 30 cases. Scand J Gastroenterol. 2011;46(10):1228–35. 11 Huppmann AR, Orenstein JM. Opportunistic disorders of the gastrointestinal tract in the age of highly active antiretroviral therapy. Hum Pathol. 2010;41(12):1777–87. 12 Mehta KD, Vacchani A, Mistry MM, Kavathia GU, Goswami YS. To Study the Prevalence of Various Enteric Parasitic Infections Among HIV Infected Individuals in the P.D.U. Medical College and Hospital, Rajkot, Gujarat, India. J Clin Diagn Res. 2013;7(1):58–60. 13 Nagata N, Shimbo T, Yazaki H, Asayama N, Akiyama J, Teruya K, et al. Predictive clinical factors in the diagnosis of gastrointestinal Kaposi‘s sarcoma and its endoscopic severity. PLoS One. 2012;7(11):e46967. 33 14 Nagata N, Sekine K, Igari T, Hamada Y, Yazaki H, Ohmagari N, et al. False-Negative Results of Endoscopic Biopsy in the Diagnosis of Gastrointestinal Kaposi‘s Sarcoma in HIV-Infected Patients. Patholog Res Int. 2012;2012:854146. Literatur 15 Sandler NG, Douek DC. Microbial translocation in HIV infection: causes, consequences and treatment opportunities. Nat Rev Microbiol. 2012;10(9):655–66. 16 Persson EC, Shiels MS, Dawsey SM, Bhatia K, Anderson LA, Engels EA. Increased risk of stomach and esophageal malignancies in people with AIDS. Gastroenterology. 2012;143(4):943–50. 17 Neuman MG, Schneider M, Nanau RM, Parry C. HIV-Antiretroviral Therapy Induced Liver, Gastrointestinal, and Pancreatic Injury. Int J Hepatol. 2012;2012:760706. 34 Fragen zu HIV-Infektion und Gastrointestinaltrakt Frage 1: Welche Aussage zum Non-Hodgkin-Lymphom (NHL) trifft zu? EE EE EE EE EE Der Gastrointestinaltrakt stellt den häufigsten extranodalen Manifestationsort dar Biopsien erbringen häufig falsch-positive Ergebnisse Eine antiretrovirale Therapie hat keinen Einfluss auf die Mortalität Das NHL tritt bei HIV-Patienten 6-mal häufiger auf als in der Normalbevölkerung Kofaktoren der Pathogenese sind bakterielle Infekte Frage 2: Welche Erkrankung des Magens findet sich im Vergleich zur Allgemeinbevölkerung nicht häufiger bei HIV-Patienten? EE EE EE EE EE Non-Hodgkin-Lymphom Helicobacter-pylori-Gastritis Kaposi-Sarkom Zytomegalie-Virus-Gastritis Tuberkulose Frage 3: Welcher klinische Befund ist häufig Anlass für die Durchführung eines HIV-Tests? EE EE EE EE EE Falk Gastro-Kolleg Gesamter GI-Trakt Salmonellose Trichinellose Orale Candidose Pediculose Leptospirose Bitte beachten Sie: Bei der Beantwortung der Fragen ist immer nur 1 Antwort möglich. Die Beantwortung der Fragen und Erlangung des Fortbildungszertifikats ist nur online möglich. Bitte gehen Sie dazu auf unsere Homepage www.falkfoundation.de. Unter dem Menüpunkt Falk Gastro-Kolleg können Sie sich anmelden und die Fragen beantworten. Bitte diesen Fragebogen nicht per Post oder Fax schicken! Frage 4: Welche Antwort ist richtig? Eine Candida-Ösophagitis sollte nicht behandelt werden mit EE EE EE EE EE Fluconazol Doxorubicin Imidazolderivaten Ketoconazol Amphotericin B Frage 5: Welches ist der häufigste Erreger einer viralen Ösophagitis? EE EE EE EE EE EBV HIV HHV-8 HSV CMV Wichtig: Fragebeantwortung unter www.falkfoundation.de Falk Gastro-Kolleg 35 Frage 6: Welche Aussage zu Diarrhöen bei HIV-Patienten trifft nicht zu? EE EE EE EE EE Lamblien kommen bei HIV-infizierten Patienten häufig vor Bei etwa einem Drittel der Patienten ist mit Mehrfachinfektionen zu rechnen Die Ursache muss primär endoskopisch abgeklärt werden Klassische bakterielle Erreger sind z. B. Shigellen, Salmonellen oder Campylobacter Das Zytomegalie-Virus verursacht eine nekrotisierende Entzündung der Kolonschleimhaut Falk Gastro-Kolleg Gesamter GI-Trakt Frage 7: Welches Medikament führt nicht zu einer Pankreatitis bei HIV-Patienten? EE EE EE EE EE Pentamidin Trimethoprim Sulfamethoxazol Didanosin Valganciclovir Frage 8: Welche Antwort ist richtig? Plaqueähnliche, nicht abwischbare Auflagerungen finden sich bei EE EE EE EE EE oraler Haarzellleukoplakie Condylomata accuminata Analkarzinom oraler Candidose Kaposi-Sarkom Frage 9: Welche Aussage zum Kaposi-Sarkom trifft zu? EE Als typisch opportunistische Erkrankung findet es sich ausschließlich bei HIV-Patienten EE Das Kaposi-Sarkom tritt in allen Stadien der HIV-Infektion auf EE Gastrointestinale Läsionen finden sich bei 30–50% der Patienten EE Zugrunde liegt eine Infektion mit HPV-8 EE Im Gegensatz zum NHL zählt das Kaposi-Sarkom nicht zu den AIDS-definierenden Erkrankungen Frage 10: Was findet sich nicht bei einer oropharyngealen Candidose? EE EE EE EE EE Mundwinkelrhagaden Schmerzen bei würzigem Essen Brennen Nicht abwischbare Beläge Ansprechen auf Nystatin 36











