Teil 7
Werbung

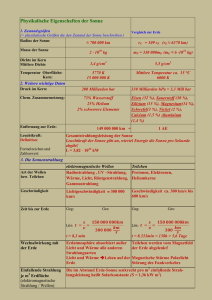
8. Wärme und Entropie Wir wollen uns jetzt mit Phänomenen befassen, bei denen Dissipation, sprich Reibung auftritt. Dabei müssen wir beachten, was mit der jeweiligen gerichteten kinetischen Energie, bzw. der potentiellen Energie passiert. Die ungeordnete kinetische Energie, die wir schon gesehen haben ist mit der Wärme gekoppelt. Sehen wir uns an, was ein Druck ist und woher er kommt. 2 Das heisst für viele Teilchen erhalten wir Oder in drei Dimensionen: 3 Ein Vergleich mit dem idealen Gasgesetz (später ausführlicher) zeigt, dass also m<v2> = 3 kB T <Ekin> = 3/2 kB T Dies werden wir noch allgemeiner sehen – es gibt einen engen Zusammenhang zwischen der Temperatur und der mittleren kinetischen Energie. 4 Welche Einheit hat die Temperatur im idealen Gasgesetz? A B C D Celsius Joule Kelvin Fahrenheit 5 Was passiert mit der mechanischen Energie, wenn ein Pendel im Wasser gedämpft wird? A B C D Epot des Wassers erhöht sich Ekin der Wassermoleküle erhöht sich Epot der Kugel erhöht sich Ekin von Strömungen im Wasser Bei solchen Prozessen gilt die mechanische Energieerhaltung nicht mehr. Wir brauchen eine neue Grösse, die die ungeordnete Bewegungs- und Bindungsenergie beschreibt. Dies ist die Wärme und wir müssen die Energieerhaltung erweitern mit der ins System gesteckten (oder gewonnenen) Wärme: dU = dW + dQ Das haben wir experimentell schon gesehen: Das erwärmte Gummiband leistet Arbeit Was passiert mit einem Gewicht das an einem Gummiband aufgehängt ist, das erwärmt wird? A B C es steigt es sinkt nichts 9 Ein Random-Walk kann zeigen, welche Struktur ein Polymer annimmt 10 Die Gleichung dazu ist die Diffusionsgleichung: ∂/∂t P(x,t) = D (∂/∂x)2 P(x,t) wobei D = ∆x2/2∆t Wodurch ist D aber physikalisch gegeben? Erinnern Sie sich an die Uebungsaufgabe auf Blatt 1. D = kT /f Was passiert mit Molekülen die thermisch angeregt werden, aber ständig durch Viskosität gebremst werden? <v2> = kT/m ∆t = 2m/f D = ∆x2/2∆t Dies ist die “Einstein Beziehung” die Mobilität ist gegeben durch die Stärke der Dissipation. Was uns interessiert ist mit welcher Geschwindigkeit ein Teilchen zwischen zwei Steuungen transportiert wird. Diffundierende Teilchen sind immer so klein, dass die Reynolds Zahl klein ist – die Reibung ist also direkt durch die Viskosität bestimmt. Für eine Kugel mit Radius a gilt dann also für den Diffusionskoeffizienten: Was können Sie über die Diffusion verschiedener Teilchen in verschiedenen Medien sagen? A B C je grösser das Teilchen desto schneller die Diffusion je zäher die Flüssigkeit, desto schneller die Diffusion je höher die Temperatur desto schneller die Diffusion Was passiert wenn Stoffe diffundieren? Neben Diffusion wird der Stoff auch abgebrochen. ergibt einen stationären Zustand, wenn ...oder (Gleichung lösen) Ein solcher exponentieller Gradient wird zum Beispiel beim Morphogen Bicoid im frühen Drosophila Embryo beobachtet. Das Protein wird von der Mutter an einer Seite deponiert und definiert so vorne und hinten Damit lässt sich auch Diffusion mit Hilfe von Stromdichten beschreiben: Wir haben gesehen, dass ein Dichtegradient einen Strom hervorruft: j = -D dρ/dx Mit der Kontinuitätsgleichung erhalten wir die Diffusionsgleichung. 17 Wie gross werden Kapillaren? Aktiver Transport wird nicht mehr benötigt wenn Diffusion effektiver ist. Auf dieser Längenskala sind auch die Kapillaren angesiedelt ∆x/∆t = v = r/τ = r2/4η*∆p/∆L 2Dτ = r2 => r/τ = 2D/r r2/4η*∆p/∆L = 2D/r => r = (8Dη∆L/∆p)1/3 Was ist die Breite der Geschwindigkeitsverteilung in einem Gas? A B C D kBT/m m/kBT (kBT)2 (kBT)1/2 Können wir Genaueres zur Verteilung der Energien, bzw. Geschwindigkeiten sagen? Betrachten wir ein ideales Gas. Wir haben gesehen, dass die Teilchen einer Gauss-Verteilung folgen und dass die mittlere kinetische Energie die Temperatur ist. Also: Wie nimmt der Druck mit der Höhe ab? wird durch Gleichgewicht von Diffusion und Sinken aufrechterhalten -> Einstein Beziehung Boltzmann Verteilung! Dies gilt allgemein: Wenn verschiedene Energien (Ei) möglich sind, ist die Wahrscheinlichkeit für Ei: pi = const*exp(-Ei/kBT) Was ist die Wahrscheinlichkeit für einen Zustand mit Energieanregung ∆E? A B C D E exp(kBT/∆E) exp(-∆E/kBT) exp(∆E/kBT) ∆E/kBT kBT/∆E Betrachten wir als Beispiel die Diffusion in einem Festkörper. Zwischen den Positionen des Atoms gibt es eine Energiebarriere. Um diese Barriere zu überwinden gibt es thermisch die Wahrscheinlichkeit der Boltzmann-Verteilung: p = exp(-∆E/kBT) Die Diffusionskonstante folgt damit der gleichen Abhängigkeit Gleiches gilt für chemische Reaktionen: Arrhenius-Plot Welche Aussage ist richtig? A B C D Epot ist immer gleich Ekin Epot + Ekin ist immer konstant Wärme ist eine Energieform Bei Prozessen mit Reibung wird Energie vernichtet Wärme hat also etwas mit Temperatur zu tun, ist aber nicht dasselbe – sie ist eine Energieform, muss also die Einheit Joule haben. Ausserdem muss die kombinierte Wärme von zwei Körpern summiert werden können. Wahrscheinlichkeiten würde man multiplizieren. Andererseits hat die Wärme etwas mit der Verteilung der mikroskopischen Energien zu tun. Wir suchen also ein Mass für die Wahrscheinlichkeitsverteilung eines Zustandes. Dazu müssen wir die Zustände unterscheiden können. Das Mass muss zudem additiv sein, also für zwei Körper zusammen die Summe ergeben. Betrachten wir spezifisch die Verteilung von Atomen in einem Gas mit zwei Hälften Quantitativer Zugang zur Entropie: W ist die Zahl der mikroskopischen Zustände, die makroskopisch gleich sind, d.h. die Wahrscheinlichkeit einer spezifischen mikroskopischen Realisierung eines makroskopischen Zustandes Betrachten wir das konkret beim idealen Gas das expandiert – die Wahrscheinlichkeit in einem Bestimmten Volumen zu sein ist: und damit die Entropie nach Boltzmann: multiplizieren mit T ergibt die Wärme Was passiert mit der Entropie wenn Sie die Anzahl Teilchen verdoppeln? A B C D sie verdoppelt sich sie halbiert sich sie bleibt gleich sie verändert sich um ln(2) Was passiert mit der Entropie wenn Sie das Volumen verdoppeln? A B C D sie verdoppelt sich sie halbiert sich sie bleibt gleich sie verändert sich um ln(2) Was ist Entropie? • Zahl der Mikrozustände für einen Makrozustand • Symmetrie • Information • Unordnung Überlegen wir uns nocheinmal das ideale Gas: Wenn wir das Volumen verringern wollen, müssen wir Arbeit leisten gegen den Druck. Diese Arbeit entspricht einer entropischen Kraft. Entropische Wechselwirkungen: In der Verarmungszone kann es keine kleinen Teilchen haben 2r r 2R Mischung von grossen und kleinen Teilchen Verarmungswechselwirkung = Anziehung zwischen den grossen Teilchen Genauso beim Gummiband: Rg Die Kraft die nötig ist um das Band zu strecken Fp : freie Energie der Kette. Wenn keine Bindungen vorhanden sind, gibt es nur entropische Beiträge. Die Biegeenergie kann von der thermischen Bewegung der Umgebung kommen dann ist ein Molekül nur bis zu einer gewissen Länge fest. Diese Länge heisst Persistenzlänge. 38 Tubulin ist sehr steif wegen seiner Dicke 39 Actin ist fast 100mal flexibler 40 Auf Längen die grösser sind als die Persistenzlänge, wird das Molekül also eine ungeordnete Struktur bilden: Wir können uns das vorstellen als eine Aneinanderreihung von Persistenzlängen, die jeweils in zufällige Richtungen zeigen. Dies wird beschrieben durch i li `j End-end Vektor L N Konturlänge S = Nl 41 Um dies zu beschreiben betrachten wir die Wahrscheinlichkeit an einem Ort zu sein P(x,i+1) = ½ P(x-δx,i) + ½ P(x+δx,i) Im Kontinuumslimit ∂/∂i P(x,i) = D (∂/∂x)2 P(x,i) wobei D = δx2/2 Daraus sehen wir auch, dass <x2> = DN 42 Wie weit kommt ein “random walker” im Mittel nach N Schritten der Länge L? A B C D L N*L N1/2*L N2*L 43 Diese Diffusions-Gleichung müssen wir lösen und erhalten für die Aufenthaltswahrscheinlichkeit als Funktion des Ortes eine GaussVerteilung 44 i si L ij Schwerpunkt `j sj Abstand Lij zwischen einzelnen Unterteilen i,j Gyrationsradius Rg 45 Wenn wir an dem Molekül ziehen, dann verändern wir diese Verteilung, was bedeutet, dass wir gegen die thermische Bewegung Arbeit leisten müssen. Die aufzuwendende Energie ist: kBT ln(p) = kBT 3r2/2Rg2 Je stärker gezogen wird, desto mehr kommt die Elastizität des Moleküls zum Tragen, was eine steigende SpannungsDehnungs Kurve gibt. 46 Die anfängliche Federkonstante ist c = 3kBT/Rg2 , wie wir bei der Behandlung der Entropie sehen werden. D.h. ein Gummi, der aus langkettigen Molekülen besteht wird mit zunehmender Temperatur steifer. 47 Sehen wir uns nochmals DNA in Lösung an… l r <r> = 0 Mittlerer quadratischer End-zu-End Vektor: Persistenzlänge 50nm <r2> = 2 n l2 = 2 s l = 6 Rg2 Kontourlänge 5cm, Gyrations-Radius Random walk n Schritte der Länge l Kann das die Verpackung der DNA in der Zelle erklären? 48 Typische Grösse eines DNA Genoms Organismus Basenpaare (Mb) Länge (µm) Viruses Polyoma λ-Phage 0.005 0.05 1,7 17 T2-Phage 0.17 56 Vaccinia 0.2 65 Bakterien Mycoplasma 0.760 260 E. coli 4 1360 yeast 13.5 4600 Drosophila 165 56000 Eukaryoten Mensch 2900 990000 49 Nicht mehr gültig für höhere Organismen! Der Mensch hat nur ~30000 Gene 50 Chromatin: (DNA im Kern verpacken) Histone H2, H3, H4 10nm H1 Nukleosom NB: Der Biegeradius von DNA im Nukleosom R ~ 5nm ist etwa 10mal kleiner als der thermische Biegeradius, d.h. die Persistenz51 länge -> starke Bindung Möglichkeiten zur Entropieerhöhung Aus der Boltzmann Entropie folgt auch direct die Boltzmann-Verteilung, wenn wir die Entropie Taylor-Entwickeln und die Definition der Temperatur betrachten, dass dS/dE = 1/T kB ln(p) = S (E0 –∆E) = S(E0) – dS/dE ∆E = S(E0) - ∆E/T pi = const*exp(-Ei/kBT) Ein Gas zu komprimieren gibt Wärme ab, wie bei der Velopumpe – umgekehrt nimmt die Expansion Wärme auf. Wieviel wird frei wenn wir das Volumen halbieren? Was ist die Wärme die in ein ideales Gas gesteckt werden muss? Q Spezifische Wärme – wieviel Wärme kann ein Körper aufnehmen bei gegebener Temperaturänderung? Dazu müssen wir betrachten auf wieviele Arten der Energie die Wärme verteilt werden kann. Boltzmann’sches Äquivalenzprinzip: ½ kBT pro mögliche Energieart oder Freiheitsgrad Wenn zusätzlich potentielle Energien, sprich Bindungen vorhanden sind, müssen diese auch mitgenommen werden. Eine potentielle Energie kann der Entropie entgegen arbeiten und somit den Wahrscheinlichsten Zustand ändern – denken Sie an das Gummiband. Mechanisch wird die Energie minimiert, thermodynamisch die Entropie maximiert. Um diese beiden Aussagen zu verbinden wird die “freie Energie” eingeführt. F = U - TS Minimierung der freien Energie führt zum Grundzustand. Beispiele für die Minimierung der freien Energie: Phasenübergänge Es gibt sehr viele Arten von Phasenübergängen: Fest - Flüssig Flüssig - Gasförmig Normalleitend - Supraleitend Magnetisch - Nichtmagnetisch Fest – Gasförmig Bei Allen gibt es eine kritische Temperatur, bei der der Zustand ändert. Alle sind ein Zusammenspiel von Entropie und Wechselwirkung Das Verhalten bei Phasenübergängen wird in einem Phasendiagramm zusammengefasst Sehr häufig werden Sie es mit Nichtgleichgewichtszuständen zu tun bekommen Was passiert mit den Teilchen wenn geschüttelt wird? Was passiert mit den Teilchen wenn geschüttelt wird? A B C nichts – es vermischt alle Teilchen gehen nach rechts alle Teilchen gehen nach links Elastizität von einzelnen Biomolekülen Die Elastizität lässt sich sogar von einzelnen Molekülen untersuchen – auch hier kommen häufig keine linearen Beziehungen zum Vorschein. Diese Nicht-linearitäten lassen sich verstehen und haben einen biologischen Sinn. Der Vorteil von Einzelmolekülexperimenten ist, dass keine Unsicherheit aus verschiedenen Molekülen entsteht. 64 Manipulation findet über ein “makroskopisches” Teilchen statt DNA oder anderes Molekül f Fixiertes kolloidales Teilchen (opt. Pinzette, Wand,…) Optische Pinzette Mikropipette Magnetisches Teilchen 65 Wie binde ich ein Einzelmolekül an ein Teilchen? -DNA 48´500 bp L0 = 16 µm (Plasmid) sticky ends Erhitzen auf 75° C abkühlen functionalisierte Oligomere hybridisieren nick L1 L2 ligation L1 biotin L2 Streptavidin (an der Oberfläche gebunden) 66 Streching of DNA 67 Frame 1-15 16 17-37 38 39-61 62-75 76 77-95 96-98 99 100-109 110-115 116-130 131-134 135 136-142 143-170 171 Action Beads (out of focus) move toward left in buffer flow A bead is caught in the laser trap The pipette sucks a bead out of the trap A different bead is caught in the trap Pipette is moved back and forth to "fish" for DNA The presence of DNA is indicated by force pulling trapped bead upstream The flow is stopped Overstretching the DNA beyond B-form shows a nearly constant force (~65pN) although the DNA length is changing When the length exceeds 170% B-form, the force increases >80 pN The laser trap is turned off The DNA tether contracts, first by reverting to B-form and then by entropic elasticity. The tethered bead moves by Brownian motion Flow is started and the trapped bead feels a drag force leftward Overstretching the DNA in a flow produces a smaller net force on the trapped bead due to hydrodynamic drag The molecule reaches 170% B-form length, the force rises Laser trap is shut off DNA contracts to B-form Overstretching DNA in flow DNA breaks 68 Damit erhält man eine Kraft-Ausdehnungs Kurve 69 Das passiert auch in Zellen… Rekombinations enzym RecA: RecA um DNA dsDNA wird um 60% ausgezogen bei Bindung RecA-DNA Komplex naked plasmid DNA 70 A. Stasiak et al., J. Mol. Biol. 151, 557 (1981) Noch eine Anwendung: Elektrophorese - Ze Die Coulomb Kraft führt zur + Bewegung und wird durch Reibung ausgeglichen Die elektrophoretische Mobilität ist Typical setup • „Slab“ Gel hat versciedene Bahnen • Gelmaterial - Polyacrylamide - Agarose - Microchip Gute Auftrennung! Aber: Die Mobilität eines geladenen Stabs in einem viskosen Medium sollte unabhängig von der Länge sein - v + --------------- v ~ ZeE/f = σLE/f = σE/8πη f ~ 8πηL ln(d/L) ~1 Um Auftrennung zu erhalten müssen wir die aufgewickelte Struktur der Moleküle mit in Betracht ziehen Reptation einer fluoreszenten DNA in konzentrierter Lösung In einem Gel ist die DNA nur entlang ihrer Länge beweglich. In diesem Schlauch führt sie eine Diffusion aus. Reptation 1D-Diffusion im Schlauch : Reptationszeit = Zeit um aus dem Schlauch zu kommen τrep ~ L2/2D1 = 8πηL3/2kBT Die entsprechende Bewegung in 3 Dimensionen hängt von der Verschlaufung des Moleküls ab. Die Mobilität ist durch die Diffusivität gegeben (Einstein): D3 ~ Rg2 / τrep ~ L-2 Gyrationsradius Rg ~ L 1/2 Was würde passieren wenn das Molekül frei im Gel beweglich wäre? A B C es gäbe keine Auftrennung das Gleiche wie im Gel die langen Stücke kämen weiter