Teil A 3 version 21.04.12
Werbung

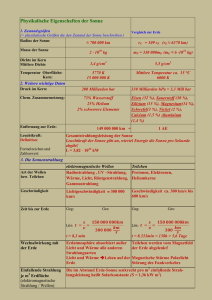
Was ist die Taylorentwicklung von (1+x)2, wenn x klein ist? A B C D E 1+x 1+2x 1+x/2 x 1+3x Was passiert mit der mechanischen Energie, wenn ein Pendel im Wasser gedämpft wird? A B C D Epot des Wassers erhöht sich Ekin der Wassermoleküle erhöht sich Epot der Kugel erhöht sich Ekin von Strömungen im Wasser 5. Wärme und Entropie Wir wollen uns jetzt mit Phänomenen befassen, bei denen Dissipation, sprich Reibung auftritt. Dabei müssen wir beachten, was mit der jeweiligen gerichteten kinetischen Energie, bzw. der potentiellen Energie passiert. Die ungeordnete kinetische Energie, die Temperatur ist mit der Wärme gekoppelt. Was ist Temperatur genau? Sehen wir uns an, was ein Druck ist und woher er kommt. Das heisst für viele Teilchen erhalten wir Oder in drei Dimensionen: In einem Gasgemisch mit konstanter Temperatur, was hat die höhere kinetische Energie? A B C D Wasserstoff Sauerstoff Kohlendioxid alle gleich Was passiert mit dem Druck wenn ich das Volumen halbiere? A B C D wird halbiert bleibt gleich wird verdoppelt kann so nicht gesagt werden Was passiert mit der Temperatur, wenn ich den Druck erhöhe? A B C wird reduziert bleibt gleich wird erhöht Ein Vergleich mit dem idealen Gasgesetz zeigt, dass also m<v2> = 3 kB T <Ekin> = 3/2 kB T Dies gilt ganz allgemein – es gibt einen engen Zusammenhang zwischen der Temperatur und der mittleren kinetischen Energie. Welcher Körper hat eine höhere Temperatur? A B C D Metall Holz Glas alle gleich Spezifische Wärme – wieviel Wärme kann ein Körper aufnehmen bei gegebener Temperaturänderung? Dazu müssen wir betrachten auf wieviele Arten der Energie die Wärme verteilt werden kann. Boltzmann’sches Äquivalenzprinzip: ½ kBT pro mögliche Energieart oder Freiheitsgrad Betrachten wir einen Random-Walk – wie weit kommt das Kind? Um dies zu beschreiben betrachten wir die Wahrscheinlichkeit an einem Ort zu sein P(x,t+t) = ½ P(x-x,t) + ½ P(x+x,t) Im Kontinuumslimit ∂/∂t P(x,t) = D (∂/∂x)2 P(x,t) wobei D = x2/2t Daraus sehen wir auch, dass <x2> = 2Dt Diese Diffusions-Gleichung müssen wir lösen und erhalten für die Aufenthaltswahrscheinlichkeit als Funktion des Ortes eine GaussVerteilung in Ort und Zeit. Welche Einheit hat die Temperatur im idealen Gasgesetz? A B C D Celsius Joule Kelvin Fahrenheit Was passiert mit Molekülen die thermisch angeregt werden, aber ständig durch Viskosität gebremst werden? <v2> = kT/m t = 2m/f D = x2/2t Die “Einstein Beziehung” verbindet die Stärke der Dissipation mit der Diffusivität. Was uns interessiert ist mit welcher Geschwindigkeit ein Teilchen zwischen zwei Steuungen transportiert wird. Diffundierende Teilchen sind immer so klein, dass die Reynolds Zahl klein ist – die Reibung ist also direkt durch die Viskosität bestimmt. Für eine Kugel mit Radius a gilt dann also für den Diffusionskoeffizienten: Was passiert wenn Stoffe diffundieren? Neben Diffusion wird der Stoff auch abgebrochen. ergibt einen stationären Zustand, wenn ...oder (Gleichung lösen) Ein solcher exponentieller Gradient wird zum Beispiel beim Morphogen Bicoid im frühen Drosophila Embryo beobachtet. Das Protein wird von der Mutter an einer Seite deponiert und definiert so vorne und hinten Was passiert mit dem Druck in der Zelle wenn aussen Helium ist? A B C er steigt er sinkt er bleibt gleich Was können Sie über die Diffusion verschiedener Teilchen in verschiedenen Medien sagen? A B C je grösser das Teilchen desto schneller die Diffusion je zäher die Flüssigkeit, desto schneller die Diffusion je höher die Temperatur desto schneller die Diffusion Alles was wir bei der Diffusion betrachtet haben war, dass es eine ungeordnete Bewegung gibt, die durch einen Zufallsprozess beschrieben wird. Wir haben gesehen, dass Temperatur die ungeordnete kinetische Energie ist. Wärmetransport kann also durch die gleiche Gleichung beschrieben werden Wie hoch ist der Luftdruck an der Decke des Hörsaals? A B C höher als am Boden tiefer als am Boden gleich hoch wie am Boden Wie nimmt der Druck mit der Höhe ab? wird durch Gleichgewicht von Diffusion und Sinken aufrechterhalten -> Einstein Beziehung Boltzmann Verteilung! Was ist die Breite der Geschwindigkeitsverteilung in einem Gas? A B C D kBT/m m/kBT (kBT)2 (kBT)1/2 Können wir Genaueres zur Verteilung der Energien, bzw. Geschwindigkeiten sagen? Betrachten wir ein ideales Gas. Wir haben gesehen, dass die Teilchen einer Gauss-Verteilung folgen und dass die mittlere kinetische Energie die Temperatur ist. Also: Was ist die Wahrscheinlichkeit für einen Zustand mit Energieanregung E? A B C D E exp(kBT/E) exp(-E/kBT) exp(E/kBT) E/kBT kBT/E Betrachten wir als Beispiel die Diffusion in einem Festkörper. Zwischen den Positionen des Atoms gibt es eine Energiebarriere. Um diese Barriere zu überwinden gibt es thermisch die Wahrscheinlichkeit der Boltzmann-Verteilung: p = exp(-E/kBT) Die Diffusionskonstante folgt damit der gleichen Abhängigkeit Gleiches gilt für chemische Reaktionen: Arrhenius-Plot Bei Prozessen mit Reibung gilt die mechanische Energieerhaltung nicht mehr. Wir brauchen eine neue Grösse, die die ungeordnete Bewegungs- und Bindungsenergie beschreibt. Dies ist die Wärme und wir müssen die Energieerhaltung erweitern mit der ins System gesteckten (oder gewonnenen) Wärme: dU = dW + dQ Was passiert mit dem Gewicht wenn das Gummiband erwärmt wird? A B C es steigt es bleibt es sinkt Das können wir experimentell sehen: Das erwärmte Gummiband leistet Arbeit Genauso umgekehrt – ein Gas zu komprimieren gibt Wärme ab, wie bei der Velopumpe. Wieviel wird frei wenn wir das Volumen halbieren? Was ist die Wärme die in ein ideales Gas gesteckt werden muss? Q Welche Aussage ist richtig? A B C D Epot ist immer gleich Ekin Epot + Ekin ist immer konstant Wärme ist eine Energieform Bei Prozessen mit Reibung wird Energie vernichtet Wärme hat also etwas mit Temperatur zu tun, ist aber nicht dasselbe – sie ist eine Energieform, muss also die Einheit Joule haben. Ausserdem muss die kombinierte Wärme von zwei Körpern summiert werden können. Wahrscheinlichkeiten würde man multiplizieren. Andererseits hat die Wärme etwas mit der Verteilung der mikroskopischen Energien zu tun. Wir suchen also ein Mass für die Wahrscheinlichkeitsverteilung eines Zustandes. Dazu müssen wir die Zustände unterscheiden können. Das Mass muss zudem additiv sein, also für zwei Körper zusammen die Summe ergeben. Betrachten wir spezifisch die Verteilung von Atomen in einem Gas mit zwei Hälften Quantitativer Zugang zur Entropie: W ist die Zahl der mikroskopischen Zustände, die makroskopisch gleich sind, d.h. die Wahrscheinlichkeit einer spezifischen mikroskopischen Realisierung eines makroskopischen Zustandes Betrachten wir das konkret beim idealen Gas das expandiert – die Wahrscheinlichkeit in einem Bestimmten Volumen zu sein ist: und damit die Entropie nach Boltzmann: multiplizieren mit T ergibt die Wärme Was passiert mit der Entropie wenn Sie das Volumen verdoppeln? A B C D E sie verdoppelt sich sie halbiert sich sie bleibt gleich sie steigt um kBln(2) sie sinkt um kBln(2) Was passiert mit der Entropie wenn Sie die Anzahl Teilchen verdoppeln? A B C D sie verdoppelt sich sie halbiert sich sie bleibt gleich sie steigt sich um kBln(2) Möglichkeiten zur Entropieerhöhung Was ist Entropie? • Zahl der Mikrozustände für einen Makrozustand • Symmetrie • Information • Unordnung Überlegen wir uns nocheinmal das ideale Gas: Wenn wir das Volumen verringern wollen, müssen wir Arbeit leisten gegen den Druck. Diese Arbeit entspricht einer entropischen Kraft. Entropische Wechselwirkungen: In der Verarmungszone kann es keine kleinen Teilchen haben 2r r 2R Mischung von grossen und kleinen Teilchen Verarmungswechselwirkung = Anziehung zwischen den grossen Teilchen Genauso beim Gummiband: Rg Die Kraft die nötig ist um das Band zu strecken Fp : freie Energie der Kette. Wenn keine Bindungen vorhanden sind, gibt es nur entropische Beiträge. Damit können wir auch die BoltzmannVerteilung verstehen: pi = const*exp(-Ei/kBT) Aus der Boltzmann Entropie folgt dies direkt, wenn wir die Entropie TaylorEntwickeln und die Definition der Temperatur betrachten, dass dS/dE = 1/T kB ln(p) = S (E0 –E) = S(E0) – dS/dE E = S(E0) - E/T Wenn zusätzlich potentielle Energien, sprich Bindungen vorhanden sind, müssen diese auch mitgenommen werden. Eine potentielle Energie kann der Entropie entgegen arbeiten und somit den Wahrscheinlichsten Zustand ändern – denken Sie an das Gummiband. Was ist die spezifische Wärme eines einatomigen, idealen Gases? A B C D E F NkBT 3/2 NkB 3/2 NkBT 5/2 NkB NkB 5/2 NkBT Mechanisch wird die Energie minimiert, thermodynamisch die Entropie maximiert. Um diese beiden Aussagen zu verbinden wird die “freie Energie” eingeführt. F = U - TS Minimierung der freien Energie führt zum Grundzustand. Beispiele für die Minimierung der freien Energie: Phasenübergänge Was passiert mit der Temperatur wenn wir die Luft wegwedeln? A B C sie steigt sie sinkt sie bleibt gleich Es gibt sehr viele Arten von Phasenübergängen: Fest - Flüssig Flüssig - Gasförmig Normalleitend - Supraleitend Magnetisch - Nichtmagnetisch Fest – Gasförmig Bei Allen gibt es eine kritische Temperatur, bei der der Zustand ändert. Alle sind ein Zusammenspiel von Entropie und Wechselwirkung Das Verhalten bei Phasenübergängen wird in einem Phasendiagramm zusammengefasst Phasenübergänge können durch das van der Waals Gas beschrieben werden. Hier gibt es einen kritischen Punkt Zustände ausserhalb des Gleichgewichtes: Konvektion Sehr häufig werden Sie es mit Nichtgleichgewichtszuständen zu tun bekommen Was passiert mit den Teilchen wenn geschüttelt wird? Was passiert mit den Teilchen wenn geschüttelt wird? A B C nichts – es vermischt alle Teilchen gehen nach rechts alle Teilchen gehen nach links