Lernzettel zu Redoxrekationen, OC
Werbung

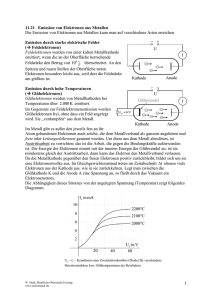
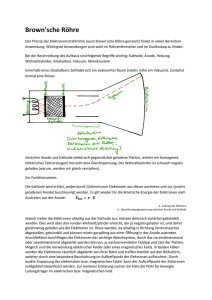
Lernzettel zu Redoxrekationen, OC CHEM Redoxreaktion / Redoxreihe der Metalle Was versteht man unter einer Oxidation? Unter einer Oxidation versteht man Elektronenabgabe. Diese findet an der Anode der galvanischen Zelle statt. Bei der Oxidation wird die Oxidationszahl des jeweiligen Stoffes erhöht. Was versteht man unter einer Reduktion? Unter einer Reduktion versteht man Elektronenaufnahme. Diese findet an der Kathode der galvanischen Zelle statt. Bei der Reduktion wird die Oxidationszahl verringert. Was versteht man folglich unter einer Redoxreaktion? Unter einer Redoxreaktion versteht man eine Elektronenübertragungsreaktion, bei der sowohl oxidiert, wie auch reduziert wird. Stöchiometrie in einer Redoxreaktion - Für eine Galvanische Zelle ist es wichtig zu wissen, was eine Redoxreaktion ist und wie sie ausgeglichen werden kann. Bsp: Gleichen Sie folgende Reaktionsgleichung aus. 𝐻3 𝑂+ + 𝑀𝑛𝑂4− + 𝐹𝑒 2+ → 𝑀𝑛 2+ + 𝐹𝑒 3+ o Bei Befolgung der Oxidationszahlregeln muss man zuerst die OZ verteilen um auf die Reduzierten, bzw. Oxidierten Elemente zu schließen: +𝐼 −𝐼𝐼 o 𝐻3 𝑂 + + +𝑉𝐼𝐼 −𝐼𝐼 𝑀𝑛𝑂 4− + +𝐼𝐼 𝐹𝑒 2+ → +𝐼𝐼 𝑀𝑛 + 2+ +𝐼𝐼𝐼 𝐹𝑒 3+ OXIDATION Fe REDUKTION Mn o Das Mangan wird reduziert, weil es Elektronen aufnimmt, was man an der Verminderung der Oxidationszahl sehen kann o Das Eisen wurde oxidiert, weil es Elektronen abgibt und somit eine kleinere OZ erhält. - - Nun schreibt man die Reduktionsgleichung und Oxidationsgleichung in s.g. Halbreaktionen ab: o Oxidation: 𝐹𝑒 2+ → 𝐹𝑒 3+ o Reduktion: 𝑀𝑛𝑂4− → 𝑀𝑛 2+ Wie man feststellt, sind die Reaktionsgleichungen nicht ausgeglichen. Allgemein kann man folgende Regeln verwenden: o Die Elemente auf beiden Seiten ausgleichen (abgesehen von O und H), wenn nötig mit Koeffizienten o Jedes O mit einem 𝐻2 𝑂 auf der anderen Seite ausgleichen o Nun die Zahl vor dem 𝐻2 𝑂 mit 2 multiplizieren, und dementsprechend HydroniumIonen (𝐻3 𝑂+) auf der anderen Seite hinzufügen. ©Stefan Pielsticker und Hendrik-Jörn Günther 1 Lernzettel zu Redoxrekationen, OC CHEM - - - o Die Zahl, die nun vor den Hydronium-Ionen stehen, addiert man nun noch zu den Wasser-Molekülen o Nun nur noch die Elektronen ausgleichen Somit ergibt sich: o Oxidation: 𝐹𝑒 2+ → 𝐹𝑒3+ + e− o Reduktion: 𝑀𝑛𝑂4− + 8H3 O+ + 5e− → 𝑀𝑛 2+ + 12H2 O Nun muss man nur noch die Elektronen in beiden Gleichungen gleichstellen, indem man die obere Gleichung mit 5 multipliziert. Man erhält: o Oxidation: 5𝐹𝑒 2+ → 5𝐹𝑒 3+ + 5e− o Reduktion: 𝑀𝑛𝑂4− + 8H3 O+ + 5e− → 𝑀𝑛 2+ + 12H2 O Nun kann man die Reaktionen in einer Redoxreaktion aufschreiben und erhält: o 5𝐹𝑒 2+ + 𝑀𝑛𝑂4− + 8H3 O+ + 5e− → 5𝐹𝑒 3+ + 5e− + 𝑀𝑛 2+ + 12H2 O o Die 5 Elektronen auf beiden Seiten lassen sich wegkürzen und man erhält als Endergebnis: o 5𝐹𝑒 2+ + 𝑀𝑛𝑂4− + 8H3 O+ → 5𝐹𝑒 3+ + 𝑀𝑛 2+ + 12H2 O Standardpotentiale / rechnen mit Standardpotentialen Aufbau und Funktion der Standard-Wasserstoff-Halbzelle - - Das Potential einer Wasserstoff-Halbzelle ist definitionsgemäß 0. Ein Platinblech taucht man in eine saure Lösung mit einer Hydronium-Ionen von 1 mol*l-1. Das Blech wird nun unter STP mit Wasserstoff umspült. Die Platin-Elektrode hat die Eigenschaft, Wasserstoff an ihrer Oberfläche zu adsorbieren, was sie auch tut. Die Platinelektrode wird nun versuchen, ein elektrochemisches Equilibrium (Gleichgewicht) zwischen adsorbierten Wasserstoff-Molekülen und hydratisierten Wasserstoff-Ionen herzustellen. Der Elektronenaustausch findet an der Elektronenoberfläche statt, wodurch die PlatinElektrode ein bestimmtes Potential erhält Somit gilt für die allgemeine Bestimmung von Standard-Elektronenpotentialen die RedoxSchreibweise: (Donator//Akzeptor) Me /Mez+ (c = 1 Mol L)//H + (c = 1 Mol L)/H2 - Somit ist die Wasserstoff-Halbzelle die Akzeptorzelle. Wie werden Elektrodenpotentiale gemessen? - - Um die Standardelektrodenpotentiale eines Stoffes zu messen, muss man einen international anerkannten Vergleichswert haben. Man hat sich dazu entschlossen die Standard Hydrogen Elektrode (SHE) auch Wasserstoffelektrode als 0-Zelle anzuerkennen. Die Wasserstoff-PlatinZelle hat die kleinste messbare Spannung und man hat deshalb diese Elektrode als Standardvergleichselektrode benützt. Man hat die Elektrodenpotentiale als Tabelle in einer s.g. Spannungsreihe aufgeführt. Je negativer das Element ist, desto lieber will das Element seine Elektronen abgeben (Bsp: Lithium mit -3.04 V ist ein sehr gutes Reduktionsmittel, weil es gerne die Elektronen abgibt und somit selbst Oxidiert wird.) ©Stefan Pielsticker und Hendrik-Jörn Günther 2 Lernzettel zu Redoxrekationen, OC CHEM - - Je größer der Wert ist, desto lieber will ein Stoff Elektronen aufnehmen und dient somit als Oxidationsmittel Aus diesem „Verlangen“ zweier Stoffe, Elektronen abzugeben und aufzunehmen lässt sich das Elektrodenpotential bestimmen. Beispiel zur Errechnung der Redoxpotentiale: o Zink-Lithium-Halbzelle. o 1. Aufschreiben und feststellen der Elektrodenpotentiale: Zink: 𝑍𝑛 2+ + 2𝑒 − ↔ 𝑍𝑛 | − 0,76𝑉 Lithium: 𝐿𝑖 + + 𝑒 − ↔ 𝐿𝑖 | − 3,04𝑉 Lithium ist der Donator; Zink der Akzeptor o 2. Aufschreiben der beiden Stoffe in Donator // Akzeptor Schreibweise 𝐿𝑖 /𝐿𝑖 + //𝑍𝑛 2+/𝑍𝑛 o 3. Aufschreiben der daraus zu schließenden Reaktionen und ausgleichen der e- : Oxidaion: 2𝐿𝑖 ↔ 2𝐿𝑖 + + 2𝑒 − | − 3,04𝑉 Reduktion: 𝑍𝑛 2+ + 2𝑒 − ↔ 𝑍𝑛 | − 0,76𝑉 Redox: : 2𝐿𝑖+𝑍𝑛 2+ ↔ 2𝐿𝑖 + + 𝑍𝑛 o 4. Berechnung des Redoxpotentials mit: ∆𝐸° = 𝐸° 𝐴𝐾𝑍𝐸𝑃𝑇𝑂𝑅 − 𝐸° 𝐷𝑂𝑁𝐴𝑇𝑂𝑅 ∆𝐸° = 𝐸° 𝑍𝑖𝑛𝑘 − 𝐸° 𝐿𝑖𝑡𝑖𝑢𝑚 ∆𝐸° = −0,76𝑉 − −3,04𝑉 ∆𝐸° = 2,28 𝑉 Der errechnete Wert ist als Spannung über ein Voltmeter zu messen Galvanische Zelle Was ist eine Galvanische Zelle? - Eine Galvanische Zelle ist ein Gerät, das aus chemischer Energie elektrische Energie formen kann. In der Zelle findet eine spontane Reaktion statt, die einen Elektronenaustausch mit sich zieht. ©Stefan Pielsticker und Hendrik-Jörn Günther 3 Lernzettel zu Redoxrekationen, OC CHEM Wie ist eine Galvanische Zelle aufgebaut? Diaphragma - Es muss unbedingt beachtet werden, dass die beiden Elektronen in einer Elektrolyt-Lösung stehen. Welche Reaktion läuft in einer Galvanischen Zelle ab? - Allgemein lässt sich sagen, dass die Galvanische Zelle auf einer Redox-Reaktion beruht. Eine Redox-Reaktion ist eine Reaktion bei der sowohl oxidiert, wie auch reduziert wird. Oxidieren heißt Elektronenabgabe und findet an der Anode statt; Erhöhung der Oxidationszahl Reduzieren heißt Elektronenaufnahme und findet an der Kathode statt; Verminderung der Oxidationszahl Oxidationsmittel: Die Substanz, die Elektronen aufnimmt selbst reduziert wird Reduktionsmittel: Eine Substanz, dass das Potential hat, eine andere Substanz zu reduzieren und wird somit selbst oxidiert Bestimmung der reduzierten und oxidierten Elemente mit Hilfe der Oxidationszahlen. Was ist eine elektrochemische Doppelschicht - Eine Ladungsschicht, die sich zwischen Elektrode und Elektrolyt bildet. An der äußeren Schicht des Metalls befinden sich Elektronen, die frei werden, wenn sich positive Metall-Ionen ablösen Gleichzeitig werden diese positiven Ionen und die anderen positiven Teilchen der ElektrolytLösung wieder von den Elektronen angezogen, sodass sie sich an der Grenze zum Metall anlagern ©Stefan Pielsticker und Hendrik-Jörn Günther 4 Lernzettel zu Redoxrekationen, OC CHEM - Ist die elektrochemische Doppelschicht dick genug, können sich keine Metall-Ionen mehr lösen und die Reaktion stoppt Wie hängen Redoxreaktionen mit Galvanischen Zellen zusammen? - - - - In einer Galvanischen Zelle finden an den Elektroden auch Reduktion und Oxidation statt. An der Anode wird Oxidiert, also Elektronen abgegeben. Deshalb wird diese Elektrode auch häufig als Minuspol bezeichnet. Bei diesem Prozess wollen die Atome der Anode Ionen bilden und lösen sich somit in der Elektrolyt-Lösung und geben ihre Elektronen durch die Anode ab. Dieses passiert auch nur, weil die Ionen in der Elektrolyt-Lösung auf der Kathoden-Seite sich gerne zu ihrem elementaren Zustand begeben wollen und somit Elektronen benötigen um dies zu erreichen. Diese Elektronen bekommen sie von der Anode. Aus diesem Grunde findet an der Kathode Reduktion statt, also Elektronenaufnahme! Da die beiden Elektroden durch z.B. ein Kabel verbunden sind, kann man ein Messgerät einbinden. Beim Einbau eines Spannungsmessgerätes kann man das Potential dieser Zelle messen. Als Potential versteht man zwischen den Elektroden der beiden Halbzellen einer Galvanische Zelle die Potentialdifferenz, also eine messbare Spannung. [Es drückt also vereinfacht nichts anderes aus, als das Verlangen eines Stoffes dem anderen Stoff gegenüber Elektronen abzugeben oder aufzunehmen] Konzentrationszellen 1. Die Nernst-Gleichung - Mit Hilfe der Nernst-Gleichung kann man das Standard-Potential eines Daniell-Elements (Zn/Zn2+//CU2+/Cu) ausrechnen, wobei bei beiden Halbzellen das gleiche Elektrodenmaterial und die gleiche Metallsalzlösung benützt; mit dem Unterschied, dass eine der beiden Salzlösungen weniger konzentriert ist. - Die Nernst-Gleichung lautet: o 𝑈=𝐸 𝑀𝑒 𝑀𝑒 𝑧+ + o 𝐴𝑙𝑠 𝐾𝑢𝑟𝑧𝑓𝑜𝑟𝑚: 𝑐 𝑀𝑒 𝑧+ , wobei z die Anzahl 1𝑀𝑜𝑙 𝐿 0,059𝑉 𝑐(𝑂𝑥𝑖𝑑𝑎𝑡𝑖𝑜𝑛𝑠 𝑎𝑙𝑏𝑧𝑒𝑙 𝑙𝑒 ) ∗ log 𝑐(𝑅𝑒𝑑𝑢𝑘𝑡𝑖𝑜𝑛𝑠 𝑎𝑙𝑏𝑧𝑒𝑙𝑙𝑒 ) 𝑧 0,059𝑉 𝑧 ∗ log der Ionenladung darstellt. 2. Die Konzentrationszelle - Unter der Konzentrationszelle versteht man eine galvanische Zelle, die auf zwei gleichen Halbzellen beruht, mit dem einzigen Unterschied, dass die Konzentration des Elektrolyten in einer der beiden Halbzellen geringer ist als die Konzentration der anderen - Die Elektroden bestehen aus dem selben Material und die Elektrolytlösungen sind identisch im Hinblick auf die Ionenart - Da die beiden Halbzellen ihre Konzentration ausgleichen wollen, entsteht eine messbare Spannung - Unter einer Konzentrationszelle versteht man aber auch, wenn man die Elektrode eine Lösung mit Ionen der Elektrode gibt (Bsp: Cu-Elektrode mit Cu-Lösung und Zn-Elektrode mit Zn-Lösung) - Da sich beim Stromfluss die Konzentrationen ausgleichen, werden sich in der Halbzelle mit der geringeren Elektrolytkonzentration die Atome der Elektrode lösen. Dabei verlieren diese ©Stefan Pielsticker und Hendrik-Jörn Günther 5 Lernzettel zu Redoxrekationen, OC CHEM - Elektronen, werden also Oxidiert und die Elektrode in der geringeren Konzentration wird somit zur Anode Die Elektrode in der höheren Konzentration wird zur Kathode, da an dieser reduziert wird Anwendung in der Technik (galvanische Zellen) a) Brennstoffzelle Entladung Oxidation: 2𝐻2 + 4𝐻2 0 → 𝐻3 𝑂+ + 4𝑒 − Reduktion: 𝑂2 + 4𝐻3 𝑂+ + 4𝑒 − → 6𝐻2 0 𝐸𝑛𝑡𝑙𝑎𝑑𝑢𝑛𝑔 → Redoxreaktion: : 2𝐻2 + 𝑂2 2 𝐻2 𝑂 ← 𝐴𝑢𝑓𝑙𝑎𝑑𝑢𝑛𝑔 Vorteile: - Leicht - Effizient - Zuverlässig - Leise - Gute Luftqualität Nachteile: - Hohe Kosten Geringe Reichweite bei Autos mit Brennstoffzellenmotor Anwendungsgebiet: - Raumfahrt - Autos - Stationärer Betrieb - Häufig mit Photovoltaik-Zellen gekoppelt b) Zink-Luft-Batterie Entladung Oxidation: 𝑍𝑛 → 𝑍𝑛 2+ + 2𝑒 − Reduktion: : 𝑂2 + 2 𝐻2 𝑂 + 4𝑒 − → 4𝑂𝐻 − Redoxreaktion: 𝑍𝑛 + 𝑂2 + 2 𝐻2 𝑂 𝐸𝑛𝑡𝑙𝑎𝑑𝑢𝑛𝑔 2 Zn(OH)2 → Vorteile: - Preiswert - Umweltfreundlich - Geringe Selbstentladung - Gute Lagerbarkeit Nachteile: - Zink ist selten in der Natur relativ teuer ©Stefan Pielsticker und Hendrik-Jörn Günther 6 Lernzettel zu Redoxrekationen, OC CHEM Anwendungsgebiet: - Hörgeräte - Taschenrechner - Digitaluhren - Weidezäune - Baustellenbeleuchtungen c) Alkali-Mangan-Batterie Entladung Oxidation: 𝑍𝑛 → 𝑍𝑛 2+ + 2𝑒 − Reduktion: 2𝑀𝑛𝑂2 + 2𝐻 + + 2𝑒 − → 2𝑀𝑛𝑂𝑂𝐻 Redoxreaktion: : 𝑍𝑛 + 2𝑀𝑛𝑂2 + 2𝐻 + 𝐸𝑛𝑡𝑙𝑎𝑑𝑢𝑛𝑔 𝑍𝑛2+ + 2𝑀𝑛𝑂𝑂𝐻 → Vorteile: - Spannungsrehabilisierung nach gewisser Ruhephase Nachteile: - großer Spannungsabfall innerhalb von kurzer Zeit Es kann zur Tiefenentladung kommen Anwendungsgebiete: - MP3-Player Digitalkameras Fernbedienung Taschenrechner Was versteht man unter einem Akkumulator? Ein Akkumulator ist ein elektrochemisches System, welches das Prinzip der galvanischen Zelle zur Energiegewinnung und das der Elektrolyse zum Wiederaufladen verwendet. Die chemischen Reaktionen sind also reversibel. 1. Welche Vorgänge spielen sich beim Ladevorgang, welche beim Entladevorgang des BleiAkkumulators ab? Im geladenen Zustand besteht der positive Pol aus Blei(IV) Oxid PbO2 und der negative Pol aus Blei Pb. Als Elektrolyt-Lösung wird eine 20-40%ige, Schwefelsäure (H2SO4) verwendet. Bei der Entladung läuft folgende Reaktion ab: Pluspol: 𝑃𝑏𝑂2 + 𝑆𝑂42− + 4𝐻3 𝑂+ + 2𝑒 − → 𝑃𝑏𝑆𝑂4 + 6𝐻2 𝑂 Minuspol: 𝑃𝑏 + 𝑆𝑂42− → 𝑃𝑏𝑆𝑂4 + 2𝑒 − Gesamtreaktion: 𝑃𝑏 + 𝑃𝑏𝑂2 + 2𝐻2 𝑆𝑂4 → 2𝑃𝑏𝑆𝑂4 + 2𝐻2 𝑂 ©Stefan Pielsticker und Hendrik-Jörn Günther 7 Lernzettel zu Redoxrekationen, OC CHEM Es sei zu beachten, dass im entladenen Zustand beide Pole aus PbSO4 bestehen. Bei der Aufladung sind die obigen Gleichungen umzudrehen: Gesamtreaktion: 2𝑃𝑏𝑆𝑂4 + 2𝐻2 𝑂 → 𝑃𝑏 + 𝑃𝑏𝑂2 + 2𝐻2 𝑆𝑂4 Dabei sei zu beachten, dass man beim Aufladen eine Spannung anlegen muss, entgegengesetzt der Stromflussrichtung bei der galvanischen Zelle. 2. Die drei untersuchten Akkumulatoren: Nickel-Cadmium-Akkumulator Entladung: Oxidation: 𝐶𝑑 + 2𝑂𝐻 − → 𝐶𝑑(𝑂𝐻)2 + 2𝑒 − Reduktion: 2𝑁𝑖𝑂 𝑂𝐻 + 2𝐻2 𝑂 + 2𝑒 − → 2𝑁𝑖(𝑂𝐻)2 + 2𝑂𝐻 − 𝐸𝑛𝑡𝑙𝑎𝑑𝑢𝑛𝑔 → Redoxreaktion: 2𝑁𝑖𝑂 𝑂𝐻 + 2𝐻2 𝑂 + 𝐶𝑑 𝐶𝑑(𝑂𝐻)2 + 2𝑁𝑖(𝑂𝐻)2 + 2𝑂𝐻 − ← 𝐴𝑢𝑓𝑙𝑎𝑑𝑢𝑛𝑔 Vorteile - Besonders belastbar und betriebssicher - Können hohe Ströme aufgrund des geringen Innenwiderstandes liefern Nachteile - Nickel gilt als allergieauslösend - Cadmium ist giftig und in der EU verboten - Großer Memory Effekt - Kann bei Überhitzung / Überladung gasen Anwendungsgebiete: - Modellbau, Mobiltelefone, Camcorder, USV Reaktionsgleichung bei der Gasung: Bei der Überladung eines NiCd-Akkus kommt es zur Zersetzungsspannung, bei der die Anzihungskräft zwischen den Elektronen und der Anionen und Kationen im Elektrolyten so groß wird, dass es zur Zersetzung des Elektrolyten kommt. Negative Elektrode: 4𝐻2 𝑂 + 4𝑒 − → 2𝐻2 + 4𝑂𝐻− Positive Elektrode: 4𝑂𝐻− → 2𝐻2 𝑂 + 𝑂2 + 4𝑒 − Gesamtreaktion: 2𝐻2 𝑂 → 2𝐻2 + 𝑂2 Nickel-Metallhydrid-Akkumulator Entladung: Oxidation: 2𝑀𝑒 − 𝐻 + 2𝑂𝐻 − → 2𝑀𝑒 + 2𝐻2 𝑂 + 2𝑒 − Reduktion: 2𝑁𝑖𝑂𝑂𝐻 + 2𝐻2 𝑂 + 2𝑒 − → 2𝑁𝑖(𝑂𝐻)2 + 2𝑂𝐻 − ©Stefan Pielsticker und Hendrik-Jörn Günther 8 Lernzettel zu Redoxrekationen, OC CHEM 𝐸𝑛𝑡𝑙𝑎𝑑𝑢𝑛𝑔 → Redoxreaktion: 2𝑀𝑒 − 𝐻 + 2𝑁𝑖𝑂𝑂𝐻 2𝑀𝑒 + 2𝑁𝑖(𝑂𝐻)2 ← 𝐴𝑢𝑓𝑙𝑎𝑑𝑢𝑛𝑔 Vorteile - Lange Lebensdauer - Schnelladefähig - Hohe Belastbarkeit - Umweltfreundlich Nachteile - Nickel gilt als allergieauslösend - Großer Memory-Effekt - Hohe Selbstentladung (z.B. durch Nebenreaktionen in den Elektroden; Kurzschlüsse in den Batterien) Anwendungsgebiete: - Hybrid-Autos, Spielzeuge, Kameras, USV Lithium-Ionen-Akkumulator Entladung: Oxidation: 𝐺𝑟𝑎𝑝𝑖𝑡 2− ∗ 2𝐿𝑖 + → 𝐺𝑟𝑎𝑝𝑖𝑡 + 2𝐿𝑖 + + 2𝑒 − Reduktion: 𝑀𝑛𝑂2 + 2𝐿𝑖 + + 2𝑒 − → Li2 𝑀𝑛𝑂2 Redoxreaktion: 𝐺𝑟𝑎𝑝𝑖𝑡 2− Vorteile - Hohhe Leistungsdichte - Sehr hohe Spannung - Keine giftigen Bestandteile 𝐸𝑛𝑡𝑙𝑎𝑑𝑢𝑛𝑔 → ∗ 2𝐿𝑖 + + 𝑀𝑛𝑂2 Graphit + Li2 𝑀𝑛𝑂2 ← 𝐴𝑢𝑓𝑙𝑎𝑑𝑢𝑛𝑔 Nachteile - Hohe Wärmeentwicklung - Teuer (Lithium, hermetische Abkapslung) - Hohe Selbstentladung (s.o.) - Schlechte Leistung bei niedriger Temperatur (Elektrolyt wird starrer) Anwendungsgebiete: - Handys, Camcorders, Digitalkameras, Laptops ©Stefan Pielsticker und Hendrik-Jörn Günther 9 Lernzettel zu Redoxrekationen, OC CHEM Korrosionsschutz und Elektrolyse 1. Was versteht man unter einer Elektrolyse? Unter der Elektrolyse versteht man das Aufspalten einer chemischen Verbindung mit Hilfe von elektrischem Strom in ihre Elemente. Die Spannung, die dabei angelegt werden muss ergibt sich aus dem Redoxpotential der aus den Ausgangsstoffen resultierenden galvanischen Zelle sowie aus einem Überpotential, welches benötigt wird, um die Elektrolyse zu starten. Bei der Elektrolyse entsteht auch gleichzeitig ein galvanisches Element, das der Elektrolyse entgegenstrebt: Dieses versteht man auch als Polarisationsspannung. Um eine Elektrolyse durchführen zu können, so wird an den – Pol (Anode) der galvanischen Zelle der Pluspol angelegt und an den + Pol (Kathode) der galvanischen Zelle der Minuspol angelegt. Die Anode wird somit in der Elektrolyse zur Kathode und die Kathode zur Anode. Das OxidationsReduktionsverständnis ändert sich jedoch nicht. An der Kathode wird nach wie vor reduziert und an der Anode oxidiert. 2. Was versteht man unter aktiven / passiven Korrosionsschutz? - Passiver Korrosionsschutz: o Überzug eines Werkstoffes mit Lack, Gummi etc. aber auch galvanotechnische Deckschichten (Vergoldung, Versilberung,…) o Beim passiven Korrosionsschutz muss die das Metall abdichtende material komplett dicht sein, damit keine Lokalelemente entstehen - Aktiver Korrosionsschutz: o Aufbringung von unedleren Schichten auf ein Metall (siehe Opferanode) o Kathodischer Korrosionsschutz: Fremdstrom dient als Anode, um einen unedleren Stoff zu „simulieren“. Somit gibt es kein verschleiß material, da die Anode und der Gegenpol mittels Fremdspannung geschützt werden, 3. Was versteht man unter einer Opferanode - Eine Opferanode besteht meistens aus einem unedlen Metall, welches oxidiert werden kann. Sie wird meistens bei Schiffen eingesetzt, da sich das Metall der Schiffshaut nicht auflösen soll / korrodieren soll, wird ein im Vergleich zum Schiffsmetall unedleres Metall aufgesetzt. - Nach der elektrochemischen Spannungsreihe muss dieses ein niedrigeres Potential besitzen, als das der Schiffshaut. Nur dann oxidiert dieses - Es liegt also ein Lokalelement Opferanode//Schiffmetall vor. Die Opferanode wird also oxidiert, da dann Elektronen an das Schiffmetall abgegeben werden und gleichzeitig Opferanodenmaterial in Ionenform in Wasser übergeht. Dadurch können sich keine Metallionen der Schiffwand lösen und das Schiff bleibt heile *freu* - Opferanoden sollten beim Schiffbau regelmäßig gewechselt werden. Energie in der Organischen Chemie - Berechnung der molaren Standardreaktionsenthalpien aus Tabellendaten o Allgemein lässt sich die molare Standardreaktionsenthalpie von Reaktionen folgendermaßen berechnen: ©Stefan Pielsticker und Hendrik-Jörn Günther 10 Lernzettel zu Redoxrekationen, OC CHEM 𝑅𝑒𝑎𝑘𝑡𝑖𝑜𝑛𝑠𝑔𝑙𝑒𝑖𝑐𝑢𝑛𝑔: 𝑣𝑎 𝐴𝐵 + 𝑣𝑏 𝐶𝐷 → 𝑣𝑐 𝐴𝐶 + 𝑣𝑑 𝐵𝐷 ∅ ∅ ∅ ∆𝑅 𝐻𝑚 = ∑(∆𝑅 𝐻𝑚 (𝑃𝑅𝑂𝐷𝑈𝐾𝑇𝐸)) − ∑(∆𝑅 𝐻𝑚 (𝐸𝐷𝑈𝐾𝑇𝐸)) ∅ ∅ ∆𝑅 𝐻𝑚 = ∆𝑓 𝐻𝑚 𝑣𝑐 𝐴𝐶 o o o o ∅ + ∆𝑓 𝐻𝑚 𝑣𝑑 𝐵𝐷 ∅ − [∆𝑓 𝐻𝑚 𝑣𝑎 𝐴𝐵 ∅ + ∆𝑓 𝐻𝑚 𝑣𝑏 𝐶𝐷 ] Wichtig ist der Satz von Hess: Die Enthalpieänderung eines Gesamtprozesses ist die Summe der Enthalpieänderung der einzelnen Prozesse. In anderen Worten ist die Energie die während einer Reaktion absorbiert oder abgegeben wurde unabhängig von der Anzahl der Reaktionen um das gewünschte Produkt zu erreichen. Demnach können chemische Reaktionen so manipuliert werden, dass man wie bei math. Algebra die Standardbildungsenthalpie eines Stoffes ausrechen kann, ohne diesen erst experimentell erzeugen zu müssen. Bsp: Es soll die Standardbildungsenthalpie von Pentan errechnet werden. 393,5𝑘𝐽 𝑚𝑜𝑙 285,8𝑘𝐽 ∅ ∆𝑅 𝐻𝑚 = − 𝑚𝑜𝑙 ∅ C+O2CO2 ∆𝑅 𝐻𝑚 =− H2 + 2 O2H2O ∅ C5H12 + 8 O2 5 CO2 + 6H2O ∆𝑅 𝐻𝑚 =− 1 3535 ,6𝑘𝐽 𝑚𝑜𝑙 Um nun die Standardbildungsenthalpie von Pentan zu errechnen dreht man die letzt Reaktionsgleichung um: 3535 ,6𝑘𝐽 ; 𝑚𝑜𝑙 ∅ 5 CO2 + 6H2O C5H12 + 8 O2 ∆𝑅 𝐻𝑚 =+ Außerdem muss man die Teilreaktionsgleichungen ausgleichen, sodass die Anzahl der CO2 und H2O gleich ist: ∅ 5C+5O25CO2 ∆𝑅 𝐻𝑚 =− ∅ 6H2 + 3 O26H2O ∆𝑅 𝐻𝑚 = Die Energie wird positiv!!! 393,5𝑘𝐽 ∗5 𝑚𝑜𝑙 285,8𝑘𝐽 − 𝑚𝑜𝑙 ∗ 6 Nun schreibt man alleszusammen auf und kürzt (links und rechts muss gleich sein); außerdem ausgleichen: 5C+5O2 +6 H2 + 3 O2+5 CO2 + 6H2O 5CO2 + 6H2O + C5H12 + 8 O2 Bleibt übrig: 5C + 6H2 C5H12 ; 5*(− 393,5𝑘𝐽 285,8𝑘𝐽 3535 ,6𝑘𝐽 145,7,6𝑘𝐽 )+6*(− 𝑚𝑜𝑙 )+ 𝑚𝑜𝑙 =− 𝑚𝑜𝑙 𝑚𝑜𝑙 (auch hier müssen die jeweiligen Energien mit den Koeffizienten der Reaktion multipliziert werden) o Ist die errechnete Reaktionsenthalpie negativ, so ist die Reaktion exotherm. Ist die errechnete Reaktionsenthalpie positiv, so ist die Reaktion endotherm. Nomenklatur - Homologe Reihe der Alkane, Alkene, Alkine, Alkohole, Aldehyde und Carbonsäuren o Unter einer homologen Reihe versteht man eine Reihe von Stoffen, die sich durch eine allgemeine Summenformel darstellen lassen und bei der ein Stoff dieser Reihe aus dem vorherigen Stoff durch Hinzufügen eines weiteren Kettengliedes gebildet wird. o Alkane: CnH2n+2 ©Stefan Pielsticker und Hendrik-Jörn Günther 11 Lernzettel zu Redoxrekationen, OC CHEM o o o - Alkene: Besitzen im Gegensatz zu den Alkanen eine oder mehrere C-CDoppelbindungen. Dadurch kommt eine geringere Anzahl an gebundenen Wasserstoffatomen zustande Alkine: Besitzen C-C-Dreifachbindungen, sodass pro Bindung 4 Wasserstoffatome weniger auftreten als bei einem gleich langen Alkan. Alkohole besitzen eine Hydroxylgruppe (-OH) anstelle eines Wasserstoffes an einem C-Atom. Endung auf –ol. o Aldehyde sind chemische Verbindungen, die als funktionelle Grupp eine Carbonylgruppe (-CHO) besitzen. Die von den Alkanen abgeleitete Reihe der Aldehyde bildet die homologe Reihe der Alkanale. Erste Oxidationsstufe primärer Alkohole. Endung auf –al. o Ketone beinhalten als funktionelle Gruppe eine Keto-Gruppe (>C=O). Endung auf – on. Oxidationsprodukt sekundärer Alkohole o Carbonsäuren beinhalten die Carboxylgruppe (-COOH). Zweite Oxidationsstufe primärer Alkohole, erste Oxidationsstufe der Aldehyde. Endung auf –säure. Benennung von organischen Verbindungen o Unter der Nomenklatur von Organischen Elementen versteht man die IUPACSchreibweise zur Nennung organischer Verbindungen, also Kohlen-Wasserstoffe. o Die Benennung erfolgt für ein Stammsystem sowie für Substituenten o Prinzipiell wird unterschieden in 3 Gruppen: o Alkane, Alkene und Alkine Alkane: besitzen in der gesamten Kette nur Einfachbindungen zwischen den Kohlenstoff-Atomen gesättigte Kohlenstoffe, da es nur Einfachbindungen gibt Alkene: besitzen sowohl Doppel- wie auch Einfachbindungen zwischen den C-Atomen. Wenn es nur eine Doppelbindung ist, handelt es sich schon um Alkene ungesättigte Kohlenstoffe Alkine: besitzen sowohl Einfach-, Doppel- und Dreifachbindungen zwischen den C-Atomen ungesättigte Kohlenstoffe ©Stefan Pielsticker und Hendrik-Jörn Günther 12 Lernzettel zu Redoxrekationen, OC CHEM o Um eine Benennung eines Kohlenwasserstoffes vorzunehmen geht man im Prinzip folgendermaßen vor. Wir gehen hier von einem Beispiel aus, um expurgativ zu benennen: Zunächst einmal schaut man, welche Bindungsarten vorkommen und gibt dem Molekül somit schon mal einen Rahmen. In diesem Beispiel gibt es eine Dreifachbindung. Es handelt sich also um ein Alkin, hat also die Endung –in. Dann zählt man an einer Kohlenwasserstoff-Kette die Anzahl der KohlenstoffAtome. Dabei muss man jedoch beachten, dass immer die längste Kette gezählt wird und eventuelle Seitenketten später benannt werden. Hier eine kleine Tabelle für die jeweiligen Namen zu den Atomanzahlen: Anzahl der Name Kohlenstoffe 1 Meth2 Eth3 Prop4 But5 Pent6 Hex7 Hept8 Oct9 Non10 DecBei unserem Beispiel handelt es sich also um eine Kette mit 7 KohlenstoffAtomen. Somit muss es sich schon mal um ein Heptin handeln. Nun zählt man die Elektronenbindungen durch: Dabei zählt man sowohl von links (schwarz), wie auch von rechts die Elektronenbindungen durch. Für welche Zählart man sich letztendlich entscheidet, hängt davon ab, dass man am Ende eine möglichst kleine Summe an Koeffizienten erhalten sollte. In diesem Falle ist es offensichtlich von rechts zu zählen, da sich bereits die erste Doppelbindung ganz rechts befindet. In IUPAC-Schreibweise sieht das dann unter Einbeziehung unserer Vorherigen Erkenntnisse so aus: 1,3,5-Heptin Man schreibt also die Stelle der Doppel und Dreifachbindungen mit Kommata getrennt auf. ©Stefan Pielsticker und Hendrik-Jörn Günther 13 Lernzettel zu Redoxrekationen, OC CHEM Leider wars das noch nicht! Es geht weiter: Wir müssen Doppel- und Dreifachbindungen getrennt voneinander ausweisen. Das schaut dann so aus: Hepta-1,5-di-en-3-in Dies ist dann der letztendliche Name des Moleküls. Man erkennt: 1. Zuerst kommt die Anzahl der Kohlenstoff-Atome: Hepta 2. Die Stellen der Doppelbindungen, gefolgt durch ein di, da wir zwei Doppelbindungen haben und ein –en, welches aussagt, dass es sich bei diesen Beiden Bindeungen um Doppelbindungen handelt. 3. Es folgt die 3 als Stelle der Dreifachbinung, eigentlich gefolgt durch ein mono (nur einmal vorkommenden Bindungstypen zählt man nicht auf, deswegen entfällt es) und ein –in, welches signalisiert, dass es sich an der 3. Bindung um eine Dreifachbindung handelt. Die Vorsilben für –an, -en und –in, die die Anzahl der Bindungsart angeben lautet folgendermaßen: Anzahl der Bindungen 1 2 3 4 5 6 7 8 9 o Vorsilbe: MonodiTriTetraPentaHexaHeptaOctanona Hier sind noch einige Beispiele: ©Stefan Pielsticker und Hendrik-Jörn Günther 14 Lernzettel zu Redoxrekationen, OC CHEM - Oxidation von Alkoholen o Bei Alkoholen unterscheidet man zusätzlich, wie viele weitere Kohlenstoffatome sich an den Kohlenstoff-Atom befinden, an dem sich die Hydroxyl-Gruppe befindet. o Oxidationskette n-Alkan n-Alkan prim. C-Atom sek. C-Atom 1. OXIDATIONSSCHRITT Primärer Alkohol Sekundärer Alkohol i-Alkan tert.C-Atom Tertiärer Alkohol 2. OXIDATIONSSCHRITT Alkanal (Aldehyd) Alkanol (Keton) 3. OXIDATIONSSCHRITT Alkansäure (Carbonsäure) o Der letzte Schritt kann nicht weiter oxidiert werden. Weitere funktionelle Gruppen sind: Radikale: Carbonsäure: Carbonsäureester (-carboxylat): Amine: (Amino-): ©Stefan Pielsticker und Hendrik-Jörn Günther 15 Lernzettel zu Redoxrekationen, OC CHEM - - Ether (-ether): Ester (-ester): Zwischenmolekulare Wechselwirkungen und ihre Auswirkungen auf Stoffeigenschaften o Allgemein lässt sich sagen, dass je höher die molare Masse, desto höher ist die Elektronendichte und desto höher ist der Siedepunkt o Je stärker die Bindungskräfte, desto höher der Siedepunkt, da dieser erst überwunden werden muss Es gilt: Dispersionskräfte <van der Waals-Kräfte< Dipol-Dipol < WasserstoffBrückenbindungen o Je größer der Dipol eines Moleküls, desto höher ist die Siedetemperatur o Je mehr Elektronen das Atom hat, desto leichter lässt es sich polarisieren und desto höher ist demnach auch die Siedetemperatur o Je kleiner die Elektronegativitätsdifferenz, desto höher der Siedepunkt (Denn je kleiner die Elektronegativität, desto mehr Elektronen besitzt das Atom und desto stärker lässt es sich polarisieren und umso höher ist die Siedetemperatur) Funktionelle Gruppen organischer Moleküle und ihre Auswirkung auf Stoffeigenschaften o Im Folgenden gehe ich nur auf die oben beschriebenen Funktionsgruppen näher ein: o Aldehyde: keine Wasserstoffbrückenbindungen, da kein sauerstoffgebundenes Wasserstoffatom vorhanden ist. Siedepunkt zwischen Alkane und Alkohole o Alkohole: im Vergleich zu Alkanen ähnlicher Struktur höhere Siedepunkte, da die Hydroxyl-Gruppe Wasserstoffbrückenbindungen aufbaut Je mehr Hydroxylguppen es gibt, desto höher der Siedepunkt Je länger ein Alykrest zweier Moleküle desto höher die Siedetemperatur Sphärische Moleküle haben einen niedrigeren Siedepunkt als lineare. o Carbonsäuren: Carboxylgruppen bilden Wasserstoffbrückenbindungen aus und haben deswegen relativ hohe Siedetemperaturen. Bei besonderer Sterie kommt es zu Carbonsäure-Dimeren (Molekül, welches starke Wasserstoffbrückenbindungen hat, sodass nach außen fast wie eines wirkt) mit fast doppelter Masse und somit höherer Dipole als das einzelne Molekül o Ketone: niedrigere Siedetemp. Als Aldehyde, sonst ähnlich, da selbe Oxidationsstufe ©Stefan Pielsticker und Hendrik-Jörn Günther 16 Lernzettel zu Redoxrekationen, OC CHEM Reaktionsmechanismen - - - - Radikalische Substitution o Die radikalische Substitution ist die Reaktion von Halogenen mit gesättigten Kohlenwasserstoffen und sie erfolgt in 3 Schritten: Kettenstartreaktion: Ein Halogenmolekül wird homolytisch (Licht, Druck etc) gespalten in zwei Radikale (Atom mit ungepaartem Elektron) 𝑋2 → 2𝑋 ∙ Es folgt der Schritt der Kettenreation: 𝑋 ∙ +𝑅 − 𝐻 → 𝑋 − 𝐻 + 𝑅 ∙ ; Das Halogenradikal greift die Kohlenwasserstoffkette R-H an und es entsteht ein Alkylradikal. Dieses greift nun ein weiteres Halogenmolekül an, spaltet es chemisch und es bindet sich mit dem entstandenen Halogenatom. Außerdem entsteht ein weiteres Halogenradikal, welches erneut einen gesättigten Kohlenwasserstoff angreift und die Kettenreaktion beginnt erneut 𝑅 ∙ +𝑋2 → 𝑅 − 𝑋 + 𝑋 ∙ Es folgt letztendlich der Schritt der Kettenabbruchreaktion, die auftritt, wenn zwei Radikale aufeinander treffen: 𝑅 ∙ +𝑋 ∙→ 𝑅 − 𝑋 oder 𝑅 ∙ +𝑅 ∙→ 𝑅 − 𝑅 oder 2 ∗ 𝑋 ∙→ 𝑋2 Nukleophile Substitution o Ein Nukleophil, also ein negatives Teilchen, welches von positiven Atomkernen angezogen wird, ist Ausgangspunkt von diesem wichtigem Reaktionstypus. Es ist ein Elektronenpaardonator, also eine Lewis-Base. Bei dieser Reaktion wird ein Heteroatom vom Typ R-X (X=elektronenanziehendes Heteroatom =kein C,H-Atom) von diesem Nukleophil ersetzt Elektrophile Substitution o Ein Elektrophil ist ein positiv geladenes Teilchen, welches Elektronen anzieht, also kationisch (Lewis-Säure). Bei der Elektrophilen Substitution wird ein Atom oder eine Atomgruppe gegen dieses Teilchen getauscht. Besonders häufig bei der Elektrophilen aromatischen Substitution, bei der durch frei-delokalisierte Elektronenpaare die Elektronen für ein Elektrophil relativ leicht zugänglich sind. Elektrophile Addition o Bei diesem Reaktionsmechanismus reagieren ungesättigte Kohlenwasserstoffe mit Wasser (Hydratisierung), Halogenen (Halogenierung), etc verbunden. o Im ersten Schritt wird ein Alken oder Alkin durch die hohe Elektronendichte der Doppelbindung bzw. Dreifachbindung polarisiert und heterolytisch, also in zwei meta-Ionen gespalten. Das angreifende Molekül greift deshalb an der Doppelbindung an elektrophil. Dabei entstehen ein Anion und ein Kation. Das Kation (ehemalige Alken oder Alkin) bleibt in diesem und bindet sich im zweiten Schritt mit dem ©Stefan Pielsticker und Hendrik-Jörn Günther 17 Lernzettel zu Redoxrekationen, OC CHEM Substituenten, das Anion kann, da es negativ geladen ist einen s.g. nucleophilen Rückseitenangriff durchführen, auf Basis einer nukleophilen Substitution. Standardreaktionen - - Veresterung o Bei einer Veresterung paart sich ein Alkohol mit einer Säure zu einem Ester. Da es sich um eine Kondensatinsreaktion handelt wird immer Wasser abgespalten. o Zunächst wird die Carbonsäure protoniert: o Das durch die Protonierung entstandene Carbeniumion wird von einem freien Elektronenpaar des Alkohols angegriffen (nukleophiler Angriff) o Anschließend erfolgt die Abspaltung von Wasser und die Deprotonierung: Die funkionelle Gruppe R-COO-R zeichnet die Ester aus. Verseifung o Die Verseifung macht sich Ester zum Nutze und führt eine hydrolytische Spaltung durch, mit Hilfe einer Lauge. Dafür greift zunächst das Laugen-typische Hydroxid-Ion an dem Ester an ©Stefan Pielsticker und Hendrik-Jörn Günther 18 Lernzettel zu Redoxrekationen, OC CHEM o Dem entstandenen Ion wird durch Abspaltung eines Alkoholat-Ions wieder eine Carbonsäure erstellt o Nun folgt der irreversible Schritt, der die Verseifung ausmacht: Der Protonenübergang von der Carbonsäure zum Alkoholat-Ion: Bei der Verseifung entstehen als Produkte immer Alkohol und das entsprechende Salz der Säure. - Cracken o Unter dem Reaktionsmechanismus des Crackens versteht man das spalten von langen Kohlenwasserstoffe in kürzere Kohlenwassestoffe. Bei diesem Vorgang unterscheidet man in zwei Hauptkategorien zwischen: Thermisches Cracken wird benutzt, um siedende Alkane unter hohen Druck zu brechen, da sie in starke Schwingungen geraten sind. Steam Cracken: langkettige Alkane werden unter Zugabe von Wasserdampf in kurzkettige Alkene gespalten. Visbreaking: dieses Verfahren dient der Verringerung des dickflüssigen Rückbestandes aus dem Steamcracken, indem der Rückbestand lange bei ca. 400°C im Behälter verweilt. Durch schnelles Abkühlen entstehen dabei kurzkettige Alkane Delayed Coocking: dieses Verfahren wird angewandt um selbst die teerähnlichen Rückstände aus dem Steam Cracking zu verarbeiten. Dazu wird dieses Material in einem Hochofen bei 30bar und 500°C erhitzt und ein heißes Gas wird in den Öfen nah oben getrieben, wo es abgesaugt werden kann Katalytisches Cracken Fluid Catalytic Cracken: Bei diesem Verahren wird ein schweres Vakuumdestillat in einer Raffinerie zu Gasen, Flüssiggasen und Kerosin verarbeitet. Die Spaltung erfolgt bei 450°C. Dabei entsteht sehr viel Koks, welches der Katalysation dient. Bei diesem Prozess werden n-Alkane produziert. Hydrockracken: Koksbildung wird vermieden, da Wasserstoff hinzugefügt wird. Unter 350°C und ca 70-80bar wird das Vakuumdestillat zu n-Alkanen und iso-Alkanen umgeformt. Vorteil: sehr schnell; Nachteil: teuer ©Stefan Pielsticker und Hendrik-Jörn Günther 19 Lernzettel zu Redoxrekationen, OC CHEM Kunststoffe - Kunststofftypen und Aufbau und Eigenschaften von diesen o Thermoplast Kunststoffe, die durch Erwärmung in den Flüssigen Zustand übergehen und dann beliebig verformt werden können. Bei Abkühlung nehmen sie wieder eine feste Form an. Der Vorrang ist reversibel, kann also unendlich oft wiederholt werden, solange eine Temperatur von 250°C nicht überschritten wird thermische Zersetzung Aufgebaut aus langkettigen Kohlewasserstoffen, ohne oder nur sehr wenigen Verzweigungen. Intermolekulare Kräfte sind VAN der WAALS-Bindungen Verarbeitung im Spritzgießverfahren und Druckluft, z.B. zur PETFlaschenherstellung Struktur: o Duroplast Kunststoffe, die nach ihrer Aushärtung nicht wieder verformt werden können (Nur noch mechanische Verarbeitung) Bei Erwärmung, gehen duroplastische Kunststoffe kaputt, da ihre Schmelztemperatur über der Zersetzungstemperatut liegt Aufgebaut aus engmaschig vernetzten Polymeren, die über Elektronenpaarbindungen miteinander verbunden sind. Herstellung oft durch Polykondensation Struktur: o Elastomere Kunststoffe, die sich unter Druck oder Zug verformen lassen, dann jedoch wieder in ihre ursprüngliche Form zurückformen. Aufgebaut aus langkettigen Polymeren, die an einigen Stellen über Elektronenpaarbindungen verbunden sind. (jedoch nicht so engmaschig wie beim Duroplasten) ©Stefan Pielsticker und Hendrik-Jörn Günther 20 Lernzettel zu Redoxrekationen, OC CHEM - Bei tiefer Temperatur sind Elastomere eher starr und spröde, da sie für die Ausdehnung thermische Energie benötigen. Bei Wärmezufuhr nimmt ihr Dehnungsvermögen zu, solange die Zersetzungstemperatur nicht überschritten wird. Struktur: Reaktionstypen o Radikalische Polymerisation Als Ausgangsstoff dient eine C=C-Doppelbindung an beiden Enden des Monomers. Damit die Reaktion jedoch beginnt, muss ein Radikal vorliegen. Dann wird die C=C-Doppelbindung aufgespalten. Es entsteht eine C-C-Einfachbindung und zwei freie Elektronen. Eins der freien Elektronen kann nun noch eine Verbindung zu einem weiteren Monomer aufbauen. An diesem wird ebenfalls eine Doppelbindung aufgespalten, sodass zwei Elektronen frei werden. Eins bildet die C-C-Einfachbindung zum anderen Monomer, das andere sorgt als Radikal für die Fortführung der Reaktion. So können langkettige Polymere entstehen, die auf Polymerisate genannt werden. Bei der Polymerisation entstehen vor allem langlkettige Thermoplaste Reaktionsgleichung: o Polykondensation Ausgangsstoffe sind Monomere mit zwei funktionellen Gruppen, geeignet sind: Hydroxlgruppen Carboxylgruppe Aminogruppen ©Stefan Pielsticker und Hendrik-Jörn Günther 21 Lernzettel zu Redoxrekationen, OC CHEM o Die Monomere reagieren an den funktionellen Gruppen unter Abspaltung eines kleinen Moleküls, z.B. Wasser Zunächst bilden sich Dimere, dann Polykondensate Bei der Polykondensation entstehen aus bifunktionellen Monomeren (Monomere mit zwei funktionellen Gruppen) thermoplastische Kunstoffe, bei trifunktinellen Monomeren(Monomer mit drei funktionellen Gruppen) hingegen duroplastische Kunststoffe. Reaktionsgleichung: Polyaddition Ähnlich wie bei der Polykondensation sind Monomere mit Funktionellen Gruppen notwendig. Jedoch braucht man für die Addition funktionelle Gruppen mit Doppelbindungen, die dann aufgelöst werden können, sodass eine Verbindung zwischen beiden entsteht Es werden jedoch weder andere Stoffe frei (Polykondensation) noch wird ein Radikal als Start benötigt(Polymerisation) Bei der Polyaddition entstehen aus bifunktionellen Monomeren (Monomere mit zwei funktionellen Gruppen) thermoplastische Kunstoffe, bei trifunktinellen Monomeren(Monomer mit drei funktionellen Gruppen) hingegen duroplastische Kunststoffe Die Polymere werden nach der Polyaddition auch Polyaddukte genannt Reaktionsgleichung: ©Stefan Pielsticker und Hendrik-Jörn Günther 22 Lernzettel zu Redoxrekationen, OC CHEM - - - Copolymerisation o Die Copolymerisation läuft genauso wie die Polymerisation ab o Der einzige Unterschied besteht darin, dass nicht immer die selben Monomere aneinander polymerisiert werden, sondern unterschiedliche Monomere o Damit ist es möglich dem Kunststoff bestimmt Eigenschaften zu geben Verwertung von Kunststoffen o Upcycling Nicht mehr benötigte Kunststoffe werden, thermisch, bzw. chemisch soweit bearbeitet, dass sie danach einen höheren Qualitätsgrad besitzen, also z.B. längere Ketten o Recycling Werkstoffliche Verwendung Aus den Sekundärrohstoffen können durch Schmelzverfahren und neues Gießen wieder neue Kunststoffprodukte hergestellt werden Voraussetzung ist ein thermoplastischer Kunststoff Besonders gut eigen sich sortenreine Kunststoffe Mischkunststoffe können zerkleinert und nur in kleinen Mengen der normalen Produktion zugemengt werden und führen zu minderwertigen Kunststoffen (Downcycling) Rohstofflich Verwertung Die Makromoleküle des Kunstsoffst werden wieder in Monomre aufgespalten und können dann in den bereits bekannte Verfahren wieder zusammengefügt werden Dieser Vorgang ist jedoch sehr aufwendig und teuer o Downcycling Nicht mehr benötigte Kunststoffe werden, thermisch, mechanisch oder chemisch soweit bearbeitet, dass sie danach einen geringeren Qualitätsgrad besitzen, also z.B. kürzere Ketten o Thermische Verwertung Als letzte Möglichkeit besteht noch die Verbrennung, wobei die entstehende Wärme genutzt und beispielsweise in elektrische Energie umgewandelt werden kann Dies setzt jedoch eine gute Filterung der Abgase voraus, da giftige Gase entstehen Gründe für die Herstellung o Geringeres Gewicht als Metall und Keramiken o Höhere Bruchsicherheit als Gas und Keramik o Chemische Beständigkeit gegenüber anorganischen Verbindungen, jedoch stark zersetzend bei organischen Lösemitteln o Geringe Verarbeitungstemperaturen Konstruktion räumlich komplizierter Teile o Farbigkeit o Geringe Wärmeleitfähigkeit Wärmedämmung, Isolation o Eine elektrische Leitfähigkeit Isolation von Kabeln o Günstige Herstellung ©Stefan Pielsticker und Hendrik-Jörn Günther 23