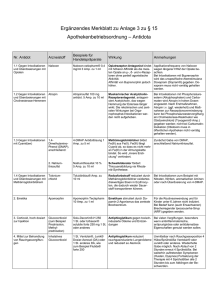
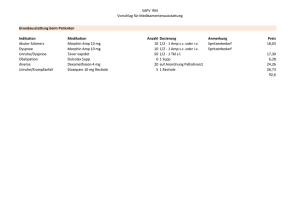
Diplom 2005 (pdf / 890 KB) - unics.uni
Werbung

Synthese und Charakterisierung von Carboxylaten der Lanthanide mit stickstoffhaltigen Aromaten zur Erfüllung der Prüfungsbedingungen für die Diplomhauptprüfung im Fachbereich Chemie an der Universität Hannover von Daniela John geboren am 22. September 1980 in München Hiermit versichere ich, dass ich die vorliegende Arbeit selbstständig angefertigt und alle verwendeten Hilfsmittel angegeben habe. Hannover, den 05.01.2005 Diese Arbeit wurde im Zeitraum September 2004 bis Januar 2005 im Institut für Anorganische Chemie (ACI) der Universität Hannover unter der Leitung von Herrn Prof. Dr. Werner Urland angefertigt. Herrn Prof. Dr. Werner Urland danke ich besonders für die interessante Aufgabenstellung sowie die persönliche und sehr freundliche Betreuung bei der Durchführung dieser Arbeit. Herrn Prof. Dr. Michael Binnewies danke ich für die Übernahme des Korreferats. Ganz herzlich möchte ich mich für die Einführung in die Kristallstrukturanalyse und die Technik der magnetischen Messungen sowie für die nette Aufnahme in den Arbeitskreis bei Alexander Rohde, Dagmar Grüne und Herrn Prof. Dr. Werner Urland bedanken. Sie waren stets bereit für anregende und aufschlussreiche Diskussionen und gaben hilfreiche Vorschläge. Desweiteren danke ich Herrn Dr. Rudolph Wartchow, der die Einkristalldatensätze aufnahm. Lena Müller danke ich für stete Diskussionsbereitschaft, auch bei außerfachlichen Problemstellungen und für eine einmalig schöne und lustige Zeit im Studium. Dr. Christina Quandt und Anett Körn danke ich sehr für das Korrekturlesen dieser Arbeit. Ich danke der Firma EBRC Consulting GmbH, insbesondere Dr. Rüdiger Battersby, für die Möglichkeit, dort während des Studiums zu arbeiten. Hervorzuheben ist vor allem die angenehme familiäre Atmosphäre bei EBRC. Die flexible Arbeitszeiteinteilung gab mir außerdem die Möglichkeit, mich besonders in Phasen der Prüfungsvorbereitungen voll auf das Studium zu konzentrieren. Ganz besonderer Dank gilt meinen Eltern Erika und Roland John und meinem Freund Kevin Klipsch für ihre Unterstützung in allen Lebenslagen, ihre Geduld, ihren Zuspruch und ihr Vertrauen in mich. Meinen Eltern danke ich desweiteren auch für ihre finanzielle Unterstützung, ohne die mein Studium nicht in der kurzen Zeit möglich gewesen wäre. Inhaltsverzeichnis Inhaltsverzeichnis 1 Einleitung 4 2 Röntgenstrukturanalyse 7 2.1 Grundlagen der Röntgenbeugung . . . . . . . . . . . . . . . . . . . . . 7 2.2 Röntgenpulverdiffraktometrie . . . . . . . . . . . . . . . . . . . . . . . 8 2.3 Einkristallverfahren . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 8 2.3.1 Einkristalldiffraktometrie mit einem IPDS . . . . . . . . . . . . 9 Rechenverfahren zur Kristallstrukturanalyse . . . . . . . . . . . . . . . 9 2.4 2.5 2.4.1 Patterson-Synthese . . . . . . . . . . . . . . . . . . . . . . . . 11 2.4.2 Direkte Methoden . . . . . . . . . . . . . . . . . . . . . . . . . . 11 2.4.3 Korrekturen . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 11 2.4.4 Gütefaktoren der Strukturbestimmung . . . . . . . . . . . . . . 14 Rechenprogramme . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 16 3 Magnetische Eigenschaften 17 3.1 Grundbegriffe . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 17 3.2 Magnetische Eigenschaften der Materie . . . . . . . . . . . . . . . . . . 18 3.2.1 Diamagnetismus . . . . . . . . . . . . . . . . . . . . . . . . . . . 19 3.2.2 Paramagnetismus . . . . . . . . . . . . . . . . . . . . . . . . . 19 3.2.3 Ferromagnetismus, Ferrimagnetismus und Antiferromagnetismus 20 Interpretation der magnetischen Suszeptibilitätsmessungen . . . . . . . 21 3.3.1 Dinukleare Einheit . . . . . . . . . . . . . . . . . . . . . . . . . 23 3.3.2 Das Korrekturprogramm DANSY . . . . . . . . . . . . . . . . . 24 3.3 1 Inhaltsverzeichnis 4 Das SQUID-Magnetometer 26 4.1 Messprinzip . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 26 4.2 Probenvorbereitung . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 28 4.3 Justierung und Messung . . . . . . . . . . . . . . . . . . . . . . . . . . 28 4.4 Datenausgabe . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 29 5 Edukte 30 6 Präparativer Teil 31 6.1 Darstellung von Gd4 (CClF2 COO)12 (C12 N2 H8 )6 (H2 O)4 ·2C2 H5 OH ·H2 O . 32 6.2 Darstellung von Gd(CClF2 COO)3 (C12 N2 H8 )2 (H2 O)2 . . . . . . . . . . . 32 6.3 Darstellung von Gd(CClF2 COO)3 (C12 N2 H8 )(H2 O) . . . . . . . . . . . . 33 6.4 Darstellung von Gd(CF2 HCOO)3 (C12 N2 H8 ) . . . . . . . . . . . . . . . 33 7 Röntgenographische Untersuchungen 7.1 Nummerierungskonzept in den synthetisierten Verbindungen . . . . . . 7.2 Verknüpfungsmodi der Carboxylatgruppen in den komplexen Carboxylaten 7.3 7.4 7.5 7.6 34 34 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 35 Gd4 (CClF2 COO)12 (C12 N2 H8 )6 (H2 O)4 ·2C2 H5 OH ·H2 O . . . . . . . . . . 37 7.3.1 Einkristallstrukturanalyse . . . . . . . . . . . . . . . . . . . . . 37 7.3.2 Strukturmodell . . . . . . . . . . . . . . . . . . . . . . . . . . . 39 Gd(CClF2 COO)3 (C12 N2 H8 )2 (H2 O)2 . . . . . . . . . . . . . . . . . . . . 50 7.4.1 Einkristallstrukturanalyse . . . . . . . . . . . . . . . . . . . . . 50 7.4.2 Strukturmodell . . . . . . . . . . . . . . . . . . . . . . . . . . . 52 Gd(CClF2 COO)3 (C12 N2 H8 )(H2 O) . . . . . . . . . . . . . . . . . . . . . 60 7.5.1 Einkristallstrukturanalyse . . . . . . . . . . . . . . . . . . . . . 60 7.5.2 Strukturmodell . . . . . . . . . . . . . . . . . . . . . . . . . . . 62 Gd(CF2 HCOO)3 (C12 N2 H8 ) . . . . . . . . . . . . . . . . . . . . . . . . . 69 7.6.1 Einkristallstrukturanalyse . . . . . . . . . . . . . . . . . . . . . 69 7.6.2 Strukturmodell . . . . . . . . . . . . . . . . . . . . . . . . . . . 71 8 Magnetische Untersuchungen an Gd(CClF2 COO)3 (C12 N2 H8 )(H2 O) und Gd(CF2 HCOO)3 (C12 N2 H8 ) 78 2 Inhaltsverzeichnis 9 Diskussion der präparativen und strukturchemischen Ergebnisse 81 10 Zusammenfassung 83 A Pulverdiffraktogramme 86 A.1 Gd4 (CClF2 COO)12 (C12 N2 H8 )6 (H2 O)4 ·2C2 H5 OH·H2 O . . . . . . . . . . 86 A.2 Gd(CClF2 COO)3 (C12 N2 H8 )2 (H2 O)2 . . . . . . . . . . . . . . . . . . . . 87 A.3 Gd(CClF2 COO)3 (C12 N2 H8 )(H2 O) . . . . . . . . . . . . . . . . . . . . . 88 A.4 Gd(CF2 HCOO)3 (C12 N2 H8 ) . . . . . . . . . . . . . . . . . . . . . . . . . 89 B Magnetische Messungen 90 C Abkürzungsverzeichnis 92 Literaturverzeichnis 93 3 1 Einleitung 1 Einleitung Im 19. und 20. Jahrhundert wurden die Lanthanide (Ln) entdeckt. Dies sind die 15 Elemente, Lanthan bis Lutetium, die im Periodensystem auf Barium folgen [1]. Die Lanthanide sind für Naturwissenschaftler verschiedenster Fachrichtungen interessant, da diese Elemente periodische und aperiodische physikalische und chemische Eigenschaften haben. Ihre Sonderstellung im Periodensystem beruht auf ihrer Elektronenkonfiguration, da bei voll besetzten äußeren Unterschalen (5s2 , 5p6 , 6s2 ) vom Lanthan ([Xe] 4f0 5d1 ) bis zum Lutetium ([Xe] 4f14 5d1 ) sukzessive die kernnahen 4f-Orbitale mit Elektronen besetzt werden. Durch die annähernd gleiche Besetzung der äußeren Elektronenschalen ist das chemisch ähnliche Verhalten aller Lanthanidmetalle bedingt. Für die chemische Bindung spielen die 4f-Elektronen nur eine untergeordnete Rolle. In ihren Verbindungen treten die Lanthanide überwiegend als dreiwertige, seltener als zwei- oder vierwertige Kationen auf. Bei Neodym, Samarium, Europium, Dysprosium, Thulium und Ytterbium tritt die Valenz +2 auf und bei Cer, Praseodym, Neodym, Terbium und Dysprosium findet man die Valenz +4. In wässriger Lösung sind nur Eu2+ und Ce4+ beständig, wobei die anderen von der Valenz +3 abweichenden Wertigkeiten vor allem in Festkörpern anzutreffen sind. Mit zunehmender Ordnungszahl wächst die effektive Kernladung, die einen starken Einfluss auf die kernnahen 4f-Orbitale hat, wodurch diese trotz steigender Elektronenzahl kontrahieren. Daraus resultiert die Lanthanidenkontraktion - die wohl wichtigste aperiodische Eigenschaft der Lanthanide. Für die Koordinationszahl (KZ) 6 sinken die Ionenradien von La3+ (r = 103,2 pm) bis zu Lu3+ (r = 86,1 pm) um fast 20 % [2]. Die unterschiedlichen Ionengrößen haben direkten Einfluss auf die Koordinationszahlen und die Koordinationsgeometrie und bestimmen deshalb entscheidend die 4 1 Einleitung Strukturchemie der Verbindungen der Lanthanide. Von großer Bedeutung für die physikalischen Eigenschaften sind die nach außen abgeschirmten 4f-Elektronen. Die optischen Spektren der Lanthanide (f-f-Übergänge) und ihrer Verbindungen weisen selbst im Festkörper eine hohe Linienschärfe auf. Auch das magnetische Verhalten wird von den 4f-Elektronen bestimmt. In den Arbeiten von Klemm [3] ist der Beginn der Magnetochemie der Lanthanide begründet, die mit der von van Vleck [4] entwickelten Theorie des Paramagnetismus z. B. die Valenzen des Lanthanidions in den Verbindungen CeS2 und CeO2 zu bestimmen gestattet. Die Lanthanidionen weisen mit Ausnahme der diamagnetischen Ionen La3+ , Ce4+ , Yb2+ und Lu3+ paramagnetisches Verhalten auf. Die Suszeptibilitäten der meisten Lanthanidionen folgen näherungsweise dem Curie-Gesetz, nur Sm3+ und Eu3+ weichen deulich davon ab. Der Beitrag des temperaturunabhängigen Paramagnetismus (van Vleckscher Paramagnetismus) zum gesamten magnetischen Moment ist hierbei relativ groß. Da die f-Elektronen einer starken Abschirmung unterliegen, tritt der Einfluss des Kristallfeldes auf die magnetischen Eigenschaften der Lanthanidionen in der Regel erst unterhalb von 80 K in Erscheinung. Die Chemie der Lanthanide geht über das Interesse der Grundlagenforschung hinaus, was die mittlerweile vielfältigen technischen Anwendungen zeigen. Hier sollen nur einige wenige davon aufgezählt werden: Als Permanentmagnete mit besonders hoher Koerzitivkraft dienen Nd-Fe-B-haltige Magnete [5] oder SmCo5 [6]. Als Feststofflaser, wie z. B. der Nd-YAG-Laser (Y3+ in Y3 Al5 O12 wird durch Nd3+ ersetzt), kommen Lanthanidverbindungen zum Einsatz [1]. Weitere Anwendungsgebiete finden sich in der PhotoOptik [7], der medizinischen Röntgendiagnostik [8] und in der Katalysatortechnik für Automobile [9]. Auch in der enantiomerenreinen organischen Synthese finden Lanthanidverbindungen immer mehr Anwendungen [10]. Hervorzuheben ist eine sehr wichtige Anwendung in der Medizin, in der bei der Kernspintomographie (MRI, magnetic resonance imaging) gut verträgliche Gd3+ -haltige Kontrastmittel gegeben werden [11]. Dieses Verfahren kommt immer dann zum Einsatz, wenn eine Abgrenzung verschiedener Gewebearten nicht ohne weiteres möglich ist. Auf diese Art und Weise können 5 1 Einleitung genauere Aussagen über die betreffende Körperregion gemacht werden. Carboxylate der Lanthanide mit stickstoffhaltigen Aromaten (1,10-Phenanthrolin = phen; 2,2’-Bipyridin = bipy; Terpyridin = terpy) mit der Zusammensetzung Ln(CH3 COO)3 (phen) mit Ln = La–Nd und Sm-Lu [12], Ln(CH3 COO)3 (bipy) mit Ln = Pr, Nd, Yb [13] und Ln(CClx H3−x COO)3 (terpy) mit x = 1–3 und Ln = Nd, Eu, Er [14] sind schon länger bekannt. Seit dieser Zeit sind viele solcher Verbindungen synthetisiert worden. Lanthanidcarboxylate sind wegen des verbrückenden Charakters der Carboxylatgruppe als molekularmagnetische Materialien von Interesse. So sind z. B. einige Verbindungen bekannt, die antiferromagnetische Eigenschaften zeigen [15–21]. Es wurde aber auch ferromagnetisches Verhalten bei [Gd(L)3 (H2 O)]2 (HL = Salicylsäure) [22] und Gd(CH3 COO)3 (H2 O)2 ·2H2 O [23] beobachtet. In dieser Arbeit sollen neue Carboxylate der Lanthanide mit dem stickstoffhaltigen Aromaten 1,10-Phenanthrolin dargestellt werden. Die Kristallstrukturen der so synthetisierten Verbindungen sollen anhand von röntgenographischen Einkristalldaten bestimmt werden. Von besonderem Interesse sind dabei Verbindungen, die dimere Baueinheiten der Lanthanidionen enthalten. Solche Carboxylate sollten Eigenschaften zeigen, die auf magnetische Wechselwirkungen hinweisen. Daher sind auch magnetische Untersuchungen geplant. 6 2 Röntgenstrukturanalyse 2 Röntgenstrukturanalyse Die in dieser Arbeit erhaltenen Produkte wurden mit Hilfe der Röntgenstrukturanalyse charakterisiert. Die Methoden dieser Analysetechnik beruhen auf der Beugung von Röntgenstrahlen an den Atomen der jeweiligen Proben und erlauben so eine Aufklärung des strukturellen Aufbaus. Je nach Güte des erhaltenen Produkts kann die Untersuchung an einer Vielzahl von Kristalliten (Pulvermethoden [26]) oder an einem Einkristall (Einkristallmethoden [27, 28]) vorgenommen werden. 2.1 Grundlagen der Röntgenbeugung Wenn Röntgenstrahlen auf ein Objekt treffen, werden sie gemäß ihrer Wellennatur gebeugt. Physikalisch beruht diese Beugung auf einer Streuung der elektromagnetischen Röntgenwellen an den in dem Objekt enthaltenen Elektronen. Diese führen im magnetischen Wechselfeld der Röntgenwellen erzwungene Schwingungen aus und werden so zum Ausgangspunkt kohärenter Sekundärwellen. Sind die Streuzentren dreidimensional periodisch angeordnet, findet eine Überlagerung der von jedem Punkt des Gitters ausgehenden kugelförmigen Streuwellen statt, und es kommt zu sowohl positiver als auch negativer Interferenz. Die physikalisch falsche, aber als Modell sinnvolle Betrachtungsweise - die Reflexion von Röntgenstrahlen an den Netzebenenscharen (hkl) - führt zu einer einfachen mathematischen Beziehung, der Braggschen Gleichung: nλ = 2dhkl sinθ (2.1) 7 2 Röntgenstrukturanalyse dhkl = Abstand der Netzebenen (hkl) θ = Einfallswinkel n = Beugungsordnung λ = Wellenlänge der Röntgenstrahlen Nur wenn Gleichung (2.1) erfüllt ist, tritt positive Interferenz ein und das Beugungsbild kann beobachtet werden. 2.2 Röntgenpulverdiffraktometrie Die in der vorliegenden Arbeit zur Überprüfung der Reinheit der Produkte angefertigten Pulverdiffraktogramme wurden mit einem Transmissionsdiffraktometer (Transmissionsdiffraktometer-System STADIP, Fa. STOE & CIE GmbH, Darmstadt) angefertigt. Der Aufbau des Gerätes entspricht dem des Debye-Scherrer-Verfahrens [29]. Der monochromatische Röntgenstrahl wird auf den Goniometerkreis fokussiert. In der Mitte des Goniometerkreises befindet sich die Substanz auf einem Flachbrettträger. Bei der Vermessung wird der Primärstrahl mit Hilfe eines Kollimators auf den Durchmesser des Flachbrettträgers eingegrenzt, wodurch man eine Minimierung der Untergrundstreuung erreicht. Die Intensitätsmessung der Reflexe erfolgt mit Hilfe eines ortsempfindlichen Proportionaldetektors (position sensitive detector, PSD). Die vom PSD gesammelten Daten werden digital erfasst und mit dem Programm Win XP OW (Fa. STOE & CIE GmbH, Darmstadt) ausgewertet. 2.3 Einkristallverfahren Zur röntgenographischen Charakterisierung von Einkristallen gibt es verschiedene Methoden, die sich bezüglich der Gerätegeometrie und des Informationsgehaltes der Ergebnisse stark unterscheiden. Die Kristalle sollten im Allgemeinen eine Kantenlänge zwischen 0,03 mm und 1,00 mm haben und während der Aufnahme eine definierte Orientierung zum Röntgenstrahl einnehmen. Durch Messung der Reflexlagen und intensitäten eines Einkristalls wird eine Strukturlösung ermöglicht, die zu einem Strukturmodell führt. Die anschließende Verfeinerung nach der Methode der kleinsten Feh- 8 2 Röntgenstrukturanalyse lerquadrate (least-sqares-Methode) liefert schließlich ein optimiertes Strukturmodell die Kristallstruktur. 2.3.1 Einkristalldiffraktometrie mit einem IPDS Bei dem verwendeten einkreisigen Imaging-Plate-Diffraction-System (IPDS, Fa. STOE, Darmstadt) handelt es sich um einen Röntgen-Flächendetektor. Während bei der Eulerwiegengeometrie die Reflexe einzeln in Reflektionsstellung gefahren und vermessen werden, ähnelt die Aufnahmetechnik beim IPDS den Drehkristall-Aufnahmetechniken. Alle im eingestellten ω-Winkelbereich erfassten Röntgenquanten werden gleichzeitig auf der „imaging plate“, einer mit Europium(II) dotierten BaClF-Schicht, gespeichert. Das Auslesen der Reflexe und ihrer Intensität erfolgt durch Laserabtastung der vorher aktivierten Farbzentren. Der Rohdatensatz kann dann einer numerischen Absorptionskorrektur unterzogen werden. 2.4 Rechenverfahren zur Kristallstrukturanalyse Zur Bestimmung der Atomanordnung innerhalb der Elementarzelle ist die Kenntnis des komplexen Strukturfaktors Fhkl notwendig: Fhkl = n fj e2πi(hxj +kyj +lzj ) = |Fhkl |eiφ = Fber (2.2) j=1 fj = Atomfaktor des j-ten Atoms hkl = xj , yj , zj = Koordinaten des j-ten Atoms φ = Phasenwinkel Fber = berechneter Fhkl Millersche Indizes Die Intensität der gebeugten Strahlung aber ist gemäß I ∼ |Fhkl |2 (2.3) dem Quadrat des Strukturfaktors proportional. Infolgedessen gibt das Experiment keine Auskunft über die Phasen der gestreuten Wellen (so genanntes „fundamentales Phasenproblem der Röntgenstrukturanalyse“). 9 2 Röntgenstrukturanalyse Unter Berücksichtigung der periodischen Anordnung der Atome im Kristallgitter lässt sich der Strukturfaktor über eine Elektronendichtefunktion beschreiben: Fhkl = ρ(x, y, z)e2πi(hx+ky+lz) dxdydz = Fbeob (2.4) V V = Elementarzellenvolumen ρ(x, y, z) = Elektronendichte am Ort xyz dxdydz = Volumenelement Fbeob = beobachteter Fhkl Durch Fourier-Transformation lässt sich Gleichung (2.4) nach der Elektronendichteverteilung, deren Maxima den gesuchten Atomlagen entsprechen, auflösen [30]: ρ(xyz) = +∞ +∞ +∞ 1 Fhkl e−2πi(hx+ky+lz) V h=−∞ k=−∞ l=−∞ (2.5) Durch Einsetzen der beobachteten Fhkl als Fourier-Koeffizienten lässt sich die Elektronendichte an jedem beliebigen Punkt berechnen. Da die Reihe der Summanden in Gleichung (2.5) unendlich ist, aber nur eine begrenzte Anzahl von Reflexen erfasst wird und so für die Rechnung zur Verfügung steht, bricht die Summation im endlichen Bereich ab. Hieraus resultieren so genannte Abbrucheffekte, die sich in Form zusätzlicher Maxima in der Elektronendichteverteilung bemerkbar machen. Bei Kenntnis erster Atomlagen können weitere Atomlagen durch Differenzfouriersynthesen bestimmt werden. Als Fourier-Koeffizienten werden die Differenzen aus gefundenen (Fbeob ) und berechneten (Fber ) Fhkl eingesetzt. Auf diese Weise kann nach und nach die komplette Struktur ermittelt werden. Für eine Fourier-Synthese müssten jedoch die Fhkl -Werte mit Phasenwinkeln (s. Gl. (2.2)) zur Verfügung stehen. Das Experiment lässt aber keine Bestimmung der Phasenwinkel zu und daher ist die Lösung von Gleichung (2.5) nicht unmittelbar möglich. Wege zur Lösung dieses Problems sollen im Folgenden aufgezeigt werden. 10 2 Röntgenstrukturanalyse 2.4.1 Patterson-Synthese Mit Hilfe einer Patterson-Synthese gelingt es, ohne Kenntnis der Phasen der Fhkl Werte Aussagen über eine Kristallstruktur zu treffen. Nach Patterson [31] und Harker [32] ist eine Fourier-Reihe (Gl. (2.5)) definiert, in der die aus der Messung zugänglichen Quadrate der Strukturamplituden |Fhkl | als Fourier-Koeffizienten eingesetzt werden. Die Patterson-Funktion zeigt Maxima an den Endpunkten von Abstandsvektoren zwischen Atomschwerpunkten, aus denen in vielen Fällen die Lagen schwerer Atome bestimmt werden können. 2.4.2 Direkte Methoden Das Prinzip der direkten Methoden beruht auf vorwiegend statistischen Überlegungen, die von bestimmten Beziehungen zwischen den Phasenwinkeln der Strukturamplituden ausgehen. Zur Lösung des Phasenproblems wird eine Beziehung nach Sayre [33] verwendet, die für eine zentrosymmetrische Struktur die Phasen dreier Reflexe ausreichend hoher Intensität miteinander verknüpft: Shkl = Sh k l Sh−h k−k l−l (2.6) S = Vorzeichen von Fhkl Ausgehend von vorgegebenen Startphasen sind anhand der „Sayre-Beziehung“ die Phasen weiterer Strukturfaktoren berechenbar. Man erhält mehrere Lösungsvorschläge, von denen der wahrscheinlichste einer Fourier-Synthese unterworfen wird, aus deren Maxima auf die ungefähren Atomlagen geschlossen werden kann. 2.4.3 Korrekturen Für die Intensität gebeugter Röntgenstrahlen sind neben der Besetzung der reflektierenden Netzebenen eine Reihe weiterer Faktoren ursächlich. Polarisationsfaktor: Die Beugung an einer Netzebene führt zu einer partiellen Polarisierung und damit zu einem Intensitätsverlust der Röntgenstrahlung. Der Grad der Abschwächung ist 11 2 Röntgenstrukturanalyse abhängig vom Beugungswinkel θ und wird als Polarisationsfaktor P bezeichnet. Da bereits die Monochromatisierung der Strahlung mit einem Kristall erfolgt, muss auch dessen Polarisationseffekt berücksichtigt werden. Lorenz-Faktor: Während der Drehung des Kristalls kommt es zu unterschiedlichen Verweilzeiten der Netzebenen in Reflektionsstellung, was zu Abstufungen in den verschiedenen Reflexintensitäten führt. Diese werden mit Hilfe des Lorenz-Faktors korrigiert, dessen Form von der Art des verwendeten Messverfahrens abhängt. Absorption: Sowohl der Primär- als auch der gebeugte Röntgenstrahl erfahren auf dem Weg durch den Kristall aufgrund von Ionisationsprozessen und Compton-Streuung einen Intensitätsverlust. Für die Abhängigkeit der Intensität Is von der Weglänge s gilt: Is = I0 e−µ·s (2.7) Der als linearer Absorptionskoeffizient µ bezeichnete Abschwächungsfaktor ist bei bekannter chemischer Zusammensetzung für jede Substanz berechenbar und ergibt sich bei bekannter Materialdichte ρ aus der Summe der Massenabsorptionskoeffizienten µ/ρ. Hierbei stellt (µ/ρ)i einen für jede Atomsorte i spezifischen, wellenlängenabhängigen Wert dar [34]: µ=ρ i xi µ xi ρ i (2.8) = Molenbruch der Atomsorte i Temperaturfaktor: Die Schwingungsellipsoide der Atome sollten eine physikalisch sinnvolle Form besitzen. Die beobachteten Reflexintensitäten werden durch die thermischen Schwingungen der Atome um ihre Ruhelage beeinflusst und müssen dementsprechend bei Berechnung des Strukturfaktors Fber (Gl. (2.2)) berücksichtigt werden. Nach Debye [38] und Waller [39] werden daher die Atomfaktoren f mit einem Exponentialterm, dem Temperaturfaktor T, multipliziert. Hierbei wird Tiso zur Beschreibung isotroper bzw. Taniso 12 2 Röntgenstrukturanalyse zur Beschreibung anisotroper Schwingungen verwendet. Die in diesen Faktoren enthaltenen Koeffizienten werden auch Auslenkungsparameter genannt. Im Fall isotroper Schwingungen resultiert der folgende Ausdruck für den effektiven Atomformfaktor f ’: f = f Tiso = f e−B sin2 θ λ2 θ = Beugungswinkel λ = Wellenlänge der verwendeten Strahlung B = (2.9) Debye-Waller-Faktor Diese Gleichung ist jedoch nur für isotrope Auslenkungen der Atome gültig und wird lediglich im Anfangsstadium der Strukturrechnungen in Form isotroper Auslenkungsparameter Uiso verwendet, die mit B in folgender Weise verknüpft sind: Uiso = B 8π 2 (2.10) Gegen Ende der Strukturverfeinerung können anisotrope Temperaturfaktoren Taniso mit den anisotropen Auslenkungsparametern Uij eingesetzt werden, die die tatsächlichen Schwingungsverhältnisse der Atome besser beschreiben: Taniso = e−2π 2 (U h2 a∗ a∗ +U k 2 b∗ b∗ +U l2 c∗ c∗ +2U klb∗ c∗ +2U hla∗ c∗ +2U hka∗ b∗ ) 11 22 33 23 13 12 (2.11) Die Koeffizienten Uij des anisotropen Temperaturfaktors Taniso sind Komponenten eines symmetrischen Tensors zweiter Stufe, der die Orientierung und Auslenkung der sich ergebenden Schwingungsellipsoide beschreibt. Neben den isotropen und anisotropen Auslenkungsparametern Uiso bzw. Uij werden häufig äquivalente isotrope Auslenkungsparameter Uäq verwendet, die aus den anisotropen Parametern berechnet werden und im Allgemeinen wie folgt definiert sind [40]: Uäq 1 = U11 (aa∗ )2 + U22 (bb∗ )2 + U33 (cc∗ )2 + 2U12 aba∗ b∗ cos γ 3 ∗ ∗ ∗ ∗ +2U13 aca c cos β + 2U23 bcb c cos α (2.12) 13 2 Röntgenstrukturanalyse Typische Werte von Uij liegen bei Raumtemperatur in anorganischen Festkörperstrukturen bei 50 bis 200 pm2 für schwere Atome bzw. bei 1000 bis 2000 pm2 für leichte Atome. 2.4.4 Gütefaktoren der Strukturbestimmung Die Übereinstimmung beobachteter und berechneter Strukturfaktoren ist ein Maß für die Güte einer Strukturbestimmung. Neben den Standardabweichungen, die möglichst klein sein sollten, sind so genannte R-Werte („residuals“ oder Zuverlässigkeitsfaktoren) definiert [41]. Je kleiner die R-Werte, desto größer ist die Übereinstimmung zwischen Modell und Realstruktur. Der konventionelle R-Wert R1 gibt die mittlere Abweichung zwischen beobachteten (|Fbeob |) und berechneten (|Fber |) Strukturamplituden an [27]: R1 = ||Fbeob | hkl − |Fber || hkl |Fbeob | (2.13) In jüngerer Zeit, insbesondere seit der Einführung des Programmsystems SHELXL 2 93 [42] zur Lösung von Kristallstrukturen, setzte sich jedoch die Verfeinerung an Fbeob Daten, also den direkt gemessenen Intensitäten, durch. Der Vorteil dieser Verfeinerungsmethode besteht in der Möglichkeit, alle gemessenen Daten, einschließlich negativer Intensitätswerte, zur Verfeinerung heranzuziehen, ohne einen systematischen Fehler in 2 -Daten durch kleiden Datensatz einzubringen, z. B. durch Ersatz der negativen Fbeob ne positive Werte oder Unterdrückung der negativen Reflexe durch Einführung einer σ-Schranke. Ein entsprechender R-Wert, der die Abweichung von beobachteten und berechneten F 2 -Werten beschreibt, ist durch die Ziffer 2 gekennzeichnet (R2 ). In der Regel wird jedoch der so genannte gewichtete R-Wert wR2 angegeben, bei dem direkt die bei der Verfeinerung minimalisierten Fehlerquadratsummen eingehen: 2 2 2 w(Fbeob − Fber ) hkl wR2 = w(F 2 )2 (2.14) beob hkl 14 2 Röntgenstrukturanalyse Die Wichtungsfunktion w ist dabei im Programmsystem SHELXL - 97 wie folgt definiert [27, 32]: w= 1 + (aP )2 + bP (2.15) 2 2 + M ax(0, Fbeob ) 2Fber 3 (2.16) 2 σ 2 (Fbeob ) mit P = Die Parameter a und b werden so angepasst, dass möglichst eine Gleichverteilung der Varianzen (gewichtete Fehlerquadrate) über die verschiedenen Beugungswinkel und Intensitätsbereiche erreicht wird. Im Vergleich zum ungewichteten R-Wert ist wR2 der wichtigere Zuverlässigkeitsfaktor, da er empfindlicher auf kleine Fehler im Strukturmodell reagiert. Aus seinen Bewegungen während eines Verfeinerungszyklus kann entschieden werden, ob eine Änderung im Strukturmodell sinnvoll ist. Bei einem guten Datensatz und einer unproblematischen Struktur sollten wR2 -Werte von unter 15 % und R1 -Werte von unter 5 % erreicht werden. Ein weiterer Gütefaktor ist der allein auf F 2 -Daten basierende so genannte Goodness of Fit GooF. Bei richtiger Struktur und korrekter Wichtung sollte er Werte um 1 annehmen. 2 2 2 w(Fbeob − Fber ) hkl GooF = S = n−p (2.17) n = Zahl der Reflexe p = Zahl der verfeinerten Parameter Neben den Gütefaktoren sind noch einige weitere Dinge bei der Strukturverfeinerung wichtig: • Die Verfeinerung sollte konvergieren, d.h. die Differenz eines Parameterwertes (∆) zwischen zwei Iterationszyklen sollte gegen Null gehen. Die absolute Differenz wird im Allgemeinen durch die Standardabweichung σ geteilt(|∆|/σ). 15 2 Röntgenstrukturanalyse • Die Standardabweichung der Atomlagen sollten möglichst klein sein. • In einer abschließenden Differenzfouriersynthese sollte keine signifikanten Restelektronendichten mehr auftreten. In Leichtatomstrukturen betragen Maxima und Minima dann höchstens noch ± (0,2 - 0,3) · 10−6 e/pm3 . Bei schweren Atomen findet man erfahrungsgemäß noch Restmaxima bis ca. 10 % ihrer Elektronenzahl im Abstand von 60 bis 120 pm. • Die Schwingungsellipsoide der Atome sollten eine physikalisch sinnvolle Form haben. 2.5 Rechenprogramme Zur röntgenographischen Charakterisierung der hergestellten Produkte wurden die folgenden Computerprogramme verwendet: Win XP OW [43] R -Programmpaket zur Steuerung des PulverdiffrakWindows tometers STADIP Fa. STOE &CIE GmbH, Darmstadt), sowie zur Indizierung und Simulation von Pulverdiffraktogrammen. Win GX [44] Programmpaket mit MS Windows-Programmen zur Lösung, Verfeinerung und Analyse von röntgenographischen Einkristalldaten. SHELXS-97 [45] Programmsystem zur Lösung von Kristallstrukturen mit Hilfe Direkter Methoden und Patterson-Synthese. SHELXL-97 [37] Programmsystem mit zur Lösung von Kristallstrukturen Full-Matrix-Least-Squares-Verfeinerung, Fourier- bzw. Differenzfouriersynthesen. DIAMOND 2.1c [46] Programm zur graphischen Darstellung von Kristallstrukturen aus Strukturdaten. X-SHAPE [47] Programm zur numerischen Absorptionskorrektur. X-RED [47] Programm zur Erzeugung von Eingabedateien für X-SHAPE. 16 3 Magnetische Eigenschaften 3 Magnetische Eigenschaften Die magnetischen Eigenschaften eines Stoffes sind ein direktes Abbild seines elektronischen Grundzustandes. Das magnetische Verhalten des Stoffes wird dabei durch die magnetische Suszeptibilität charakterisiert. Zur Klärung chemischer Strukturfragen [48, 49], z. B. bei der Bestimmung der Valenz von Atomen in gemischtvalenten Verbindungen [3] sowie bei der Interpretation von Phasenübergängen in Festkörpern [50], erlangen magnetische Suszeptibilitätsmessungen und deren Interpretation zunehmend an Bedeutung. 3.1 Grundbegriffe Die magnetischen Eigenschaften der in dieser Arbeit diskutierten Verbindungen werden unter Verwendung des nichtrationalen CGS-emu-Systems (centimètre gramme second; electromagnetic unit) beschrieben. Tabelle 3.1 gibt die wichtigsten magnetischen Größen, ihre Symbole und Einheiten wieder. Wenn eine Probe einem äußeren Magnetfeld H ausgesetzt wird, so ergibt sich die magnetische Induktion B in der Probe aus H und einem Beitrag 4πM, der von der Probe selbst herrührt: B = H + 4πM (3.1) M stellt dabei die Magnetisierung dar. Über das Verhältnis von magnetischer Flussdichte und Feldstärke (magnetische Permeabilität) wird die magnetische Volumensuszeptibilität χ betragsmäßig folgendermaßen definiert: M B = 1 + 4π = 1 + 4πχ H H (3.2) 17 3 Magnetische Eigenschaften Tabelle 3.1: Magnetische Größen mit ihren CGS-Einheiten Größe Symbol CGS-Einheit Magnetische Feldstärke H Oe (Oersted) Magnetische Flussdichte (magnetische Induktion) B G (Gauß) Magnetisierung M G molare Magnetisierung Mm G cm3 ·mol−1 magnetisches Diplolmoment m G·cm3 Volumensuszeptibilität χ dimensionslos Molsuszeptibilität χm cm3 · mol−1 effektive Bohr-Magnetonzahl µef f dimensionslos Die magnetische Suszeptibilität eines Stoffes wird in der Regel nicht bezüglich seines Volumens, sondern bezüglich seiner molekularen Masse angegeben. Die so genannte Molsuszeptibilität ist dann wie folgt definiert: χm = χ · Mmol ρ (3.3) Mmol entspricht der molekularen Masse [g·mol−1 ] und ρ der Dichte [g·cm−3 ] der betreffenden Verbindung. Die auf Kraftwirkungen beruhenden Messmethoden zur Bestimmung der magnetischen Suszeptibilität fanden breite Anwendung. Zu nennen seien hier die Methoden nach Gouy [51], Quinke [52, 53] und Faraday-Curie [54–57]. Bei diesen wird mit einer Waage die Kraft gemessen, mit der die zu untersuchende Probe in ein Magnetfeld hineingezogen bzw. herausgedrückt wird. Weiter seien die Induktionsmethoden nach Broersma [58] und Foner [59] erwähnt. Für die in dieser Arbeit durchgeführten Messungen wurde ein SQUID-Magnetometer [60, 61] verwendet. 3.2 Magnetische Eigenschaften der Materie Die magnetischen Eigenschaften der Materie lassen sich aufgrund der Temperatur- und Magnetfeldstärkeabhängigkeit der magnetischen Suszeptibiliät χ in verschiedene Gruppen einteilen. 18 3 Magnetische Eigenschaften 3.2.1 Diamagnetismus χ ist weder von der Temperatur noch von der Magnetfeldstärke abhängig. Der Diamagnetismus ist eine allgemeine Eigenschaft der Materie. Er tritt bei allen Stoffen in Erscheinung, bei denen sich die magnetischen Felder der permanenten atomaren Kreisströme innerhalb jedes Atoms gegenseitig aufheben (Elektronenpaarung). Zusätzliche atomare Ringströme werden durch Induktion beim Einschalten des Magnetfeldes hervorgerufen. Die Richtung des induzierten Magnetfeldes ist der Stromrichtung in der Spule entgegengesetzt (Lenzsche Regel). Der Wert für χ ist daher negativ (χ<0). In inhomogenen Magnetfeldern erfahren diamagnetische Stoffe Kräfte in Richtung abnehmender Feldstärke. 3.2.2 Paramagnetismus χ ist temperaturabhängig und nahezu unabhängig von der Magnetfeldstärke. Die permanenten magnetischen Momente erfahren im Magnetfeld eine Ausrichtung derart, dass ihre Richtung mit der des felderzeugenden Spulenstroms übereinstimmt. Diese Ausrichtung erzeugt eine zusätzliche magnetische Induktion parallel zum angelegten Magnetfeld; der Wert für die Suszeptibilität χ ist daher positiv (χ>0). Paramagnetische Stoffe erfahren in inhomogenen Magnetfeldern Kräfte in Richtung wachsender Feldstärke. Häufig kann die Temperaturabhängigkeit der magnetischen Suszeptibilität durch das Curie-Gesetz beschrieben werden: χ= C = C T (3.4) Curie-Konstante T = absolute Temperatur Paramagnetisches Verhalten kann auf ungepaarte Elektronen zurückgeführt werden. Bei Lanthanidverbindungen kann oftmals die Anzahl der ungepaarten 4f-Elektronen 19 3 Magnetische Eigenschaften aus der gemessenen magnetischen Suszeptibilität über das im Folgenden beschriebene Verfahren ermittelt werden. Experimentell wird die so genannte effektive Bohr-Magnetonenzahl µef f bestimmt: (3.5) µef f,exp = 2, 828 χm T Ist der Russel-Saunders-Term 2S+1 LJ für den Grundzustand des entsprechenden Lanthanidions bekannt, so kann µef f unter Verwendung der Quantenzahlen S, L und J mit der Hundschen Formel µef f,theo = g J(J + 1) (3.6) bei bekanntem Landé-Faktor g g= 3 S(S + 1) − L(L + 1) + 2 2J(J + 1) (3.7) berechnet werden. 3.2.3 Ferromagnetismus, Ferrimagnetismus und Antiferromagnetismus χ ist temperatur- und feldstärkeabhängig. Dies ist immer der Fall, wenn die Wechselwirkung zwischen den magnetischen Momenten dominierend ist. Diese Wechselwirkung hat unterhalb einer Ordnungstemperatur eine spontane Ausrichtung aller Momente entweder parallel (Ferromagnetismus) oder antiparallel zueinander (Ferri- und Antiferromagnetismus) zur Folge. Komplizierte Spinstrukturen seien hier nicht erwähnt. Ferromagnetismus: Unterhalb einer bestimmten Temperatur TC , der ferromagnetischen Curie-Temperatur, sind alle permanenten magnetischen Momente weitgehend parallel ausgerichtet. Oberhalb von TC folgt die Suszeptibilität der Beziehung χ= C T − ΘC (3.8) 20 3 Magnetische Eigenschaften ΘC = paramagnetische Curie-Temperatur und zeigt paramagnetisches Verhalten an. Eisen, Cobalt und Nickel sind klassische Beispiele für ferromagnetische Stoffe. Ferrimagnetismus: Die permanenten magnetischen Momente sind paarweise entgegengesetzt ausgerichtet und von verschiedener Größe. Es verbleibt eine resultierende spontane Magnetisierung. Einige Beispiele für ferrimagnetische Stoffe sind: Ferrite (MFe2 O4 , M = Fe2+ , Ni2+ , etc. ), Lanthanid-Eisen-Granate (Ln3 Fe5 O12 ) sowie Lanthanid-Perowskite (LnMO3 , M = dreiwertige Metallkationen). Die starke Temperatur- und Feldstärkeabhängigkeit ähnelt der des Ferromagnetismus. Antiferromagnetismus: Die permanenten magnetischen Momente unterliegen unterhalb einer bestimmten Temperatur TN , der antiferromagnetischen Néel-Temperatur, einer antiparallelen Ausrichtung. MnO und MnF2 sind Beispiele für antiferromagnetische Stoffe. Oberhalb von TN gehorcht die Suszeptibilität der folgenden Beziehung: χ= ΘN C T − ΘN (3.9) = paramagnetische Néel-Temperatur Sie zeigt paramagnetisches Verhalten an. Unterhalb von TN sinkt der Wert für χ mit fallender Temperatur. 3.3 Interpretation der magnetischen Suszeptibilitätsmessungen Die Temperaturabhängigkeit der paramagnetischen Suszeptibilität lässt sich im einfachsten Falle durch das Curie-Gesetz (vgl. Gleichung (3.4)) beschreiben. Wäre dieses Gesetz streng gültig, so müsste die effektive Bohr-Magnetonzahl µef f temperaturunabhängig sein. Im allgemeinen Fall ist µef f aber temperaturabhängig, d. h. das Curiesche 21 3 Magnetische Eigenschaften Gesetz ist nur eine Näherung für das temperaturabhängige magnetische Verhalten von paramagnetischen Stoffen. Es gibt mehrere physikalische Phänomene, die die Abweichung von dem Curieschen Gesetz begründen können. Diese werden im Folgenden kurz angesprochen. Ligandenfeldeffekte: Die Liganden eines Komplexes beeinflussen den energetischen Grundzustand des Zentralions. Die Symmetrie des Ligandenfeldes führt dabei zu einer Energieaufspaltung, deren Größe durch Art und Anzahl der Liganden, dem Abstand von Liganden zum Zentralteilchen und der Art des Zentralteilchens bestimmt wird. Während der Symmetrieaspekt durch die Kristallfeldtheorie von Bethe [62] vollständig verstanden ist, stellt die Vorhersage der durch das Ligandenfeld bewirkten Energieaufspaltung bei Vorgabe eines bestimmten Metall-Liganden-Systems auch heute noch ein großes Problem dar [63]. In der vorliegenden Arbeit brauchten Einflüsse des Ligandenfeldes nicht berücksichtigt zu werden, da das untersuchte Metallkation Gd3+ einen kugelsymmetrischen S-Grundzustand hat. Neben Gd3+ haben z. B. auch Eu2+ , Fe3+ und Mn2+ einen elektronischen S-Grundzustand. Sättigungseffekte: Wenn bei Messungen im Tieftemperaturbereich die Stärke des äußeren Magnetfeldes in der Größenordnung der thermischen Energie liegt, stellt man fest, dass die Suszeptibilitätswerte mit steigendem Feld kleiner werden. In dem einfachen Fall, dass das magnetische Verhalten allein durch das Grundmultiplett bestimmt wird, lässt sich der Verlauf der Magnetisierung durch die Brillouin-Funktion [64] beschreiben: ∞ · BJ (α) Mm = M m Mm = Molmagnetisierung M∞ m = maximal mögliche Molmagnetisierung (3.10) mit 2J + 1 BJ (α) = coth 2J 1 2J + 1 α coth α − 2J 2J 2J (3.11) 22 3 Magnetische Eigenschaften wobei α= JgJ BµB , kB T χB = eh 4πme und ∞ Mm = NA JgJ µB NA = Avogadro-Konstante kB = Bolzmann-Konstante J = Gesamtdrehimpulsquantenzahl µB = e = Elementarladung me = Elektronenmasse h = sind. Bohr-Magneton Plancksche Konstante Kooperative magnetische Effekte: Die Wechselwirkungen zwischen zwei paramagnetischen Zentren beruhen sowohl auf magnetischen Dipol-Dipol-Wechselwirkungen (MDD) [65] als auch auf Austauschwechselwirkungen [66] elektronischer Natur. Die MDD-Wechselwirkung wird durch das auf einen Dipol wirkende Magnetfeld eines anderen hervorgerufen. Die Austauschwechselwirkung ist vergleichbar mit der Wechselwirkung zwischen Elektronen des gleichen Atoms (vergleichbar mit der Russel-Saunders-Aufspaltung). Die Austauschwechselwirkung ist im Allgemeinen stärker als die MDD-Wechselwirkung. Beide Wechselwirkungen sind aber von dem Abstand der interagierenden Zentren abhängig, wobei die Austauschwechselwirkung mit zunehmenden Abstand stärker abnimmt als die MDDWechselwirkung. Da zur Parametrisierung der kooperativen magnetischen Effekte keine einheitliche Theorie existiert, ist man auf Modellvorstellungen angewiesen, die in der Regel nur auf spezielle Situationen anwendbar sind. Im Folgenden wird das in der vorliegenden Arbeit verwandte Modell der Austauschwechselwirkung (Spin-SpinAustauschkopplung) in einer dinuklearen Einheit vorgestellt. 3.3.1 Dinukleare Einheit Im einfachsten Fall wird eine austauschgekoppelte homodinukleare Einheit aus zwei magnetischen Zentren (1 und 2) mit den Spinquantenzahlen S1 = S2 = 1/2 im Heisenberg-Modell [67] betrachtet. Hierdurch lässt sich die Suszeptibilitätsgleichung auf 23 3 Magnetische Eigenschaften die sog. Bleaney-Bowers-Gleichung [68] reduzieren. Im allgemeinen Fall einer polynuklearen Einheit aus n äquivalenten Zentren ergibt sich für die Molsuszeptibilität [64]: χm = NA µ2B 2 g 3kB T n S − S (S + 1)(2S + 1)Ω(S )e E(S ) − kB T (2S + 1)Ω(S )e E(S ) kB T (3.12) S mit z · Jex E(S ) = − S (S + 1) − nS(S + 1) n−1 und Ω(S ) = ω(S ) − ω(S + 1) S’ = Spinquantenzahl der gekoppelten Zustände n = Anzahl der in Wechselwirkung stehenden Zentren z = Zahl der nächsten Nachbarn eines Zentrums Jex = Austauschparameter (Hälfte der Energiedifferenz zwischen Singulett- und Triplett-Zustand) Ω(S’) = Häufigkeit, mit der ein Zustand S’ vorkommt ω(S’) = Koeffizient von XS in der Entwicklung (xS +xS−1 +...+x−S )n Eine dinukleare Einheit mit S1 = S2 = 7/2 (Gd3+ –Gd3+ ) lässt sich somit wie folgt beschreiben: χm = NA µ2B g 2 e2x + 5e6x + 14e12x + 30e20x + 55e30x + 91e142x + 140e56x kB T 1 + 3e2x + 5e6x + 7e12x + 9e20x + 11e30x + 13e42x + 15e56x (3.13) mit x= Jex kB T Das Vorzeichen von Jex gibt hierbei die Art der Wechselwirkung an. Bei Jex >0 handelt es sich um eine ferromagnetische, bei Jex <0 um eine antiferromagnetische Wechselwirkung. 3.3.2 Das Korrekturprogramm DANSY Bei der Messung mit dem SQUID-Magnetometer wird das magnetische Moment m einer Probe erfasst. Die Rohdatenausgabe erfolgt in Einheiten von emu (electromagnetic unit 24 3 Magnetische Eigenschaften = cm3 Oe). Die Berechnung korrigierter Suszeptibilitätsdaten χg und χm sowie der effektiven Bohr-Magnetonzahl µef f in Einheiten des nichtrationalen CGS-emu-Systems (vgl. Tabelle 3.1) erfolgt mit dem Programm DANSY [69]. Dieses Programm ermöglicht eine diamagnetische Korrektur des Leerköchers durch Anwendung einer allgemein gültigen, empirisch ermittelten Korrekturfunktion. Der diamagnetische Beitrag, der die Verbindung aufbauenden Ionen, wird durch tabellierte Werte nach Haberditzl [70] berücksichtigt. 25 4 Das SQUID-Magnetometer 4 Das SQUID-Magnetometer Die magnetischen Messungen der im Rahmen dieser Arbeit dargestellten Verbindungen wurden mit einem SQUID-Magnetometer (Superconducting Quantum Interference Device; Gerät: MPMS 5, Fa. Quantum Design, San Diego, USA) im Temperaturintervall von 1,75 K bis 250 K und bei magnetischen Feldstärken (H ) von 0,5 kOe und 1 kOe vorgenommen. 4.1 Messprinzip Die Detektorspulen (Flusstransformator) werden zum Zeitpunkt der Messpunktaufnahme von einem homogenen äußeren Magnetfeld durchsetzt. Das angelegte Magnetfeld induziert im Flusstransformator einen Abschirmstrom, der entsprechend der Lenzschen Regel so gerichtet ist, dass er das ursprüngliche Feld kompensiert. Das durch die supraleitende Magnetspule (Solenoid) erzeugte Magnetfeld hat weiterhin eine Magnetisierung der Probe zur Folge. Das Feld der Probe ist entweder parallel (paramagnetische Probe) oder antiparallel (diamagnetische Probe) zum äußeren Feld gerichtet. Im sensiblen Bereich des Flusstransformators werden infolge des Störfeldes der Probe durch das Eindringen von magnetischem Fluss in einem bestimmten Bereich der Spule zusätzliche Abschirmströme induziert, die je nach Richtung des Störfeldes den ursprünglichen Induktionsstrom verstärken oder abschwächen. Da der Gesamtfluss in der supraleitenden Schleife konstant bleiben muss, treten in anderen Regionen der Spule entsprechende Flussvariationen auf. Die Kombination von zwei entgegengesetzt gewickelten Detektorspulen (Abbildung 4.1) erlaubt mit dem Flusstransformator die Bestimmung des Magnetfeldgradienten. Inso- 26 4 Das SQUID-Magnetometer Abbildung 4.1: Schematischer Aufbau der supraleitenden Detektorspulen, Sensoren und Signalübertragungselemente im SQUID-Magnetometer. fern wird die beschriebene Anordnung auch als Gradiometer bezeichnet. Der Isolationstransformator ermöglicht eine Trennung zwischen den abgegriffenen Spannungssignalen in den Detektorspulen und dem Stromkreislauf im eigentlichen SQUIDSystem. Nach jedem Messvorgang erfolgt durch Temperaturerhöhung oberhalb der kritischen Temperatur TC des Supraleiters ein erneuter Nullabgleich. Die gemessene Spannung ist ein Maß für die Feldänderung in dem Flusstransformator und wird auf die Signalspule des SQUID-Sensors übertragen. Der Sensor ist aus einem supraleitenden Ring mit einem Bereich schwacher Kopplung („weak link“), der durch zwei parallele Josephson-Kontake (Isolierschicht aus z. B. Al2 O3 oder normalleitendem NbO) realisiert ist, aufgebaut [71] (vgl. Abbildung 4.2). 27 4 Das SQUID-Magnetometer m ag ne tis Jb s Feld H Ja che Jges Isolator a Isolator b Abbildung 4.2: Schematischer Aufbau des SQUID-Sensors. 4.2 Probenvorbereitung Die Kristalle werden in einem Achatmörser zerrieben. Dieses Pulver wird danach in eine Gelantinekapsel (4 mm Durchmesser, 10 mm Höhe) eingewogen. Die Fixierung des Pulvers kommt durch Anpressen mit einer weiteren kleinen Kapsel zustande. Während der gesamten Präparation ist darauf zu achten, dass die Probe nur mit Aluminium-, Glas-, oder Kunststoffspateln in Kontakt kommt, um die Messung nicht durch Verunreinigungen mit para- oder ferromagnetischen Substanzen zu verfälschen. Die Fixierung der Kapsel in einem konventionellen Kunststoffhalm erfolgt mit zwei R Baumwollfäden. Der Halm wird am unteren Ende des Probenstabes mit tesafilm befestigt und durch eine mehrmals evakuierte und mit Helium gespülte Schleuse in den Probenraum des Magnetometers eingeführt. 4.3 Justierung und Messung Zur Feinjustierung der Probe in der Mitte des Detektors wird der Probenstab mehrere Male durch die Detektorspule gezogen und die abgegriffene Spannung in Abhängigkeit vom Ort gemessen. Die Probe ist in den Spulen ideal positioniert, wenn sich das Maximum der detektierten Spannung im Ordinatenursprung befindet. Ist die Probe nicht optimal justiert, kann die Differenz des Maximums zum Ursprung abgeschätzt und mittels Schrittmotor korrigiert werden. 28 4 Das SQUID-Magnetometer Die Steuerung der Messung erfolgt nach Eingabe einer Messsequenz automatisch über den angeschlossenen Computer (HP-Vectra-Computer). 4.4 Datenausgabe Die Ausgabe der Rohdaten erfolgt in Einheiten von emu und muss bezüglich der Matrix aus Kunststoffhalm, Baumwollfaden und Gelantinekapsel korrigiert werden. Das Moment der Matrix wird in Form von Leermessungen bestimmt. Die Aufarbeitung dieser Rohdaten erfolgt mit dem Programm DANSY (vgl. Kapitel 3.3.2). Als Ergebnis liefert DANSY die korrigierten Werte für µef f , χg , χm und 1/χm in Einheiten des nichtrationalen CGS-emu-Systems. 29 5 Edukte 5 Edukte Zur Durchführung der Synthesen wurden die in Tabelle 5.1 aufgeführten, handelsüblichen Chemikalien verwendet. Tabelle 5.1: Verwendete Ausgangssubstanzen Substanz Hersteller Reinheit Gadoliniumsesquioxid Strem Chemicals, Newbury-Port, USA 99,99 % Difluoressigsäure Sigma-Aldrich Chemie GmbH, Steinheim 98 % Chlordifluoressigsäure Sigma-Aldrich Chemie GmbH, Steinheim 98 % Ethanol Sigma-Aldrich Laborchemikalien GmbH, Seelze 99,8 % 1,10-Phenanthrolin Sigma-Aldrich Chemie GmbH, Steinheim 99 % 30 6 Präparativer Teil 6 Präparativer Teil Ziel der präparativen Arbeiten war die einkristalline Darstellung von komplexen Gadoliniumcarboxylaten mit 1,10-Phenanthrolin (phen) als stickstoffhaltigem aromatischen Ligand. In den Formeln der Verbindungen wird im Folgenden 1,10-Phenanthrolin als C12 N2 H8 angegeben. Zur Synthese der Verbindungen des Typs Gdn (CXF2 COO)p (phen)q (H2 O)r ·yS (X = Cl, H; S (Solvens) = C2 H5 OH/H2 O, H2 O) wurde das entsprechende Gadoliniumcarboxylat mit 1,10-Phenanthrolin in einer Lösung aus gleichen Teilen Ethanol und Wasser bei Raumtemperatur umgesetzt. Zur Darstellung der eingesetzten Gadoliniumcarboxylate wurde entsprechend einer Vorschrift von Rohde [18] Gadoliniumsesquioxid (Gd2 O3 )(2 mmol) zu einer wässrigen Lösung (5 mL H2 O) der jeweiligen Halogenessigsäure (6 mmol) gegeben. Die dabei entstandenen Suspensionen wurden in einem Wasserbad bei etwa 80 ◦ C bis zur Auflösung des Feststoffes erhitzt. Aus den Lösungen wurden nach etwa zwei bis drei Wochen klare, farblose Kristalle des jeweiligen Gadoliniumcarboxylates erhalten. Es wurden folgende neue Carboxylate der Lanthanide mit 1,10-Phenanthrolin synthetisiert: Gd4 (CClF2 COO)12 (C12 N2 H8 )6 (H2 O)4 ·2C2 H5 OH·H2 O, Gd(CClF2 COO)3 (C12 N2 H8 )2 (H2 O)2 , Gd(CClF2 COO)3 (C12 N2 H8 )(H2 O) und Gd(CF2 HCOO)3 (C12 N2 H8 ). 31 6 Präparativer Teil 6.1 Darstellung von Gd4(CClF2COO)12(C12N2H8)6(H2O)4·2C2H5OH ·H2O 0,17 mmol Gd(CClF2 COO)3 (H2 O)3 wurden mit 0,17 mmol 1,10-Phenanthrolin (Molverhältnis Gd/phen 1:1) in etwa 2 mL einer Lösung aus Ethanol und Wasser (1:1) unter Rühren bei Raumtemperatur gelöst. Aus dieser Lösung fiel Gd4 (CClF2 COO)12 (C12 N2 H8 )6 (H2 O)4 ·2C2 H5 OH·H2 O durch langsame Verdunstung der Lösungsmittel bei Raumtemperatur nach wenigen Tagen in Form von klaren, farblosen Kristallen aus. Das Pulverdiffraktogramm des so synthetisierten Carboxylats ist in Anhang A.1 wiedergegeben. Das berechnete Diffraktogramm basiert auf röntgenographischen Einkristalldaten der Verbindung (Kapitel 7). Der zusätzlich beobachtete Reflex R bei der Probenpräpaim niederen Thetabereich ist auf die Verwendung von tesafilm ration zurückzuführen. Dies trifft auch für die anderen in Anhang A wiedergegebenen Pulverdiffraktogramme zu. 6.2 Darstellung von Gd(CClF2COO)3(C12N2H8)2(H2O)2 0,17 mmol Gd(CClF2 COO)3 (H2 O)3 wurden mit 0,34 mmol 1,10-Phenanthrolin (Molverhältnis Gd/phen 1:2) in etwa 3 mL einer Lösung aus Ethanol und Wasser (1:1) unter Rühren bei Raumtemperatur gelöst. Nach wenigen Tagen fiel Gd(CClF2 COO)3 (C12 N2 H8 )2 (H2 O)2 in Form von klaren, farblosen Kristallen aus. Das Pulverdiffraktogramm des so erhaltenen Produkts ist in Anhang A.2 gezeigt. Zur Berechnung des Diffraktogramms wurden die röntgenographischen Einkristalldaten der Verbindung (Kapitel 7) zugrunde gelegt. 32 6 Präparativer Teil 6.3 Darstellung von Gd(CClF2COO)3(C12N2H8)(H2O) 0,17 mmol Gd(CClF2 COO)3 (H2 O)3 wurden mit 0,04 mmol 1,10-Phenanthrolin (Molverhältnis Gd/phen 4:1) in etwa 2 mL einer Lösung aus Ethanol und Wasser (1:1) bei Raumtemperatur unter Rühren gelöst. Nach wenigen Tagen fiel aus dieser Lösung Gd(CClF2 COO)3 (C12 N2 H8 )(H2 O) durch langsame Verdunstung der Lösungsmittel bei Raumtemperatur in Form von klaren, farblosen Kristallen aus. In Anhang A.3 ist das Pulverdiffraktogramm der so synthetisierten Verbindung wiedergegeben. Die Berechnung des Diffraktogramms basiert auf röntgenographischen Einkristalldaten des Carboxylats (Kapitel 7). 6.4 Darstellung von Gd(CF2HCOO)3(C12N2H8) 0,17 mmol Gd(CF2 HCOO)3 (H2 O)2 ·H2 O wurden mit 0,10 mmol 1,10-Phenanthrolin (Molverhältnis Gd/phen 2:1) in etwa 2 mL einer Lösung aus Ethanol und Wasser (1:1) unter Rühren bei Raumtemperatur gelöst. Aus dieser Lösung fiel nach wenigen Tagen bei Raumtemperatur Gd(CF2 HCOO)3 (C12 N2 H8 ) in Form von klaren, farblosen Kristallen aus. In Anhang A.4 befindet sich das Pulverdiffraktogramm des so synthetisierten Produkts. Zur Berechnung des Diffraktogramms wurden die röntgenographischen Einkristalldaten der Verbindung (Kapitel 7) zugrunde gelegt. 33 7 Röntgenographische Untersuchungen 7 Röntgenographische Untersuchungen 7.1 Nummerierungskonzept in den synthetisierten Verbindungen Im Folgenden soll die in dieser Arbeit verwandte Nummerierung der Atome kurz am Beispiel von Gd(CClF2 COO)3 (C12 N2 H8 )2 (H2 O)2 erläutert werden (siehe Abbildung 7.1). • Die Gd3+ -Ionen werden aufwärts gezählt; einzelne Atome werden nicht nummeriert. • Die Sauerstoffatome einer Carboxylatgruppe werden von On1 bis On2 mit n = 1, 2, ... durchnummeriert. n gibt dabei die Nummer der zu benennenden Gruppe an. • Analog zu den Sauerstoffatomen werden die beiden Kohlenstoffatome benannt, wobei das Kohlenstoffatom, welches an die Sauerstoffatome gebunden ist, immer Cn1 ist. • Die Halogenatome an dem zweiten Kohlenstoffatom werden mit Fn1, Fn2 und Cln1 durchnummeriert bzw. das Wasserstoffatom mit Hn1. • Die Sauerstoffatome der Wassermoleküle werden mit O1W, O2W, ... bezeichnet. Analog dazu werden Ethanolatome mit dem Buchstaben E gekennzeichnet. • Ein 1,10-Phenanthrolinmolekül wird in der Form N1A, N2A, C1A, ..., C12A 34 7 Röntgenographische Untersuchungen durchdummeriert, wobei im Falle von mehreren 1,10-Phenanthrolinmolekülen alphabetisch fortgefahren wurde. Abbildung 7.1: Nummerierungskonzept der Atome und Ionen am Beispiel der Verbindung Gd(CClF2 COO)3 (C12 N2 H8 )2 (H2 O)2 . 7.2 Verknüpfungsmodi der Carboxylatgruppen in den komplexen Carboxylaten In dieser Arbeit wird nicht die häufig in der Literatur verwendete Hapto-Nomenklatur für die Metallion-Carboxylat-Bindung benutzt, sondern, der IUPAC (International Union of Pure and Applied Chemistry) folgend, die Kappa-Konvention. In komplexen Carboxylaten gibt es vier Verknüpfungsmodi der Carboxylatgruppen [72] (vgl. Abbildung 7.2). Sie können klassifiziert werden als: a) Monodentaler Verknüpfungsmodus: Das Lanthanidatom (Ln) ist nur an ein Carboxylatsauerstoffatom (O) koordiniert. 35 7 Röntgenographische Untersuchungen b) Bidentaler (µ2 –κ1 O:κ1 O’) [73] Verknüpfungsmodus: Zwei Lanthanidatome (Ln und Ln’) sind miteinander über einen Carboxylatliganden verbrückt. c) Chelatartiger Verknüpfungsmodus: Ein Lanthanidatom (Ln) ist zu jedem der Carboxylatsauerstoffatome (O und O’) koordiniert. d) Tridentaler (κ1 O:µ2 –κ2 O’) [73] Verknüpfungsmodus: Während ein Lanthanidatom (Ln) analog Modus c) an beide Carboxylatsauerstoffatome koordiniert, ist das zweite Lanthanidatom (Ln’) nur an ein Carboxylatsauerstoffatom (O’) gebunden. Abbildung 7.2: Verknüpfungsmodi der Carboxylatgruppen in komplexen Carboxylaten: a) monodentaler, b) bidentaler, c) chelatartiger und d) tridentaler Verknüpfungsmodus. 36 7 Röntgenographische Untersuchungen 7.3 Gd4(CClF2COO)12(C12N2H8)6(H2O)4·2C2H5OH ·H2O 7.3.1 Einkristallstrukturanalyse Zur Einkristallpräparation wurden Kristalle von Gd4 (CClF2 COO)12 (C12 N2 H8 )6 (H2 O)4 ·2C2 H5 OH·H2 O aus der Lösung auf ein Uhrglas überführt. Unter einem Mikroskop mit Polarisationsfilter wurden gut ausgebildete, optisch klare Einkristalle auf einen Glasfaden geklebt und auf einem Goniometerkopf befestigt. Die Messungen der Reflexintensitäten wurden gleich anschließend bei Raumtemperatur mit dem IPDS durchgeführt, da sich der Kristall innerhalb von wenigen Tagen wieder zersetzte. Unter der Voraussetzung, dass die Verbindung in der zentrosymmetrischen Raumgruppe P1̄ kristallisiert, wurden 46203 gemessene zu 11787 symmetrieunabhängigen Reflexen gemittelt und für die anschließende Strukturrechnung verwendet. Die Strukturbestimmung erfolgte mit Hilfe von Patterson-Synthesen und Differenzfourieranalysen. Die gewählte zentrosymmetrische Raumgruppe P1̄ erwies sich im Laufe der Strukturverfeinerung als richtig. Der interne R-Wert Rint , der die Güte der Datensätze beschreibt, betrug 10,31 %. Die Verfeinerung in der Raumgruppe P1̄ führte unter Berücksichtigung anisotroper Auslenkungsparameter zu R1 = 11,01 % und wR2 = 11,82 %. Detaillierte Informationen zu der Strukturbestimmung sind in Tabelle 7.1 zu finden. 37 7 Röntgenographische Untersuchungen Tabelle 7.1: Kristalldaten und Angaben zur Strukturbestimmung von Gd4 (CClF2 COO)12 (C12 N2 H8 )6 (H2 O)4 ·2C2 H5 OH·H2 O. Gd4 (CClF2 COO)12 (C12 N2 H8 )6 (H2 O)4 ·2C2 H5 OH·H2 O Kristallsystem triklin Raumgruppe P1̄ Gitterparameter a = 1298,7(2) pm, α = 112,053(16)◦ b = 1723,7(3) pm, β = 99,130(17)◦ c = 1755,8(2) pm, γ = 111,256(17)◦ Volumen der Elementarzelle 3191,2(8)·10−6 pm3 Formeleinheiten Z pro Elementarzelle 2 röntgenographische Dichte 1,793 g·cm−3 Absorptionskoeffizient µ 2,413 mm−1 F(000) 1678 Kristallabmessungen 0,111 × 0,222 × 0,222 mm3 Temperatur 293(2) K Wellenlänge Mo-Kα (λ = 71,073 pm) Winkelbereich der Datensammlung 2,12◦ bis 26,12◦ hkl-Bereich -16 ≤ h ≤ 16; -21 ≤ k ≤ 21; -21 ≤ l ≤ 21 Zahl der gemessenen Reflexe 46203 Zahl der symmetrieunabhängigen Reflexe 11787 beobachtete Reflexe mit F > 2σ 5681 Interner R-Wert 0,1031 verwendete Rechenprogramme SHELXS-97 [45] und SHELXL-97 [37] Verfeinerungsmethode Volle Matrix an F2 , kleinste Fehlerquadrate Zahl der verfeinerten Parameter 844 GooF a 0,777 R-Werte [I > 2σ(I)] a R-Werte (alle Daten) R1 = 0,0473; wR2 = 0,1050 a Restelektronendichten min. / max. a R1 = 0,1101; wR2 = 0,1182 -1,239·10−6 e·pm−3 / 0,866·10−6 e·pm−3 Definition der Gütefaktoren R1 , wR2 und GooF nach [37]. 38 7 Röntgenographische Untersuchungen 7.3.2 Strukturmodell Strukturparameter Die Atomanordnung in der Elementarzelle wurde durch Patterson-Methoden (Gd) und sukzessive Differenzfouriersynthesen (O, C, N, Cl, F) ermittelt und anisotrop verfeinert. Die Wasserstoffatome wurden unter Vorgabe idealer Geometrie fixiert und mit dem „riding model “ verfeinert. Die endgültigen Atomlagen und die äquivalenten isotropen Auslenkungsparameter Uäq (siehe Gleichung 2.12) sind in Tabelle 7.2, die anisotropen Auslenkungsparameter Uij in Tabelle 7.3 wiedergegeben. Tabelle 7.4 enthält ausgewählte interatomare Bindungsabstände, in Tabelle 7.5 sind einige Bindungswinkel zusammengestellt. 39 7 Röntgenographische Untersuchungen Tabelle 7.2: Wyckoff-Symbole, Lageparameter und äquivalente isotrope Auslenkungsparameter in pm2 für Gd4 (CClF2 COO)12 (C12 N2 H8 )6 (H2 O)4 ·2C2 H5 OH·H2 O. Atom Lage x/a y/b z/c Uäq Gd1 2i 0,3300(1) 0,8891(1) 0,3828(1) 440(1) Gd2 2i 0,2549(1) 1,3412(1) 0,1741(1) 460(1) O11 2i 0,4834(5) 1,4209(5) 0,2471(4) 770(20) O12 2i 0,3964(5) 1,3024(4) 0,1149(4) 670(18) C11 2i 0,4842(8) 1,3625(7) 0,1790(6) 600(20) C12 2i 0,6030(9) 1,3658(9) 0,1745(8) 880(40) Cl11 2i 0,6336(6) 1,3043(6) 0,2223(5) 2410(40) F11 2i 0,6069(6) 1,3319(7) 0,0975(5) 1500(40) F12 2i 0,6902(6) 1,4546(7) 0,2183(7) 2050(60) O21 2i -0,0218(5) 1,1096(5) 0,1322(4) 682(19) O22 2i 0,0909(5) 1,2656(4) 0,2123(4) 595(16) C21 2i 0,0102(8) 1,1882(8) 0,1932(6) 550(20) C22 2i -0,0572(10) 1,1920(8) 0,2573(9) 900(40) Cl21 2i -0,1594(5) 1,2262(5) 0,2321(5) 2220(30) F21 2i -0,1171(8) 1,1098(6) 0,2537(6) 1480(40) F22 2i 0,0114(9) 1,2519(8) 0,3422(5) 2100(60) O31 2i 0,3359(5) 1,4849(5) 0,1768(4) 661(17) O32 2i 0,3170(9) 1,6111(6) 0,1847(6) 1220(30) C31 2i 0,3562(8) 1,5523(8) 0,1629(6) 670(30) C32 2i 0,4356(13) 1,5685(11) 0,1071(9) 1120(50) Cl31 2i 0,3514(6) 1,5299(5) 0,0085(4) 2160(30) F31 2i 0,5158(8) 1,6509(6) 0,1268(7) 1890(50) F32 2i 0,4971(17) 1,5235(14) 0,1068(13) 3620(130) O41 2i 0,1453(5) 0,8124(5) 0,3929(4) 689(18) O42 2i 0,0902(8) 0,6646(6) 0,3620(7) 1310(40) C41 2i 0,0824(8) 0,7376(8) 0,3914(8) 730(30) C42 2i -0,0155(11) 0,7411(14) 0,4270(12) 1440(70) Cl41 2i -0,1335(6) F41 2i -0,0368(13) 0,6904(14) 0,4718(11) 2680(90) F42 2i 0,0049(10) 0,8218(8) 0,4955(8) 2010(60) O51 2i 0,5103(5) 0,8866(5) 0,3790(4) 653(18) O52 2i 0,6691(5) 0,9849(4) 0,4994(4) 705(19) C51 2i 0,6129(8) 0,9192(6) 0,4249(6) 550(20) C52 2i 0,6791(11) 0,8682(12) 0,3843(8) 1140(50) Cl51 2i 0,7086(8) 0,8883(7) 0,3077(6) 2980(50) F51 2i 0,6222(11) 0,7704(7) 0,3492(7) 1840(50) F52 2i 0,7789(11) 0,8903(13) 0,4328(7) 3520(130) O61 2i 0,3896(5) 0,8713(5) 0,5067(4) 720(19) O62 2i 0,4487(5) 1,0296(4) 0,3765(4) 672(18) C61 2i 0,5526(8) 1,0908(6) 0,4154(6) 500(20) C62 2i 0,6168(10) 1,1312(8) 0,3615(6) 820(40) Cl61 2i 0,5546(7) 1,0696(5) 0,2579(4) 2520(40) F61 2i 0,6565(13) 1,2161(5) 0,3854(7) 2240(70) 0,6949(9) 0,3571(5) 3330(60) 40 7 Röntgenographische Untersuchungen Fortsetzung von Tabelle 7.2 Atom Lage x/a y/b z/c F62 2i 0,7132(9) 1,1085(12) 0,3600(9) 2540(80) N(1A) 2i 0,0844(6) 1,3788(5) 0,1360(5) 630(20) N(2A) 2i 0,1772(6) 1,3103(5) 0,0147(5) 600(20) C(1A) 2i 0,2232(9) 1,2772(7) -0,0447(6) 760(30) C(2A) 2i 0,1843(12) 1,2640(9) -0,1307(6) 990(40) C(3A) 2i 0,0991(11) 1,2869(9) -0,1540(8) 980(40) C(4A) 2i 0,0492(9) 1,3227(7) -0,0919(7) 760(30) C(5A) 2i 0,0905(8) 1,3330(6) -0,0082(6) 590(30) C(6A) 2i -0,0401(10) 1,3488(8) -0,1126(9) 940(40) C(7A) 2i -0,0861(10) 1,3818(8) -0,0523(10) 950(40) C(8A) 2i -0,0464(8) 1,3930(7) 0,0333(8) 710(30) C(9A) 2i 0,0425(7) 1,3706(6) 0,0557(7) 600(30) C(10A) 2i -0,0917(9) 1,4277(8) 0,0964(11) 970(40) C(11A) 2i -0,0500(9) 1,4383(8) 0,1780(9) 880(40) C(12A) 2i 0,0366(7) 1,4122(7) 0,1940(7) 710(30) N(1B) 2i 0,3036(6) 1,4528(5) 0,3327(4) 547(19) N(2B) 2i 0,3143(6) 1,2861(5) 0,2829(5) 600(20) C(1B) 2i 0,3214(8) 1,2057(7) 0,2604(7) 770(30) C(2B) 2i 0,3403(9) 1,1716(9) 0,3188(10) 920(40) C(3B) 2i 0,3521(10) 1,2222(12) 0,4031(10) 1060(50) C(4B) 2i 0,3471(8) 1,3076(11) 0,4312(8) 880(40) C(5B) 2i 0,3286(7) 1,3362(8) 610(30) C(6B) 2i 0,3648(10) 1,3664(12) 0,5220(9) C(7B) 2i 0,3643(11) 1,4491(12) 0,5445(9) 1060(50) C(8B) 2i 0,3438(8) 1,4824(9) 0,4837(6) 740(30) C(9B) 2i 0,3258(7) 1,4257(7) 0,3951(6) 590(30) C(10B) 2i 0,3429(10) 1,5697(9) 0,5046(7) 910(40) C(11B) 2i 0,3254(10) 1,5974(8) 0,4445(7) 910(40) C(12B) 2i 0,3048(8) 1,5357(7) 0,3592(6) 690(30) N(1C) 2i 0,3116(6) 0,8494(5) 0,2232(4) 490(18) N(2C) 2i 0,1845(6) 0,9242(5) 0,3044(5) 570(20) C(1C) 2i 0,3727(8) 0,8117(6) 0,1842(5) 600(30) C(2C) 2i 0,3689(9) 0,7966(7) 0,0981(6) 750(30) C(3C) 2i 0,2994(11) 0,8233(8) 0,0557(7) 880(40) C(4C) 2i 0,2365(9) 0,8620(7) 0,0952(7) 680(30) C(5C) 2i 0,2433(8) 0,8747(6) 0,1805(6) 550(30) C(6C) 2i 0,1615(12) 0,8878(9) 0,0526(8) 1010(40) C(7C) 2i 0,0984(10) 0,9235(10) 0,0932(9) 990(40) C(8C) 2i 0,1032(8) 0,9392(7) 0,1790(8) 710(30) C(9C) 2i 0,1756(8) 0,9143(6) 0,2236(6) 590(30) C(10C) 2i 0,0384(10) 0,9752(8) 0,2239(9) 970(40) C(11C) 2i 0,0470(9) 0,9869(8) 0,3040(9) 880(40) C(12C) 2i 0,1216(8) 0,9593(7) 0,3426(7) 720(30) C(1E) 2i 0,3292(12) 1,0825(11) -0,0581(12) 1330(60) C(2E) 2i 0,3811(18) 1,0455(17) -0,018(2) 0,3683(7) Uäq 1010(50) 2740(170) 41 7 Röntgenographische Untersuchungen Fortsetzung von Tabelle 7.2 Atom Lage x/a O(1E) 2i y/b z/c Uäq 0,2176(6) 1,0651(5) -0,0460(6) 1070(30) O(1W) 2i 0,1682(6) 1,1736(5) 0,0836(4) 608(18) O(2W) 2i 0,2738(7) 0,7249(5) 0,3140(5) 639(19) O(3W) 1g 0 6500(500) 1/2 1/2 Tabelle 7.3: Anisotrope Auslenkungsparameter Uij in pm2 mit Standardabweichungen für Gd4 (CClF2 COO)12 (C12 N2 H8 )6 (H2 O)4 ·2C2 H5 OH·H2 O. Atom U11 U22 U33 U23 U13 U12 Gd1 447(2) 486(3) 356(2) 171(2) 120,8(19) 221(2) Gd2 474(3) 477(3) 358(2) 126(2) 125,8(19) 232(2) O11 760(40) 840(50) 500(40) 120(40) 170(30) 390(40) O12 530(30) 680(40) 510(30) 90(30) 60(30) 250(30) C11 580(50) 670(60) 590(60) 320(50) 230(50) 290(50) C12 590(60) 1060(90) 810(80) 270(70) 170(60) 400(60) Cl11 2280(60) 4200(100) 2950(70) 2560(80) 1470(50) 2580(70) F11 1090(50) 2300(90) 910(50) 310(60) 600(40) 860(60) F12 590(40) 1530(80) 2450(110) -170(70) 460(50) 100(50) O21 670(40) 580(40) 680(40) 220(40) 310(30) 210(30) O22 570(30) 560(40) 580(40) 210(30) 250(30) 240(30) C21 600(60) 740(70) 510(50) 360(60) 270(50) 410(50) C22 910(80) 650(70) 1160(100) 340(70) 720(70) 320(60) Cl21 2430(60) 2760(70) 3930(90) 2480(70) 2490(60) 2120(60) F21 1960(80) 1220(60) 1970(80) 1010(60) 1580(70) 800(60) F22 1790(80) 2240(100) 640(50) 60(60) 590(50) -110(70) O31 780(40) 530(40) 300(30) 210(30) 280(30) O32 1930(90) 1020(60) 1400(70) 680(60) 1100(70) 1030(60) C31 800(60) 620(60) 640(60) 220(50) 400(50) 410(50) C32 1280(100) 1240(110) 870(90) 370(80) 700(80) 650(100) Cl31 2420(60) 2400(60) 1470(40) 810(40) 990(40) 920(50) F31 1400(70) 1100(60) 2050(100) 540(60) 810(70) -320(50) F32 5900(300) 6500(300) 6100(300) 5800(300) 5700(300) 5900(300) O41 520(30) 680(40) 860(40) O42 1270(70) 790(60) 1930(100) 660(60) 1080(70) 340(50) C41 550(60) 570(70) 950(80) 310(50) 110(50) C42 600(80) 1670(150) 1780(160) 730(140) Cl41 1410(50) 6140(170) 2460(80) F41 2850(140) 4400(200) 3190(170) 3140(190) 2390(140) 2170(160) F42 1880(90) 1710(90) 1930(100) 210(80) O51 530(40) 880(50) 610(40) 320(30) 210(30) 400(30) O52 800(40) 650(40) 500(40) 60(30) 220(30) 390(30) C51 610(60) 630(60) 550(60) 240(50) 300(50) 420(50) 660(40) 360(40) 370(60) 310(30) 740(100) 2050(100) 960(50) 1150(80) 240(30) 130(90) 1750(70) 780(80) 42 7 Röntgenographische Untersuchungen Fortsetzung von Tabelle 7.3 Atom U11 U22 U33 C52 940(80) 1540(130) 640(70) Cl51 4100(110) 3820(110) 2970(90) F51 2920(120) 1290(70) F52 2380(110) 5500(200) 1460(80) -620(120) -380(80) 3330(160) O61 780(40) 970(50) 400(30) 340(40) 160(30) 390(40) O62 680(40) 530(40) 680(40) 270(30) 230(30) 160(30) C61 710(60) 410(50) 500(50) 280(40) 250(50) 280(50) C62 900(70) 750(70) 580(60) 240(60) 410(50) 120(60) Cl61 2890(70) 1980(60) 1320(40) 580(40) 690(50) -80(50) F61 4180(170) 470(40) 1630(80) 500(50) 1640(100) 420(70) F62 1890(90) 5800(200) 3510(160) 4000(190) 2270(110) 2700(130) N(1A) 490(40) 670(50) 690(50) 290(40) 190(40) 270(40) N(2A) 610(40) 590(50) 420(40) 140(40) 140(40) 210(40) C(1A) 820(70) 750(70) 460(50) 190(50) 160(50) 220(50) C(2A) 1270(100) 900(80) 320(50) 210(60) 150(60) 160(80) C(3A) 880(80) 870(80) 750(80) 460(70) -30(70) 30(70) C(4A) 710(70) 590(60) 590(60) 300(60) -10(50) 20(50) C(5A) 450(50) 430(50) 520(60) 190(50) -60(40) -30(40) C(6A) 780(80) 700(80) 870(90) 480(70) -270(70) -30(60) C(7A) 620(70) 730(80) 1380(120) 640(90) -50(70) 150(60) C(8A) 450(50) 600(60) 960(80) 430(60) -50(50) 170(50) C(9A) 490(50) 500(50) 670(60) 290(50) 130(50) 110(40) C(10A) 500(60) 640(70) 1590(130) 460(80) 80(70) 240(50) C(11A) 720(70) 750(70) 1180(100) 380(80) 320(70) 430(60) C(12A) 530(50) 730(60) 840(70) 310(60) 200(50) 340(50) N(1B) 580(40) 540(50) 420(40) 130(40) 160(30) 280(40) N(2B) 620(40) 530(40) 550(50) 200(40) 60(30) 270(40) C(1B) 730(60) 670(70) 730(70) 250(60) 40(50) 320(50) C(2B) 820(70) 800(80) 1100(100) 590(80) 30(70) 340(60) C(3B) 880(80) 1150(110) 1040(110) 800(100) -30(70) 210(80) C(4B) 490(60) 1140(100) 850(90) 640(90) 60(50) 100(60) C(5B) 450(50) 680(70) 340(60) 40(40) 120(50) C(6B) 730(70) 1640(140) 790(100) 850(100) 180(60) 360(90) C(7B) 970(90) 1560(140) 600(80) 510(100) 290(60) 470(100) C(8B) 670(60) 990(90) 370(50) 230(60) 190(40) 260(60) C(9B) 450(50) 770(70) 350(50) 200(50) 100(40) 190(50) C(10B) 1010(80) 840(80) 510(60) 20(60) 260(60) 380(70) C(11B) 1100(80) 740(70) 590(70) 0(60) 260(60) 490(60) 1690(90) 560(60) U23 U13 U12 10(80) 290(60) 820(90) 1920(90) 2750(90) 2870(100) 430(70) 1110(90) 1490(80) C(12B) 830(70) 640(60) 550(60) 190(50) 250(50) 390(50) N(1C) 510(40) 500(40) 400(40) 200(30) 140(30) 190(30) N(2C) 540(40) 600(50) 580(50) 270(40) 130(40) 310(40) C(1C) 640(50) 530(50) 430(50) 170(40) 210(40) 140(40) C(2C) 840(70) 700(70) 490(60) 220(50) 290(50) 190(60) C(3C) 1000(80) 790(80) 470(60) 320(60) 100(60) 110(70) C(4C) 820(70) 480(60) 580(60) 330(50) 130(50) 100(50) 43 7 Röntgenographische Untersuchungen Fortsetzung von Tabelle 7.3 Atom U11 U22 C(5C) 570(50) 430(50) 360(50) 180(40) -50(40) 40(40) C(6C) 1190(110) 850(90) 610(70) 500(70) -140(70) 120(80) C(7C) 760(80) 990(100) 930(100) 630(90) -220(70) 160(70) C(8C) 540(50) 570(60) 830(70) 340(60) -100(50) 190(50) C(9C) 560(50) 460(50) 500(60) 210(50) -80(40) 100(40) C(10C) 790(70) 710(70) 1080(100) 320(80) -190(70) 310(60) C(11C) 840(70) 850(80) 980(90) 360(80) 100(70) 570(60) C(12C) 590(60) 800(70) 680(60) 340(60) 90(50) 300(50) C(1E) 990(100) 990(100) 1610(140) 210(100) 430(90) 470(80) C(2E) 1240(160) 2200(200) 5200(500) 2300(300) 700(200) 550(160) O(1E) 770(50) 720(50) 1120(60) -60(40) 450(50) 240(40) O(1W) 660(40) 470(40) 530(40) 100(30) 260(30) 190(30) O(2W) 830(50) 530(40) 620(40) 270(30) 330(40) 350(40) O(3W) 5400(500) 2300(300) 6900(1200) 600(600) Tabelle 7.4: Ausgewählte interatomare U33 U23 Abstände in U13 pm U12 300(800) 1700(300) mit Standardabweichungen für Gd4 (CClF2 COO)12 (C12 N2 H8 )6 (H2 O)4 ·2C2 H5 OH·H2 O. Abstand Abstand Gd1-Gd1a 460,9(10) C12-F11 127,8(12) Gd1-O41 235,3(6) C12-F12 134,0(13) Gd1-O51 236,7(5) C12-Cl11 169,6(14) Gd1-O52a 236,5(5) O21-C21 122,9(10) Gd1-O61 235,9(6) O22-C21 123,8(10) Gd1-O62 240,8(6) C22-F21 132,3(12) Gd1-O(2W) 237,8(6) C22-F22 136,0(13) Gd1-N(1C) 257,1(7) C22-Cl21 169,0(13) Gd1-N(2C) 254,2(7) O31-C31 Gd2-O11 261,7(6) O32-C31 125,2(11) Gd2-O12 242,6(6) C32-F31 128,7(15) Gd2-O22 240,5(6) C32-F32 129,9(16) Gd2-O31 229,2(7) C32-Cl31 163,1(14) 122,4(11) Gd2-O(1W) 240,2(6) O41-C41 Gd2-N(1A) 258,2(7) O42-C41 123,8(11) 121,5(12) Gd2-N(2A) 259,4(7) C42-F42 134,8(18) Gd2-N(1B) 253,0(6) C42-F41 137(2) Gd2-N(2B) 256,2(8) C42-Cl41 150,8(16) O11-C11 124,1(10) O51-C51 O12-C11 122,8(10) 123,6(9) Symmetrietransformationen zur Erzeugung der äquivalenten Atome: a -x+1,-y+2,-z+1 44 7 Röntgenographische Untersuchungen Fortsetzung von Tabelle 7.4 Abstand Abstand O52-C51 123,1(9) O62-C61 124,3(9) O52-Gd1a 236,5(5) C61-O61a 122,7(10) C52-F52 126,6(13) C62-F61 122,9(12) C52-F51 138,7(16) C62-F62 144,2(14) C52-Cl51 157,8(16) C62-Cl61 159,4(11) O61-C61a 122,7(10) O(1E)-O(1W) 268,8(3) Tabelle 7.5: Ausgewählte interatomare Winkel in ◦ mit Standardabweichungen für Gd4 (CClF2 COO)12 (C12 N2 H8 )6 (H2 O)4 ·2C2 H5 OH·H2 O. Winkel Winkel O12-C11-O11 124,5(8) F31-C32-F32 O21-C21-O22 129,9(8) F31-C32-Cl31 104,2(12) 101,2(14) O31-C31-O32 128,4(9) F32-C32-Cl31 110,7(12) O42-C41-O41 126,7(10) F42-C42-F41 O52-C51-O51 130,1(8) F42-C42-Cl41 112,8(15) O61a -C61-O62 128,1(8) F41-C42-Cl41 102,1(11) 93,9(15) F11-C12-F12 106,5(11) F52-C52-F51 F11-C12-Cl11 107,5(9) F52-C52-Cl51 101,5(12) 102,9(15) F12-C12-Cl11 108,3(9) F51-C52-Cl51 106,0(8) F21-C22-F22 105,7(12) F61-C62-F62 F21-C22-Cl21 105,2(8) F61-C62-Cl61 112,5(11) F22-C22-Cl21 107,5(9) F62-C62-Cl61 91,6(9) 108,2(11) Symmetrietransformationen zur Erzeugung der äquivalenten Atome: a -x+1,-y+2,-z+1 45 7 Röntgenographische Untersuchungen Abbildung 7.3: Ausschnitt aus der Kristallstruktur von Gd4 (CClF2 COO)12 (C12 N2 H8 )6 (H2 O)4 ·2C2 H5 OH·H2 O. Die trikline Elementarzelle ist eingezeichnet; zur besseren Übersicht wurden Wasserstoffatome nicht wiedergegeben; die grauen Gd1-Atome kennzeichnen die dimeren Gd-Einheiten, die schwarzen Gd2-Atome die monomeren Gd-Einheiten. Strukturbeschreibung Aus den Verfeinerungsrechnungen für Gd4 (CClF2 COO)12 (C12 N2 H8 )6 (H2 O)4 ·2C2 H5 OH ·H2 O resultiert ein Strukturmodell, das nachfolgend beschrieben wird. Ein Ausschnitt aus der Kristallstruktur von Gd4 (CClF2 COO)12 (C12 N2 H8 )6 (H2 O)4 ·2C2 H5 OH·H2 O ist in Abbildung 7.3 dargestellt. Die strukturbestimmenden Elemente sind durch ein Gd-Dimer (vgl. Abbildung 7.4, Gd3+ -Gd3+ -Abstand 460,9 pm) und ein Gd-Monomer (vgl. Abbildung 7.5) gegeben. Die Gd3+ -Ionen des Dimers (Gd1) sind von sechs Sauerstoff- und zwei Stickstoffatomen in Form eines quadratischen Antiprismas koordiniert (siehe Abbildung 7.6a). Die Gd1-O-Abstände liegen zwischen 235,3 pm und 240,8 pm, die Gd1-N-Abstände bei 254,2 pm und 257,1 pm (vgl. Tabelle 7.4). Das Gd3+ -Ion des Monomers (Gd2) ist von fünf Sauerstoff- und vier Stickstoffatomen in Form eines verzerrten einfach überkappten quadratischen Antiprismas umgeben (siehe Abbildung 7.6b). Die Gd2-O-Abstände 46 7 Röntgenographische Untersuchungen Abbildung 7.4: Dimere Einheit in Gd4 (CClF2 COO)12 (C12 N2 H8 )6 (H2 O)4 ·2C2 H5 OH·H2 O. Abbildung 7.5: Monomere Einheit in Gd4 (CClF2 COO)12 (C12 N2 H8 )6 (H2 O)4 ·2C2 H5 OH·H2 O. 47 7 Röntgenographische Untersuchungen Abbildung 7.6: Koordination um Gd1 (a) und Gd2 (b). liegen zwischen 229,2 pm und 261,7 pm, die Gd2-N-Abstände zwischen 253,0 pm und 259,4 pm (vgl. Tabelle 7.4). Die O-C-O-Winkel der Carboxylatgruppen weichen teilweise erheblich von dem zu erwartenden sp2 -Winkel (120◦ ) ab (vgl. Tabelle 7.5). Die Vergrößerung des Winkels wird bei vielen Carboxylatverbindungen gefunden. Als Beispiel sei hier Nd(CFH2 COO)3 (H2 O)2 [74] mit Winkeln zwischen 122,7◦ und 128,9◦ genannt. Bei Ni(CF3 COO)2 (CH2 N(CH3 )2 ) [75] beträgt der Winkel sogar 133,6◦ . Die F-C-F- und F-C-Cl-Winkel liegen zwischen 93,9◦ und 117,3◦ . Zu erwarten waren hier sp3 -Winkel von 109,5◦ . Es treten drei Verknüpfungsmodi der Carboxylatgruppen (vgl. Kapitel 7.2) auf: In der dimeren Einheit der bidentale (µ2 –κ1 O:κ1 O’) Verknüpfungsmodus, der zwei Gd3+ Atome miteinander verbrückt, in der monomeren Einheit der chelatartige Verknüpfungsmodus, bei dem beide Sauerstoffatome eines Carboxylates zu einem Gd3+ -Atom koordiniert sind. In beiden Baueinheiten ist außerdem noch der monodentale Verknüpfungsmodus enthalten, der nur ein Sauerstoffatom des Carboxylates mit einem Gd3+ Atom verknüpft. In der Kristallstruktur befinden sich zwischen den dimeren und monomeren Baueinhei- 48 7 Röntgenographische Untersuchungen Abbildung 7.7: Ausschnitt aus der Packung der organischen 1,10-Phenanthrolinmoleküle in Gd4 (CClF2 COO)12 (C12 N2 H8 )6 (H2 O)4 ·2C2 H5 OH·H2 O. ten Ethanol- und Wassermoleküle. Der Abstand von 268,8 pm des Sauerstoffatoms O1E des Ethanolmoleküls zu dem Sauerstoffatom O1W des koordinierten Wassermoleküls an Gd2 deutet auf eine Wasserstoffbrückenbindung hin [76]. Durch π-π-Wechselwirkungen wird ein nur durch die organische Teilstruktur gebildetes Packungsmotiv (siehe Abbildung 7.7), ein so genanntes „π-stacking“ [77, 78], realisiert. Der kleinste orthogonale Abstand zwischen zwei Ebenen, die durch je einen aromatischen Ring definiert sind, beträgt 349,4 pm. 49 7 Röntgenographische Untersuchungen 7.4 Gd(CClF2COO)3(C12N2H8)2(H2O)2 7.4.1 Einkristallstrukturanalyse Zur Einkristallpräparation wurden Kristalle von Gd(CClF2 COO)3 (C12 N2 H8 )2 (H2 O)2 aus der Lösung auf ein Uhrglas überführt. Gut ausgebildete, optisch klare Einkristalle wurden unter einem Mikroskop mit Polarisationsfilter auf einen Glasfaden geklebt und auf einem Goniometerkopf befestigt. Die Messungen der Reflexintensitäten wurden bei Raumtemperatur mit dem IPDS durchgeführt. Unter der Voraussetzung, dass die Verbindung in der zentrosymmetrischen Raumgruppe P21 /c kristallisiert, wurden 47727 gemessene zu 6564 symmetrieunabhängigen Reflexen gemittelt und für die anschließende Strukturrechnung verwendet. Die Strukturbestimmung erfolgte mit Hilfe von Patterson-Synthesen und Differenzfourieranalysen. Die gewählte zentrosymmetrische Raumgruppe P21 /c erwies sich im Laufe der Strukturverfeinerung als richtig. Der interne R-Wert Rint betrug 9,96 %. Die Verfeinerung in der Raumgruppe P21 /c führte unter Berücksichtigung anisotroper Auslenkungsparameter zu R1 = 9,90 % und wR2 = 7,40 %. Detaillierte Informationen zu der Strukturbestimmung sind in Tabelle 7.6 zu finden. 50 7 Röntgenographische Untersuchungen Tabelle 7.6: Kristalldaten und Angaben zur Strukturbestimmung von Gd(CClF2 COO)3 (C12 N2 H8 )2 (H2 O)2 . Gd(CClF2 COO)3 (C12 N2 H8 )2 (H2 O)2 Kristallsystem monoklin Raumgruppe P21 /c Gitterparameter a = 1401,90(17) pm, α = 90◦ b = 1354,80(11) pm, β = 94,291(14)◦ c = 1797,2(2) pm, γ = 90◦ Volumen der Elementarzelle 3403,8(6)·10−6 pm3 Formeleinheiten Z pro Elementarzelle 4 röntgenographische Dichte 1,838 g·cm−3 Absorptionskoeffizient µ 2,273 mm−1 F(000) 1844 Kristallabmessungen 0,111 × 0,1776 × 0,3145 mm3 Temperatur 293(2) K Wellenlänge Mo-Kα (λ = 71,073 pm) Winkelbereich der Datensammlung 2,09◦ bis 26,19◦ hkl-Bereich -17 ≤ h ≤ 17; -16 ≤ k ≤ 16; -22 ≤ l ≤ 22 Zahl der gemessenen Reflexe 47727 Zahl der symmetrieunabhängigen Reflexe 6564 beobachtete Reflexe mit F > 2σ 3076 Interner R-Wert 0,0996 verwendete Rechenprogramme SHELXS-97 [45] und SHELXL-97 [37] Verfeinerungsmethode Volle Matrix an F2 , kleinste Fehlerquadrate Zahl der verfeinerten Parameter 475 GooF a 0,727 R-Werte [I > 2σ(I)] a R-Werte (alle Daten) R1 = 0,0366; wR2 = 0,0655 a Restelektronendichten min. / max. a R1 = 0,0990; wR2 = 0,0740 -1,872·10−6 e·pm−3 / 0,725·10−6 e·pm−3 Definition der Gütefaktoren R1 , wR2 und GooF nach [37]. 51 7 Röntgenographische Untersuchungen 7.4.2 Strukturmodell Strukturparameter Die Atomanordnung in der Elementarzelle wurde durch Patterson-Methoden (Gd) und sukzessive Differenzfouriersynthesen (O, C, N, Cl, F) ermittelt und anisotrop verfeinert. Die Wasserstoffatome wurden unter Vorgabe idealer Geometrie fixiert und mit dem „riding model “ verfeinert. Die endgültigen Atomlagen und die äquivalenten isotropen Auslenkungsparameter Uäq (siehe Gleichung 2.12) sind in Tabelle 7.7, die anisotropen Auslenkungsparameter Uij in Tabelle 7.8 wiedergegeben. Tabelle 7.9 enthält ausgewählte interatomare Bindungsabstände, in Tabelle 7.10 sind einige Bindungswinkel zusammengestellt. 52 7 Röntgenographische Untersuchungen Tabelle 7.7: Wyckoff-Symbole, Lageparameter und äquivalente isotrope Auslenkungsparameter in pm2 für Gd(CClF2 COO)3 (C12 N2 H8 )2 (H2 O)2 . Atom Lage x/a y/b z/c Uäq Gd 4e 0,2793(1) 0,1664(1) 0,8764(1) 393(1) O11 4e 0,4416(3) 0,2111(3) 0,9009(2) 488(11) O12 4e 0,5325(3) 0,0834(3) 0,9393(3) 653(13) C11 4e 0,5192(4) 0,1678(5) 0,9160(3) 435(14) C12 4e 0,6087(4) 0,2271(4) 0,9010(4) 501(17) F11 4e 0,6024(3) 0,3188(3) 0,9282(2) 907(14) F12 4e 0,6889(3) 0,1867(3) 0,9332(3) 1013(16) Cl11 4e 0,6245(2) 0,2360(2) 0,8063(1) 875(6) O21 4e 0,1328(3) 0,2496(3) 0,8597(3) 558(12) O22 4e 0,0069(3) 0,1519(4) 0,8423(3) 951(19) C21 4e 0,0444(5) 0,2320(6) 0,8555(4) 585(19) C22 4e -0,0200(6) 0,3218(8) 0,8654(5) 970(30) F21 4e -0,0105(4) 0,3959(4) 0,8069(3) 1420(20) F22 4e -0,1112(4) 0,3024(5) 0,8609(5) 1780(30) Cl21 4e 0,0111(3) 0,3907(4) 0,9353(2) 2250(20) O31 4e 0,3071(4) -0,1643(4) 0,8848(3) 953(18) O32 4e 0,1553(4) -0,1389(3) 0,8503(4) 1140(20) C31 4e 0,2270(6) -0,1893(5) 0,8667(4) 620(20) C32 4e 0,2064(6) -0,3007(5) 0,8623(6) 840(30) Cl31 4e 0,1477(2) -0,3345(2) 0,9366(2) 1654(12) F31 4e 0,1420(3) -0,3348(3) 0,8015(3) 1010(16) F32 4e 0,2876(4) -0,3537(3) 0,8663(4) 1165(18) N(1A) 4e 0,2952(3) 0,2980(3) 0,7758(3) 415(13) N(2A) 4e 0,3666(3) 0,1128(3) 0,7614(3) 439(13) C(1A) 4e 0,4024(5) 0,0229(5) 0,7533(4) 538(18) C(2A) 4e 0,4658(5) -0,0008(5) 0,7009(4) 599(19) C(3A) 4e 0,4934(5) 0,0696(5) 0,6536(4) 600(20) C(4A) 4e 0,4559(4) 0,1660(6) 0,6580(3) 463(14) C(5A) 4e 0,3939(4) 0,1836(4) 0,7133(3) 394(15) C(6A) 4e 0,4787(5) 0,2423(6) 0,6078(4) 620(20) C(7A) 4e 0,4383(4) 0,3315(6) 0,6119(3) 562(16) C(8A) 4e 0,3742(4) 0,3534(4) 0,6672(4) 454(17) C(9A) 4e 0,3527(4) 0,2807(4) 0,7199(3) 343(14) C(10A) 4e 0,3298(5) 0,4454(5) 0,6726(4) 556(19) C(11A) 4e 0,2705(5) 0,4623(4) 0,7271(4) 560(20) C(12A) 4e 0,2556(5) 0,3878(5) 0,7780(4) 524(18) N(1B) 4e 0,2845(4) 0,3048(3) 0,9728(3) 433(13) N(2B) 4e 0,1967(4) 0,1304(4) 0,9951(3) 515(15) C(1B) 4e 0,1561(5) 0,0453(6) 1,0089(4) 640(20) C(2B) 4e 0,0957(6) 0,0300(7) 1,0658(5) 810(30) C(3B) 4e 0,0757(5) 0,1065(9) 1,1098(5) 870(30) C(4B) 4e 0,1172(5) 0,1992(7) 1,0997(4) 650(20) C(5B) 4e 0,1786(4) 0,2076(5) 1,0415(4) 477(17) 53 7 Röntgenographische Untersuchungen Fortsetzung von Tabelle 7.7 Atom Lage x/a y/b z/c Uäq C(6B) 4e 0,1039(6) 0,2854(9) 1,1451(5) 830(30) C(7B) 4e 0,1475(7) 0,3704(8) 1,1331(5) 850(30) C(8B) 4e 0,2101(5) 0,3812(6) 1,0758(4) 551(19) C(9B) 4e 0,2251(4) 0,3000(5) 1,0290(4) 467(17) C(10B) 4e 0,2590(6) 0,4687(5) 1,0616(5) 700(20) C(11B) 4e 0,3178(6) 0,4721(5) 1,0072(4) 620(20) C(12B) 4e 0,3306(5) 0,3889(4) 0,9647(4) 524(18) O(1W) 4e 0,3478(3) 0,0175(3) 0,9212(3) 554(12) O(2W) 4e 0,1703(3) 0,0477(3) 0,8252(3) 555(12) Tabelle 7.8: Anisotrope Auslenkungsparameter Uij in pm2 mit Standardabweichungen für Gd(CClF2 COO)3 (C12 N2 H8 )2 (H2 O)2 . Atom U11 U22 U33 U23 U13 Gd 434,4(15) 373,5(14) 383,1(16) 27(2) 109,6(11) -27,2(19) O11 430(30) 450(20) 590(30) -50(20) 90(20) 30(20) O12 560(30) 460(30) 940(40) 90(30) 120(30) -20(20) C11 410(40) 440(30) 460(40) -90(40) 50(30) -70(40) C12 450(40) 480(40) 570(50) -70(30) 80(40) -80(30) F11 1120(30) 640(30) 990(30) -340(30) 270(30) F12 560(20) 1170(40) 1270(40) 340(30) -210(30) -180(30) Cl11 860(14) 1065(15) 742(16) -32(12) 345(12) -164(12) O21 440(30) 580(30) 680(30) 60(20) 130(20) 30(20) O22 570(30) 750(40) 1520(60) 240(40) -10(30) -130(30) C21 510(50) 820(60) 440(50) 130(40) 110(40) 0(40) C22 540(50) 1430(80) 930(70) -540(70) 30(50) F21 1710(60) 1470(50) 1100(50) 610(40) F22 560(30) 1930(70) 2820(90) -910(60) 50(40) 340(40) U12 -360(20) 240(60) 990(40) 270(40) Cl21 1660(30) 3150(50) 1890(40) -940(40) -300(30) 920(30) O31 620(30) 570(30) 1650(60) -20(40) -110(30) O32 790(40) 520(30) 2070(80) 110(40) -170(40) 40(30) C31 590(50) 470(50) 800(60) 0(40) 100(40) -50(40) C32 640(50) 410(40) 1510(90) 100(40) 300(60) 0(40) 510(20) -100(40) Cl31 1570(30) 1390(20) 2060(40) 680(30) F31 930(30) 730(30) 1300(40) -560(30) -380(30) 200(30) -20(20) F32 840(30) 620(30) 2020(60) -120(30) 50(30) 180(30) N(1A) 410(30) 380(30) 460(40) -20(20) 60(30) 10(20) N(2A) 520(30) 360(30) 440(40) -20(20) 90(30) -20(20) C(1A) 710(50) 410(40) 510(50) -60(30) 120(40) 70(30) C(2A) 690(50) 550(40) 550(50) -190(40) -10(40) 130(40) C(3A) 490(40) 730(50) 590(60) -200(40) 110(40) -10(40) 54 7 Röntgenographische Untersuchungen Fortsetzung von Tabelle 7.8 Atom U11 U22 U33 U23 U13 U12 C(4A) 410(30) 620(40) C(5A) 390(30) 440(40) 370(40) -70(40) 80(30) -100(40) 350(40) -70(30) -40(30) C(6A) 560(50) 820(50) 500(50) -100(40) 220(40) -40(30) C(7A) 650(40) 650(40) 400(40) 60(40) 170(30) -200(40) C(8A) 460(40) 540(40) 350(40) 30(30) 10(30) -130(30) C(9A) 350(30) 410(30) 270(40) -30(30) 20(30) -90(30) -110(40) C(11A) 770(50) 320(40) 580(50) 90(30) 10(40) 10(30) N(1B) 340(30) 10(20) 50(30) 0(20) 480(30) 480(30) N(2B) 520(30) 590(40) 440(40) 80(30) 90(30) -140(30) C(1B) 630(50) 780(50) 520(50) 120(40) 80(40) -220(40) C(2B) 740(60) 1190(80) 520(60) 260(50) 140(50) -360(50) C(3B) 410(50) 1760(100) 460(60) 230(60) 70(40) -200(60) C(4B) 380(40) 1170(70) 410(50) 170(40) 80(40) 10(40) C(5B) 350(40) 760(50) 310(40) 90(30) 30(30) 30(30) C(6B) 620(60) 1530(90) 350(50) -40(60) 110(40) 310(60) C(7B) 850(70) 1140(70) 550(70) -150(50) -20(60) 420(60) C(8B) 550(40) 810(50) 290(40) -90(40) 30(40) 290(40) C(9B) 410(40) 620(50) 370(40) 10(30) 30(30) 110(30) C(10B) 950(60) 610(50) 510(60) -170(40) -150(50) 260(50) C(11B) 890(60) 400(40) 550(50) -80(30) -50(50) 30(40) C(12B) 680(50) 390(40) 500(50) -20(30) 10(40) -90(30) O(1W) 520(30) 500(30) 630(30) 140(20) -10(30) 10(20) O(2W) 590(30) 460(30) 600(30) 40(20) 0(30) -70(20) Tabelle 7.9: Ausgewählte interatomare Abstände in pm mit Standardabweichungen für Gd(CClF2 COO)3 (C12 N2 H8 )2 (H2 O)2 . Abstand Abstand Gd-O11 236,4(4) C12-Cl11 173,6(7) Gd-O21 234,1(4) O21-C21 Gd-N(1A) 256,1(5) O22-C21 122,1(8) Gd-N(2A) 258,5(5) C22-F22 130,1(9) Gd-N(1B) 255,0(5) C22-F21 146,7(12) Gd-N(2B) 254,9(6) C22-Cl21 159,9(9) 125,8(8) Gd-O(1W) 235,2(4) O31-C31 119,4(7) Gd-O(2W) 235,8(4) O32-C31 123,2(8) O11-C11 124,8(7) C32-F32 134,2(8) O12-C11 122,8(7) C32-F31 144,1(10) C12-F11 133,9(7) C32-Cl31 168,3(9) C12-F12 134,3(7) 55 7 Röntgenographische Untersuchungen Tabelle 7.10: Ausgewählte interatomare Winkel in ◦ mit Standardabweichungen für Gd(CClF2 COO)3 (C12 N2 H8 )2 (H2 O)2 . Winkel O12-C11-O11 128,3(6) O22-C21-O21 126,1(7) O31-C31-O32 129,9(7) F11-C12-F12 107,2(5) F11-C12-Cl11 108,1(4) F12-C12-Cl11 106,7(5) F22-C22-F21 103,6(8) F22-C22-Cl21 112,0(6) F21-C22-Cl21 97,5(7) F32-C32-F31 110,5(7) F32-C32-Cl31 106,0(6) F31-C32-Cl31 101,4(5) Strukturbeschreibung Aus den Verfeinerungsrechnungen für Gd(CClF2 COO)3 (C12 N2 H8 )2 (H2 O)2 resultiert ein Strukturmodell, das nachfolgend beschrieben wird. Die Kristallstruktur von Gd(CClF2 COO)3 (C12 N2 H8 )2 (H2 O)2 ist aus Gd-Monomeren (vgl. Abbildung 7.8) aufgebaut. Ein Ausschnitt aus dieser Struktur ist in Abbildung 7.9 dargestellt. Die Gd3+ -Ionen des strukturbestimmenden Monomers sind von vier Sauerstoff- und vier Stickstoffatomen in Form eines verzerrten quadratischen Antiprismas koordiniert (siehe Abbildung 7.10). Die Gd-O-Abstände liegen zwischen 234,1 pm und 236,4 pm, die Gd-N-Abstände zwischen 254,9 pm und 258,5 pm (vgl. Tabelle 7.9). Die O-C-O-Winkel der Carboxylatgruppen weichen erheblich von dem zu erwartenden sp2 -Winkel (120◦ ) ab (vgl. Tabelle 7.10). Die F-C-F- und F-C-Cl-Winkel liegen zwischen 97,5◦ und 112,0◦ . Zu erwarten waren hier sp3 -Winkel von 109,5◦ . Es tritt nur ein Verknüpfungsmodus der Carboxylatgruppen (vgl. Kapitel 7.2) auf: Der monodentale Verknüpfungsmodus, der nur ein Sauerstoffatom des Carboxylates mit einem Gd3+ -Atom verknüpft. 56 7 Röntgenographische Untersuchungen Abbildung 7.8: Monomere Einheit in Gd(CClF2 COO)3 (C12 N2 H8 )2 (H2 O)2 . Durch π-π-Wechselwirkungen wird ein nur durch die organische Teilstruktur gebildetes Packungsmotiv (siehe Abbildung 7.11), ein so genanntes „π-stacking“ [77,78], realisiert. Der kleinste orthogonale Abstand zwischen zwei Ebenen, die durch je einen aromatischen Ring definiert sind, beträgt 343,9 pm. 57 7 Röntgenographische Untersuchungen Abbildung 7.9: Ausschnitt aus der Kristallstruktur von Gd(CClF2 COO)3 (C12 N2 H8 )2 (H2 O)2 . Die monokline Elementarzelle ist eingezeichnet; zur besseren Übersicht wurden Wasserstoffatome nicht wiedergegeben. Abbildung 7.10: Koordination um Gd. 58 7 Röntgenographische Untersuchungen Abbildung 7.11: Ausschnitt aus der Packung der organischen 1,10-Phenanthrolinmoleküle in Gd(CClF2 COO)3 (C12 N2 H8 )2 (H2 O)2 . 59 7 Röntgenographische Untersuchungen 7.5 Gd(CClF2COO)3(C12N2H8)(H2O) 7.5.1 Einkristallstrukturanalyse Zur Einkristallpräparation wurden Kristalle von Gd(CClF2 COO)3 (C12 N2 H8 )(H2 O) aus der Lösung auf ein Uhrglas überführt. Gut ausgebildete, optisch klare Einkristalle wurden unter einem Mikroskop mit Polarisationsfilter auf einen Glasfaden geklebt und auf einem Goniometerkopf befestigt. Die Messungen der Reflexintensitäten wurden bei Raumtemperatur mit dem IPDS durchgeführt. Unter der Voraussetzung, dass die Verbindung in der zentrosymmetrischen Raumgruppe P1̄ kristallisiert, wurden 17962 gemessene zu 4626 symmetrieunabhängigen Reflexen gemittelt und für die anschließende Strukturrechnung verwendet. Die Strukturbestimmung erfolgte mit Hilfe von Patterson-Synthesen und Differenzfourieranalysen. Die gewählte zentrosymmetrische Raumgruppe P1̄ erwies sich im Laufe der Strukturverfeinerung als richtig. Der interne R-Wert Rint betrug 9,03 %. Die Verfeinerung in der Raumgruppe P1̄ führte unter Berücksichtigung anisotroper Auslenkungsparameter zu R1 = 9,46 % und wR2 = 12,24 %. Detaillierte Informationen zu der Strukturbestimmung sind in Tabelle 7.11 zu finden. 60 7 Röntgenographische Untersuchungen Tabelle 7.11: Kristalldaten und Angaben zur Strukturbestimmung von Gd(CClF2 COO)3 (C12 N2 H8 )(H2 O). Gd(CClF2 COO)3 (C12 N2 H8 )(H2 O) Kristallsystem triklin Raumgruppe P1̄ Gitterparameter a = 1038,39(15) pm, α = 99,903(17)◦ b = 1170,42(16) pm, β = 109,517(16)◦ c = 1202,30(17) pm, γ = 106,031(16)◦ Volumen der Elementarzelle 1266,1(3)·10−6 pm3 Formeleinheiten Z pro Elementarzelle 2 röntgenographische Dichte 1,951 g·cm−3 Absorptionskoeffizient µ 3,021 mm−1 F(000) 714 Kristallabmessungen 0,111 × 0,1480 × 0,1961 mm3 Temperatur 293(2) K Wellenlänge Mo-Kα (λ = 71,073 pm) Winkelbereich der Datensammlung 2,23◦ bis 26,17◦ hkl-Bereich -12 ≤ h ≤ 12; -14 ≤ k ≤ 14; -14 ≤ l ≤ 14 Zahl der gemessenen Reflexe 17962 Zahl der symmetrieunabhängigen Reflexe 4626 beobachtete Reflexe mit F > 2σ 2550 Interner R-Wert 0,0903 verwendete Rechenprogramme SHELXS-97 [45] und SHELXL-97 [37] Verfeinerungsmethode Volle Matrix an F2 , kleinste Fehlerquadrate Zahl der verfeinerten Parameter 329 GooF a 0,816 R-Werte [I > 2σ(I)] a R-Werte (alle Daten) R1 = 0,0488; wR2 = 0,1120 a Restelektronendichten min. / max. a R1 = 0,0946; wR2 = 0,1224 -0,853·10−6 e·pm−3 / 0,982·10−6 e·pm−3 Definition der Gütefaktoren R1 , wR2 und GooF nach [37]. 61 7 Röntgenographische Untersuchungen 7.5.2 Strukturmodell Strukturparameter Die Atomanordnung in der Elementarzelle wurde durch Patterson-Methoden (Gd) und sukzessive Differenzfouriersynthesen (O, C, N, Cl, F) ermittelt und anisotrop verfeinert. Die Wasserstoffatome wurden unter Vorgabe idealer Geometrie fixiert und mit dem „riding model “ verfeinert. Die endgültigen Atomlagen und die äquivalenten isotropen Auslenkungsparameter Uäq (siehe Gleichung 2.12) sind in Tabelle 7.12, die anisotropen Auslenkungsparameter Uij in Tabelle 7.13 wiedergegeben. Tabelle 7.14 enthält ausgewählte interatomare Bindungsabstände, in Tabelle 7.15 sind einige Bindungswinkel zusammengestellt. 62 7 Röntgenographische Untersuchungen Tabelle 7.12: Wyckoff-Symbole, Lageparameter und äquivalente isotrope Auslenkungsparameter in pm2 für Gd(CClF2 COO)3 (C12 N2 H8 )(H2 O). Atom Lage x/a y/b z/c Uäq Gd 2i 0,6036(1) 0,7049(1) 0,5228(1) 472(2) O11 2i 0,4202(9) 0,6596(8) 0,6030(7) 760(20) O12 2i 0,6659(9) 0,5446(7) 0,4366(6) 810(20) C11 2i 0,3494(12) 0,5624(11) 0,6121(9) 580(30) C12 2i 0,266(2) F11 2i 0,1110(13) 0,5129(16) 0,6340(16) 2770(100) F12 2i 0,3040(18) 0,6853(11) 0,7631(13) 2250(70) Cl11 2i 0,3464(16) 0,5343(9) 0,8161(9) 3250(70) O21 2i 0,6866(7) 0,8772(6) 0,7003(6) 631(18) O22 2i 0,5539(10) 0,9972(7) 0,6836(6) 850(20) C21 2i 0,6414(12) 0,9544(9) 0,7402(8) 580(30) C22 2i 0,6969(16) 0,9986(13) 0,8823(10) 920(40) F21 2i 0,5912(10) 0,9823(11) 0,9262(7) F22 2i 0,8235(19) 0,9787(15) 0,9448(7) 2670(90) Cl21 2i 0,7830(10) 1,1477(8) 0,9307(6) 2780(50) O31 2i 0,3941(8) 0,5779(7) 0,3450(6) 713(19) O32 2i 0,2965(8) 0,3741(6) 0,3141(6) 693(19) C31 2i 0,3047(11) 0,4710(10) 0,2876(8) 570(20) C32 2i 0,1864(15) 0,4651(14) 0,1705(11) 1020(50) F31 2i 0,0976(16) 0,5365(17) 0,1805(9) F32 2i 0,0727(19) 0,3705(16) 0,1252(15) 3650(170) Cl31 2i 0,2302(11) 0,4740(14) 0,0687(7) 3430(60) N(1A) 2i 0,6763(10) 0,7718(7) 0,3540(7) 620(20) N(2A) 2i 7/8(9) 0,5831(7) 560(20) C(1A) 2i 0,5782(13) 0,7561(10) 0,2412(9) 750(30) C(2A) 2i 0,6215(19) 0,7706(13) 0,1445(11) 980(40) C(3A) 2i 0,761(2) C(4A) 2i 0,8646(16) 0,8165(10) 0,2779(12) 770(30) C(5A) 2i 0,8195(13) 0,8038(9) C(6A) 2i 1,0193(19) 0,8514(14) 0,3048(17) 1080(50) C(7A) 2i 1,120(2) C(8A) 2i 1,0751(15) 0,8611(11) 0,5169(14) 830(30) C(9A) 2i 0,9241(11) 0,8232(8) 0,5687(17) 0,6955(17) 1260(60) 0,8092(7) 1590(40) 2390(80) 0,8018(14) 0,1638(14) 1070(50) 0,3720(10) 600(30) 0,8730(15) 0,4190(18) 1180(50) 0,4940(10) 580(30) C(10A) 2i 1,1718(14) 0,8826(12) 0,6363(15) 920(40) C(11A) 2i 1,1241(13) 0,8717(12) 0,7267(13) 880(40) C(12A) 2i 0,9738(12) 0,8320(10) 0,6969(10) 720(30) O(1W) 0,4789(8) 2i 0,8431(6) 0,4612(6) 720(20) 63 7 Röntgenographische Untersuchungen Tabelle 7.13: Anisotrope Auslenkungsparameter Uij in pm2 mit Standardabweichungen für Gd(CClF2 COO)3 (C12 N2 H8 )(H2 O). Atom U11 U22 U33 U23 U13 U12 Gd 534(3) 447(3) 446(2) 167,5(18) 196,2(19) 169(2) O11 820(60) 690(50) 860(50) 280(40) 490(40) 180(50) O12 1160(60) 650(50) 760(50) 150(40) 420(40) 500(50) C11 620(70) 610(70) 650(60) 250(60) 320(50) 290(60) C12 2000(200) 1220(130) 1460(140) 650(110) 1380(140) 980(140) F11 1120(80) 1540(110) -190(100) F12 4100(200) 1550(90) 2930(150) 920(100) 2890(160) 1750(120) Cl11 6200(200) 2600(90) 2660(90) 1410(80) 3140(130) 2010(130) O21 680(40) 570(40) 600(40) 70(30) 210(30) 290(40) O22 1230(70) 920(60) 600(40) 310(40) 350(40) 650(60) C21 740(70) 570(60) 480(50) 210(50) 280(50) 220(60) C22 1110(100) 990(100) 510(60) -30(60) 130(70) 520(90) F21 1360(70) 2600(120) 720(50) 360(60) 700(50) 280(80) F22 4900(200) 4100(200) 620(50) 910(80) 1020(90) 3790(190) Cl21 3330(110) 2220(70) 1430(50) -380(50) 850(60) -330(70) O31 750(50) 630(50) 530(40) 160(40) 120(40) 100(40) O32 930(50) 560(40) 580(40) 280(30) 220(40) 300(40) C31 530(60) 620(70) 440(50) 140(50) 110(50) 150(60) C32 850(90) 1130(110) 600(70) 470(70) -120(70) 40(90) F31 2450(140) 4000(200) 1250(80) 590(100) 130(80) 2760(170) F32 2470(150) 2680(160) 2260(150) 1760(130) -1720(140) -1590(140) Cl31 2890(110) 5900(200) 1560(60) 1850(90) 510(70) 1650(130) N(1A) 750(60) 570(50) 570(50) 220(40) 300(50) 210(50) N(2A) 650(50) 470(50) 620(50) 180(40) 310(40) 210(40) C(1A) 850(80) 760(70) 610(70) 340(60) 290(60) 170(70) C(2A) 1290(130) 1090(110) 640(80) 430(70) 490(80) 320(110) C(3A) 1590(150) 1140(120) 1000(110) 610(90) 970(110) 520(120) C(4A) 1130(110) 630(70) 920(90) 460(60) 650(80) 400(80) C(5A) 720(80) 810(80) 320(50) 470(70) 210(60) C(6A) 1290(140) 1230(120) 1590(150) 880(110) 1210(120) 670(120) C(7A) 1320(150) 1250(130) 1660(160) 850(120) 1050(140) 640(120) C(8A) 810(90) 700(80) 1240(110) 470(70) 640(90) 280(70) C(9A) 170(60) 3220(190) 3230(180) -590(150) 460(60) 560(70) 410(60) 850(80) 260(50) 340(60) C(10A) 550(80) 840(90) 1230(120) 360(90) 280(90) 120(70) C(11A) 630(80) 850(90) 1010(90) 250(80) 160(70) 250(70) O(1W) 720(50) 720(40) 310(40) 380(40) 490(40) 920(50) 64 7 Röntgenographische Untersuchungen Tabelle 7.14: Ausgewählte interatomare Abstände in pm mit Standardabweichungen für Gd(CClF2 COO)3 (C12 N2 H8 )(H2 O). Abstand Abstand Gd-Gda 453,3(4) C12-Cl11 159,3(19) Gd-O12 233,7(7) F12-Cl11 Gd-O31 235,1(7) O21-C21 122,6(11) Gd-O32a 236,1(6) O22-C21 122,3(11) Gd-O11 238,4(8) C22-F21 135,1(15) Gd-O21 238,6(6) C22-F22 138,5(15) 208,7(14) Gd-O(1W) 240,2(6) C22-Cl21 161,9(16) Gd-N(2A) 252,7(8) O31-C31 123,9(11) Gd-N(1A) 255,7(8) O32-C31 121,9(11) O11-C11 121,7(12) O32-Gda 236,1(6) O12-C11a 123,0(11) C32-F32 124,8(16) C11-O12a 123,0(11) C32-F31 142,4(17) C12-F12 133,7(19) C32-Cl31 145,0(17) C12-F11 142(2) Symmetrietransformationen zur Erzeugung der äquivalenten Atome: Tabelle 7.15: Ausgewählte interatomare Winkel in ◦ a -x+1,-y+1,-z+1 mit Standardabweichungen für Gd(CClF2 COO)3 (C12 N2 H8 )(H2 O). Winkel Winkel O11-C11-O12a 129,2(10) F21-C22-F22 O22-C21-O21 129,2(9) F21-C22-Cl21 103,7(9) O32-C31-O31 130,0(9) F22-C22-Cl21 91,3(11) F12-C12-F11 109,8(14) F32-C32-F31 F12-C12-Cl11 90,4(13) F11-C12-Cl11 118,4(15) F31-C32-Cl31 112,2(11) 119,2(12) 87,8(16) F32-C32-Cl31 104,0(15) Symmetrietransformationen zur Erzeugung der äquivalenten Atome: a -x+1,-y+1,-z+1 65 7 Röntgenographische Untersuchungen Abbildung 7.12: Ausschnitt aus der Kristallstruktur von Gd(CClF2 COO)3 (C12 N2 H8 )(H2 O). Die trikline Elementarzelle ist eingezeichnet; zur besseren Übersicht wurden Wasserstoffatome nicht wiedergegeben. Strukturbeschreibung Aus den Verfeinerungsrechnungen für Gd(CClF2 COO)3 (C12 N2 H8 )(H2 O) resultiert ein Strukturmodell, das nachfolgend beschrieben wird. Ein Ausschnitt aus der Kristallstruktur von Gd(CClF2 COO)3 (C12 N2 H8 )(H2 O) ist in Abbildung 7.12 dargestellt. Das strukturbestimmende Element ist durch ein Gd-Dimer (vgl. Abbildung 7.13, Gd3+ -Gd3+ -Abstand: 453,3 pm) gegeben. Die Gd3+ -Ionen des strukturbestimmenden Dimers sind von sechs Sauerstoff- und zwei Stickstoffatomen in Form eines quadratischen Antiprismas koordiniert (siehe Abbildung 7.14). Die Gd-O-Abstände liegen zwischen 233,7 pm und 240,2 pm, die Gd-N-Abstände 66 7 Röntgenographische Untersuchungen Abbildung 7.13: Dimere Einheit in Gd(CClF2 COO)3 (C12 N2 H8 )(H2 O). Abbildung 7.14: Koordination um Gd. 67 7 Röntgenographische Untersuchungen Abbildung 7.15: Ausschnitt aus der Packung der organischen 1,10-Phenanthrolinmoleküle in Gd(CClF2 COO)3 (C12 N2 H8 )(H2 O). bei 252,7 pm und 255,7 pm (vgl. Tabelle 7.14). Die O-C-O-Winkel der Carboxylatgruppen weichen erheblich von dem zu erwartenden sp2 -Winkel (120◦ ) ab (vgl. Tabelle 7.15). Die F-C-F- und F-C-Cl-Winkel liegen zwischen 87,8◦ und 119,2◦ . Zu erwarten waren hier sp3 -Winkel von 109,5◦ . Es treten zwei Verknüpfungsmodi der Carboxylatgruppen (vgl. Kapitel 7.2) auf: Der monodentale Verknüpfungsmodus, der nur ein Sauerstoffatom des Carboxylates mit einem Gd3+ -Atom verknüpft und der bidentale (µ2 –κ1 O:κ1 O’) Verknüpfungsmodus, der zwei Gd3+ -Atome miteinander verbrückt. Durch π-π-Wechselwirkungen wird ein nur durch die organische Teilstruktur gebildetes Packungsmotiv (siehe Abbildung 7.15), ein so genanntes „π-stacking“ [77,78], realisiert. Der kleinste orthogonale Abstand zwischen zwei Ebenen, die durch je einen aromatischen Ring definiert sind, beträgt 357,8 pm. 68 7 Röntgenographische Untersuchungen 7.6 Gd(CF2HCOO)3(C12N2H8) 7.6.1 Einkristallstrukturanalyse Zur Einkristallpräparation wurden Kristalle von Gd(CF2 HCOO)3 (C12 N2 H8 ) aus der Lösung auf ein Uhrglas überführt. Gut ausgebildete, optisch klare Einkristalle wurden unter einem Mikroskop mit Polarisationsfilter auf einen Glasfaden geklebt und auf einem Goniometerkopf befestigt. Die Messungen der Reflexintensitäten wurden bei Raumtemperatur mit dem IPDS durchgeführt. Unter der Voraussetzung, dass die Verbindung in der zentrosymmetrischen Raumgruppe P1̄ kristallisiert, wurden 6892 gemessene zu 3546 symmetrieunabhängigen Reflexen gemittelt und für die anschließende Strukturrechnung verwendet. Die Strukturbestimmung erfolgte mit Hilfe von Patterson-Synthesen und Differenzfourieranalysen. Die gewählte zentrosymmetrische Raumgruppe P1̄ erwies sich im Laufe der Strukturverfeinerung als richtig. Der interne R-Wert Rint betrug 7,38 %. Die Verfeinerung in der Raumgruppe P1̄ führte unter Berücksichtigung anisotroper Auslenkungsparameter zu R1 = 10,36 % und wR2 = 7,45 %. Detaillierte Informationen zu der Strukturbestimmung sind in Tabelle 7.16 zu finden. 69 7 Röntgenographische Untersuchungen Tabelle 7.16: Kristalldaten und Angaben zur Strukturbestimmung von Gd(CF2 HCOO)3 (C12 N2 H8 ). Gd(CF2 HCOO)3 (C12 N2 H8 ) Kristallsystem triklin Raumgruppe P1̄ Gitterparameter a = 874,57(15) pm, α = 104,731(18)◦ b = 928,85(14) pm, β = 106,956(19)◦ c = 1338,5(2) pm, γ = 99,918(19)◦ Volumen der Elementarzelle 969,5(3)·10−6 pm3 Formeleinheiten Z pro Elementarzelle 2 röntgenographische Dichte 2,132 g·cm−3 Absorptionskoeffizient µ 3,519 mm−1 F(000) 598 Kristallabmessungen 0,0851 × 0,111 × 0,0888 mm3 Temperatur 293(2) K Wellenlänge Mo-Kα (λ = 71,073 pm) Winkelbereich der Datensammlung 2,41◦ bis 26,12◦ hkl-Bereich -10 ≤ h ≤ 10; -11 ≤ k ≤ 11; -16 ≤ l ≤ 14 Zahl der gemessenen Reflexe 6892 Zahl der symmetrieunabhängigen Reflexe 3546 beobachtete Reflexe mit F > 2σ 1637 Interner R-Wert 0,0738 verwendete Rechenprogramme SHELXS-97 [45] und SHELXL-97 [37] Verfeinerungsmethode Volle Matrix an F2 , kleinste Fehlerquadrate Zahl der verfeinerten Parameter 293 GooF a 0,515 R-Werte [I > 2σ(I)] a R-Werte (alle Daten) R1 = 0,0326; wR2 = 0,0541 a Restelektronendichten min. / max. a R1 = 0,1036; wR2 = 0,0745 -1,263·10−6 e·pm−3 / 0,713·10−6 e·pm−3 Definition der Gütefaktoren R1 , wR2 und GooF nach [37]. 70 7 Röntgenographische Untersuchungen 7.6.2 Strukturmodell Strukturparameter Die Atomanordnung in der Elementarzelle wurde durch Patterson-Methoden (Gd) und sukzessive Differenzfouriersynthesen (O, C, N, F) ermittelt und anisotrop verfeinert. Die Wasserstoffatome wurden unter Vorgabe idealer Geometrie fixiert und mit dem „riding model “ verfeinert. Die endgültigen Atomlagen und die äquivalenten isotropen Auslenkungsparameter Uäq (siehe Gleichung 2.12) sind in Tabelle 7.17, die anisotropen Auslenkungsparameter Uij in Tabelle 7.18 wiedergegeben. Tabelle 7.19 enthält ausgewählte interatomare Bindungsabstände, in Tabelle 7.20 sind einige Bindungswinkel zusammengestellt. 71 7 Röntgenographische Untersuchungen Tabelle 7.17: Wyckoff-Symbole, Lageparameter und äquivalente isotrope Auslenkungsparameter in pm2 für Gd(CF2 HCOO)3 (C12 N2 H8 ). Atom Lage x/a y/b z/c Uäq Gd 2i 0,4716(1) 0,8441(1) 0,3556(1) 282(1) O11 2i 0,6199(7) 1,0697(8) 0,3211(5) 392(16) O12 2i 0,5803(7) 1,1399(7) 0,4797(5) 368(16) C11 2i 0,6333(12) 1,1691(13) 0,4057(8) 310(20) C12 2i 0,7069(11) 1,3388(12) 0,4252(8) 350(30) F11 2i 0,8431(7) 1,3932(7) 0,5216(4) 532(17) F12 2i 0,7667(7) 1,3565(7) 0,3459(4) 590(17) O21 2i 0,2412(7) 0,9496(7) 0,3427(4) 389(16) O22 2i 0,7378(7) 0,8980(7) 0,4894(5) 389(16) C21 2i 0,1892(11) 1,0281(12) 0,4078(7) 310(20) C22 2i 0,0138(10) 1,0414(12) 0,3630(8) 410(20) F21 2i -0,0323(7) 1,0252(8) 0,2543(5) 720(20) F22 2i 0,0037(7) 1,1845(8) 0,4128(5) 780(20) O31 2i 0,4736(8) 0,5841(8) 0,3807(5) 423(18) O32 2i 0,2513(7) 0,6061(8) 0,2616(5) 441(17) C31 2i 0,3276(13) 0,5277(13) 0,3148(8) 340(30) C32 2i 0,2341(15) 0,3726(14) 0,3018(10) 480(30) F31 2i 0,3260(10) 0,2735(10) 0,2963(9) 1280(40) F32 2i 0,1168(12) 0,3062(11) 0,2041(8) 1390(40) N(1A) 2i 0,3679(9) 0,8262(9) 0,1511(6) 371(19) N(2A) 2i 0,6294(8) 0,7215(9) 0,2417(5) 341(19) C(1A) 2i 0,7535(12) 0,6638(12) 0,2850(8) 390(30) C(2A) 2i 0,8542(11) 0,6098(13) 0,2278(8) 490(30) C(3A) 2i 0,8220(13) 0,6114(14) 0,1248(9) 590(30) C(4A) 2i 0,6919(12) 0,6664(12) 0,0743(7) 450(30) C(5A) 2i 0,5983(11) 0,7202(11) 0,1363(7) 340(20) C(6A) 2i 0,6510(14) 0,6735(15) -0,0359(8) 640(40) C(7A) 2i 0,5253(15) 0,7256(16) -0,0817(9) 660(40) C(8A) 2i 0,4239(12) 0,7809(13) -0,0203(7) 470(30) C(9A) 2i 0,4585(11) 0,7780(12) 0,0889(7) 380(20) C(10A) 2i 0,2908(14) 0,8362(14) -0,0645(9) 630(30) C(11A) 2i 0,2003(15) 0,8851(15) -0,0031(8) 650(40) C(12A) 2i 0,2429(12) 0,8780(13) 0,1035(7) 500(30) 72 7 Röntgenographische Untersuchungen Tabelle 7.18: Anisotrope Auslenkungsparameter Uij in pm2 mit Standardabweichungen für Gd(CF2 HCOO)3 (C12 N2 H8 ). Atom U11 U22 U33 U23 U13 U12 Gd 294(2) 294(3) 280(2) 78,4(19) 121,3(17) 116(2) O11 490(40) 350(50) 270(30) 50(30) 110(30) 90(30) O12 410(40) 400(50) 410(40) 200(30) 230(30) 150(30) C11 330(60) 340(80) 340(60) 190(60) 130(50) 170(50) C12 340(60) 370(80) 370(60) 190(50) 120(50) 120(50) F11 440(30) 520(50) 450(30) 0(30) 90(30) 20(30) F12 860(40) 500(50) 540(40) 250(30) 410(30) 80(40) O21 430(40) 470(50) 280(30) 80(30) 120(30) 230(40) O22 420(40) 410(50) 370(40) 100(30) 160(30) 220(40) C21 330(50) 340(70) 270(50) 110(50) 100(40) 60(50) C22 280(50) 330(80) 510(60) 60(50) 70(50) 80(50) F21 570(40) 1130(60) 510(40) 340(40) 80(30) 420(40) F22 440(40) 620(50) 1050(50) -30(40) 70(30) 330(40) O31 320(40) 440(50) 450(40) 120(40) 90(30) 80(40) O32 480(40) 380(50) 510(40) 210(40) 180(30) 140(40) C31 420(60) 290(80) 360(60) 110(50) 200(50) 50(60) C32 620(80) 240(80) 600(70) 10(60) 340(60) 110(70) F31 890(60) 380(60) 2420(110) 480(60) 370(60) 180(50) F32 1230(70) 730(80) 1340(80) 360(60) -350(60) -530(60) N(1A) 420(50) 340(60) 350(40) 70(40) 160(40) 130(40) N(2A) 380(40) 350(60) 310(40) 100(40) 110(30) 150(40) C(1A) 480(60) 310(80) 380(60) 60(50) 180(50) 120(60) C(2A) 380(60) 600(90) 540(70) 120(60) 220(50) 240(60) C(3A) 600(70) 690(100) 600(70) 140(60) 380(60) 250(70) C(4A) 510(60) 580(80) 330(50) 90(50) 270(50) 200(60) C(5A) 450(50) 290(70) 240(50) 10(40) 140(40) 100(50) C(6A) 730(80) 900(110) 350(60) 90(60) 360(60) 250(80) C(7A) 750(90) 870(110) 370(60) 200(70) 200(60) 190(80) C(8A) 480(60) 660(90) 200(50) 110(50) 120(40) 40(60) C(9A) 410(60) 380(80) 320(50) 60(50) 90(50) 150(40) C(10A) 810(80) 500(100) 470(70) 130(60) 70(60) 170(70) C(11A) 800(90) 720(110) 330(60) 110(60) 0(60) 380(80) C(12A) 470(60) 660(90) 150(60) 90(50) 220(60) 360(60) 73 7 Röntgenographische Untersuchungen Tabelle 7.19: Ausgewählte interatomare Abstände in pm mit Standardabweichungen für Gd(CF2 HCOO)3 (C12 N2 H8 ). Abstand Gd-Gda Gd-O11 Abstand 403,4(2) O12-Gda 235,1(5) 248,9(6) C12-F12 134,5(9) Gd-O12a 235,1(5) C12-F11 137,9(10) Gd-O12 265,9(6) O21-C21 123,3(10) Gd-O21 237,0(5) O22-C21a 127,6(10) Gd-O22 236,4(6) C21-O22a 127,6(10) Gd-O31 252,3(7) C22-F21 135,2(9) Gd-O32 242,6(7) C22-F22 135,8(10) Gd-N(1A) 257,2(7) O31-C31 124,9(11) Gd-N(2A) 253,2(6) O32-C31 127,9(11) O11-C11 122,6(11) C32-F32 131,6(13) O12-C11 127,7(10) C32-F31 132,4(11) Symmetrietransformationen zur Erzeugung der äquivalenten Atome: Tabelle 7.20: Ausgewählte interatomare Winkel in ◦ a -x+1,-y+2,-z+1 mit Standardabweichungen für Gd(CF2 HCOO)3 (C12 N2 H8 ). Winkel O11-C11-O12 123,3(10) O21-C21-O22a 129,3(8) O31-C31-O32 121,3(10) F12-C12-F11 105,3(7) F21-C22-F22 105,4(8) F32-C32-F31 99,0(10) Symmetrietransformationen zur Erzeugung der äquivalenten Atome: a -x+1,-y+2,-z+1 74 7 Röntgenographische Untersuchungen Abbildung 7.16: Dimere Einheit in Gd(CF2 HCOO)3 (C12 N2 H8 ). Strukturbeschreibung Aus den Verfeinerungsrechnungen für Gd(CF2 HCOO)3 (C12 N2 H8 ) resultiert ein Strukturmodell, das nachfolgend beschrieben wird. Die Kristallstruktur von Gd(CF2 HCOO)3 (C12 N2 H8 ) ist aus Gd-Dimeren (vgl. Abbildung 7.16, Gd3+ -Gd3+ -Abstand: 403,4 pm) aufgebaut. Ein Ausschnitt aus dieser Struktur ist in Abbildung 7.17 dargestellt. Die Gd3+ -Ionen des strukturbestimmenden Dimers sind von sieben Sauerstoff- und zwei Stickstoffatomen in Form eines verzerrten einfach überkappten quadratischen Antiprismas koordiniert (siehe Abbildung 7.18). Die Gd-O-Abstände liegen zwischen 235,1 pm und 265,9 pm, die Gd-N-Abstände bei 253,2 pm und 257,2 pm (vgl. Tabelle 7.19). Die O-C-O-Winkel der Carboxylatgruppen weichen teilweise von dem zu erwartenden sp2 -Winkel (120◦ ) ab (vgl. Tabelle 7.20). Die F-C-F- und F-C-Cl-Winkel liegen zwischen 99,0◦ und 105,4◦ . Zu erwarten waren hier sp3 -Winkel von 109,5◦ . Es treten drei Verknüpfungsmodi der Carboxylatgruppen (vgl. Kapitel 7.2) auf: Der bidentale (µ2 –κ1 O:κ1 O’) Verknüpfungsmodus, der zwei Gd3+ -Atome miteinander verbrückt. Der tridentale (κ1 O:µ2 –κ2 O’) Verknüpfungsmodus, bei dem ein Gd3+ -Atom an beide Carboxylatsauerstoffatome koordiniert ist und das zweite Gd3+ -Atom nur an ein Carboxylatsauerstoffatom gebunden ist. Außerdem ist noch der chelatartige Verknüpf- 75 7 Röntgenographische Untersuchungen Abbildung 7.17: Ausschnitt aus der Kristallstruktur von Gd(CF2 HCOO)3 (C12 N2 H8 ). Die trikline Elementarzelle ist eingezeichnet; zur besseren Übersicht wurden Wasserstoffatome nicht wiedergegeben. Abbildung 7.18: Koordination um Gd. 76 7 Röntgenographische Untersuchungen Abbildung 7.19: Ausschnitt aus der Packung der organischen 1,10-Phenanthrolinmoleküle in Gd(CF2 HCOO)3 (C12 N2 H8 ). ungsmodus vorhanden, bei dem beide Sauerstoffatome eines Carboxylates zu einem Gd3+ -Atom koordiniert sind. Durch π-π-Wechselwirkungen wird ein nur durch die organische Teilstruktur gebildetes Packungsmotiv (siehe Abbildung 7.19), ein so genanntes „π-stacking“ [77,78], realisiert. Der kleinste orthogonale Abstand zwischen zwei Ebenen, die durch je einen aromatischen Ring definiert sind, beträgt 392,2 pm. 77 8 Magnetische Untersuchungen an Gd(CClF2 COO)3 (C12 N2 H8 )(H2 O) und Gd(CF2 HCOO)3 (C12 N2 H8 ) 8 Magnetische Untersuchungen an Gd(CClF2COO)3(C12N2H8)(H2O) und Gd(CF2HCOO)3(C12N2H8) Lanthanidionen zeigen mit Ausnahme der diamagnetischen Ionen La3+ , Ce4+ , Yb2+ und Lu3+ paramagnetisches Verhalten. Ziel dieser Arbeit war auch, das magnetische Verhalten der dargestellten Verbindungen zu untersuchen. Dazu wurden polykristalline Proben der Titelverbindungen im Temperaturbereich von 1,75 K bis 250 K bei magnetischen Feldstärken (H ) von 0,5 kOe und 1 kOe mit dem SQUID-Magnetometer vermessen. Die gemessenen Suszeptibilitätswerte sind nahezu feldstärkeunabhängig. Da Sättigungseffekte vernachlässigt werden konnten, wurden die Messdaten mit Hilfe von Gleichung 3.13 (vgl. Kapitel 3.3.1) für eine Spin-Spin-Austauschkopplung in einer dinuklearen Gd3+ -Gd3+ -Einheit interpretiert, was sich aus den Kristallstrukturen (vgl. Kapitel 7.5 und 7.6) ergibt. Für beide Verbindungen erhält man durch Anpassungsrechnungen den Landé-Faktor g = 2,03, der gut mit denen anderer Gd-Komplexverbindungen z.B. g = 2,003 [79], g = 2,023 [80] und g = 2,025 [19] übereinstimmt. Für Gd(CClF2 COO)3 (C12 N2 H8 )(H2 O) ergibt sich ein Austauschparameter von Jex = −0,0017 cm−1 und für Gd(CF2 HCOO)3 (C12 N2 H8 ) Jex = −0,017 cm−1 . Das negative Vorzeichen von Jex lässt auf antiferromagnetische Wechselwirkungen schließen. Die Zunahme des Betrags des Austauschparameters |Jex | von 0,0017 cm−1 auf 0,017 cm−1 bei kleiner werdendem Gd3+ -Gd3+ -Abstand von 453,3 pm (Gd(CClF2 COO)3 (C12 N2 H8 )(H2 O)) auf 403,4 pm (Gd(CF2 HCOO)3 (C12 N2 H8 )) ist auf 78 8 Magnetische Untersuchungen an Gd(CClF2 COO)3 (C12 N2 H8 )(H2 O) und Gd(CF2 HCOO)3 (C12 N2 H8 ) Abbildung 8.1: Vergleich der beobachteten (H = 0,5 kOe, 1 kOe) und berechneten BohrMagnetonenzahl µef f für Gd(CClF2 COO)3 (C12 N2 H8 )(H2 O). eine stärkere magnetische Wechselwirkung zwischen den Gd3+ -Ionen in der dimeren Einheit zurückzuführen. Die korrigierten magnetischen Messwerte µef f sowie die mit Hilfe von Gleichung 3.13 und 3.5 berechneten Werte µef f sind in Abhängigkeit von der Temperatur T in Abbildung 8.1 und 8.2 wiedergegeben. In Anhang B sind die magnetischen Daten tabellarisch zusammengestellt. Das Gd3+ -Ion hat einen 8 S7/2 Grundzustand. Dieser sollte keinen Kristallfeldeffekt zeigen. Die Bohr-Magnetonenzahl µef f sollte von der Temperatur unabhängig sein (vgl. Abbildungen 8.1 und 8.2). Die Abweichungen von diesem Verhalten bei tiefer Temperatur ist auf antiferromagnetische Wechselwirkungen zurückzuführen. 79 8 Magnetische Untersuchungen an Gd(CClF2 COO)3 (C12 N2 H8 )(H2 O) und Gd(CF2 HCOO)3 (C12 N2 H8 ) Abbildung 8.2: Vergleich der beobachteten (H = 0,5 kOe, 1 kOe) und berechneten BohrMagnetonenzahl µef f für Gd(CF2 HCOO)3 (C12 N2 H8 ). 80 9 Diskussion der präparativen und strukturchemischen Ergebnisse 9 Diskussion der präparativen und strukturchemischen Ergebnisse Bei einem Molverhältnis Gd/phen 1:1 wurde die erstmals dargestellte Verbindung Gd4 (CClF2 COO)12 (C12 N2 H8 )6 (H2 O)4 ·2C2 H5 OH·H2 O erhalten, deren Kristallstruktur aus Gd-Dimeren (vgl. Abbildung 7.4, Kapitel 7.3.2) und Gd-Monomeren aufgebaut ist. Ein Überschuss an 1,10-Phenanthrolin (Molverhältnis Gd/phen 1:2) führt hingegen zur Synthese der neuen Verbindung Gd(CClF2 COO)3 (C12 N2 H8 )2 (H2 O)2 , die ausschließlich aus monomeren Gd-Einheiten besteht (vgl. Abbildung 7.8, Kapitel 7.4.2). Im Falle der erstmaligen Synthese der Verbindungen Gd(CClF2 COO)3 (C12 N2 H8 )(H2 O) (Molverhältnis Gd/phen 4:1) (vgl. Abbildung 7.13, Kapitel 7.5.2) und Gd(CF2 HCOO)3 (C12 N2 H8 ) (Molverhältnis Gd/phen 2:1) (vgl. Abbildung 7.16, Kapitel 7.6.2), wobei hier ein Überschuss an Gd3+ -Ionen eingesetzt wurde, entstehen Strukturen, die nur aus Gd-Dimeren aufgebaut sind. Monomere Gd-Einheiten sind immer nur von einem 1,10-Phenanthrolinmolekül koordiniert, Gd-Dimere hingegen immer von zwei 1,10-Phenanthrolinmolekülen. Dies wurde bereits bei Carboxylaten der Lanthanide mit 2,2’-Bipyridyl-Liganden beobachtet [81]. Die erhaltenen präparativen und strukturchemischen Ergebnisse sind in Tabelle 9.1 noch mal zusammengefasst dargestellt. 81 9 Diskussion der präparativen und strukturchemischen Ergebnisse Tabelle 9.1: Präparative und strukturchemische Ergebnisse eingesetztes Verbindung Molverhältnis resultierende Gd/phen Gd-Baueinheit Gd(CClF2 COO)3 (C12 N2 H8 )2 (H2 O)2 1:2 Monomer Gd4 (CClF2 COO)12 (C12 N2 H8 )6 (H2 O)4 ·2C2 H5 OH·H2 O 1:1 Monomer und Dimer Gd(CF2 HCOO)3 (C12 N2 H8 ) 2:1 Dimer Gd(CClF2 COO)3 (C12 N2 H8 )(H2 O) 4:1 Dimer 82 10 Zusammenfassung 10 Zusammenfassung 1. Bei der Umsetzung von Gd(CClF2 COO)3 (H2 O)3 mit 1,10-Phenanthrolin (Molverhältnis Gd/phen 1:1) in einer Lösung aus Ethanol und Wasser (1:1) wurde das neue Carboxylat Gd4 (CClF2 COO)12 (C12 N2 H8 )6 (H2 O)4 ·2C2 H5 OH·H2 O einkristallin erhalten. Die Kristallstruktur konnte anhand von röntgenographischen Einkristalldaten bestimmt werden. Die Verbindung kristallisiert in der triklinen Raumgruppe P1̄ (Nr. 2). Die Gitterkonstanten und die Winkel der Elementarzelle wurden zu a = 1298,7(2) pm, b = 1723,7(3) pm, c = 1755,8(2) pm, α = 112,053(16)◦ , β = 99,130(17)◦ und γ = 111,256(17)◦ ermittelt. Die Kristallstruktur von Gd4 (CClF2 COO)12 (C12 N2 H8 )6 (H2 O)4 ·2C2 H5 OH·H2 O ist aus Gd-Dimeren und Gd-Monomeren aufgebaut, zwischen denen sich Wasser- und Ethanolmoleküle befinden. 2. Bei der Reaktion von Gd(CClF2 COO)3 (H2 O)3 mit 1,10-Phenanthrolin (Molverhältnis Gd/phen 1:2) in einer Lösung aus Ethanol und Wasser (1:1) bildete sich die neue Verbindung Gd(CClF2 COO)3 (C12 N2 H8 )2 (H2 O)2 . Die Kristallstruktur wurde anhand von röntgenographischen Einkristalldaten aufgeklärt. Die Verbindung kristallisiert in der monoklinen Raumgruppe P21 /c (Nr. 14) mit folgenden Gitterparametern: a = 1401,90(17) pm, b = 1354,80(11) pm, c = 1797,2(2) pm und β = 94,291(14)◦ . In Gd(CClF2 COO)3 (C12 N2 H8 )2 (H2 O)2 liegen Gd-Monomere vor. 3. Aus einem Ansatz von Gd(CClF2 COO)3 (H2 O)3 mit 1,10-Phenanthrolin (Molverhältnis Gd/phen 4:1) in einer Lösung aus Ethanol und Wasser (1:1) wurde 83 10 Zusammenfassung erstmals das Carboxylat Gd(CClF2 COO)3 (C12 N2 H8 )(H2 O) synthetisiert. Die Kristallstruktur wurde anhand von röntgenographischen Einkristalldaten bestimmt. Die Verbindung kristallisiert in der triklinen Raumgruppe P1̄ (Nr. 2) mit folgenden Gitterparametern: a = 1038,39(15) pm, b = 1170,42(16) pm, c = 1202,30(17) pm, α = 99,903(17)◦ , β = 109,517(16)◦ und γ = 106,031(16)◦ . Die Verbindung ist aus dimeren Gd-Einheiten aufgebaut. An einer pulverförmigen Probe von Gd(CClF2 COO)3 (C12 N2 H8 )(H2 O) wurden magnetische Messungen im Temperaturbereich von 1,75 K bis 250 K bei Feldstärken von 0,5 kOe und 1 kOe durchgeführt. Zur eingehenden Untersuchung des magnetischen Verhaltens wurden kooperative magnetische Effekte in der dinuklearen Gd3+ -Gd3+ -Einheit berücksichtigt. Es konnte gezeigt werden, dass eine schwache antiferromagnetische Wechselwirkung zwischen den Gd3+ -Ionen der dimeren Baugruppe (Gd3+ -Gd3+ -Abstand: 453,3 pm) vorliegt. Der Austauschparameter wurde zu Jex = −0,0017 cm−1 bestimmt. 4. Aus einem Versuch mit Gd(CF2 HCOO)3 (H2 O)2 ·H2 O mit 1,10-Phenanthrolin (Molverhältnis Gd/phen 2:1) in einer Lösung aus Ethanol und Wasser (1:1) wurde die Verbindung Gd(CF2 HCOO)3 (C12 N2 H8 ) erhalten. Aus röntgenographischen Einkristalldaten resultiert eine Strukturlösung in der triklinen Raumgruppe P1̄ (Nr. 2). Die Gitterkonstanten und die Winkel wurden zu a = 874,57(15) pm, b = 928,85(14) pm, c = 1338,5(2) pm, α = 104,731(18)◦ , β = 106,956(19)◦ und γ = 99,918(19)◦ ermittelt. Die Kristallstruktur weist GdDimere auf. Eine polykristalline Probe von Gd(CF2 HCOO)3 (C12 N2 H8 ) wurde magnetischen Messungen im Temperaturbereich von 1,76 K bis 250 K bei Feldstärken von 0,5 kOe und 1 kOe unterzogen. Zur eingehenden Untersuchung des magnetischen Verhaltens wurden kooperative magnetische Effekte in der dinuklearen Gd3+ -Gd3+ -Einheit berücksichtigt. Die Messungen ergaben, dass die Gd3+ -Ionen in der dimeren Baueinheit (Gd3+ Gd3+ -Abstand: 403,4 pm) antiferromagnetisch mit Jex = −0,017 cm−1 gekoppelt sind. 84 10 Zusammenfassung Der hier gefundene höhere absolute Wert für den Austauschparameter im Vergleich zu dem für Gd(CClF2 COO)3 (C12 N2 H8 )(H2 O) ist auf einen kürzeren Gd3+ Gd3+ -Abstand in der dimeren Einheit zurückzuführen. 85 A Pulverdiffraktogramme A Pulverdiffraktogramme relative Intensität in % A.1 Gd4(CClF2COO)12(C12N2H8)6(H2O)4·2C2H5OH·H2O 100 a) 80 60 40 20 relative Intensität in % 0 100 b) 80 60 40 20 0 5 10 15 20 25 30 35 40 ° 2θ Abbildung A.1: Berechnetes a) und gemessenes b) Pulverdiffraktogramm von Gd4 (CClF2 COO)12 (C12 N2 H8 )6 (H2 O)4 ·2C2 H5 OH·H2 O. 86 A Pulverdiffraktogramme relative Intensität in % A.2 Gd(CClF2COO)3(C12N2H8)2(H2O)2 100 a) 80 60 40 20 relative Intensität in % 0 100 b) 80 60 40 20 0 5 10 15 20 25 30 35 40 ° 2θ Abbildung A.2: Berechnetes a) und gemessenes b) Pulverdiffraktogramm von Gd(CClF2 COO)3 (C12 N2 H8 )2 (H2 O)2 . 87 A Pulverdiffraktogramme relative Intensität in % A.3 Gd(CClF2COO)3(C12N2H8)(H2O) 100 a) 80 60 40 20 relative Intensität in % 0 100 b) 80 60 40 20 0 5 10 15 20 25 30 35 40 ° 2θ Abbildung A.3: Berechnetes a) und gemessenes b) Pulverdiffraktogramm von Gd(CClF2 COO)3 (C12 N2 H8 )(H2 O). 88 A Pulverdiffraktogramme relative Intensität in % A.4 Gd(CF2HCOO)3(C12N2H8) 100 a) 80 60 40 20 relative Intensität in % 0 100 b) 80 60 40 20 0 5 10 15 20 25 30 35 40 ° 2θ Abbildung A.4: Berechnetes a) und gemessenes b) Pulverdiffraktogramm von Gd(CF2 HCOO)3 (C12 N2 H8 ). 89 B Magnetische Messungen B Magnetische Messungen Tabelle B.1: Temperaturabhängigkeit der Bohr-Magnetonenzahl µef f für Gd(CClF2 COO)3 (C12 N2 H8 )(H2 O). berechnet T in K µef f T in K µef f T in K µef f T in K µef f 1,75 8,00 12,00 8,05 5,49 8,04 50,00 8,05 2,00 8,01 14,00 8,05 5,98 8,04 60,00 8,06 2,20 8,01 16,00 8,05 6,47 8,04 70,00 8,06 2,50 8,02 18,00 8,05 6,99 8,04 80,00 8,06 2,80 8,02 20,00 8,05 7,48 8,04 90,00 8,06 3,00 8,02 25,00 8,05 7,97 8,04 100,00 8,06 3,50 8,03 30,00 8,05 8,48 8,04 125,00 8,06 4,00 8,03 35,00 8,05 8,97 8,05 150,00 8,06 4,48 8,03 40,00 8,05 9,47 8,05 200,00 8,06 4,99 8,04 45,00 8,05 9,97 8,05 250,00 8,06 H = 500 Oe T in K µef f T in K µef f T in K µef f T in K µef f 1,75 8,00 5,49 8,04 12,00 8,05 50,00 8,09 2,00 8,03 5,98 8,04 14,00 8,06 60,00 8,09 2,20 8,01 6,47 8,04 16,00 8,06 70,00 8,09 2,50 8,03 6,99 8,04 18,00 8,06 80,00 8,10 2,80 8,03 7,48 8,04 20,00 8,07 90,00 8,09 3,00 8,03 7,97 8,05 25,00 8,08 100,00 8,09 3,50 8,04 8,48 8,05 30,00 8,08 125,00 8,08 4,00 8,05 8,97 8,04 35,00 8,08 150,00 8,08 4,48 8,03 9,47 8,05 40,00 8,10 200,00 8,07 4,99 8,04 9,97 8,05 45,00 8,09 250,00 8,04 90 B Magnetische Messungen Fortsetzung von Tabelle B.1 H = 1000 Oe T in K µef f T in K µef f T in K µef f T in K µef f 1,81 7,67 4,00 8,06 30,00 8,09 150,00 8,04 2,00 8,01 5,99 8,06 40,00 8,11 200,00 8,04 2,50 7,91 9,97 8,07 50,00 8,09 250,00 8,02 3,00 8,04 15,00 8,08 75,00 8,08 3,50 8,04 20,00 8,09 100,00 8,05 Tabelle B.2: Temperaturabhängigkeit der Bohr-Magnetonenzahl µef f für Gd(CF2 HCOO)3 (C12 N2 H8 ). berechnet T in K µef f T in K µef f T in K µef f T in K µef f 1,79 7,39 5,48 7,84 18,00 7,99 50,00 8,03 2,00 7,46 5,99 7,86 20,00 8,00 60,00 8,04 2,20 7,52 6,48 7,88 9,49 7,93 70,00 8,04 2,50 7,58 6,98 7,89 9,99 7,94 80,00 8,04 2,80 7,63 7,48 7,90 12,00 7,96 90,00 8,04 3,00 7,66 7,98 7,91 25,00 8,01 100,00 8,05 3,50 7,72 8,48 7,92 30,00 8,02 125,00 8,05 4,12 7,77 8,00 7,91 35,00 8,02 150,00 8,05 4,48 7,79 14,00 7,97 40,00 8,03 200,00 8,05 4,99 7,82 16,00 7,98 45,00 8,03 250,00 8,05 H = 500 Oe T in K µef f T in K µef f T in K µef f T in K µef f 1,79 7,51 5,48 7,86 12,00 7,95 50,00 8,05 2,00 7,62 5,99 7,86 14,00 7,96 60,00 8,04 2,20 7,54 6,48 7,87 16,00 7,97 70,00 8,04 2,50 7,62 6,98 7,89 18,00 7,98 80,00 8,04 2,80 7,72 7,48 7,90 20,00 8,00 90,00 8,04 3,00 7,72 7,98 7,91 25,00 8,01 100,00 8,05 3,50 7,77 8,48 7,91 30,00 8,01 125,00 8,05 4,12 7,82 8,00 7,79 35,00 8,02 150,00 8,08 4,48 7,81 9,49 7,93 40,00 8,04 200,00 8,08 4,99 7,83 9,99 7,93 45,00 8,04 250,00 8,12 H = 1000 Oe T in K µef f T in K µef f T in K µef f T in K µef f 1,76 7,51 4,12 7,81 30,00 8,00 150,00 8,01 2,00 7,50 5,98 7,86 40,00 8,02 200,00 8,03 2,50 7,67 9,97 7,92 50,00 8,02 250,00 8,04 3,00 7,72 15,00 7,96 75,00 8,01 3,50 7,76 20,00 7,98 100,00 8,00 91 C Abkürzungsverzeichnis C Abkürzungsverzeichnis aniso anisotrop IPDS Imaging-Plate-Diffraction-System Aufl. Auflage iso isotrop Bd. Band IUPAC International Union of Pure and beob beobachtet ber berechnet K Kelvin bipy 2,2’-Bipyridin KZ Koordinationszahl bzw. beziehungsweise λ Wellenlänge CGS centimètre gramme seconde Ln Lanthanide cm Zentimeter mm Millimeter d.h. das heißt MRI magnetic resonance imaging e Elementarladung; Oe Oersted Basis der natürlichen Logarithmen phen 1,10-Phenanthrolin eff effektiv pm Pikometer emu electromagnetic unit PSD position sensitive detector etc. et cetera r Radius exp experimentell R-Wert Zuverlässigkeitsfaktor Fa. Firma G Gauß s. siehe g Gramm sog. so genannt Gl. Gleichung SQUID Superconducting Quantum Applied Chemistry (R = residuals) GmbH Gesellschaft mit beschränkter Interference Device Haftung terpy Terpyridin GooF Goodness of Fit theo theoretisch hkl Millersche Indizes vgl. vergleiche HL Carbonsäure YAG Yttrium Aluminium Granat Hrsg. Herausgeber Z Zahl der Formeleinheiten Inc. incorporated z.B. zum Beispiel 92 Literaturverzeichnis Literaturverzeichnis [1] A.F. Holleman, N. Wiberg, Lehrbuch der Anorganischen Chemie, 101. Auflage, Walter de Gruyter, Berlin, New York (1995). [2] R. D. Shannon, Acta Cryst., A32 (1976) 751. [3] W. Klemm, Magnetochemie, Akademische Verlagsgesellschaft, Leipzig (1936). [4] H. van Vleck, The Theory of Electric and Magnetic Susceptibilities, Oxford University Press, London (1932). [5] M. Sagawa, S. Fujimura, N. Togawa, H. Yamamoto, Y. Matsuura, J. Appl. Phys, 55 6 (1984) 2083. [6] U. Müller, Anorganische Strukturchemie, 2. Auflage, B. G. Teubner, Stuttgart (1992). [7] R. Serna, M. Jimenez de Castro, J. A. Chaos, M. Fernandez, International Conference on f Elements, Abstract Book, Madrid (2000) CO7. [8] M. Virtuani, International Conference on f Elements, Abstract Book, Madrid (2000) KI1. [9] F. Fajardie, A. Seigneurin, International Conference on f Elements, Abstract Book, Madrid (2000) HP9. [10] K. Mikami, M. Terada, H. Matsuzawa, Angew. Chem. Int. Ed. 41 (2002) 3554. 93 Literaturverzeichnis [11] D. Storch, J. S. Schmitt, C. Waldherr, J. Chen, E. Toth, A. E. Merbach, J.-C. Reubi, H. R. Mäcke, 5th International Conference on f Elements, Abstract Book, Genf, Schweiz (2003) CO5-OP6. [12] F. A. Hart, F. P. Laming, J. Inorg. Nucl. Chem. 27 (1965) 1605. [13] F. A. Hart, F. P. Laming, J. Inorg. Nucl. Chem. 27 (1965) 1825. [14] P. Spacu, E. Antonescu, Rev. Roumaine Chim. 16 (1971) 373. [15] S. Lui, L. Gelmini, S. J. Rettig, J. Am. Chem. Soc 114 (1992) 6081. [16] W. Plass, G. Fries, Z. Anorg. Allg. Chem. 623 (1997) 1205. [17] A. Panagiotopoulos, T. F. Zafiropoulos, O. Kahn, Inorg. Chem. 34 (1995) 4918. [18] A. Rohde, Diplomarbeit Universität Hannover (2003). [19] J. P. Costes, A. Dupuis, J. P. Laurent, Inorg. Chim. Acta 268 (1998) 125. [20] J. P. Costes, A. Dupuis, F. Dahan, S. Lagrave, J. P. Laurent, Inorg. Chem. 37 (1998) 153. [21] F. Avecilla, C. Platas-Iglesias, R. Rodriguez-Cortinas, G. Guillemot, J. C. G. Bünzli, C. D. Brondino, C. F. G. C. Geraldes, A. de Blas, T. Rodriguez-Blas, J. Chem. Soc., Dalton Trans. (2002) 4658. [22] J. P. Costes, J. M. Clemente-Juan, F. Dahan, F. Nicodeme, Angew. Chem. 114 (2002) 333. [23] S. T. Hatscher, W. Urland, Angew. Chem. 115 (2003) 2969. [24] E. R. Birnbaum, Gmelin Handbook of Inorganic Chemistry, 8th Edition, Syst. No. 39 D5, Springer-Verlag, Berlin, Heidelberg (1984). [25] P. T. Cleve, Bull. Soc. Chim. France 21 (1874) 196. [26] H. Krischner, B. Koppelhuber-Bitschnau, Röntgenstrukturanalyse und Rietveldmethode, 5. Auflage, Vieweg Verlag, Braunschweig (1994). 94 Literaturverzeichnis [27] W. Massa, Kristallstrukturbestimmung, 2. Auflage, B. G. Teubner, Stuttgart (1996). [28] E. R. Wölfel, Theorie und Praxis der Röntgenstrukturanalyse, 3. Auflage, Vieweg Verlag, Braunschweig (1987). [29] W. Kleber, Einführung in die Kristallographie, 11. Auflage, VEB Verlag Technik, Berlin (1970). [30] R. C. Weast (Editor - in - Chief), CRC Handbook of Chemistry and Physics, 67th Edition, CRC Press Inc., Boca Raton, Florida (1987), A - 73. [31] A. L. Patterson, Phys. Rev. 46 (1934) 372. [32] D. Harker, J. Chem. Phys. 4 (1936) 381. [33] D. Sayre, Acta Cryst. 5 (1952) 60. [34] International Tables for X-ray Crystallography, Vol. III, Kynoch Press, Birmingham (1974). [35] S. Haussühl, Kristallstrukturbestimmung, 1. Auflage, Physik - Verlag, Weinheim (1979). [36] P. J. Becker, P. Coppens, Acta Cryst. A30 (1974) 129. [37] G. M. Sheldrick, SHELXL - 97, Program for Crystal Structure Refinement, Göttingen (1997). [38] P. Debye, Ann. Phys. 43 (1914) 49. [39] I. Waller, Ann. Phys. 83 (1927) 153. [40] R. X. Fischer, E. Tillmanns, Acta Cryst. C44 (1988) 775. [41] International Union of Crystallography, Acta Cryst. B38 (1982) 699. [42] G. M. Sheldrick, SHELXL - 93, Program for Crystal Structure Refinement, Göttingen (1993). 95 Literaturverzeichnis [43] STOE Powder Diffraction Software, Version 3.18 (1997). [44] L. J. Farrugia, Win GX, An Integrated System of Windows Programs for the Soulution, Refinement and Analysis of Single Crystal Diffraction Data, Glasgow (1999). [45] G. M. Sheldrick, SHELXS - 97, Program for Crystal Structure Solution, Göttingen (1997). [46] G. Bergerhoff, Diamond - Program for Exploration and Drawing of Crystal Structures, Version 2.1c (1999). [47] STOE, IPDS Software, Darmstadt. [48] J. B. Goodenough, Magnetism and the Chemical Bond, Hrsg.: F. A. Cotton, Interscience Publishers, New York, London, Sydney (1966). [49] W. Urland, Angew. Chem. 93 (1981) 205. [50] P. Gütlich, Angew. Chem. 106 (1994) 109. [51] M. Gouy, C. R. Acad. Sci. Paris 109 (1889) 935. [52] G. Quincke, Ann. Phys. 24 (1885) 347. [53] G. Quincke, Ann. Phys. 34 (1888) 401. [54] M. Faraday, Pogg. Ann. 67 (1844) 400. [55] M. Faraday, Pogg. Ann. 69 (1846) 289. [56] M. Faraday, Pogg. Ann. 70 (1847) 283. [57] M. Faraday, Pogg. Ann. Erg. Bd. 3 (1852) 73. [58] S. Broersma, Rev. Sci. Instr. 20 (1949) 660. [59] S. Foner, Rev. Sci. Instr. 30 (1959) 548. [60] R. L. Fagaly, Sci Prog., Oxford 71 (1987) 181. 96 Literaturverzeichnis [61] J. C. Gallop, SQUIDS, The Josephson Effects and Superconducting Electronics, Adam Hilger, Bristol, Philadelphia, New York (1991). [62] H. A. Bethe, Ann. Phys., 5 (1929) 133. [63] B. N. Figgis, Ligand Field Theory, in G. Wilkinson, R. D. Girard, J. A. Mc Cleverty, Comprehensive Coordination Chemistry, Vol. 1, Theory and Background, Pergamon, Oxford (1987). [64] H. Lueken, Magnetochemie, 1. Auflage, B. G. Teubner, Stuttgart (1999). [65] K. H. Hellwege, Einführung in die Festkörperphysik, 3. Auflage, Springer, Berlin (1988). [66] W. Nolting, Quantentheorie des Magnetismus, Bd. 1 und 2, B. G. Teubner, Stuttgart (1986). [67] W. Heisenberg, Z. Phys. 49 (1928) 619. [68] B. Bleaney, K. D. Bowers, Proc. Roy. Soc. (London) A214 (1952) 451. [69] A. Heinrich, Dissertation, Universität Hannover (1993). [70] W. Haberditzl, Angew. Chem. 78 (1966) 277; Angew. Chem. Int. Ed. 5 (1966) 288. [71] W. Buckel, Supraleitung, 5. Auflage, VCH Verlagsgesellschaft, Weinheim, New York, Basel, Cambridge, Tokyo (1993). [72] J. Catterick, P. Thornton, „Advances in Inorganic Chemistry and Radiochemistry“, Acad. Press., New York 20 (1977) 291. [73] Nomenklatur der Anorganischen Chemie: deutsche Ausgabe der Empfehlungen 1990 / International Union of Pure and Applied Chemistry (IUPAC), Hrsg. Gesellschaft Deutscher Chemiker, VCH, Weinheim (1995). [74] L. A. Aslanov, V. M. Ionov, I. D. Kiekbaev, Koordination Khim. 2 (1976) 1674. 97 Literaturverzeichnis [75] M. Ahlgren, U. Turpeinen, Acta. Cryst. B38 (1982) 276. [76] T. Steiner, Angew. Chem. 114 (2002) 50. [77] T. Liljefors, I. Pettersen, J. Comput. Chem. 8 (1987) 1139. [78] W. L. Jorgensen, D. L. Severance, J. Am. Chem. Soc. 112 (1990) 4768. [79] J. P. Costes, F. Dahan, F. Dahan, F. Nicodeme, Inorg. Chem. 40 (2001) 5285. [80] F. Avecilla, C. Platas-Iglesias, R. Rodriguez-Cortinas, G. Guillemot, J. C. G. Bünzli, C. D. Brondino, C. F. G. C. Geraldes, A. de Blas, T. Rodriguez-Blas, Dalton Trans 24 (2004) 4658. [81] A. Rohde, D. John, W. Urland, Z. Krist. (2005) in press. 98