Grundwissen 10
Werbung
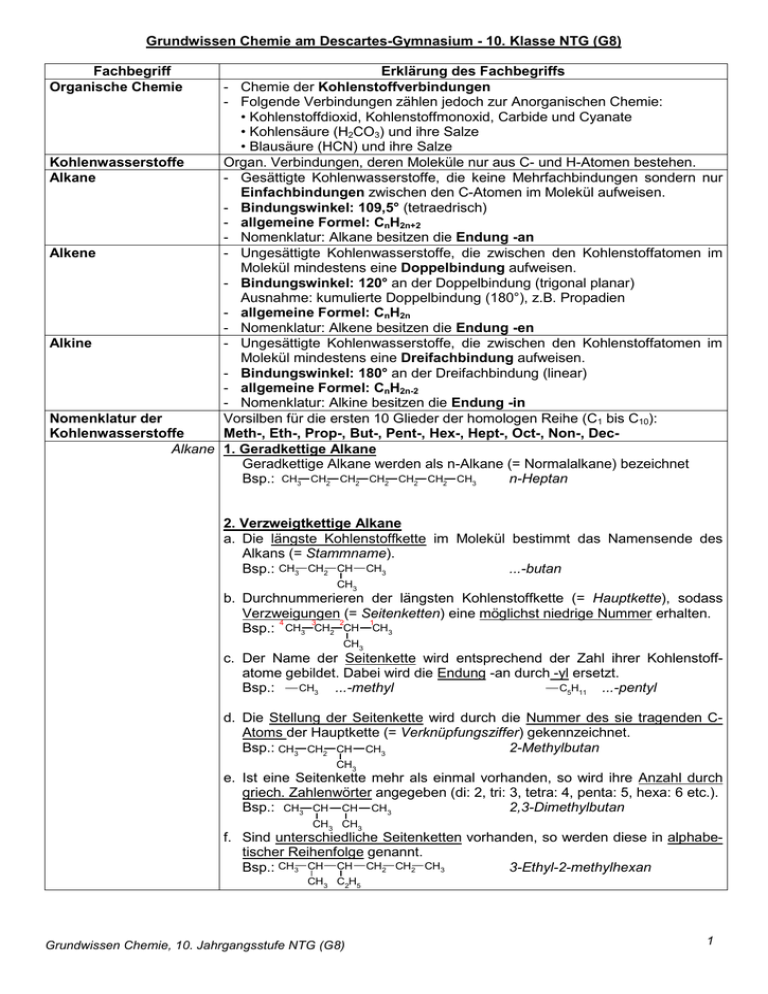
Grundwissen Chemie am Descartes-Gymnasium - 10. Klasse NTG (G8) Fachbegriff Organische Chemie Erklärung des Fachbegriffs - Chemie der Kohlenstoffverbindungen - Folgende Verbindungen zählen jedoch zur Anorganischen Chemie: • Kohlenstoffdioxid, Kohlenstoffmonoxid, Carbide und Cyanate • Kohlensäure (H2CO3) und ihre Salze • Blausäure (HCN) und ihre Salze Kohlenwasserstoffe Organ. Verbindungen, deren Moleküle nur aus C- und H-Atomen bestehen. Alkane - Gesättigte Kohlenwasserstoffe, die keine Mehrfachbindungen sondern nur Einfachbindungen zwischen den C-Atomen im Molekül aufweisen. - Bindungswinkel: 109,5° (tetraedrisch) - allgemeine Formel: CnH2n+2 - Nomenklatur: Alkane besitzen die Endung -an Alkene - Ungesättigte Kohlenwasserstoffe, die zwischen den Kohlenstoffatomen im Molekül mindestens eine Doppelbindung aufweisen. - Bindungswinkel: 120° an der Doppelbindung (trigonal planar) Ausnahme: kumulierte Doppelbindung (180°), z.B. Propadien - allgemeine Formel: CnH2n - Nomenklatur: Alkene besitzen die Endung -en Alkine - Ungesättigte Kohlenwasserstoffe, die zwischen den Kohlenstoffatomen im Molekül mindestens eine Dreifachbindung aufweisen. - Bindungswinkel: 180° an der Dreifachbindung (linear) - allgemeine Formel: CnH2n-2 - Nomenklatur: Alkine besitzen die Endung -in Nomenklatur der Vorsilben für die ersten 10 Glieder der homologen Reihe (C1 bis C10): Kohlenwasserstoffe Meth-, Eth-, Prop-, But-, Pent-, Hex-, Hept-, Oct-, Non-, DecAlkane 1. Geradkettige Alkane Geradkettige Alkane werden als n-Alkane (= Normalalkane) bezeichnet Bsp.: CH3 CH2 CH2 CH2 CH2 CH2 CH3 n-Heptan 2. Verzweigtkettige Alkane a. Die längste Kohlenstoffkette im Molekül bestimmt das Namensende des Alkans (= Stammname). Bsp.: CH3 CH2 CH CH3 ...-butan CH3 b. Durchnummerieren der längsten Kohlenstoffkette (= Hauptkette), sodass Verzweigungen (= Seitenketten) eine möglichst niedrige Nummer erhalten. 4 3 2 1 Bsp.: CH3 CH2 CH CH3 CH3 c. Der Name der Seitenkette wird entsprechend der Zahl ihrer Kohlenstoffatome gebildet. Dabei wird die Endung -an durch -yl ersetzt. C5H11 ...-pentyl CH3 Bsp.: ...-methyl d. Die Stellung der Seitenkette wird durch die Nummer des sie tragenden CAtoms der Hauptkette (= Verknüpfungsziffer) gekennzeichnet. Bsp.: CH3 CH2 CH CH3 2-Methylbutan CH3 e. Ist eine Seitenkette mehr als einmal vorhanden, so wird ihre Anzahl durch griech. Zahlenwörter angegeben (di: 2, tri: 3, tetra: 4, penta: 5, hexa: 6 etc.). Bsp.: CH3 CH CH CH3 2,3-Dimethylbutan CH3 CH3 f. Sind unterschiedliche Seitenketten vorhanden, so werden diese in alphabetischer Reihenfolge genannt. Bsp.: CH3 CH CH CH2 CH2 CH3 3-Ethyl-2-methylhexan CH3 C2H5 Grundwissen Chemie, 10. Jahrgangsstufe NTG (G8) 1 Alkene 1. Endsilbe: -en, -dien, -trien H2C CH H2C C CH3 Propen Propadien CH2 2. Die Lage der Doppelbindung wird durch die Nummer des C-Atoms gekennzeichnet, das die kleinste Nummer trägt. H3C CH2 CH2 CH CH2 Pent-1-en H2C CH CH CH2 Buta-1,3-dien 3. Verzweigtkettige Alkene a. Der Stammname des Alkens ist die längste Kette, die die Doppelb. enthält. CH3 CH2 C CH2 2-Methylbut-1-en CH3 b. Die Kette wird so durchnummeriert, dass die Doppelbindung die niedrigste Nummer erhält (und nicht die erste Seitenkette): CH3 CH CH CH2 3-Methylbut-1-en CH3 H3C CH CH2 C CH3 H2ClC CH2 2-Ethyl-4-methylpent-1-en CH2 CH3 CH CH2 C CH3 CH CH2 CH3 6-Chlor-3-ethyl-5-methylhex-2-en CH3 4. Bei Alkenen mit symmetrischem Stammsystem erhält die Seitenkette die niedrigere Nummer. H3C CH2 CH CH CH CH3 2-Methylhex-3-en CH3 H2C CH C CH2 2-Methylbuta-1,3-dien CH3 Alkine - Nomenklatur analog der Nomenklatur der Alkene (s.o.): Beispiel: H3C C C CH CH3 4-Methylpent-2-in CH3 Radikalische Substituti- Beispiel: Chlorierung von Methan on bei Alkanen A Summengleichung: CH4 + Cl2 → H3C-Cl + HCl↑ 2. Kettenreaktion (= Reaktionskette = Kettenfortpflanzung): a) Reaktion des Halogenradikals: H3C-H + •Cl → H3C• + HCl b) Reaktion des Alkylradikals: B Ablauf / Mechanismus: H3C• + Cl-Cl → H3C-Cl + •Cl c) Mehrfachsubstitution: 1. Startreaktion (Kettenstart): ClH2C-H + •Cl → ClH2C• + HCl Homolyse bei Licht / hoher Temp. ClH2C• + Cl-Cl → ClH2C-Cl + •Cl 4. Kettenabbruch (Kettenstopp): Cl—Cl → Cl• + •Cl Kombination der Radikale a) Cl• + •Cl → Cl-Cl Chlormolekül Chlorradikale b) H3C• + •Cl → H3C-Cl c) H3C• + •CH3 → H3C-CH3 etc. Isomerie Phänomen, dass mehrere Verbindungen trotz gleicher Summenformel einen unterschiedlichen Molekülbau und infolgedessen unterschiedliche (physikalische und chemische) Eigenschaften aufweisen Konstitutionsisomerie - Typ von Isomerie, bei der die Atome im Molekül unterschiedlich miteiCH3 nander verknüpft sind. CH CH3 2-Methylpropan CH CH CH CH - Beispiel: n-Butan 3 CH 3 2 2 3 Stereoisomerie Typ von Isomerie, bei der die Atome trotz gleicher Verknüpfung zueinander räumlich unterschiedlich angeordnet sind. E-Z-Isomerie Typ der Stereoisomerie, bei der die unterschiedliche räumliche Anordnung der (veraltete Bezeichnung: Atome auf der gehinderten Rotation um eine C-C-Doppelbindung beruht: Cl H Cl Cl cis-trans-Isomerie) C C C H H Z- bzw. cis-1,2-Dichlorethen Grundwissen Chemie, 10. Jahrgangsstufe NTG (G8) Cl C H E- bzw. trans-1,2-Dichlorethen 2 Elektrophiles Teilchen - wörtliche Übersetzung: "elektronenliebendes Teilchen" - Kation oder positiv polarisiertes Teilchen - Angriff an einem Ort hoher Elektronendichte (z.B. Doppelbindung) möglich Nukleophiles Teilchen - wörtliche Übersetzung: "kernliebendes Teilchen" - Anion oder Teilchen mit einem freien Elektronenpaar - Angriff an einem Ort erniedrigter Elektronendichte Elektrophile Addition Beispiel: Bromierung von Ethen bei Alkenen A Summengleichung: H2C=CH2 + Br2 → BrH2C-CH2Br B Ablauf / Mechanismus: 1. Angriff des Elektrophils: Br Br Br δ- Br C POLARISIERUNG C Br C + δ+ HETEROLYSE C Br C C (Bromonium-Ion) 2. Angriff des Nukleophils: Br Br C C C Br C Br Alkohole Organische Moleküle mit mindestens einer Hydroxy(l)-Gruppe (-OH) - Primäre Alkohole: • OH-Gruppe an einem endständigen C-Atom • oxidierbar zum Aldehyd oder zur Carbonsäure - Sekundäre Alkohole: • OH-Gruppe an einem C-Atom, das mit zwei weiteren C-Atomen verbunden ist • oxidierbar zum Keton - Tertiäre Alkohole: • OH-Gruppe an einem C-Atom, das mit drei weiteren C-Atomen verbunden ist • nicht oxidierbar δCarbonylverbindungen - Sie enthalten eine Carbonylgruppe (C=O) im Molekül. O - Dazu gehören Aldehyde = Alkanale (z.B. Ethanal H3Cδ+ R C CHO) und Ketone = Alkanone (z.B. Aceton H3C-CO-CH3). H - Das C-Atom der Carbonylgruppe ist positiv polarisiert Fehlingprobe - Nachweisreaktion für Aldehyde = Alkanale durch Mischung von: • Fehling I = Lösung von Kupfer(II)-sulfat • Fehling II = Lösung von Kalium-Natrium-Tartrat und Natriumhydroxid - Bei Erwärmen mit einem Aldehyd wird dieser zur Carbonsäure oxidiert und die Kupfer(II)-Ionen zu rotem Kupfer(I)-oxid (Cu2O) reduziert: Ox.: R-CHO + 2OH→ R-COOH + 2e- + H2O 2+ Red.: 2Cu + 2e + 2OH → Cu2O + H2O 2+ Redox: 2Cu + 4OH + R-CHO → Cu2O + 2H2O + R-COOH Nukleophile Addition A Summengleichung: R R bei O C HO C X + X H Carbonylverbindungen R' Carbonylverbindung R' Addukt Nukleophil B Ablauf / Mechanismus: 1. Nukleophiler Angriff: am positiv polarisierten C-Atom der Carbonylgruppe δ- O R δ+ R C R' + O C X H X H R' 2. Intramolekulare Protonenübertragung (Umlagerung): R O C X H R' Grundwissen Chemie, 10. Jahrgangsstufe NTG (G8) R HO C X R' 3 Carbonsäuren - Organische Moleküle mit mindestens einer Carboxy(l)-Gruppe (-COOH). - Carbonsäuren reagieren sauer: O O R C δO δ+ + R H2O O H Carbonsäure Ester H3O + + C Carboxylat-Anion - Ester entstehen bei der Reaktion einer Carbonsäure mit einem Alkohol. Veresterung / Kondensation O R C O R + O H C + Esterhydrolyse H O R H O H O R Carbonsäureester - Ester können umgekehrt mit Wasser wieder zu den Ausgangsstoffen reagieren (Esterhydrolyse). => Einstellung eines Ester-Gleichgewichts, bei dem Esterbildung und Esterhydrolyse in gleichem Maße ablaufen Kohlenhydrate Monosaccharid Bildung der Ringform durch intramolekulare nukleophile Addition: (Beispiel: Glucose) CHO H C OH H C OH HO C H OH H C OH OH H C CHO H C OH HO C H OH H C OH H C H C OH HO C H H C H C CH2OH CH2OH Glucose (Aldehydform) O CH2OH O H H OH H H OH OH CH 2OH Ringschluss OH Glucose (Ringform) Disaccharid Bildung formal durch Kondensation zweier Glucose-Moleküle: CH2OH CH2OH CH2OH (Beispiel: Maltose) H OH O H H OH H + H OH H OH OH H H OH H Glucosemolekül 1 Kondensation O H H OH H OH Hydrolyse OH O H H OH H O H Glucosemolekül 2 H CH2OH H OH O H + H H2O OH OH H OH Disaccharid (Maltose) Wasser Polysaccharid Bildung formal durch Kondensation vieler Glucose-Moleküle: CH2OH CH2OH CH2OH CH2OH (Beispiel: Stärke) H O O H H OH H O H Aminosäuren OH O H H OH O H OH O H H H O H OH OH O H H OH H O H OH -Aminocarbonsäuren = 2-Aminocarbonsäuren In natürlich vorkommenden Proteinen findet man 20 verH 2N C H schiedene Aminosäuren, die sich in ihren Resten (R) unterscheiden. R Entsteht durch Wasserabspaltung (Kondensation) zw. der Carboxy-Gruppe einer Aminosäure und der -Aminogruppe einer anderen Aminosäure: H2N - CH O Kondensation C O H+ H R Aminosäure 1 Fette H H H COOH 2 Peptidbindung H Peptidbindung O N CH H R' COOH H2N CH C R Aminosäure 2 N CH H R' COOH + H2O Dipeptid Wasser Durch fortgesetzte Kond. bilden sich Polypeptide bzw. Proteine (=Eiweißstoffe). - Fette sind Tri-Ester aus langkettigen Carbonsäuren (= Fettsäuren) und dem dreiwertigen Alkohol Glycerin (= Propan-1,2,3-triol). - Die alkalische Hydrolyse (Verseifung) von Fetten liefert Glycerin und Seifen: O H2C O C O R O HC O C R' + 3 NaOH (aq) Hydrolyse H2C O H HC O H Na O Na O O C Fett Grundwissen Chemie, 10. Jahrgangsstufe NTG (G8) R O + O H2C C C R' O R'' H2C Natronlauge O Glycerin H Na O C R'' Seife 4

![6.3.1 1-Oxa-spiro[2.5]octan - Institut für Organische Chemie](http://s1.studylibde.com/store/data/001356875_1-96e669e5c88ad586db9f9f199d424d05-300x300.png)









