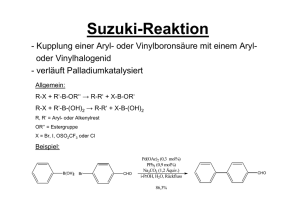
Katalyse - Metallorganik I
Werbung

Prinzipien in der Katalyse 1. Die 18 Elektronenregel Übergangsmetalle können max. 18 Elektronen in ihrer äußeren Schale haben Katalyse - Metallorganik I z. B. 3. Periode: 4s2 , 4p6 ==> Ligandenbeitrag; 3d10 ==> Metallbeitrag Oliver Reiser Universität Regensburg 8 Elektronen 10 Elektronen 18 Elektronen vgl. Oktettregel bei Hauptgruppenelementen ==> max. 8 Elektronen P-1 Polarisierung von Metall-Liganden Bindungen Das Zählen von Elektronen in Metallkomplexen Atom Elektronegativität Atom Elektronegativität 2 mögliche Formalismen: Li 1.0 Si 1.9 (1) Liganden werden als neutrale Einheiten vom Metall abgetrennt. Ti 1.5 B 2.0 V 1.6 H 2.1 Cr 1.7 P 2.2 Mn 1.6 C 2.5 Fe 1.8 N 3.0 Co 1.9 Cl 3.2 Ni 1.9 O 3.5 F 4.0 Ich bevorzuge jedoch Metalle (2) Liganden werden mitsamt ihrem Bindungselektronenpaaren vom Metall abgetrennt. Klassifikation in (a) positiv geladene NO (b) neutrale CO, PR3 , CR2 (Carben) (c) anionische Liganden Weniger Elektropositiv Stärker Elektronegativ H, Alkyl, Aryl, Vinyl, Alkinyl, Acyl, F, Cl, Br, I, CN Daher... Liganden δ+ M alle Liganden wirken als 2 Elektronendonoren P-2 δ– Ligand Bindungselektronen sind stärker am Liganden lokalisiert P-3 Beispiele Ligandentypen Liganden Anzahl der Elektronen CH3 , Cl, OMe, C6 H5 (sp Orbital am C) C O H2 C CH2 (š-Orbital) oder Me O O M ⇒ Komplex ist neutral, daher Fe in der Oxidationsstufe +2 2 ⇒ Eisen(II) = d6 Konfiguration = 6 Elektronen Fe ⇒ Gesamtelektronen = 6 (Fe) + 2x6 (CP's = 18) 2. Cobalticinium Ion jedes Cp– hat 6 Elektronen ⇒ Komplexladung = +1, daher Co in der Oxidationsstufe +3 4 ⇒ Co(III) = d6 = 6 Elektronen ⇒ Gesamtelektronen = 6 (Co) + 2x6 (Cp's) = 18 M H H Cp2 Co+ 4 M PPh2 Ph2 P M H jedes Cp– hat 6 Elektronen 2 4 O M or 2 Cp2 Fe Me = O M = M 1. Ferrocen 6 Co 3. CpFe(CO)2 CH3 H H M M η5 -Cyclopentadienyl oder "Cp" ⇒ Cp– = 6, 2xCO = 2x2 = 4, CH3 – = 2 Elektronen ⇒ Komplex ist neutral, daher Fe in der Oxidationsstufe +2 6 P-4 ⇒ Eisen(II) = d6 = 6 Elektronen ⇒ Gesamtelektronen = 6(Fe) + 6(CP) + 4(CO) + 2 (Me) = 18 OC Fe CH3 OC P-5 1 Bindungsmotive Beispiele Cl 4. Ni = Ni Ni Cl ηx= "hapto-x" = Haptizität Ni Cl η1 -Allyl M jedes Allylanion hat 4 Elektronen, jedes Cl– = 2 +2 Elektronen ⇒ Komplex neutral, daher Ni = +2 ⇒ Ni(II) = d8 = 8 Elektronen ⇒ Gesamtelektronenzahl = 8 (Ni) + 4 (Allyl) + 4 (Cl) = 16 η3-Allyl oder "š-Allyl" M η 2-Alkene CO CO OMe OC Cr Me OC CO 5. η= "eta" = griechisch für "h" Haptizität = # der Bindungspunkte Cl M = Fischer Carbenkomplex η 4-Diene M jedes CO = 2 Elektronen, Carben = 2 Elektronen ⇒ Komplex neutral, daher Cr = 0 ⇒ Cr(0) = d6 = 6 Elektronen η 5-Cyclopentadienyl = "Cp" M ⇒ Gesamtelektronenzahl = 6 (Cr) + 5x2 (CO) + 2 (Carben) = 18 η 6-Aren P-6 P-7 M š-Rückbindungen = Ligand als Elektronakzeptor σ-Donor Bindungen: Der Ligand als Elektrondonor zwischen leeren Liganden- und vollen Metallorbitalen Metalorbital liegt auf der Bindungsachse Drei Typen von π-Rückbindungen: Drei Typen von σ-Bindungen: 1. Metall wirkt als Donor in ein š* anti-bindendes Orbital, z. B. H2 C=CH2 1. Ligand wirkt als Donor auf der Bindungsachse (e.g., CH3 , PPh3 , CO) H H H M Ph M oder P PhPh HH oder M M CO π∗CC H H 2. Metall wirkt als Donor in ein š* anti-bindendes Orbital, z. B. CO 2. š-Bindung wirkt als Donor auf der Bindungsachse (e.g., H2 C=CH 2) H H M M π∗CO O C H H 3. Metall wirkt als Donor in ein σ* anti-bindendes Orbital, z. B. H2 3. σ-Bindung wirkt als Donor auf der Bindungsachse (e.g., H2, CH4 ) H M H σHH M P-8 H P-9 σ∗HH H Komplexgeometrien š-Rückbindung – Physikalische Eigenschaften Beeinflußt durch sterische und elektronische Effekte. (1) IR Streckschwingungen Liganden nehmen möglichst großen Abstand voneinander ein. je schwächer die Bindung, desto niedriger die Streckschwingung 1. 2-fach Koordination = linear νC O (cm –1 ) Verbindung 1908 (CO) 5W←OEt2 (CO) 5W←PMe3 CH3 –Zn–CH3 2. 3-fach Koordination CO Bindung wird stärker ==> Rückbindung vom Metall zum CO wird schwächer d 1947 (CO) 5W←P(OPh)3 1965 (CO) 5W← CH2 CH2 1973 10 Ph3 P = trigonal planar Ph3 P d8 = T-form d10 = tetraedrisch PPh3 Rh 14-Elektronen, d8 -Komplex Ph3 P OC Ni OC pKa (MeCN) CO CO PPh3 PPh3 Pd 15.4 18-Elektronen, d10 -Komplex Ph3 P Cl 8.4 H—Co(CO) 3 [P(OPh) 3] 11.4 H—Co(CO) 3 [PPh3 ] 16-Elektronen, d10 -Komplex 3. 4-fach Koordination (2) Azidität von Metallhydrid Komplexen H—Co(CO) 4 PPh3 PPh3 Ph3 P ⇒ Abnahme der "š=Azidität" (Fähigkeit, Rückbindungen zu akzeptieren) = Alken > Phosphit > Phosphan > Ether Verbindung Pt ⇒ Stärke der Rückbindung zum anderen Liganden (nicht CO) steigt d8 = quadratisch planar Steigende Fähigkeit der Liganden, die konjugierte Base durch Rückbindung zu stabilisieren. Ph3 P Ph3 P P-10 Rh PPh3 16-Elektronen, d8 -Komplex = Wilkinson Katalysator P-11 2 Reaktionsmechanismen Komplexgeometrien (1) Ligandenaustausch 4. 5-fach Koordination trigonal bipyramidal (normal), quadratisch pyramidal möglich L L M L CO OC Fe CO + L L 1 L1 CO L 5. 6-fach Koordination = oktaedrisch L M L L L1 + CO CO CO OC L L M L L n Elektronen L L L L M L1 L L L M L 1 + L L n+2 Elektronen Ausgangskomplex kann (a) höchstens 16 Elektronen haben und muß (b) eine freie Koordinationsstelle aufweisen 18-Elektronen, d 6 -Komplex Cr + L Assoziativ 8 18-Elektronen, d -Komplex CO OC L1 M L L CO N Et3 P 6 OC Fe OC 18-Elektronen, d -Komplex Cl CH3 M Et 3P N Cl Et 3P Cl M Cl PEt3 PEt3 N M Cl PEt3 Cl P-12 Bindungswinkel = 90° P-13 Austauschgeschwindigkeiten: M = Ni > Pd > Pt Reaktionsmechanismen Reaktionsmechanismen (1) Ligandenaustausch L (2) Oxidative Addition / Reduktive Eliminierung L M L + L L1 M L L L1 + + Mn L L A B Oxidative Addition A Mn+ 2 B • Oxidation des Metalls • Zwei Liganden werden in die Koordinationsphere aufgenommen n = Oxidationszahl Dissoziativ L L –L L M L L L n Elektronen +L1 M L M L L Ausgangskomplex muß mehr als 2 d-Elektronen besitzen und 2 freie Koordinationsstellen aufweisen L1 L n-2 Elektronen Reduktive Eliminierung Mn+ 2 A –CO Ni(CO) 3 Ni(CO)3 (PR 3 ) P-14 P-15 Reaktionsmechanismen + A B Oxidative Addition Reaktionsmechanismen (2) Oxidative Addition / Reduktive Eliminierung A Mn+ 2 B Mn Substrate für Oxidative Additionen + A B Oxidative Addition A Mn+ 2 M0 H H M0 H H M2 H H H–H, R3Si–H, R–H cis-Addition Addition verläuft unter Retention (b) polare Verbindungen SN 2-Mechanismus O R X X = I, Br, Cl, OTf, OP(O)(OR)2 M0 (c) Mehrfachbindungen Cl Ir M0 B Konzertierter Mechanismus (unpolare Bindungen) (a) unpolare Verbindungen H–X, R–X, B Reduktive Eliminierung ist die Umkehr der Oxidativen Addition PR3 (2) Oxidative Addition / Reduktive Eliminierung Mn A • Reduktion des Metalls • Zwei Liganden werden aus der Koordinationsphere eliminiert normalerweise bei 18 Elektronenkomplexen langsamer als assoziative Austauschreaktionen Ni(CO)4 + Mn B R3 P M2 Liganden, die die Elektronendichte am Metall erhöhen, beschleunigen die oxidative Addition P-16 PR3 CO "Vaska's Komplex" 16 Elektronen d8, Ir(I) M2 R R X I Me Me–I Cl R3P M PR3 CO Me Cl M R3 P PR3 CO I 18 Elektronen d6, Ir(III) P-17 3 Reaktionsmechanismen Reaktionsmechanismen (2) Oxidative Addition / Reduktive Eliminierung (3) Insertion / Deinsertion Alkene M n + A Oxidative Addition B A Mn+ 2 B Insertion X X M M Deinsertion Protonierung CO M0 M H X 2 X H X O M2 H "insertion" C X X "deinsertion" M O C M "When a Proton is not a Proton", B. M. Trost, Chem. Eur. J. 1998, 4, 2405. Insertion in die M–X Bindung: Elektronenzahl von M ändert sich von n auf n–2 X und Ligand: cis und weitgehend coplanare Stellung erforderlich X wandert unter Retention Deinsertion in 18 Elektronenkomplexen nicht möglich Geschwindigkeit der Insertion keine Änderung der Oxidationsstufe von M Liganden, die die Elektronendichte am Metall erhöhen, verlangsamen die reduktive Eliminierung Liganden, die die Elektronendichte am Metall erniedrigen, beschleunigen die reduktive Eliminierung O > z. B. CO oder R > > P-18 P-19 Reaktionsmechanismen Reaktionsmechanismen (3) Insertion / Deinsertion: β-Hydrideliminierung (4) Transmetallierung Ligandenaustausch zwischen Metallen R β H β-Hydrideliminierung α R H L* M* + L M M* + *L L M M M Metathesemechanismus Oft anzutreffender Reaktionspfad in Übergangsmetallkatalysen L Voraussetzungen: *M 16 Elektronen oder weniger + L L M *M L* M *M L* + M L* cis-Anordnung von M und H in der Regel wird ein Ligand von einem Hauptgruppenelement auf ein Übergangsmetall übertragen, z.B.: coplanare Anordnung von M und H R Pd X + Bu3Sn R1 –Bu3SnX R Pd R1 Stabile Organometallverbindungen M Me häufige Hauptgruppenelemente Li, Mg, B, Si, Sn, Zn, Hg R M M CH2 SiMe3 M CH2CMe3 oft der geschwindigkeitsbestimmende Schritt in Katalysen M M R P-20 P-21 Warum Palladium? Preis Ni < Pd << Rh, Os, Ru, Pt Stabilität Pd(0)-Komplexe relativ luftstabil, z. B. im Gegensatz zu Ni(0)-Komplexen Spezielle Eigenschaften von Palladium in der Katalyse Anwendung Besonders vielseitig für C–C-Verknüpfungsreaktionen Hohe Toleranz gegen funktionelle Gruppen Verfügbarkeit als stabile und kommerziell erhältliche Ausgangssalze wie Pd(OAc)2 oder PdCl2 Pd-1 4 Palladium(0)komplexe Liganden für Palladium(0)komplexe Vorläufer können Palladium(II)salze sein, Darstellung von Pd(0) in situ P-Liganden Ausgangsmaterial: Pd(OAc) 2 PBu3 Bei Bedarf Umkristallisation aus Benzol (Lösen in heißem Benzol, Abtrennung der unlöslichen Bestandteile und Einengen der Lösung) > PPh3 P Pd(OAc)2 + PPh3 + H2 O Pd(0) + Ph3 PO > P(OR) 3 Elektronenreicher Ph2 P + 2 AcOH Ph2 P SO 3H NMe3 SO3H X 3 J. Mol. Cat. 1990, 59, 1 T. Hayashi, Chem. Lett. 1992, 2177 wasserlösliche Phosphanliganden Als Reduktionsmittel können aber auch Amine oder Alkene fungieren Pd(OAc)2 + THF oder PBu3 Pd(0) Review: W. Herrmann, Angew. Chem. Int. Ed. Engl. 1993, 32, 1524 PPh2 O=PBu3 Benzol Ph2 P PPh2 Ph2 P sehr aktive, Liganden-freie, aber instabile Pd(0)-Spezies PPh2 Ph2P PPh2 PPh 2 dppe J. Tsuji, Tetrahedron Lett. 1993, 34, 2513 dppp dppb dppf Pd-3 2-zähnige Liganden --> Bißwinkel Pd-2 Bißwinkel in Metallkomplexen Chirale Liganden für Palladium(0)komplexe L P-Liganden M OCH3 H3C CH3 L H 3C PPh2 PPh2 L,M,L = Bißwinkel Ph2 P CH 3 PPh 2 O P O H3 CO P Ph2P PPh2 je kleiner der Bißwinkel, desto kleiner die sterische Hinderung BINAP (1) L Ni L Ni L L CHIRAPHOS (2) diPAMP (4) DIOP (3) L KD L 25°C O. Reiser, Nachr. Chem. Tech. Lab. 1996, 44, 380-88. L R. Noyori, H. Takaya, Acc. Chem. Res. 1990, 23, 345-350. 1 L= P(OEt)3 P(O-p-tolyl)3 P(O-iPr)3 P(O-o-tolyl)3 D. Cai et al., J. Org. Chem. 1994, 59, 7180-7181. PPh3 D. Cai et al., Tetrahedron Lett. 1995, 44, 7991-7994. Bißwinkel [°] KD 109 128 <10-10 6 x 10-10 130 2.7 x 10-5 141 4 x 10-2 145 Pd-5 kein NiL4 Pd-4 Chirale Liganden für Palladium(0)komplexe Chirale Liganden für Palladium(0)komplexe P-Liganden P,N-Liganden Ph 2P R 1 Fe Ph2 P N PPh 2 N(CH 3 )2 R O N(CH3)2 CH3 O O VALPHOS ( R = iPr) t-LEUPHOS (R = tBu) PHEPHOS (R = C6 H5 CH2 ) OH O N + N BPPFA PPh2 PPh 2 Ph P 2 H2 N NH2 J. M. J. Williams, Synlett 1996, 705-722 G. Helmchen, Amgew. Chem. 1997, 109, 2199 1 a) B. M. Trost, R. Madsen, S. G. Guile, A. E. H. Elia, Angew. Chem. 1996, 108, 1666. b) B. M. Trost, Z. P. Shi, J. Am. Chem. Soc. 1996, 118, 3037. A: Pfaltz, Tetrahedron Asymmetry 1994, 5, 573 Pd-6 Pd-7 5 Stille Reaktion R1 SnBu3 Pd(0) R2 X + 1 R1 R2 X SnBu3 + R R = Y O 2 R R R = Y Stille, J. K.; Milstein, D. J. Am. Chem. Soc. 1978, 100, 3636. K. C. Nicolaou, Chem. Eur. J. 1995, 1, 318. Me Stille Kupplung Me I I Me O O HO O OMe N OH O Me SnBu3 20 mol% Pd(MeCN)2Cl2 i-Pr2 NEt OMe Me 25 °C DMF/THF OH 48 hours O O O Me Bu3Sn Me Me Me OMe Me O O HO O OMe N O O O OMe OH O Me Me OH Me Me OMe rapamycin, 27% Reviews: Farina, V.; Krishnamurthy, V.; Scott, W. J. in Organic Reactions, Volume 50; L. Paquette et al., Eds. Wiley: New York, 1997; p 1. Mitchell, T. N. Synthesis 1992, 803. Mechanismus der Stille Reaktion Katalysecyclus Katalysator: entweder Pd(0) oder Pd(II) kann eingesetzt werde Pd(0) ist jedeoch die katalytisch aktive Spezies Pd(0)Ln R1 Wie wird Pd(0) aus Pd(II) erzeugt? R1 SnBu3 + R 1 SnBu3 +PdX 2 R 1 1 + R 2 X SnBu3 + Pd(0) R2 + R2X Oxidative Addition Reduktive Eliminierung Diese Reaktion erzeugt Pd(0) und hat auch selbst präparative Bedeutung R2 PdII R1 + XSnBu3 McDermott, T. S.; Mortlock, A. A.; Heathcock, C. H. J. Org. Chem. 1996, 61, 700. H N H H N H SnBu3 H 20 mol% CuI Luftsauerstoff 34% H SnBu3 Transmetallierung H NH HN H 10 mol% PdCl2(PPh3 ) 2 R2 PdII X + R1 SnBu3 H H Oxidative Addition papuamine (a) Amatore, C.; Azzabi, M.; Jutand, A. J. Am. Chem. Soc 1991, 113, 8375. Luftsauerstoff oxidiert Pd(0) zu Pd(II) (b) Amatore, C.; Jutand, A.; Suarez, A. J. Am. Chem. Soc. 1993, 115, 9531-9541. S-3 S-2 Mechanismus der Oxidativen Addition Mechanismus der Oxidativen Addition Pd(0)Ln + 2 R X R 2 II Pd Pd(0)Ln + X R 2X R2 PdII X oxidative Addition Pd(0) Quelle: Pd(dba)2 or Pd2 (dba)3 •CHCl3 Pd(PPh3 )3 Pd(PPh3 ) 4 Festkörper + PPh3 Pd(PPh3 ) 2 Lösung + 2 PPh3 löslich, gut handhabbar O Aktive Species Ph O dba = Dibenzylidenaceton = Ph Ph Halogenidionen (Cl– , Br– ) beschleunigen die Bildung der aktiven Species L L Pd L trans L = PPh3 L Pd cis Pd(0) L + Br R L Pd Oxidative Addition Br cis R Pd Pd(dba)2 = Ph L R Br Pd Ph O Ph dba ist ein besserer Ligand für Palladium als PPh3 ! Oxidative Addition langsamer als bei Pd-phosphin Komplexen L trans (dba ist ein š-Akzeptor und σ-Donor, PPh3 ist nur ein σ-Donor) Pd(II) Oxidative Addition: Retention der Stereochemie an Alkylhalogenid mit Alkylhalogeniden keine konzertiere Addition, Ein-Elektronenmechanismus wahrscheinlich Pd(dba) 2 + 2 PPh3 ergibt einen weniger aktiver Katalysator Pd(PPh 3 )4 S-4 Amatore, C.; Jutand, A.; Khalil, F.; M'Barki, M. A.; Mottier, L. Organometallics 1993, 12, 3168. S-5 6 Mechanismus der Transmetallierung + R1SnBu3 II R2 Pd X II 1 R2 Pd R Mechanismus der Transmetallierung + XSnBu3 2 stufiger Mechnismus in der Regel geschwindigkeitsbestimmend! L II Ph Pd Parameter 1. Liganden Keq I Ph Pd L I Pd2 (dba)3 + II I + L L je stärker L bindet, desto kleiner Keq 16-Elektronen SnBu3 Ligand Ph PdII kr el Ligand I + MeO < 0.1 P 3 1 Ph3P O P 3 Ph PdII SnBu3 L 14-Elektronen Bindungsstärke des Liganden nimmt zu Die 14-Elektronen Species wird transmetalliert, nicht die 16-Elektronen Species! 105 Farina, V. Pure Appl. Chem. 1996, 68, 73. S-6 Ph3 As 1100 + Bu3 SnI L S-7 Farina, V. Pure Appl. Chem. 1996, 68, 73. Effekt von Cu(I) auf die Transmetallierung in Dioxan Reduktive Eliminierung krel Ligand und Additiv PPh3 1 PPh3, CuI 100 AsPh3 1 AsPh3, CuI 1 CuI bindet gut an PPh3 +L Ph PdII CuI bindet schwach an AsPh3 L SnBu3 Cu Cu + L schnell NMP + Ph PdII L –L L 14-Elektronen CuI fängt PPh3 ab, Oxidative Addition wird beschleunigt CuI Ph PdII ISnBu3 Ph + langsam L +L PdII PdII L + Ph L Elektronenarme Pd(II)-Komplexe gehen schneller eine reduktive Eliminierung ein transmetalliert zu Pd schneller als PhSnBu3 D. Milstein, J. K. Stille J. Am. Chem. Soc. 1979, 101, 4981. CuI katalysiert die Transmetallierung S-9 S -8 L. S. Liebeskind, J. Org. Chem. 1990, 55, 5359. Anwendungen der Stille Reaction PtBu3 und CsF in der Stille Reaktion 1. Halogenide: I > Br >> Cl Pd2 (dba) 3 (1.5 mol%) OTIPS Et Me O O Bn OTIPS I + N OTBS O SnBu3 O Et Pd2 (dba) 3 , CdCl2 i-PrN(Et2 ) NMP 65 % CdCl2 hat einen ähnlichen Effekt wie CuI Me PtBu 3 (6 mol%) Cl OTIPS + R R SnBu 3 CsF (2.2 equiv) OTIPS Dioxan, 80-100°C O O 12-48 h O O N Me Bn Me Bu n MeO H2N Me O OTBS 87% 80% 82% 61% 71% Evans , D. A.; Black , W. C. J. Am. Chem. Soc. 1992 , 114 , 2260. S-10 Pd(OAc)2 weniger geeignet als Pd2(dba)3 G. Fu, Angew. Chem. 1999, 111, 2569 S-10a 7 Anwendungen der Stille Reaktion PtBu3 und CsF in der Stille Reaktion 1. Halogenide: Säurechloride + R SnBu 3 MeO R R PtBu3 (6 mol%) O + R1 SnBu3 Pd 2(dba)3 (1.5 mol%) Cl 2 O Pd catalyst Cl R 2 R1 + Cl SnBu3 R1 = Alkyl, Alkenyl, Aryl, Alkynyl, H MeO CsF (2.2 equiv) R2 = Alkyl, Alkenyl, Aryl, Alkynyl Dioxan, 100°C Pd-Katalysator nicht immer nötig 48 h OEt Bun Ph R2COCl NHBoc MeO 98% MeO MeO MeO 87% HN 94% 82% O O SnMe3 NHBoc HN Pd2 dba3 •CHCl3 K2 CO3 i-Pr2 NEt O O R O 2 O O K2CO3 und i-Pr 2NEt wurden zur Stabilisierung des Ausgangsmaterials hinzugegeben S-11 Plunkett, M. J.; Ellman, J. A. J. Am. Chem. Soc. 1995, 117, 3306. G. Fu, Angew. Chem. 1999, 111, 2569 S-10b Solution Phase Combinatorial Synthesis PEG unterstützte Stille Reaktion O I Me Ph Stille Rxn O Me O n O n KCN/MeOH R1 Pd(PPh3 )4 Bu3 Sn transesterification R2 40-70% + R2 NH BHT Dioxan, 100°C R2 O R1 HN O R1 HN + O (n-Bu)3SnPh O O I But SnBu3 BHT = OH Me But Ph Me O O OH n O RO Abfiltrieren aus Ether I R1 R2 Anwendung der Stille Reaktion R1 S N Cl CO2 CHPh2 O 1. LiNi-Pr 2 R2 O HO O O 1. LiNi-Pr2 (< 1 equivalent) Me3 Sn OTf Me 2. Tf2 O NHBoc H N + R 1–SnBu3 OTf R1 2. Tf2 O R2 Tf = CF3 SO2 X = I, Br, Cl (sogar OAc) Me O S-11b 2. Triflate Regioisomere möglich, in der Regel erfolgt Substitution am primären C O R2 total of 64980 compounds 1. Halogenide: Allylhalogenide HO DMF, 100°C D. Boger, J. Org. Chem. 1999, 64, 7094 Anwendungen der Stille Reaktion NHBoc H N R2 40-80% S-11-a X R1 HN NH O Janda, K. D. Chem. Rev., 1997, 97, 489-509. Janda, K. D. Chem. Rev., 2002, ASAP. R O R1 Pd/C, NEt 3 HN S R1 N SiMe3 SiMe3 Pd(PPh3 )4 LiCl THF, ∆ Me W. D. Wulff Tetrahedron Lett. 1988, 29, 4795. CO2 CHPh2 Triflate als Ausgangsmaterialien für Stannane • 10 Beispiele, 60-98% OTf Me V. Farina J. Org. Chem. 1990, 55, 5833. S-12 Me3 Sn SnMe3 Pd(PPh3 ) 4 LiCl, Li2 CO3 oder (Me3 Sn)2 Cu(CN)Li2 SnMe3 Me W. D. Wulff J. Org. Chem. 1986, 51, 277. S-13 8 Arylstannane Anwendungen der Stille Reaktion 2. Triflate I H SnBu 3 PdCl 2(PMePh 2)3 (3 mol%) + + + Bu3SnH KOAc (3 equiv) NMP, Raumtemp. R 3-9% 70-94% 16 h Ar Ar R R 0% Me Me Me SnMe3 Me O O OH Me Me O 30°C 5 min OTf R = OMe, H, NH2, CO2 Et, Me O Me (Ph3P) 4Pd (cat.) Me Me Me 81% Me Me Dolastane Diterpen ArI Piers, E.; Friesen ,R. W. J. Org. Chem. 1986, 51, 3405 ArSnBu3 Pd(0) 3. Iodonium Verbindungen Ar-Pd-I Ar-Pd-SnBu3 KOAc Bu3 SnOAc Bu3SnH I Ph BF4 Ph + SnBu3 Ph DMF, 25 °C 79% Ar-Pd-OAc Bu 3Sn SnBu 3 Pd(MeCN)2 Cl2 S-14 KI P. J. Stang J. Am. Chem. Soc. 1993, 115, 11626. S-30b Y. Masuda, Synlett 2000, 1043 Anwendungen der Stille Reaktion 4. Alkylhalogenide: sind normalerweise nicht reaktiv genug Anwendungen der Stille Reaktion Ausnahme: OMe Ph + Ph SnBu3 Cl OMe Pd(PPh3)4 aktivierte Alkylstannane: Ph 65% MeO SnBu3 NC SnBu3 Ph Ye, J.; Bhatt, R. K.; Falck, J. R. J. Am. Chem. Soc. 1994, 116, 1. J. R. Falck and C. R. Mioskowski Tetrahedron Lett. 1992, 33, 4885. Stannane S Aryl, Alkenyl und Alkynyl, aber nicht Alkyl können transferiert werden. TBSO 5-10 mol% Pd2 (dba) 3 Br + N 1. Probleme mit Alkylstannanen SnBu3 20-40% Trifurylphosphin 10 mol% CuI S TBSO a. Alkylgruppen werden nur langsam transmetalliert; Ausnahme Me4 Sn b. nach dem Transfer einer Gruppe R group werden nachfolgende Übertragungen sehr langsam N 37-49% NMP Schmitz, W. D.; Romo, D. Tetrahedron Lett. 1996, 37, 4857. S-16 c. Selektivität problematisch: Me am schnellsten, 1° am zweitschnellsten (aber dennoch langsam) S-15 Anwendungen der Stille Reaktion (1) Intramolekulare Koordination Anwendungen der Stille Reaktion N X + Br Pd(PPh 3 )4 X Sn Bu Bu 75-110 °C 64-86% (3) Aminostannane X = OMe, NO2 Me t-Bu Vedejs, E.; Haight, A. R.; Moss, W. O. J. Am. Chem. Soc. 1992, 114, 6556. cf: Brown, J. M.; Pearson, M.; Jastrzebski, J. T. B. H.; Van Koten, G. J. Chem. Soc., Chem. Commun. 1992, 1440. + I Me N(SiMe3 ) 2 Sn N(SiMe3 )2 Br t-Bu 1 mol% Pd(PPh3 )4 Bu4 NF 101 °C Me Me 76% (2) Trichlorostannane Fouquet, E.; Pereyre, M.; Rodriguez, A. L. J. Org. Chem. 1997, 62, 5242. CO2 H CO2 H BuSnCl3 S-18 I KOH, H2 O 0.5 mol% PdCl2 Bu 74% Rai, R.; Aubrecht, K. B.; Collum, D. B. Tetrahedron Lett. 1995, 36, 3111. S-17 9 Stille Kupplung mit Phosphonaten Me OH H Me Me Me Me H O Stille Kupplungen mit allylischen Substraten (PhO) 2 POCl O O O 80% OH H Me Me Me H O KN(SiMe3 )2 Me Pd 2 (dba)3 AcO PhO2 S O SnBu3 SO2 Ph OP(O)(OPh)2 (PhO)2 (O)PO Bu3 Sn PPh3 LiCl DMF-H 2O 91% PhO2 S PhO2 S H Me ein Stereoisomer A. M. Echavarren J. Org. Chem. 1997, 62, 7540. 10 mol% Pd(PPh3 ) 4 6 equiv LiCl 97% Me Me Me H O CbzNH CbzNH S N OH O H + R 1 Pd(0) R + R OH Pd2(dba) 3 • CHCl 3 (5 mol%) 1 R kein Ligand Cl 88% Cl OH NR2 1 + H R S-20 Allyl-Transfer in der Stille Reaktion H H Pd SnBu 3 CO2 C6 H4 OMe S. Torii J. Org. Chem. 1997, 62, 3782. S-19 O R Cl O Terpyridin (1 equiv) 68% O R N NMP CO2 C6 H4 OMe Allyl-Transfer in der Stille Reaktion PPh 3 SnBu3 O K. C. Nicolaou J. Am. Chem. Soc. 1997, 119, 5467. S CuI (1 equiv) + Cl Pd2(dba) 3 • CHCl 3 (5 mol%) SnBu 3 NR 2 O O 1 R kein Ligand H + H PPh 3 (40 mol%) 73% PPh3 steuert die Chemoselektivität Yamamoto, Angew. Chem. 2001, 113, 3308 Yamamoto, Angew. Chem. 2001, 113, 3308 S-20a S-20b Stille Kupplungen Stille Kupplungen Iminochloride NPh Ph Pd2(dba)3 AsPh3 67% NPh Me NPh PhSnBu3 Cl Cl Bu Bu Sn O Ph NPh Me + Pd(PPh3)4 94% I OH Me Me R. Faust Tetrahedron Lett. 1997, 38, 8017. G. A. Kraus Tetrahedron Lett. 1996, 37, 5287. Pyridine N N N O N O Br N Pd(PPh3) 4 N + 37% Br Br Br N Bu3 Sn Br S N N N O T. R. Kelly J. Org. Chem. 1997, 62, 2774. O S -21 PF 6 + Ph SnBu3 0.2 mol% Pd2(dba)3 trifurylphosphine EtOH 55 °C 80% L. S. Liebeskind J. Am. Chem. Soc. 1997, 119, 12376. Ph S-22 10 Stille Kupplungen Stille Kupplungen Palladium / C als Katalysator I SnBu3 Oligomeris ierungen + BocNH NHBoc R R SnBu3 S Pd2(dba)3 S AsPh3 Br O MeO 10 mol % CuI 20 mol % AsPh 3 12 hrs. NHBOC (88%) OMe O Br + Bu3 Sn BOCNH O 0.5 mol % Pd (10 mol % Pd/C) R R 51% n O SnBu3 I 0.5 mol % Pd (10 mol % Pd/C) + R = C12H 25 Mn = 9400 10 mol % CuI 20 mol % AsPh3 16 hrs. H3 CO 95 % trans H3 CO (82 %) 100 % trans J. M. Tour J . Am. Chem. Soc. 1997, 119, 9624. Liebeskind , L. ,Tetrahedron Letters , 1995 , 36 , 2191. S-24 S-23 Stille Kupplungen mit zusätzlicher CO Insertion R1 SnBu3 + R2 X + O Pd catalyst CO R1 Nebenreaktionen in der Stille Kupplung 1. Homokupplung der Stannane durch Pd(II) + R2 X SnBu3 R 1 SnBu3 R2 = Aryl-, Alkyl-, Allylhalogenide und -triflate I Ph + (PPh3 )2 PdCl2 SnBu3 Ph 3. Wanderung von Arylgruppen vom Liganden Ph Br Me3Sn J. K. Stille J. Am. Chem. Soc. 1984, 106, 6417 5 mol% Pd(PPh3 ) 4 + MeN OMe + N MeN 22% Ph3 As CO (12 bar) LiCl , NMP 70o C 80% I OtBu Me3 Sn O 2.5 mol % Pd2 (dba)3 OMe R = OMe, 22% OTIPS NMe R DMF 105 °C OMe O Me N 1 R1 R Luft 2. Methylierung der Halogenids oder Triflats wenn Me3RSn als Kupplungsreagenz verwendet wird O 70% OTIPS Pd-Katalysator McDermott, T. S.; Mortlock, A. A.; Heathcock, C. H. J. Org. Chem. 1996, 61, 700. Ph 11 bar CO R 1 SnBu3 + R =H, 55% O N Segelstein, B. E.; Butler, T. W.; Chenard, B. L. J. Org. Chem. 1995, 60, 12. OtBu Mechanistische Studien 1. C.-H. Cheng, J. Am. Chem. Soc. 1991, 113, 6313. L. E. Overman J. Am. Chem. Soc. 1993 , 115 , 3966 S-25 S-26 2. J. R. Norton, J. Am. Chem. Soc. 1995, 117, 8576. 3. B. M. Novak J. Am. Chem. Soc. 1997, 119, 12441. Verwandte Reaktionen zur Stille Kupplung Verwandte Reaktionen zur Stille Kupplung 2. Pd oder Ni-katalysierte Kupplungen mit Alkylzinkverbindungen 1. Pd und Ni-katalysierte Kupplungen mit reaktiveren Organometallverbindungen X R1 + X = Br, I, OTf R2 –M I catalyst OEt R2 R1 O Ni(acac) 2 + (C5H11) 2Zn C5H11 OEt O 83% P. Knochel, Angew. Chem. Int. Ed. Engl. 1995, 34, 2723. R2 =Aryl, Alkenyl, Alkyl M = ZnX, MgX, Li, AlX2 , Cu, ZrX2 , etc. 3. Cuprate Katalysatoren: Pd(0) or Pd(II), Ni(II) TBSO I Me ZnX wahrscheinlich am besten und einfachsten + TBSO Cu(CN)Li2 Me keine Ausbeute angegeben Li O O PMP OTBS I + Me J. A. Marshall J. Am. Chem. Soc. 1987, 109, 1186 Me Me Me Me Me Me Me Me OTBS Pd(PPh3 )4 22 °C Me OPMB 66% O O PMP OTBS OTBS ebenso: Me R OTf + Me2Cu(CN)Li2 R Me Me Eisenorganyle: T. Kauffmann Angew. Chem. Int. Ed. Engl. 1996, 35, 386. OPMB S-28 Smith, III, A. B.; Qiu, Y.; Jones, D. R.; Kobayashi, K. J. Am. Chem. Soc. 1995, 117, 12011. S-27 11 Verwandte Reaktionen zur Stille Kuppplung Verwandte Reaktionen zur Stille Kupplung 4. Wenkert Reaktion 6. Silizium analoge Stille Kupplung = Hiyama Kupplung Me + cat (Ph3 P)2 NiCl 2 MeMgBr O OH Me I Pd(OAc)2 + Me 92% SiMe 3 PPh3 / DMF Et3 N / 125°C P. Kociensky Tetrahedron Lett. 1988, 29, 2869. 60% 5. Cupfer ohne Pd oder Ni For a review, see: Hatanaka, Y.; Hiyama, T. Pure App. Chem. 1994, 66, 1471. (1) Piers, E.; McEachern, E. J.; Romero, M. A. Tetrahedron Lett. 1996, 37, 1173-1176. (2) Piers, E.; Romero, M. A. J. Am. Chem. Soc. 1996, 118, 1215-1216. (3) Piers, E.; McEachern, E. J.; Romero, M. A.; Gladstone, P. L. Can. J. Chem. 1997, 75, 794-701. Me SnMe3 DMF, 50 °C SnMe3 MeO2C 96% Me TfO + SiF3 CuCl (5 equiv) Me O MeO2C (S) Pd(PPh3 ) 4 Me Bu4 NF Lösungsmittel 60 °C Mechanismus O Lösungsmittel %ee SnMe3 SnMe3 + MeO2C + CuCl MeO2C SnMe3 Me3 SnCl (beobachtet) Cu Konfiguration 34 S HMPA/THF 8 R DMF/THF 16 S THF Transmetallierung S-29 S-30 Hatanaka, Y.; Hiyama, T. J. Am. Chem. Soc. 1990, 112, 7793. Bildung von Aryl-Aryl-Bindungen Silanole R Pd(PPh3 )4 (5 mol%) Ag2O (100 mol%) 1 Me R + Si OH Me OH 1 Br THF, 60°C, 36h O 30-80% R1 = 2-Me, 4-Me, 4-CF3, 4-NO2 , 4-Br, 4-OTf R = 2-Me, 4-OMe, 4-CF3 Mechanismus OH 20 mol% Pd(PPh3 )4 R R I ortho Produkt 3 equiv KOt-Bu Me2 NCOMe 95 °C OK Br Pd O O 87% H Red. Elim. OK KOt-Bu Pd Pd Bromide und Triflate sind keine guten Kupplungspartner O SiMe 2OH Pd(PPh3 )4 (5 mol%) Ag2O (100 mol%) + I O O OMe OMe OH THF, 60°C, 36h Cs2 CO3 Br 80% OH + O O ortho Pd(PPh3 )4 (5 mol%) Ag2O (100 mol%) + SiMe2OH Br Ar2 P O Pd O THF, 60°C, 14h 55% S-30a A. Mori, Org. Lett. 1999, 1, 299 1:2 96% HO O para Me O Pd O P Ar2 Me = Optimaler Katalysator Ar = o-Tol S-31 V. H. Rawal J. Org. Chem. 1997, 62, 2. Direkte Biarylkupplungen /TDAE PdCl 2(PhCN)2, TDAE (200 mol%) X 2 R R R DMF, 50°C 52-98% X = Br, I Me2 N NMe 2 Me2 N NMe 2 TDAE = Die Suzuki Reaktion –1 2+ PdX ±0 Pd R R TDAE TDAE 2+ H. Tanaka, Synlett 2002, 637 S-32 12 Suzuki Coupling Reaction Suzuki Kupplung (wichtigste Alternative zur Stille Kupplung Stille Reaction) Mechanismus: Miyaura, N.; Suzuki, A. Chem. Rev. 1995, 95, 2457. Review: Miyaura, N.; Suzuki, A. Chem. Rev. 1995, 95, 2457. R1 BL2 Vorteile: + Pd Katalysator R2 X R1 BL2 2 R1 R Base R1 R2 base 1. Borane sind leichter darstellbar und besser handhabbar als Stannane 2. Größere Vielseitigkeit 3. Borane sind ungifitg, Stannane oftmals sehr giftig Nachteil: Pd catalyst R2 X + Schrittweise Analyse des Mechanismus: 1. Oxidative Addition und reduktive Eliminierung sind identisch wie in der Stille Reaktion Base ist notwendig 2. Transmetallaierung ist unterschiedlich Katalysezyklus normalerweise hat Pd ein Halogenid koordiniert --> Base wird benötigt Pd(0)Ln R 1 R2 + R2X XBL2 + R2 PdII R 1 + R1 BL2 R2 PdII X Oxidative Addition Reduktive Eliminierung große Ähnlichkeit zur Stille Kupplung II R2 Pd X keine Transmetallierung X = Br, I R1 (L)2 B–Nu aber transmetalliert sehr schnell Transmetallierung Su-1 Nu = bases like KOH (aq), K 2 CO3 /MeOH, TlOEt 1 + R BL2 Suzuki Kupplung Su-2 Suzuki Kupplung 2. Transmetallierung 2. Transmetallierung wenn OR– in der Reaktion entsteht, muß keine Base zugesetzt werden Bu BO O + Alkoxid erzeugt Pd–OR in situ L Pd(PPh3 )4 O PhH, ∆ A. Suzuki J. Am. Chem. Soc. 1985, 107, 972 L L + I D L X Kinetiken mit X diese Spezies geht die Transmetallierung ein C6 H5 O-BL2 D L = PPh3 O H D H D OR X2B H D 9-BBN OR H R = TBDMS O B O + L Transmetallierung verläuft unter Retention an der Alkylkomponente R2 PdII R1 + R1 BL2 R 2 PdII OR RO Neue mechanistische Daten: L R2 PdII OPh + L L = PPh3 75% offensichtlich: L R2 PdII X Bu Pd(dppf)Cl2 NaOH 51% H D OR Retention der Konfiguration lassen vermuten, daß PhO das Boran angreift B. H. Ridgway, K. A. Woerpel, J. Org. Chem. 1998, 63, 458. Su-3 X = Ekektronenziehend und Schiebend Su-4 K. Matos, J. A. Soderquist J. Org. Chem. 1998, 63, 461. Anwendungen der Suzuki Kupplung Anwendungen der Suzuki Kupplung 1. Alkenyl Bor Verbindungen 1. Alkenylborverbindungen Boronate sind besser als Alkylborbverbindungen TlOH als Base oftmals überlegen I Bu BX 2 3 mol% Pd(PPh3 )4 I + 2 M NaOEt in EtOH C6 H6 , ∆ Ausbeute BX 2 OAc O Bu O BnO2 CHN O OTBS O E:Z Me Me 58 OTBS Me OTBS OTBS TBSO Me B O Me TBSO Me O TBSO 94 : 6 OTBS OTBS OTBS OTBS TBSO O OTBS OTBS + O B O TBSO O TBSO 2 B(c-C6 H11 )2 49 83 : 17 B(Oi-Pr)2 98 >97 : 3 OTBS OTBS TlOH (10% aq) MeO2C H OTBS OTBS OTBS TBSO Pd(PPh3 )4 Hexan, 25 °C Die Ausbeuten sind niedrig mit Alkylboranen, da Protodeborierung durch NaOEt auftritt! OAc • 70% Su-5 Su-6 Y. Kishi J. Am. Chem. Soc. 1989, 111, 7525 Geschwindigkeiten der Protodeborierung: 9-BBN > B(c-C 6 H11 )2 > B(OR) 2 13 Anwendungen der Suzuki Kupplung Anwendungen der Suzuki Kupplung 2. β-Halocarbonylverbindungen 4. Primäre Alkylborane O O Bu Me BO O + PdCl 2 (PPh3 )2 Br PdCl2(dppf) in THF oder DMF ist optimal Me auch Pd(PPh3)4 kann eingesetzt werden, Lösungsmittel müssen dann aber C6H6 oder Dioxan sein NaOAc MeOH ∆ Bu O I A. Suzuki Bull. Chem. Soc. Jpn. 1987, 60, 3471 CO2Me B + Ph3As Cs2 CO3 DMF/THF/H2 O 25 °C TBSO 3. Arylborverbindungen sterische Hinderung kann problematisch sein, jedoch können auch in solchen Fällen gute Ergebnisse erzielt werden O PdCl2(dppf) CO 2Me TBSO 70-80% (CO)3 Cr Me Br + OMe B(OH)2 Me Me Pd(PPh3 )4 Na2 CO3 MeOH, H2 O ∆ 96% (CO) 3 Cr Me heat 79% OMe Me (CO)3 Cr Johnson, C. R.; Braun, M. P. J. Am. Chem. Soc. 1993, 115, 11014. Me OMe 5. Triflate ein Stereoisomer Review über sp2-OTf = Ritter, K. Synthesis 1993, 735. 98 : 2 Stereoselektivität Reaktivität: I > Br > OTf Su-8 Su-7 M. Uemura J. Org. Chem. 1996, 61, 1375. Anwendungen der Suzuki Kupplung Anwendungen der Suzuki Kupplung Festphasensynthese 6. sp3 -sp3 Kupplung alkyl 9- BBN or aryl boronic acid O problematisch N R 1. Oxidative Addition an primäre Alkylhalogenide ist sehr langsam; SET-Mechanismus H N R1 2M Na 2CO 3 THF, 65 o C 24 - 40 hr. S O + R2 I R2 • Pd(0) OO Br R2 PdII + •Pd(I)–I I O N R Pd(PPh 3) 4 O R 1 = H, Me, Bn, Et, iPr R 2 = (Me)2CHCH 2 , Ph, 4-MeOPh, 2,4-Cl2Ph 1 H N S R OO R2 87 - 100% 2. Wenn die Transmetallierung langsam ist, treten reduktive Eliminierungen als Nebenreaktion auf J.A. Ellm an, J. Am. Chem . Soc. 1994, 116, 11171. L PdII X β-hydrid Eliminierung möglich R H 5 mol. % Pd catalyst DME, 2M Na 2CO 3 O O O O X B(OH) 2 Br, I 7. Allylische Elektrophile X Pd catalyst = Pd(Ph 3P) 4, Pd(Ph 3P) 2Cl2, Pd(Ph 3P)2Br 2 X X = Cl, Br --> Base ist notwendig 82 - 95% X = OMe, H, Me, F X = OPh, OCOEt --> keine Base notwendig Su-9 Anwendungen der Suzuki Kupplung Anwendungen der Suzuki Kupplung Mehrfachkupplungen X DMG Reaktionen in wäßrigen Medien Pd o /Na 2CO 3 Y + X B(OH)2 Z Su-10 W. Friesen, Tetrahedron Lett. 1994, 35, 9177. DM E, reflux Y Y DMG X = I, Br DM G = directed metalation group (dirigierende Gruppe) O O Pd(OAc)2 Z Z Bu B(OH)2 + I 69 - 90% TPPTS, wateracetonitr ile, H-(NiPr)2 Bu 95% TPPTS = sulfoniertes Triphenylphosphin ( CONEt2 , CN, OM OM, NH2) Z = OMOM, Y = TM S, CH2OMe, H V. Snieckus, Tetrahedron Lett. 1992, 33, 2773. J.P. Genet, Tetrahedron Lett. 1995, 35, 1443. t-Bu t-Bu Br Br Br B + Br Br Br PdCl 2(PPh3 )2 O O t-Bu NaOH PhM e, THF 100 °C 73% H2 N t-Bu + B(OH)2 Pd(OAc)2 H2 N TPPTS, wateracetonitrile 82% t-Bu t-Bu t-Bu Su-11 J.P. Genet, Synlett. 1992, 715. Su-12 A. de Meijere Angew. Chem . Int. Ed. Engl. 1997, 36, 1289. 14 PEG, H2O und Mikrowellen in der Suzuki Reaktion O Pd( OAc)2 (5-10 mol%) + (HO)2B X PEG Polymer-gebundene Katalysatoren in Wasser O R O PEG K 2CO3 (2.5 equiv), H 2O R O B(OH) 2 X R KOH, H2 O, 25°C, 24h 80->95% Umsatz X = I, OTf, ONf R1 Pd-PEP(2 mol%) R1 + R 1-8 min Mikrowelle 59-88% X = Br, I PEG-Anbindung zur Lösungsvermittlung in Wasser Cl Pd PPh2 O I + O Pd( OAc)2 (5-10 mol%) (HO)2B R MeO R MeO K 2CO3 (2.5 equiv), H 2O PS Pd-PEP = O O O 1-8 min Mikrowelle PEG 59-78% Ausbeute HN O n PEG als Phasentransferkatalysator Y. Uozumi, T. Hayashi, J. Org. Chem. 1999, 64, 3384 Su-12a Su-12b T. Schotten, J. Org. Chem. 1999, 64, 3885 Anwendungen der Suzuki Kupplung Cyclopropane NBu4Br in der Suzuki Reaktion B(OH) 2 R O Br + Bu Ar Br + Pd(PPh 3)4 B(OH)2 Bu Ar K3PO4 PhMe, 100 °C Pd(OAc)2 (2 mol%) 83-98% R 1 R O M.-Z. Deng J. Chem. Soc., Perkin I 1996, 2663. K2CO3, H2O, 25°C, 2h R1 NBu4 Br 45-76% O B O R = H, CHO I K2 CO3 Bu 4 NCl PhMe, 100 °C 84% Ph B(OH) 2 R S Br + Pd(OAc)2 (2 mol%) R R1 OBn OBn 10 mol% Pd(OAc)2 + Ph O K2CO3, H2O, 25°C, 2h R1 NBu4 Br A. Charette J. Org. Chem. 1996, 61, 8718. 50-82% Bu R = H, CHO B O O + 10 m ol% Pd(OAc)2 I OBn 50 m ol% PPh 3 Bu OBn KOt-Bu DME, 80 °C 69% J. C. Bussolari, Org. Lett. 1999, 1, 965 Su-12c Anwendungen der Suzuki Kupplung PO-Liganden in der Suzuki Kupplung Diazoniumsalze (HO) 2 B N2 MeO + Cl Ph Pd(OAc)2 1,4-dioxane 22 °C 79% Su-13 A. B. Char ette Tetrahedron Lett. 1997, 38, 2809. Pd(dba)2 (0.5-1 mol%) Ligand (1.5-3 m ol%) B(OH) 2 Cl + R MeO R1 R R1 CsF (3 equiv) Dioxan oder Toluol, 100-110°C 5-20 h H3 C O J.-P. Genêt Bull. Soc. Chim. Fr. 1996, 133, 1095. O Ligand = P(Cy)2 Chloraromaten Cl Ph (HO)2 B + Me O CF3 CF3 5 mol% PdCl2(PCy3 )2 CsF, NMP 100 °C 98% Me F3C O O F 3C OMe 92% 80% 91% O 61% 96% W. Shen Tetrahedron Lett. 1997, 38, 5575. Su-14 X. Bei, A. S. Guram, J. Org. Chem. 1999, 64, 6797 Su-15 15 PtBu3 in der Suzuki Reaktion Carbenliganden in der Suzuki Reaktion Pd2 (dba)3 (1.5 mol% Cl R + R Cs2CO3 (1.2 equiv) Dioxan, 80-90°C 5h 1 R R 1 + R R1 PBut3 (3.6 mol%) B(OH) 2 Cl Pd2(dba) 3 ( 1.5 mol%) Ligand (3 mol%) B(OH) 2 R Cs2CO3 (3 equiv) Dioxan, 80°C 1.5 h CF3 Cs2C O3 Ligand = N N N N Cl H2N MeO Me Me O OMe 91% 86% 89% 87% 92% OMe OMe Me Me Me Me Me Me 90% 87% MeO2C Me Me 96% 99% 88% 91% 99% 82% M. L. Trudell, S. P. Nolan, J. Org. Chem. 1999, 64, 3804 Su16 Sterisch gehinderte Phosphine in der Suzuki Reaktion Sterisch gehinderte Phosphine in der Suzuki Reaktion Pd2 (OAc) 2 (1-1.5 m ol%) Pd(OAc)2 Ligand ( 2-3 mol%) B(OH) 2 Cl R1 R + R R B(OH) 2 Cl Ligand (2 equiv ref. Pd) R + R KF (3 equiv) THF, Raum temp 1 Su-17 G. Fu, Angew. Chem. 1998, 37, 3387; J. Am. Chem. Soc. 2000, 122, 4020 K 3PO4 (3 equiv) Toluol, 100°C 20-24 h 20 h P(tBu)2 Ligand = Ligand = PBu 2 NC OMe Me MeO CN O MeO O Me 91% (2h) MeO 96% 92% 91% 20000 TON 69000 TON (Pd/Lig 1:4) S. L. Buchwald, Angew, Chem. 1999, 38, 2413 Su-18 16000 TON 17400 TON M. Beller, Angew. Chem. 2000, 112, 4315 12800 TON Su-19 Tetraphosphine in der Suzuki Reaktion [PdCl(C3H5) 2]2 B(OH) 2 Cl Ligand (2 equiv ref. Pd) R + R K 2 CO3 (3 equiv) Xylol, 130°C 20 h Ph2 P Ph 2P Ligand = PPh2 PPh2 Aminierungen NO2 F3C 68000000 TON O 2N 24000 TON H. Doucet, M. Santelli, Synlett 2001, 1458 NC 13000 TON MeO 20 TON Su-20 16 Palladium-katalysierte Aminierungen Pd-Aminierungen /P(o-tolyl)3 Ph Ph P O Pd O S. L. Buchwald, Acc. Chem. Res. 1998, 31, 805 J. F. Hartwig, Acc. Chem. Res. 1998, 31, 852 Am-01 Intramolekulare Pd-Aminierungen / Pd(PPh3)4 NHBn n X CH3 O Pd O P Ph Ph CH3 Primäre Amine als Kupplungspartner geeignet für EWG- und ortho-substituierte Substrate S. L. Buchwald, Acc. Chem. Res. 1998, 31, 805 Am-02 Pd-Aminierungen / BINAP Pd(PPh3 )4 N Bn Toluol K 2CO 3, NaOtBu 100°C n X = Br n = 1 (92%) n = 2 (87%) n = 3 (89%) X= I n = 1 (93%) Pd(PPh3)4 ist ein effektiver Katalysator im Gegensatz zur intermolekularen Variante (±)-BINAP vor allem bei primären Aminen P(o-tolyl)3 überlegen S. L. Buchwald, Acc. Chem. Res. 1998, 31, 805 S. L. Buchwald, Acc. Chem. Res. 1998, 31, 805 Am-03 Pd-Aminierungen / BINAP Br Me NH2 Me Pd2(dba) 3 / (±)-BINAP + NaOtBu, Toluol, 100°C Am-04 Pd-Aminierungen / Triflate Ph N H Ph Racemisierung mit P(o-tolyl)3 Cs2CO3 als Base entscheidend für die Kupplung von Triflaten S. L. Buchwald, J. Am. Chem. Soc. 1997, 119, 8451 S. L. Buchwald, Acc. Chem. Res. 1998, 31, 805 Am-05 Am-06 17 Pd-Aminierungen / PtBu3 Pd-Aminierungen / Chloraromaten R1 N Pd(dba) 2 (1-2 mol%) R1 N Pd(OAc)2 (1-2 mol%) Cl + R Ligand (2- 4 mol%) H N 1 R R 2 R Br + R R1 H N R1 PtBu 3 (0.8-1.6 mol%) R R2 R1 NaOtBu (1.5 equiv) Toluol, Raumtemp NaOtBu (1.4 equiv) Toluol, Raumtemp 1-6 h 14-20 h Chloraromaten reagieren bei 60-70°C P(tBu)2 Me Ligand = Me NPh MeO Me N NBu 2 99% 90% NPh 2 Ph2N O 85% 90% OMe Me NPh Me Me N O MeO N Pd(dba) 2 (1-2 mol%) NHBn O 94% + R 99% 90% H N PtBu 3 (2-4 mol%) X 98% H 2N R OtBu O OtBu O NaOtBu (1.5 equiv) Toluol, 100°C 59-86% 2-24 h X = Br. C l S. L. Buchwald, Angew, Chem. 1999, 38, 2413 Am-07 Am-08 J. F. Hartwig, J. Org. Chem. 1999, 64, 5575 Palladium-katalysierte Alkinkupplungen Review: R. Rossi Org. Prep. Proc. Intl. 1995, 27, 127. A. Castro-Stevens Kupplung 1 Cu R + R2 I R2 R1 B. The Sonogashira-Hagihara Kupplung 1 + H R R2 X Alkinkupplungen R2 R1 X = I, Br, Cl PdCl2(PPh3 )2 (2 mol%) CuI oder CuOAc(1 mol%) Amin = Et 2NH, Et 3N oder 25 °C N H Lösungsmittel (wichtig!): Amin, THF(!) Mec hanismus: ähnlich wie Suzuki u nd Stille, aber m it Organokupfer verb ind ung + CuI R1 R1 H Cu Diese Species wird transmetalliert Sonogashira-Hagihara Kupplung A-1 Sonogashira-Hagihara Kupplung 1. Reaktivität der Halogenkomponente Ph 2. Triflate I = > Br ArI > Cl > ArBr PdCl2(PPh3 )2 , CuI OTf 2,6-Lutidin + R2 Br CuI (cat) R1 Ph 88% Pd(PPh3 ) 2 Cl2 (cat) CO2Et R2 CO2 Et R1 I. Saito, Tetrahedron Lett. 1996, 37, 605 Et3 N, THF R 1 4-CHO 4-COMe 2-CO2 Me 3-CO2 Me 4-CO2 Me 4-COMe 4-COMe 4-CHO 2 R Me3 Si Me3 Si Me3 Si Me3 Si Me3 Si n-Bu Ph Ph Methode* Bedingungen A A B B B B B B 25°C / 1h 25°C / 1h 25°C / 16h 25°C / 16h 25°C / 16h 25°C / 16h 25°C / 16h 25°C / 16h SiPh2 Bu Ausbeute [%] OTf 99 92 88 87 88 91 87 82 Pd(PPh3 )4 (10%), AgI (20%) O DIPEA, DMF, 20h, 78% + SiPh2 Bu A-3 O A-2 P. Pale, Tetrahedron Lett. 1996, 37, 2019 N. Krause et al, J. Org. Chem. 1998,63. 8551 18 Palladium-katalysierte Akinkupplungen Sonogashira-Hagihara Kupplung O 4. Reaktivität Katalysator / Amin 5 mol% Pd(OAc)2 SiMe3 (2 equiv) N O 25 mol% PPh3 20% CuI BuNH2 OTBDMS SiMe3 C6 H6 [Pd] (5%), CuI (10%), Amin, RT O TBDMSO + OTBDMS C5 H11 Cl Cl N O C5H11 C5 H 11 O O TBDMSO 76% C5H11 K. C. Nicolaou, J. Am. Chem. Soc. 1993, 115, 7612. [Pd] Amin Zeit [h] Ausbeute [%] PdCl2(PhCN)2 Piperidin 0.5 93 PdCl2(PPh 3)2 Piperidin 20 93 Pd(PPh3) 4 Piperidin 16 11 Pd(PPh3) 4 n-PrNH2 60 62 Me O I Me Me O Me PdCl2 (PPh3 )2 + O O CuI i-PrNH2 54% OTBS M. Alami, G. Linstrumelle, Tetrahedron Lett. 1991, 32, 6109 OTBS C. R. Johnson J. Org. Chem. 1997, 62, 1582. A-4 A-5 Palladium-katalysierte Akinkupplungen Palladium-katalysierte Akinkupplungen erminale Acetylene erminale Acetylene PdCl2 (PPh3 ) 2 , CuI RX + i i SiMe3 R Si Pr3 Pr3 Si SiMe3 Br NEt3 oder Pyridin, RT bis 60°C 1) Pd(0) / Cu(I) Br Si iPr3 + 70-92% 2) K2 CO3, MeOH H SiMe 3 Me 3Si R = Aryl, Alkenyl H KOH / MeOH R H F. Diederich, Angew. Chem. 1993, 105, 437-40 RT, 1h H 79-94% H Br Br [auch Fluorid möglich] Br Br H 1) Pd(0) / Cu(I) + SiMe 3 Br 2) KOH, MeOH Br H H 28% Synthesis 1980, 627-30 Tetrahedron Lett. 1993, 34, 2071-74 H K.P.C. Vollhart, Angew. Chem. 1986, 25, 268-9. Review: K. Sonogashira in Comprehensive Organic Synthesis 1990, Vol. 3 (Pergamon), 521-49 A-7 A-6 Palladium-katalysierte Akinkupplungen Isoquinoline erminale Acetylene; andere Schutzgruppen als TMS KOH Pd(0) / Cu(I) ArX + Ar OH OH R1 Ar ∆ N R2 Bu t H + X R 1. PdCl 2(PPh3 ) 2 (2 mol%) CuI (1 mol%), NEt3, 55°C R1 2. CuI (10 mol%, 100°C) R2 N R1 But 72-91% N R2 R R 2-Methyl-3-butyn-2-ol X = I, Br J. Org. Chem. 1985, 50, 1763 Synthesis 1996, 589 N 1. PdCl 2(PPh3) 2 (2 mol%) CuI (1 mol%), NEt3, 55°C But + N H 2. CuI (10 mol%, 100°C) Br OH 55% Pd(PPh3 ) 4 Br N NaOH, ∆ Ph I But 1. PdCl 2(PPh3) 2 (2 mol%) CuI (1 mol%), NEt3, 55°C + H N Ph 2. CuI (10 mol%, 100°C) Ph Ph 57% G. Instrumelle, Tetrahedron 1988, 44, 6337-44. A-8 R. Larock, Org. Lett. 1999, 1, 553 A-8a 19 Palladium-katalysierte Akinkupplungen Palladium-katalysierte Akinkupplungen Alkynylzinkverbindungen Alkynylzinkverbindungen M R M = Li, MgBr + R1X ClZn + ClZn CO2 H Pd(PPh3 )4 R R1 R PdCl2 (MeCN)2 I ZnCl2 R DMF, Et2 O, RT (3 equiv) CO2 H (E) oder (Z), Reaktion ist stereospezifisch R 0-25°C, THF R1 = Aryl, Vinyl X = Br, I A. Duchene, Synthesis 1996, 82-6. E. Negishi, J. Chem. Soc. Chem. Commun. 1977, 683-4 E. Negishi, J. Org. Chem. 1978, 43, 358-60 + Br Pd(PPh3)4 SiMe 3 ClZn R R R (1) NaNH2 / NH3 R 3. ICH=CHCl + Br THF –20 bis 0°C SiMe 3 R 1. n-BuLi 2. ZnCl 2 Br Cl Pd(PPh3 )4 SiMe3 H (2) H+ SiMe3 E. Negishi, J. Org. Chem. 1984, 49, 2629 A-9 R. Rosshi, Tetrahedron Lett. 1988, 29, 2239 A-10 Palladium-katalysierte Akinkupplungen Palladium-katalysierte Akinkupplungen Alkynylzinnverbindungen Alkynylzinnverbindungen M Pd(PPh3 )4 / LiCl R + OTf M = Li, MgBr Bu 3 Sn SiMe3 SiMe3 THF, RT, 41h, 90% Bu 3 SnCl J. K. Stille, J. Am. Chem. Soc. 1984, 106, 4630. Pd(0) R1 X + Bu 3 Sn R1 R R RT, THF, DMF oder HMPA R1 = Aryl, Vinyl X = I > Br > OTf >> Cl bei Zusatz von LiCl: I > OTf >Br >> Cl Kein Amin und kein Cu(I) nötig! X Bu3 Sn I+ Ph 2 OTf– Ligandenfreie Katalyatoren wie PdCl2 (CH3 CN) 2 oftmals reaktiver als Pd(PPh 3 )4 X R Bn(PPh3 )2 PdCl (5%) CuI (8%) DMF, RT I +Ph I. Beletskaya, Doke. Akad. Nauk. SSSR 1983, 272, 1384 J. K. Stille, Tetrahedron Lett. 1988, 29, 1509 R R P. Stang, J. Org. Chem. 1996, 61, 6162 A-12 A-11 Palladium-katalysierte Akinkupplungen Palladium-katalysierte Akinkupplungen Alkynylzinnverbindungen Alkynylmagnesiumverbindungen Latent basenempfindliche Substrate - Sonogashira Kupplung nicht möglich! cat. Pd(0) oder cat. Ni(0) MeO2 C Br PdCl2 (PPh3 ) 2 , THF Br + Bu3 Sn Ph + BrMg R1 R R MeO2 C 25°C, 72h, 92% CO2 Me R1 X Ph G. Linstrumelle, Tetrahedron Lett. 1978, 191 R. Rossi, Tetrahedron 1984, 40, 2773 CO2 Me Ph F. Diederich, Angew. Chem. 1992, 104, 1270. O O + PdCl2 (PPh3 )2 / CuI Bu3 Sn + BrMg SiMe3 Cl O THF, RT, 2h, 70-74% OH Ni(dppp)Cl2 Cl O I Me3 Si SiMe 3 (E) oder (Z), Reaktion ist stereospezifisch OH R. J. K. Taylor, Tetrahedron Lett. 1996, 37, 7445. K. Ogasahara, J. Chem. Soc. Chem. Commun. 1996, 1679. A-13 F. Wudl, J. Org. Chem. 1984, 49, 4733 A-14 20 Palladium-katalysierte Akinkupplungen Palladium-katalysierte Akinkupplungen 2-Alkynylverbindungen (Propargyl) Alkynylmagnesiumverbindungen R1 Ph3 Si TfO R1 Pd(0) R3 R2 R2 X R3 • PdX R1 MgBr / LiBr OTf X = Cl, OAc, OCO2 R OTf PdCl 2 [L*] R3 • R2 CuI Ph3 Si R4 R4 R4 Cu bis zu >99%ee R N Cl Pd Cl P Pd(PPh3 )4 , CuI Et Bu + C5 H11 H Cl Et T. Hayashi, Tetrahedron Lett. 1996, 37, 3161 Bu • (i-Pr) 2 NH 91% C5 H11 J. Tsuji, Tetrahedron Lett. 1990, 31, 7179 J. Tsuji, J. Organomet. Chem. 1991, 417, 305 A-15 A-16 Palladium-katalysierte Akinkupplungen 2-Alkynylverbindungen (Propargyl) Zink Pd(PPh3 )4 TMS ZnCl + TMS O THF, 85% • OH Alken / Alkin Trimerisierungen H. Kleijn, Recl. Trav. Chim. Pays-Bas 1982, 101, 97 AcO Bu + Pd(PPh 3 )4 , (CuI) H C 5 H11 Bu • THF, ZnCl2 , 65°C, 74% C5 H11 G. Linstrumelle, Tetrahedron Lett. 1993, 34, 3853 A-17 Alkin/Alken-Trimerisierungen Alkin/Alken-Trimerisierungen Prinzipien Mechanismen (1) Alkin-Trimerisierungen (1) Alkin-Trimerisierungen R Katalysator bzw. MLn R R R R R MLn Mediator R R R R R MLn Ln M R R R R R R Katalysator bzw. Mediator R R ML n R R R R MLn R R – ML n (2) Alkin/Alken-Trimerisierungen (2) Alkin/Alken-Trimerisierungen R R R R R R R R MLn R R R R R Katalysatoren: Rh, Pd Mediatoren: Co, Zr T-1 T-2 21 Alkin/Alken-Trimerisierungen Alkin/Alken-Trimerisierungen (1) Alkin-Trimerisierungen (1) Alkin-Trimerisierungen mit Nitrilen Cobalt R2 R4 R3 CpCo R4 Cobalt R1 1 Ph3 P R CpCo(PPh3 )2 + R1 R2 R5 R6 R6 R2 R5 R3 X X CpCo(COD) NMe2 R3 R4 H CN NMe2 N 14 atm 140 °C 13-59% X = H, 85% X = Cl, 75% X = Br, 70% H Kuramitsu, T.; Yamazaki, H.; Wakatsuki, Y. Tetrahedron Lett. 1974, 4549. C. Bottehi J. Org. Chem. 1994, 59, 7125. (1) Alkin-Trimerisierungen mit Isonitrilen MeO MeO Me3 Si N MeO X Cobalt N MeO SiMe3 SiMe3 SiMe3 93% SiMe3 R CpCo(CO)2 m-xylene, ∆, hυ R' 3-5h + N C O CpCo(CO)2 X=H2 , (OR) 2 Hillard, R.; Parnell, C.; K . P . C. Vollhardt Tetrahedron 1983, 39, 905 X R N 66-94% T-3 R' OH Earl, R.; Vollhardt, K. P. C., J. Am. Chem. Soc. 1983, 105, 6991 T-4 Alkin/Alken-Trimerisierungen Alkin/Alken-Trimerisierungen Rhodium (1) Alkin-Trimerisierungen (1) Alkin-Trimerisierungen Rhodium O O R O O R R RO RO RO O EtOH, 1h, 40 °C O R = H, 79% Me O 0.2 eq ClRh(PPh 3)3 EtOH, 78°C R Rh(PPh3 )3 Cl (cat) RO RO RO O OBn O BnO BnO O 2h, 25 oC 75% O Me O R = TBDPS, 35% R = Ac, 58% 59% R= Rh(PPh3 )3 Cl (cat) O BnO OBn Acetylen in EtOH 0.1 eq ClRh(PPh 3)3 , 0°C BnO BnO 89% O O BnO O Zhu, H.; Holmquist, C.; McDonald,F. E. J. Am. Chem. Soc. 1995, 117, 6605 R. Grigg, Tetrahedron Lett. 1982, 23, 2691 T-6 T-5 Alkin/Alken-Trimerisierungen Alkin/Alken-Trimerisierungen Ruthenium Ruthenium (1) Alkin-Trimerisierungen – Metathese (1) Alkin-Trimerisierungen R Ts N Ph [Ru] [Ru] R Ts N 5 mol% RuLn Ph 74% Ph R O [Ru] 68% O O R Ph Ph O 5 mol% RuLn [Ru] O O R RuLn = PhCH 2=Ru(PCy3 )2 Cl2 S. Blechert Chem. Commun. 1997, 1983. RuL n = PhCH2 =Ru(PCy3 )2Cl2 S. Blechert Chem. Commun. 1997, 1983. T-7 T-8 22 Alkin/Alken-Trimerisierungen Alkin/Alken-Trimerisierungen (1) Alkin-Trimerisierungen Zirkon Rhodium (1) Alkin-Alken-Schwefel-Trimerisierung NHAc CO2 Et (PPh3 )3 RhCl + OH NHAc HO R1 CO2 Et 80 °C 81% S. Kotha Tetrahedron Lett. 1997, 38, 3561. 2 R4 TMS Cp 2Zr Bn + Me3 Si SiMe 3 Cp2 Zr R1 R4 R1 S SCl2 , THF TMS R2 Pd(PPh3 )4 –CH4 R2 R R1 Palladium Bn MeCp2Zr Cp2Zr(Me)Cl 2 R (2) Alkin/Alken-Trimerisierungen R1 R1 Li BuLi R2 TMS 60-80% R4 R2 SiMe3 65 °C 86% Me3 Si Fang, Q.; Buchwald,S. L. J. Org. Chem. 1989, 54, 2793 Y. Yamamoto J. Am. Chem. Soc. 1997, 119, 11313. T-9 T-10 Rh-katalysierte Carben-Alkinkupplungen Prinzipielle Reaktionsmöglichkeiten R O N2 RhodiumcarbenAlkinkupplungen R O O Ln Rh O RhLn Rh2 (OAc) 4 R Ln Rh O R Ln R O RhLn O R Rh R Rh-Carbenoide können (1) nucleophil von Mehrfachbindungssystemen (Alkene, Alkine) (2) nucloephil von Carbonylsauerstoffatomen angegriffen werden Rh-1 Rh-katalysierte Carben-Alkinkupplungen Et O N2 O Ln Rh Et Et O 5 mol % Rh2 (OAc)4 72% O Me Ph 5 mol % Rh2 (OAc)4 O Me N2 CH3 H3 C O O 5 mol % Rh2(OAc)4 O O Me O Ph Ph Ln Rh O N2 O CH3 O Ln Rh O NMe Me NMe O O CH3 O H3 C O NMe Erfolg der Cyclisierungen von der Vorzugskonformation abhängig A. Padwa J. Org. Chem. 1993, 58, 21. Rh-2 23