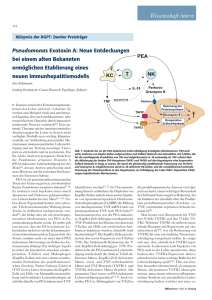
TNF-Rezeptorinteraktionen von Progranulin, TNF
Werbung

Arbeitsgruppe: PD Dr. Jonathan A. Lindquist Mitarbeiter: Doktoranden: Dr. Josephine Hildebrandt Anna Koterba (FSJ) Christopher Hessman In Kooperation mit: Prof. Dr. U. Reichl, PD Dr. Kähne Förderung: DFG Sachbeihilfeverfahren LI 1031/4-1 Kontakt: Telefon: Email: PD Dr. Jonathan A. Lindquist 0391-6724703 [email protected] TNF-Rezeptorinteraktionen von Progranulin, TNF-α und Kälteschockproteinen Pro-entzündliche Zytokine sind an zahlreichen entzündlichen Prozessen beteiligt. Dabei spielt der Tumor-Nekrose-Faktor α (TNFα) eine Rolle in der Aktivierung pro-entzündlicher Zytokin-Kaskaden. TNFα bindet an die TNF-Rezeptoren TNFR1 und TNFR2. TNFR1 vermittelt entzündliche Prozesse während TNFR 2 eine Rolle bei der Unterdrückung der Immunsystemaktivierung spielt. TNFα-blockierende Medikamente können die proentzündliche Wirkung zwar unterdrücken, zeigen jedoch starke Nebenwirkungen. Daher konzentriert sich die Forschung nun auf die Beeinflussung der Zytokin-induzierenden Signalwege in den Zellen. Ein vielversprechender Kandidat ist „Progranulin“. Progranulin wird von Fibroblasten und Endothelzellen sekretiert und extrazellulär von Proteasen gespalten, die wiederum von Immunzellen freigesetzt werden. Progranulin als Voll-LängenProtein wirkt dabei anti-entzündlich, während die Granuline als Spaltprodukte entzündliche Wirkungen aufweisen. Studien zeigen, dass Progranulin seine anti-entzündliche Wirkung vermutlich über die Bindung an TNFR1/2 vermittelt. Die gegensätzliche Funktion des VollLängen-Proteins und seiner Spaltprodukte lässt den Schluss auf eine genau abgestimmte Modulation von Immunprozessen zu. Pilotstudien unserer Gruppe weisen auf eine Interaktion von Progranulin, dem Kälteschockprotein Y-box Protein-1 (YB-1) und TNFα hin. YB-1 ist ein multifunktionales Kälteschockprotein, das eine Rolle in der Transkription, Translation, der Chromatinmodifikation, DNA-Reparatur, RNA-Packaging und in der Modulation von zellulären Stressantworten spielt. Es kontrolliert Zellzyklus-relevante Gene und spielt eine Rolle in der Entstehung von Tumoren. Ergebnisse unserer Gruppe zeigen eine Verbindung von YB-1 und immunologischen Prozessen. Neben einer chemoattraktiven Wirkung fanden wir eine Inhibition der TNFTNFR-Bindung. Derzeit testen wir die Hypothese, dass eine Progranulin/YB-1/TNFαInteraktion für die immunmodulatorische Funktion des Progranulins in Bezug auf TNFαvermittelte Entzündungsprozesse wesentlich ist. 2 Übersicht zur TNF-Rezeptor Aktivierung. Trimere Komplexe des TNF-α binden an TNFRezeptoren 1 und 2 (TNFR1/2). TNFR1 wird von allen Zellen exprimiert während TNFR2 nur auf Immunzellen zu finden ist. Stimulation von TNFR1 induziert Apoptose und begünstigt auf diese Weise Entzündungen. TNFR2 aktiviert den Nukleären Faktor Kappa B (NFκB) und unterstützt dadurch das Überleben von Zellen. Zusätzlich wird TNFR2 für die Entwicklung von regulatorischen T-Zellen benötigt. Progranulin wurde kürzlich als anti-entzündliches Protein identifiziert, welches über die TNFR-Signalwege interferiert. Wir haben eine Assoziation zwischen YB-1 und Progranulin identifiziert, die den Schluss nahelegt, dass YB-1 die anti-entzündlichen Aktivitäten von Progranulin beeinflusst. Laufende Promotionsarbeit: Christopher Hessman Titel: Wirkung der Interaktion zwischen dem Kälteschockprotein YB-1 und Progranulin auf die Tumornekrosefaktor-α-abhängige Signalkaskade in entzündlichen Nierenerkrankungen