Lösung: Die innere Energie 1
Werbung
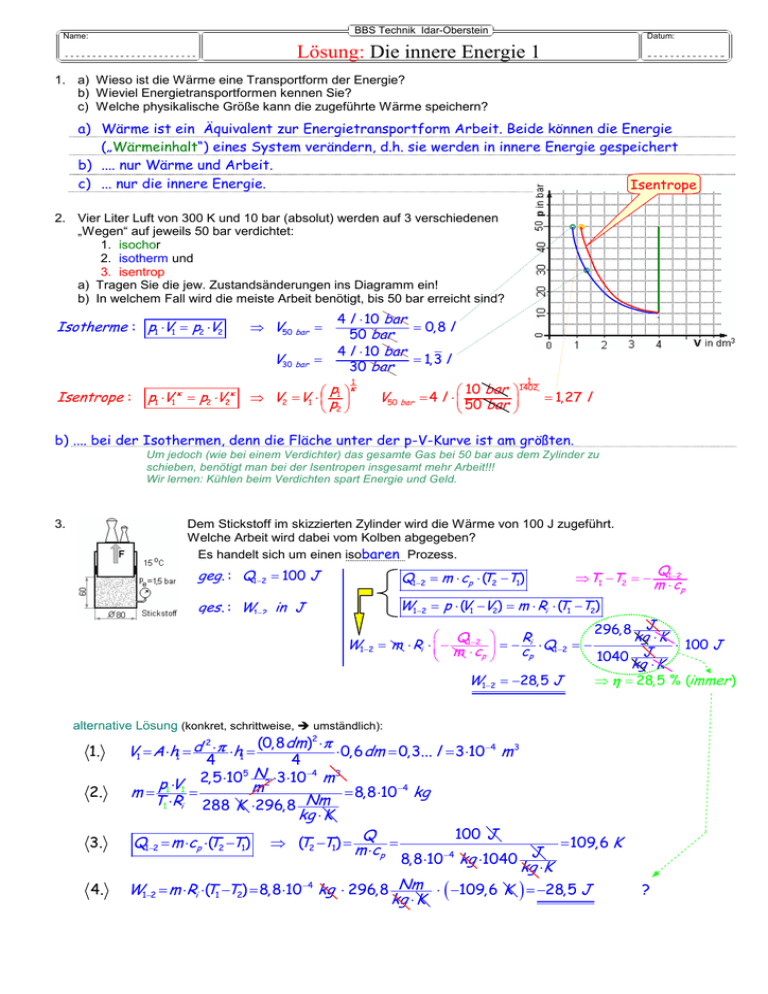
BBS Technik Idar-Oberstein Name: Datum: Lösung: Die innere Energie 1 1. a) Wieso ist die Wärme eine Transportform der Energie? b) Wieviel Energietransportformen kennen Sie? c) Welche physikalische Größe kann die zugeführte Wärme speichern? a) Wärme ist ein Äquivalent zur Energietransportform Arbeit. Beide können die Energie („Wärmeinhalt“) eines System verändern, d.h. sie werden in innere Energie gespeichert b) .... nur Wärme und Arbeit. c) ... nur die innere Energie. Isentrope 2. Vier Liter Luft von 300 K und 10 bar (absolut) werden auf 3 verschiedenen „Wegen“ auf jeweils 50 bar verdichtet: 1. isochor 2. isotherm und 3. isentrop a) Tragen Sie die jew. Zustandsänderungen ins Diagramm ein! b) In welchem Fall wird die meiste Arbeit benötigt, bis 50 bar erreicht sind? Isotherme : p1 ⋅V1 = p2 ⋅V2 ⇒ V50 bar = V30 bar = 4 l ⋅ 10 bar = 0, 8 l 50 bar 4 l ⋅ 10 bar = 1,3 l 30 bar 1 1 Isentrope : κ κ p1 ⋅V1 = p2 ⋅V2 p κ ⇒ V2 = V1 ⋅ 1 p2 V50 bar 10 bar 1402, =4 l ⋅ = 1,27 l 50 bar b) .... bei der Isothermen, denn die Fläche unter der p-V-Kurve ist am größten. Um jedoch (wie bei einem Verdichter) das gesamte Gas bei 50 bar aus dem Zylinder zu schieben, benötigt man bei der Isentropen insgesamt mehr Arbeit!!! Wir lernen: Kühlen beim Verdichten spart Energie und Geld. 3. Dem Stickstoff im skizzierten Zylinder wird die Wärme von 100 J zugeführt. Welche Arbeit wird dabei vom Kolben abgegeben? Es handelt sich um einen isobaren Prozess. geg . : Q1−2 = 100 J Q1−2 = m ⋅ cp ⋅ (T2 −T1) ges . : W1−2 in J W1−2 = p ⋅ (V1 −V2) = m ⋅ Ri ⋅ (T1 −T2) W1 −2 ⇒T1 −T2 = − 296,8 J kg ⋅ K Q1−2 Ri = m ⋅ Ri ⋅ − = − ⋅ Q1−2 = − ⋅ 100 J m c c ⋅ p p 1040 J kg ⋅ K W1−2 = −28,5 J ⇒ η = 28,5 % (immer ) alternative Lösung (konkret, schrittweise, umständlich): 2 (0,8dm) ⋅π V1 = A ⋅h1 = d ⋅π ⋅h1 = ⋅ 0,6dm = 0,3... l = 3⋅10 −4 m 3 4 4 5 N −4 2,5 ⋅ 10 ⋅ 3 ⋅ 10 m3 2 p1 ⋅V1 m = = 8,8 ⋅10 −4 kg m= T1 ⋅Ri 288 K ⋅296,8 Nm kg ⋅ K 100 J Q Q1−2 = m ⋅cp ⋅(T2 −T1) ⇒ (T2 −T1) = m ⋅c = = 109,6 K J −4 p 8,8 ⋅10 kg ⋅1040 kg ⋅K W1−2 = m ⋅Ri ⋅(T1 −T2) = 8,8⋅10 −4 kg ⋅ 296,8 Nm ⋅ ( −109,6 K ) = −28,5 J kg ⋅ K 2 1. 2. 3. 4. Q1−2 m ⋅ cp ? BBS Technik Idar-Oberstein Name: Lösung: Die innere Energie 1 Datum: 2. Teil 4. Streichen Sie die falschen Aussagen durch (u. kreuzen Sie die richtigen an)! Das allgemeine Gasgesetz gilt nur für ideale Gase. Zwischen den Molekülen des idealen Gases wirken keine Kraftfelder. Wärme ist eine von vielen Speicherformen der Energie. Innere Energie kann je nach Prozess in Wärme oder Arbeit abgeführt werden. Eine isotherme Expansion ist nur möglich, wenn das System 100%-ig wärmeisoliert ist. In einem eingeschlossenen Gas kann die zugeführte Energie einzig und allein nur in innerer Energie vorliegen. 5. Füllen Sie die Tabelle aus! (ankreuzen und p-V-Diagramm zeichnen) 6. Warum ist eine Verdichtung nur dann isotherm, wenn sie entweder nur sehr langsam abläuft oder gekühlt wird? Durch die Kompression wird Arbeit (=-Σp⋅∆V) verrichtet. Diese würde die innere Energie (~T) des Systems erhöhen, wenn nicht gleichzeitig die gesamte zugeführte Arbeit als Wärme sofort wieder abgeführt würde (W=-Q) 7. Wie kann man den (für Physik und Technik sehr bedeutsamen) Energieerhaltungssatz math. knapp formulieren? Energiebilanz: U1−2 =Q1−2 +W1−2 That’s all.











