T4 EIA WELL
Werbung

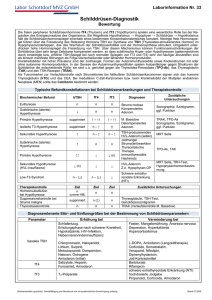
FT4 EIA WELL REF KT7EW 96 Deutsch M320.de Rev.4 - 01/2009 KITREAGENZIEN Reag. Quant. MTP 1 x 96 CAL 6 x 1 mL CONJ 2 x 12 mL Gebrauchsfertig. CTR 2 x 1 mL WASH 1 x 50 mL Konz. TMB 1 x 15 mL Flüssig. SUBS 1 x 15 mL Flüssig. STOP 1 x 14 mL Gebrauchsfertig. Gebrauchsfertig. Lyophilisiert. Lyophilisiert. KT7EW FT4 EIA WELL M320.de Rev.4 01/2009– Pag. 2/14 ENZYMIMMUNOASSAY ZUR QUANTITATIVEN BESTIMMUNG VON FREIEM THYROXIN IN HUMANSERUM. NUR ZUR IN-VITRO-DIAGNOSTIK 1. KLINISCHE BEDEUTUNG Die Konzentration von L-Thyroxin (T4) und L-Trijodthyronin (T3) gibt nützliche Informationen für die klinische Evaluierung der Schilddrüse, da der Funktionsstatus nicht aus deren Größe und Form geschlossen werden kann. Eine Dysfunktion der Schilddrüse kann entweder zu einem Anstieg oder einer Verminderung der T4- oder T3-Freisetzung führen, mit Einfluss auf den Sauerstoffverbrauch, die Energieproduktion, Kohlenhydrat- Fett- und Proteinstoffwechsel. Die Blutwerte der freien Schilddrüsenhormone T4 und T3 werden über einen negativen Feedback-Mechanismus unter Einfluss von TSH reguliert. Ein Abfall von T4 oder T3 stimuliert die Produktion von TSH und die Freisetzung von Schilddrüsenhormonen, ein Anstieg hat den gegenteiligen Effekt. T4 wird in den Epithelialzellschichten der Schilddrüsenfollikel synthetisiert und in das Schilddrüsenkolloid eingelagert. Der Abbau dieser Substanz wird über TSH geregelt und führt zur Freisetzung von T4 in das Blut. Schilddrüsenhormone werden von der Schilddrüse zu den Zielorganen eng an Plasmaproteine gebunden transportiert; dazu gehören Thyroxin-bindendes Globulin (TBG), Thyroxin-bindendes Präalbumin (TBPA) und Albumin. Ein kleiner Teil von T4 (FT4) ist immer frei (ca. 0,03 % von Gesamt T4) und es wird generell angenommen, dass diese freie Fraktion das physiologisch aktive Material ist, das in die Zellen eindringt, die Stimulation des Metabolismus auslöst und das Feedback über die Hypophyse kontrolliert. Außerdem ist das freie T4 der Vorläufer von T3. FT4-Werte sind unabhängig von der Bindeprotein-Konzentration und korrelieren daher gut mit dem Funktionsstatus der Schilddrüse. Ein Anstieg der T4-Bindung durch Serumproteine führt zu einer erhöhten Gesamt-T4-Konzentration ohne Hyperthyreose, während eine erniedrigte T4-Bindung zu einer erniedrigten Gesamt-T4-Konzentration ohne Hypothyreose führt. Die Konzentration von FT4 kann für die Unterscheidung von Hyper- und Hypothyreose bei Patienten verwendet werden, deren Gesamt-T4-Werte höher oder niedriger als normal sind. Beispielsweise sind die FT4-Werte bei Einnahme von Östrogenpräparaten, in der Schwangerschaft oder bei angeboren hohen Konzentrationen von Transportproteinen normal. Bei grenzwertigem FT4 und vermuteter SchilddrüsenFehlfunktion wird die Messung der FT3-Konzentration oder von sensitivem TSH empfohlen. KT7EW FT4 EIA WELL M320.de Rev.4 01/2009– Pag. 3/14 2. TESTPRINZIP Dieser Kit basiert auf einem kompetitiven Enzymimmunoassay (EIA). Als Festphase werden Wells verwendet, die mit spezifischen Anti-T4-Antikörpern beschichtet sind. Durch Zugabe von Serum und Konjugat (T3, gekoppelt an Meerrettich-Peroxidase, Analog-Methode) erfolgt eine Reaktion zwischen SerumT4 und Konjugat an den Bindungsstellen der Antikörper. Diese Reaktion ist sorgfältig kalibriert, um das Gleichgewicht zwischen freien und gebundenen Hormonen nicht zu stören und somit eine korrekte Konzentrationsmessung des FT4-Anteils in der Probe zu ermöglichen. Nach der Inkubation wird das ungebundene Material durch Absaug/Waschzyklen entfernt. Die enzymatische Aktivität ist an die Festphase gebunden und daher umgekehrt proportional zur FT4-Konzentration in den Kalibratoren und Proben und wird hervorgehoben durch das Inkubieren der Wells mit einer Chromogenlösung (Tetramethylbenzidin, TMB) in einem Substrat-Puffer. Die colorimetrische Messung wird mit einem Spektrophotometer bei Wellenlängen von 450 und 405 nm durchgeführt. 3. INHALT DES KITS: VORBEREITUNG UND STABILITÄT − Die Reagenzien sind ausreichend für 96 Wells. − Lagern Sie den Kit bei 2-8°C. − Das Verfallsdatum jedes Reagenzes ist auf dem Fläschchenetikett angegeben. − Nach dem ersten Öffnen ist der Kit bei 2-8°C 2 Monate haltbar. 3.1 Spezifische Reagenzien • MTP Coated Microplate: 1 Mikrotiterplatte mit 96 einzeln brechbaren Wells, beschichtet mit spezifischen Anti-T4-Antikörpern (Kaninchen). Lagern Sie nicht benötigte Wells gut verschlossen bei 2-8°C im mitgelieferten Plastikbeutel. • CAL Calibrators: 6 Fläschchen (1 ml) mit T4 in Serummatrix. Lyophilisiert. Mit 1 ml destilliertem Wasser rekonstituieren. Nach Rekonstitution können die Kalibratoren 2 Monate bei 2-8°C gelagert werden. Konservierungsmittel: Neomycin. HINWEIS: Die genauen Konzentrationen sind auf dem QC-Blatt angegeben. • CTR Control serum: 2 Fläschchen mit T4 in Serummatrix in zwei unterschiedlichen Konzentrationen. Lyophilisiert. Mit 1 ml destilliertem Wasser rekonstituieren. Nach Rekonstitution können die Kontrollen 2 Monate bei 2-8°C gelagert werden. Konservierungsmittel: Neomycin. HINWEIS: Die genauen Konzentrationen sind auf dem QC-Blatt angegeben. • CONJ Enzyme Conjugate: 2 Fläschchen (12 ml) mit T3, gekoppelt an Meerrettich-Peroxidase (HRPO), in HEPES-Puffer und Stabilisatoren. Gebrauchsfertig. Konservierungsmittel: Neomycin. KT7EW FT4 EIA WELL M320.de Rev.4 01/2009– Pag. 4/14 3.2 Universalreagenzien für alle RADIM-Kits der Hormon-Linie • WASH Washing Solution (konzentriert, REF SL01): 1 Fläschchen (50 ml) mit PBS-Tween 20. Konservierungsmittel: Thimerosal (< 0,05%). Den Inhalt des Fläschchens zu 500 ml destilliertem H2O geben. Bei ungelösten Kristallen die Lösung einige Minuten bei 37°C erwärmen. Die verdünnte Waschlösung kann 30 Tage bei 2-8°C gelagert werden. • TMB Chromogen: 1 Fläschchen (15 ml) Tetramethylbenzidin (TMB) mit ZitratPhosphat-Puffer und DMSO. Flüssig. • SUBS Substrate Buffer: 1 Fläschchen (15 ml) Zitrat-Phosphat-Puffer und H2O2. Flüssig. HINWEIS: Stellen Sie die Substrat-Lösung her, indem Sie die gleiche Menge Chromogen mit Substrat-Puffer in einem dunklen, gründlich gereinigten Fläschchen mischen. Direkte Sonneneinstrahlung vermeiden und innerhalb einer Stunde nach der Zubereitung verwenden. • STOP Blocking Reagent: 1 Fläschchen (14 ml) 1N H2SO4. Gebrauchsfertig. • CPA Abdeckfolie • Plastikbeutel 4. ZUSÄTZLICH BENÖTIGTE MATERIALIEN 4.1 Manuelle Testdurchführung − justierbare, automatische Mikropipetten mit Einwegspitzen. − Messzylinder für die Reagenzienverdünnung. − Mikrotiterplatten-Shaker, justierbar für 1200 rpm. − Absaugpumpe oder automatisierter Mikrotiterplatten-Washer. − Spektrophotometer für die Messung innerhalb eines 0-3,0 A Intervalls bei 450 und 405 nm Wellenlänge. − Millimeter Zeichenpapier. − Destilliertes H2O. 4.2 Automatisierte Testdurchführung − Dieser Test kann auf automatisierten ELISA-Analysegeräten für Mikrotiterplatten durchgeführt werden. − Wir garantieren die Verwendbarkeit auf den RADIM und/oder SEAC automatisierten Analysegeräten. − Bei Verwendung anderer automatisierter Mikrotiterplatten-Analysegeräte als RADIM oder SEAC liegt es in der Verantwortung des Benutzers, dass die Eignung für ELISA-Kits entprechend getestet wurde. KT7EW FT4 EIA WELL M320.de Rev.4 01/2009– Pag. 5/14 WARNHINWEISE UND VORSICHTSMASSNAHMEN Für fehlerfreie und reproduzierbare Ergebnisse müssen folgende Regeln eingehalten werden: − Mischen Sie keine spezifischen Reagenzien aus unterschiedlichen Chargen (s. 3.1). − Universalreagenzien aus unterschiedlichen Chargen dürfen gemischt werden (s. 3.2). − Verwenden Sie keine Reagenzien über das Verfallsdatum hinaus. − Lagern oder belassen Sie die Reagenzien nicht bei hohen Temperaturen oder in Bereichen mit möglicher Kontamination. − Verwenden Sie gründlich gesäuberte Glasbehälter, frei von Metallionenkontamination oder oxidierenden Substanzen. − Verwenden Sie destilliertes oder deionisiertes Wasser, das in absolut sauberen Behältern gelagert wurde. − Vermeiden Sie sorgfältig eine Kontamination der Proben untereinander; aus diesem Grunde sollten Einwegspitzen für jede Probe und jedes Reagenz verwendet werden. − Verändern Sie die Testdurchführung in keiner Weise. Eine Änderung der • der Reagenzienvolumina oder • exakten Temperaturen und Inkubationszeiten kann zu falschen klinischen Ergebnissen führen. − Rekonstituieren Sie evt. enthaltene lyophilisierte Reagenzien wie auf den entsprechenden Etiketten angegeben. Jede Abweichung vom Reagenziengebrauch oder falsche Volumina kann die Zuverlässigkeit der erhaltenen Werte beeinflussen. − Bei manueller Testdurchführung benötigen Sie die entsprechenden technischen Handbücher und es ist wichtig, kalibrierte Pipetten zu verwenden. Primär wichtig ist eine gute Präzision bei der Vorbereitung und dem Dispensieren der Reagenzien. Stellen Sie sicher, dass das verwendete Arbeitsmaterial korrekt kalibriert ist und regelmäßig gewartet wird. − Stellen Sie sicher, dass alle verwendeten Arbeitsmaterialien (Glasbehälter, Inkubator, Platten-Shaker, Platten-Washer, Spektrophotometer und Kühl-/ Gefriergeräte für die Lagerung der Reagenzien und Proben) perfekt arbeitsbereit und richtig kalibriert sind, und regelmäßig gewartet werden. Jede Abweichung vom korrekten Gebrauch der aufgelisteten Arbeitsmaterialien kann zu Fehlern im System führen und die Reproduzierbarkeit und Zuverlässigkeit der Ergebnisse beeinflussen. − Verwenden Sie eine geeignete Methode für die korrekte Identifizierung von Patientenproben. Eine falsche Probenidentifizierung kann zu einer niedrigeren Spezifität des Systems und falschen klinischen Ergebnissen führen. Um eine eigene Kontamination und der Umgebung zu vermeiden, müssen folgende Vorsichtsmaßnahmen eingehalten werden: − Verwenden Sie Einweghandschuhe beim Umgang mit potentiell infektiösem Material und während der Testdurchführung. − Pipettieren Sie nicht mit dem Mund. KT7EW FT4 EIA WELL M320.de Rev.4 01/2009– Pag. 6/14 − Während der Testdurchführung nicht rauchen, essen, trinken oder Kosmetika anwenden. − Chromogen und Blocking Reagent sollten mit Vorsicht behandelt werden. Vermeiden Sie Kontakt mit Haut, Augen und Schleimhaut. Bei versehentlichem Kontakt gründlich unter fließendem Wasser abspülen. − Alle Materialien humanen Ursprungs, die für die Herstellung dieses Kits verwendet wurden, wurden negativ auf HBsAg, Anti-HIV und Anti-HCV getestet. Da zurzeit kein Test die völlige Freiheit von diesen Viren garantieren kann, müssen alle Proben und Reagenzien, die biologisches Material enthalten, als potentiell infektiös betrachtet werden. − Vermeiden Sie Spritzer und die Bildung von Aerosolen; reinigen Sie in solchen Fällen sorgfältig mit 3%iger Hypochloritlösung. Das verwendete Reinigungsmaterial muss als potentiell infektiös betrachtet und entsprechend entsorgt werden. − Einige Reagenzien enthalten Natriumazid als Konservierungsmittel. Um die Bildung von explosiven Metallaziden aus Blei und Kupfer zu vermeiden, sollte bei der Entsorgung der Reagenzien mit viel Wasser nachgespült werden. − Entsprechend der italienischen Verordnung D.L.Nr.22 vom 5.2.97 und gemäß der EEC-Direktiven 91/156/EEC, 91/689/EEC und 94/62/EEC werden alle Abfallprodukte aus manueller und/oder automatisierter Testbearbeitung als gefährlicher Sonderabfall klassifiziert (Europäische Klassifizierung, Code 180103). Als solcher müssen sie durch Abgabe an ein Spezialunternehmen, das für die Abfallsammlung und -entsorgung qualifiziert ist, abgegeben werden. 6. PROBENGEWINNUNG UND -VORBEREITUNG Als Probenmaterial wird Serum eingesetzt. Stark lipämische oder hämoylsierte Proben dürfen nicht verwendet werden. Das frische Serum kann 1 Tag bei 2-8 °C oder für einen längeren Zeitraum bei -20 °C gelagert werden. Die Seren sollten nicht wiederholt eingefroren und aufgetaut werden. 7. TESTDURCHFÜHRUNG* − Bringen Sie die Reagenzien und Proben auf Raumtemperatur. − Mischen Sie die Proben vor Gebrauch durch Umdrehen über Kopf. 7.1 7.2 Bereiten Sie Wells für Blank, Kalibratoren, Kontrollseren und Proben vor. 50 µl Kalibrator, Kontrollserum und Probe in die entsprechenden Wells pipettieren. 7.3 7.4 200 µl Enzyme Conjugate in alle Wells außer Blank pipettieren. Decken Sie die Mikrotiterplatte mit der Folie ab und mischen Sie vorsichtig. KT7EW FT4 EIA WELL M320.de Rev.4 01/2009– Pag. 7/14 7.5 Inkubieren Sie die Wells 90±5 Minutes bei Raumtemperatur (18-25°C) auf einem Orbital-Schüttler bei 1200 rpm. 7.6 Entfernen Sie die Folie und saugen Sie die Inkubationsmischung sorgfältig aus den Wells ab. 7.7 Waschen Sie die Wells 4-mal mit 350 µl verdünnter Waschlösung. Saugen Sie die Flüssigkeit aus den Wells ab. 7.8 200 µl Substrat-Chromogen-Lösung (siehe Abschnitt „Reagenzien“ in alle Wells pipettieren. 7.9 15 Minuten bei Raumtemperatur (18-25°C) auf einem Orbital-Schüttler mischen. Direkte Sonneneinstrahlung vermeiden. 7.10 100 µl Blocking Reagent in alle Wells pipettieren. 7.11 Messen Sie die Extinktion der Wells bei 450 nm mit einem möglichst bichromatischen Spektrophotometer bei einer Referenzwellenlänge von 620 nm (das Gerät mit dem Blankwell auf Null einstellen). Bei überschießenden Extinktionswerten messen Sie bei 405 nm. Die Messung muss innerhalb von 20 Minuten nach der Testdurchführung beendet sein. * Falls Sie für die Testdurchführung ein automatisiertes Analysegerät für Mikrotiterplatten von RADIM und/oder SEAC verwenden, beachten Sie die entsprechende Bedienungsanleitung. 8. PIPETTIERSCHEMA: siehe Seite 14 9.BERECHNUNG DER ERGEBNISSE Um eine bessere Sensitivität zu erreichen, verwendet diese Methode eine spektrophotometrische Messung bei zwei Wellenlängen (450 und 405 nm). Messen Sie Proben mit einer FT4-Konzentration zwischen 10 und 80 pg/ml bei einer Wellenlänge von 450 nm, Proben mit einer FT4-Konzentration <10 pg/ml bei 405 nm. Zeichnen Sie eine Eichkurve auf Millimeterpapier, indem Sie die Kalibratorkonzentration (x-Achse) gegen die Extinktion jedes Kalibrators (yAchse) auftragen. Die FT4-Konzentrationen in pg/ml erhalten Sie durch Interpolieren der Extinktion jeder Probe auf der Eichkurve. 9.1 Berechnungsbeispiel Die folgenden Werte dienen nur als Beispiel und dürfen nicht anstelle der tatsächlich ermittelten Daten verwendet werden. KT7EW FT4 EIA WELL M320.de Rev.4 01/2009– Pag. 8/14 Beschreibung Calibrator Calibrator Calibrator Calibrator Calibrator Calibrator Probe 1 0 pg/ml 5 pg/ml 10 pg/ml 20 pg/ml 40 pg/ml 80 pg/ml Extinktion bei 450 nm > 3,000 > 3,000 1,683 1,025 0,398 0,141 1,346 FT4 15 pg/ml Extinktion bei 450 nm 4,536 2,533 === === === === === FT4 9.2 Normalwerte Die unten angegebenen Serumwerte für FT4 sind beeinflusst durch Faktoren wie Klima, geographische Lage und Ernährung. Jedes Labor sollte nach Möglichkeit seine eigenen Normalbereiche ermitteln. Normalwerte: Hypothyreose: Hyperthyreose: 7 – 18 pg/ml < 7 pg/ml > 18 pg/ml (9 – 23 pmol/l) ( < 9 pmol/l) ( > 23 pmol/l) 9.3 Umrechnungsfaktor pmol/l = (pg/ml : 777) x 1000 9.4 Testvalidität Bevor Sie die Ergebnisse berechnen, stellen Sie sicher, dass die Konzentrationen der Kontrollseren innerhalb der im QC-Blatt angegebenen Bereiche liegen. 10. TESTCHARAKTERISTIKA 10.1 Spezifität Diese Methode zeigt folgende Kreuzreaktionen: SUBSTANZ 3 Jod-L-Tyrosin (MIT) 3, 5 Dijod-L-Tyrosin (DIT oder T2) 3, 5 Dijodod-L-Tyronin 3, 3’, 5, Trijod-L-Tyronin (T3) 3, 3’, 5’ Trijod-L-Tyronin (rT3) 3, 3’, 5, 5’ Tetrajod-L-Tyronin (T4) 3, 3’, 5, 5’ Tetrajod-D-Tyronin (D-T4) % Kreuzreaktion 0 0 0 3,3% 6,4% > 100% > 100% KT7EW FT4 EIA WELL M320.de Rev.4 01/2009– Pag. 9/14 10.2 Analytische Sensitivität Die analytische Sensitivität wurde anhand der Eichkurve ermittelt und angegeben als kleinster vom Nullkalibrator unterscheidbarer Wert (Mittelwert OD – 2 SD). Er liegt unter 1 pg/ml. 10.3 Funktionale Sensitivität Die funktionale Sensitivität entspricht der Konzentration bei einem Interassay CV von 20%. Sie liegt unter 1,5 pg/ml. 10.4 Präzision Die Präzision wurde ermittelt durch die Bestimmung der Wiederholbarkeit und Reproduzierbarkeit (Intra- und Interassay-Varianz) anhand von Seren mit verschiedenen FT4-Konzentrationen. Wiederholbarkeit (Intraassay) Serum Mittelwert a b c d 6,2 13,1 27,2 72,1 ± (pg/ml) ± ± ± ± S.D. 0,6 0,6 0,7 2,6 C.V. % 9,6 4,6 2,6 3,6 Replikate n 10 10 10 10 C.V. % 7,5 10,4 6,6 Assays n 10 10 10 Reproduzierbarkeit (Interassay) Serum Mittelwert a b c 11,5 26,2 69,9 ± (pg/ml) ± ± ± S.D. 0,86 2,73 4,6 10.5 Verdünnung Innerhalb einer bestimmten Grenze ist die Konzentration der freien Hormone unabhängig von den Trägerproteinen; tatsächlich ist der in einer Probe gemessene Wert in derselben Probe in verschiedenen Verdünnungen immer konstant. Es wurden zwei verschiedene Methoden verwendet: a) absteigende Mengen derselben Probe wurden pipettiert; b) dieselbe Menge von verdünnter und unverdünnter Probe in einer Matrix ohne Trägerproteine wurde pipettiert. KT7EW FT4 EIA WELL M320.de Rev.4 01/2009– Pag. 10/14 a) Serum #1 b) Serum #1 Menge 50 μl 40 μl 35 μl 30 μl 25 μl 20 μl 15 μl gemessene Konz. pg/ml 28,5 23,3 23,9 22,9 21,7 19,2 18,5 Verdünnung 1/1 1/1,5 1/2 1/2,5 1/5 gemessen (pg/ml) 28,5 24,3 23,1 21,8 22 Serum Menge #2 50 μl 40 μl 35 μl 30 μl 25 μl 20 μl 15 μl Serum Verdünnung #2 1/1 1/1,5 1/2 1/2,5 1/5 gemessene Konz. pg/ml 28 23,1 23,3 24,9 21,7 19,5 18,8 gemessen (pg/ml) 28 24,3 23 22,4 22,9 11. GRENZEN DES VERFAHRENS Die Ergebnisse für diesen Assay müssen sorgfältig interpretiert und durch klinische Evaluierungen und weitere diagnostische Tests bestätigt werden. 12. SYMBOLLEGENDE: siehe Seite 12 KT7EW FT4 EIA WELL M320.de Rev.4 01/2009– Pag. 11/14 SYMBOLE EN 980 – EDMA REF Referenz oder Bestellnummer LOT Lotnummer Verfallsdatum IVD Für den Gebrauch in der IN-VITRO-DIAGNOSTIK CE-Markierung bei Erfüllung der IVD Richtlinie 98/79 EG Lagerung bei 2-8°C produkt der Biogefährdung Schauen Sie die Arbeitsanleitung an 96 genügend für 96 Tests RCNS rekonstituiren mit H 2O Deionisiertes oder Destilliertes Wasser KT7EW FT4 EIA WELL M320.de Rev.4 01/2009– Pag. 12/14 BIBLIOGRAFIA-REFERENCES-LITERATUR 1 - Larsen P.R. Triiodothyronine: review of recent studies of its physiology and pathophysiology in man. Metabolism 1972 Nov. Vol: 21 (11), p: 1073-92. 2 - Brown.J. Chopra I.J. Cornell J.S et al. Thyroid physiology in health and disease. ANNINTERNMED, 1974, 81/1 (68-81). 3 - Singer P.A., Nicoloff J.T., Estimation of the triiodothyronine secretion rate in euthyroid man. J. Clin. Endocr. Metab. 1972 Jan. Vol: 35 (1), p. 82 - 9. 4 - Surks M.I. Schadlow A.R. Stock J.M. Oppenheimer J.H. Determination of iodothyronine absorption and conversion of L-thyroxine (T4) to Ltriiodothyronine (T3) using turnover rate techniques. J.Clin.Invest 1973 Apr. Vol: 52 (4), p: 805-11. 5 - Fleischer N. Burgus R. Vale W. Dunn T. Guillemin R. Preliminary observations on the effect of synthetic thyrotropin releasing factor on plasma thyrotropin levels in man. J.Clin.Endocrinol.Metab. 1970 Jul, Vol: 31 (1), p: 109-12. 6 - Sterling K. Refetoff S. Selenkow H.A. T3 thyrotoxicosis, Thyrotoxicosis due to elevated serum triiodothyronine levels. Jama 1970 Jul 27, Vol: 213 (4), p: 571-5. 7 - Hollander C.S. and Shenkman L., in B. Rothfeld ed, "Nuclear Medicine in Vitro" (Philadelphia: Lippincott, 1974). 8 - Ekins, R. : Measurements of free hormones in blood. Endocrine Reviews, 1990, 11 (1), 5-46. 9 - Maberly G., Waite K., MA G., Soni N., and Eastman C. Binding characteristics of Thyroxin Binding Globulin in serum of normal, pregnant and severely III euthytoid patients. Clin. Chem. 1986, 32 (4), 616-20. 10 - Midgley J. E. M. Direct and indirect free thyroxine assay methods: theory and practice. Clin. Chem. 2001, 47 (8), 1353-1363. KT7EW FT4 EIA WELL M320.de Rev.4 01/2009– Pag. 13/14 PIPETTIERSCHEMA Wells Blank CAL (0 - 5) CTR Proben CAL (0 - 5) ---- 50 µL ---- ---- CTR ---- ---- 50 µL ---- Proben ---- ---- ---- 50 µL CONJ ---- 200 µL 200 µL 200 µL 200 µL 200 µL 200 µL 100 µL 100 µL 100 µL Reag − Inkubieren: 90±5' (1200 rpm), RT − Absaugen und waschen: 4 x 350 µL. TMB + SUBS 200 µL − Inkubieren: 15' (1200 rpm), RT 100 µL STOP - Messen: 450 - 405 nm. RADIM S.p.A. - Via del Mare, 125 - 00040 Pomezia (Roma) Italia Tel.: +39 06 91.249.1 - Fax: +39 06 91.249.443 National Order Entry: +39 06 91.249.702 Export Department: +39 06 91.249.701 Customer Care: +39 06 91.249.700 [email protected] - www.radim.com