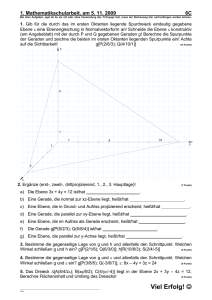
Kurztitel Kundmachungsorgan §/Artikel/Anlage
Werbung

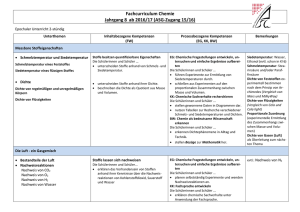
Bundesrecht Kurztitel Lehrpläne - Bildungsanstalt für Erzieher Kundmachungsorgan BGBl. Nr. 355/1985 §/Artikel/Anlage Anl. 1/17 Inkrafttretensdatum 01.09.1985 Außerkrafttretensdatum 10.05.1994 Beachte Anlage I Klassenweise gestaffeltes Inkrafttreten (Art. III § 1) Klassenweise gestaffeltes Außerkrafttretedatum (Art. III § 3 idF BGBl. Nr. 701/1993) Text CHEMIE Bildungs- und Lehraufgabe: Aufgabe des Chemieunterrichtes ist es, das Verständnis für die chemischen Vorgänge in Alltag, Natur und Technik zu wecken, sowie gleichzeitig bewußt zu machen, daß jede Materie Gegenstand chemischer Betrachtung sein kann. Der Schüler soll die Stellung der Chemie im modernen Weltbild, sowie Aufgaben und gesellschaftlichzivilisatorische Bedeutung chemischer Forschung und Technik erkennen. Die Vermittlung der grundlegenden Kenntnisse aus anorganischer, organischer und allgemeiner Chemie sollen den Schüler zu verantwortungsbewußter Verwendung chemischer Substanzen in allen Lebensbereichen insbesondere in der zukünftigen Berufsarbeit befähigen. Der Behandlung von Umweltproblemen kommt dabei eine besondere Bedeutung zu. Lehrstoff: 2. Klasse (2 Wochenstunden): Der Aufbau der Stoffe: Reinstoff, Gemisch, Elemente, Verbindungen; chemische Schreibweise, Atom, Struktur der Atomhülle, Radioaktivität, Periodensystem; Chemische Bindungen (Atombindung, Ionenbindung, Elektronegativität, Metallbindung); Molekulare, salzartige, metallische Stoffe; zwischenpartikuläre Kräfte und Zusammenhang Aggregatzuständen. www.ris.bka.gv.at Seite 1 von 3 mit Bundesrecht Eigenschaften und chemische Veränderungen von Stoffen: Die Luft (Zusammensetzung). Sauerstoff: Oxidation, Reduktion, Feuer, Feuerlöschen, Heizen. Das Wasser: Das Wassermolekül (Bindung und Struktur), Anomalie, Wasser als Lösungsmittel, Wasserstoff. Die chemische Reaktion: Chemische Grundgesetze; die Triebkräfte chemischer Reaktionen; Streben nach Energieminimum bzw. Zustand größter Unordnung; Energieumsatz bei chemischen Reaktionen (Aktivierungsenergie, Reaktionsenergie, Katalysatoren); Reaktionsgeschwindigkeit, reversible Reaktionen, chemisches Gleichgewicht, Massenwirkungsgesetz; allenfalls elektrochemische Reaktionen. Säuren und Basen, Salze: Protolyse (Neutralisation), Brönstedt-Definition, pH-Wert, Indikatoren, Salze. Die Elemente und ihre Verbindungen: Vorkommen, wichtigste Eigenschaften, allenfalls: Darstellung. 7. Gruppe des Periodensystems: Chlor und seine Verbindungen (Kochsalz, Salzsäure, allenfalls: Chlorate); Begriff der Oxidationszahl und Redoxvorgänge; Brom, Jod, Fluor. 6. Gruppe des Periodensystems: Schwefel (Allotropie); Sulfide und Sulfate als Minerale; Schwefeloxide; schwefelige Säure, Schwefelsäure; Schwefelwasserstoff. 5. Gruppe des Periodensystems: Stickstoff, Ammoniak; Stickoxide, Salpetersäure; Phosphor; Stickstoffund Phosphordünger; Überdüngung, Stickstoffkreislauf. 4. Gruppe des Periodensystems: Kohlenstoff (Grafit und Diamant); Inkohlungsprozeß; Oxide des Kohlenstoffes; Kohlensäure und Carbonate; Mörtel, Kalkverwitterung; Silizium (Halbleiter), Silikate und Silikatbaustoffe (Glas, Beton). Die Metalle: allgemeine Metalleigenschaften; Aluminium, Silber (Fotografie), Eisen und Stahl. Allenfalls: Magnesium, Natrium, Kupfer. 3. Klasse (2 Wochenstunden): Einführung in die „Organische Chemie''. Die Kohlenwasserstoffe: Erdöl (Vorkommen, Entstehung, Gewinnung, Aufarbeitung); Alkane, Alkene, Alkine, aromatische Verbindungen (Molekülbau, Struktur, Stellungs- und geometrische Isometrie, Nomenklatur); wichtigste Reaktionstypen (Substitutionsreaktion, Additionsreaktion, Crack-Reaktion). Derivate von aliphatischen und zyklischen Kohlenwasserstoffen (Aufbau, Nomenklatur, wichtigste Eigenschaften): Halogenderivate. Hydroxidderivate: Alkohole (alkoholische Gärung). Allenfalls: mehrwertige Alkohole, Phenole. Carbonyle: Aldehyde, Ketone. Carbonsäure und subsituierte Carbonsäure (optische Aktivität), Ester (Veresterung und Spaltung). Ether. Stickstoffderivate: Amine (Anilin), Amide. Allenfalls: die wichtigsten Reaktionsmechanismen (Substitutionsmechanismus, radikalisch und elektrophile Additionsmechanismen, elektrophile Reaktionen). Nährstoffe und Nahrungsmittel: Kohlehydrate: Aufbau, Monosaccharide (Trauben-, Fruchtzucker), Disaccharide (Saccharose, Milchzucker), Polysaccharide (Stärke, Zellulose). Fett und Öle: Aufbau und Verdauung. Proteine: Aminosäuren, Aufbau von Proteinen (allenfalls Enzyme). Weitere Bestandteile der Nahrungsmittel: Vitamine, Mineralstoffe, Ballaststoffe. Konservierung der Nahrungsmittel, Unterschied Nahrungsmittel und Genußmittel. Besondere Kapitel der angewandten organischen Chemie: www.ris.bka.gv.at Seite 2 von 3 Bundesrecht Treibstoffe (Oktanzahl), Treibstoffzusätze, alternative Treibstoffe. Halbsynthetische und vollsynthetische Kunststoffe (Reaktionstypen, Einteilung nach grundlegenden Eigenschaften). Seife und Waschmittel (Waschwirkung, Zusammensetzung). Farbstoffe: Wechselwirkung mit dem Licht im Zusammenhang mit dem Molekülbau. Arzneimittel und Drogen; allenfalls: Kosmetika. Umweltchemie: Luft: Schadstoffe (Entstehung und Beseitigung). Wasser: Verschmutzung, Güteklasse, Klärung, allenfalls: Wasserstofftechnologie. Didaktische Grundsätze: Der Chemieunterricht soll auf lebensnahe Probleme, mit denen die Schüler bei ihrer zukünftigen beruflichen Tätigkeit in Horten, Heimen und Tagesheimstätten für Kinder und Jugendliche täglich konfrontiert werden, ausgerichtet sein. Die Beschränkung auf Grundkenntnisse ergibt sich aus der raschen Entwicklung der chemischen Forschung. Leicht verständliche Experimente sollen Erkenntnisse über das Wesen verschiedener Stoffe und den Zusammenhang zwischen ihrer Struktur und ihren Eigenschaften vermitteln, um das Verständnis für die Natur zu vertiefen, sowie die Vor- und Nachteile der Chemie in der menschlichen Zivilisation zu erklären. Besondere Berücksichtigung verlangen Probleme des Umweltschutzes (Wasser, Luft, Boden), Nahrungsmittelchemie und Pharmakologie, Kunststoffindustrie und Energieversorgung. Wichtig sind Kenntnisse über die Behandlung und Anwendung verschiedener chemischer Substanzen (zB Arzneien, Detergentien, Farbstoffe) und deren Wirkung auf den menschlichen Organismus (bei Verätzungen und Vergiftungen), deren Brennbarkeit, Explosivität, Radioaktivität. Hinweise zur Ergänzung der Ausbildung in Erster Hilfe sind unbedingt zu empfehlen. Im Unterricht soll auf aktuelle in den Medien dargebotene Probleme vorrangig eingegangen werden. Die Schüler sollten dazu angehalten werden, sowohl einzeln als auch in kleinen Gruppen einfache Experimente durchzuführen und zu interpretieren. Hierbei ist den erforderlichen Sicherheitsmaßnahmen besonderes Augenmerk zu schenken. Die Schüler sind immer wieder auf deren Einhaltung - insbesondere in der zukünftigen beruflichen Tätigkeit - hinzuweisen. Exkursionen und Lehrausgänge in chemische Betriebe oder Laboratorien sind zur Ergänzung des Unterrichtes nach Möglichkeit durchzuführen. Wichtig ist die Herstellung von Querverbindungen zu anderen naturwissenschaftlichen Unterrichtsgegenständen (Physik, Biologie und Umweltkunde, Gesundheitslehre), sowie zur Didaktik und Praxis. www.ris.bka.gv.at Seite 3 von 3