Tropenbiologische Exkursion nach Costa Rica mit
Werbung
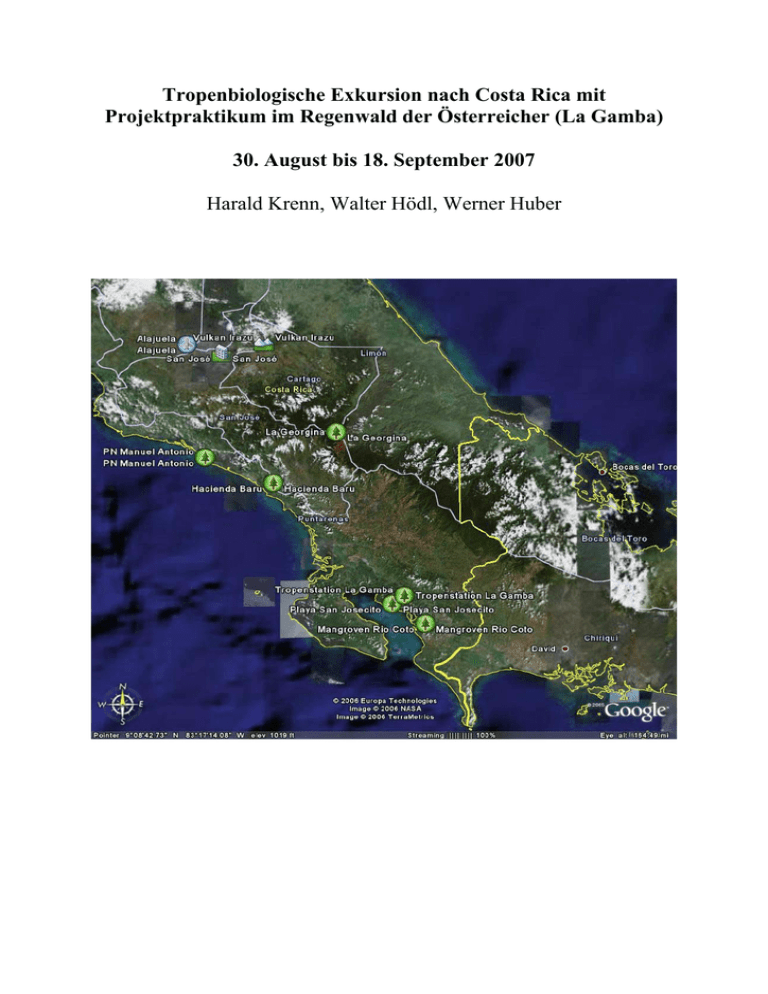
Tropenbiologische Exkursion nach Costa Rica mit Projektpraktikum im Regenwald der Österreicher (La Gamba) 30. August bis 18. September 2007 Harald Krenn, Walter Hödl, Werner Huber Liste der Teilnehmerinnen und Teilnehmer: Silvia Hufnagl [email protected] Catarina Güttner [email protected] Alexandra Bauer [email protected] Agnes Demetz [email protected] Doris Kruder [email protected] Birgit Rotter [email protected] Michaela Kainz [email protected] Harald Nowak [email protected] Adreas Benkö [email protected] Daniel Philippi [email protected] Claudia Schütz [email protected] Michael Lagler [email protected] Kerstin Olbrich [email protected] Gregor Baumgartner [email protected] Tina Buchegger [email protected] Itinerar zum Tropenbiologische Exkursion nach Costa Rica mit Projektpraktikum im Regenwald der Österreicher (La Gamba) Wochentag Datum Aktivität Donnerstag 30. Aug. Abflug nach Madrid Freitag 31. Aug. 1. Sept. Sonntag 2. Sept. Montag 3. Sept. Dienstag 4. Sept. Mittwoch 5. Sept. Donnerstag 6. Sept. Freitag 7. Sept. Samstag 8. Sept. Sonntag 9. Sept. Montag 10. Sept. Dienstag 11. Sept. Mittwoch 12. Sept. Donnerstag 13. Sept. Freitag 14. Sept. Samstag 15. Sept. Páramo, Bergregenwald Fahrt nach San José und Nachmittag Abflug nach 16. Sept. Madrid Ankunft in Madrid und 17. Sept. Weiterflug nach Wien Montag Madrid-Iberia Ankunf in San José Hotel bei Alajuela Weiterfahrt über NP Carara und weiter nach Dominical Hacienda Baru Samstag Sonntag Übernachtung Exkursion auf der Hacienda Baru Hacienda Baru Tropenstation La Weiterfahrt nach La Gamba Gamba "Regenwald der Tropenstation La Österreicher" - La Gamba Gamba "Regenwald der Tropenstation La Österreicher" - La Gamba Gamba "Regenwald der Tropenstation La Österreicher" - La Gamba Gamba "Regenwald der Tropenstation La Österreicher" - La Gamba Gamba "Regenwald der Tropenstation La Österreicher" - La Gamba Gamba "Regenwald der Tropenstation La Österreicher" - La Gamba Gamba "Regenwald der Tropenstation La Österreicher" - La Gamba Gamba "Regenwald der Tropenstation La Österreicher" - La Gamba Gamba "Regenwald der Tropenstation La Österreicher" - La Gamba Gamba "Regenwald der Tropenstation La Österreicher" - La Gamba Gamba Nachmittag Abfahrt Richtung Cerro de la Muerte La Georgina La Georgina Trockenwald, Küste Trockenwald, Küste Exkursion im Esquinas Exkursion im Esquinas Exkursion im Esquinas Praktikum Praktikum Praktikum Praktikum Praktikum MangrovenTour Praktikum Praktikum Bergregenwald, Páramo Bergregenwald, Páramo KURZINFORMATION COSTA RICA Lage: Mittelamerika, C. R. grenzt im N an Nicaragua, im Süden an Panama, im Westen an den Pazifik, im Osten an die Karibik Geografie: die Kordilleren ziehen von SW nach NO und erreichen bis zu 3820m Höhe (Chirripo). Sie bilden die klimatische Trennungslinie zwischen karibischer und pazifischer Region. Größe: 51.000km², ca. 2/3 der Größe Österreichs Länge/Breite: max. L 464km, min. B 119km, max. B 259km Einwohner: 3. 232. 526, Stand 1994. Einwohnerdichte/km² 63 Bevölkerung: 97% sind Nachfahren der Spanischen Siedler bzw. Mestizen, 2,8% Schwarze, 0,2% Indigene Sprache: Spanisch ist Amtssprache, Englisch an der Karibik, indigene Sprachen in den Reservaten Regierung: stabilste Demokratie Mittelamerikas!, einschneidende Zensur in der Politik war 1948 ein 6wöchiger Bürgerkrieg, anschließend wurde das Militär abgeschafft. Die Verfassung von 1949 ist bis heute gültig. Religion: Religionsfreiheit, 81,3 % Katholiken, kleinere Glaubensgemeinschaften (Anglikaner, Methodisten, Baptisten, Adventisten, Jehova) Bildung: Bildungsrate 93%, Schulpflicht seit 1869, 12 Universitäten Währung: Colon, 1 Colon = 100 Centimos; 100 Colon ca. c. 20 Cent (Stand 2003) Wirtschaft: hauptsächlich Landwirtschaft und Dienstleistungsgewerbe, wenig Industrie und Bodenschätze (Bauxit), Hauptexportgüter sind Banane (1) und Kaffee (2), der Tourismus ist seit einigen Jahren eine wichtige Einnahmequelle (500 Mio EUR pro Jahr), Arbeitslosenrate 4%, Inflationsrate Dez. 1993-9,04%, wichtigster Handelspartner sind seit jeher die USA (37%). 6,1% Wirtschaftswachstum 1994, Handelsbilanzdefizit 1993 6 Mrd. EUR. Natur: über 140 Schutzgebiete, darunter 13 Nationalparks, viele Biologische Reservate, insgesamt stehen ca. 25% der Landesfläche unter Naturschutz (entspricht der Größe Tirols und Kärntens zusammen). Hoher Artenreichtum aufgrund der Lage zwischen Nord- und Südamerika und aufgrund der orographischen Vielfältigkeit. Geschätzte Zahl an Gefäßpflanzen 10.000. Bekannte Artenanzahl an Wirbeltieren 1529 (127 Fische, 150 Amphibien, 199 Reptilien, 850 Vögel!, 203 Säugetiere). An einer Biodiversitätsstudie wird gearbeitet (INBio). Klima: tropisch feucht mit einer durchschnittlichen Temperatur von 28°C im Tiefland, Niederschläge variieren von 1500mm im Norden bis über 5000mm im Süden. Tageszeitenklima in den höheren Kordilleren. Niederschlagszunahme aufgrund der Steigungsregen bis in ca. 2400m. LITERATUR Reiseführer BLAKE & BECHER. Costa Rica. Ulysses Press. engl. 370 S. HABER, H. Costa Rica. Apa Guide. 310 S. gute, allgemeine Information über Natur und Kultur C.R. O`BRYAN & ZAGLITSCH. Costa Rica. Peter Mayer Reiseführer. 410 S. KIRST DETLEF. Costa Rica Handbuch. Reise Know How. 460 S. RACHOWIECKI, R. & al. Central America. engl. Vlg. Lonely planet. 640 S. RACHOWIECKI, R. & al. Mittelamerika Handbuch. G. Walther Vlg. 590 S. RACHOWIECKI, R. Costa Rica-Handbuch. G. Walther Vlg. 450 S. RACHOWIECKI, R. Costa Rica. Lonely planet. 420 S. THOMAS, P. Reiseführer Costa Rica. Tucan Verlag. 413 S. allgemeiner Reiseführer mit viel Landeskunde DENZER, W. Reiseführer Natur. Costa Rica. BLV - Verlag 1997. Wissenschaftliche Literatur über die Natur Costa Ricas ALLEN, P.H. 1956. The rainforests of the Golfo Dulce. Stanford Press. ALVARADO, G. 1993. Costa Rica-Land of Volcanoes. Gallo Pinto Press. BELETSKY, L. 1998. Costa Rica. The ecotravellers´ wildlife guide. Academic Press. Beschreibung der einzelnen Vulkane und ihre Erforschung. BOZA, M. A. 1988. Costa Rica-National Parks. Editorial Heliconia-Fundacion Neotropica-San José, Costa Rica. Informatives und reich bebildertes Werk über alle Nationalparks von Costa Rica. CROAT, TH.B. 1978. The Flora of Barro Colorado Island. Stanford Univ. Press. EMMONS, L. 1990. Neotropical rainforest mammals-a field guide. University of Chicago Press. reich bebildeter Führer der Säugetiere, mit Verbreitungskarten und guten Beschreibungen der Arten. GENTRY, A. H. 1990. Four neotropical rainforests. Yale University Press. wissenschaftliches Werk über die Regenwaldbiologie von 4 verschiedenen Tropenwäldern in Costa Rica, Brasilien, Panama und Peru. HAMMEL, B. 1999. Plantas ornamentales nativas de Costa Rica. Inbio. HENDERSON, A., GALEANO, G., BERNAL, R. 1995. The palms of the americas. Princeton. HOLDRIDGE, L.R., POVEDA, L.J., JIMÉNEZ, QU. 1997. Arboles de Costa Rica. Vol. I. Centro Cientifico Tropical. Informatives und reich bebildertes Werk über alle Nationalparks von Costa Rica. JANZEN, D.H. (ed.) 1983. Costa Rican Natural History. University of Chicago Press. Naturgeschichte Costa Ricas, beinhaltet Geologie, Klima, Landwirtschaft, wichtige Pflanzen und Tiere. Sehr empfehlenswert! JIMENEZ, A.J. 1994. Los manglares del Pacifico Centroamericano. Editorial Fundacion UNA. MAAS, P.J.M., WESTRA, L.Y.TH. 1993. Neotropical plant families. Koeltz. MORALES, F.J. 2001. Orquídeas, cactus y bromelias del bosque seco. Costa Rica. Inbio. Naturgeschichte Costa Ricas, beinhaltet Geologie, Klima, Landwirtschaft, wichtige Pflanzen und Tiere. Sehr empfehlenswert. Pflanzenführer der wichtigsten Bäume dieser Region. RIDGELEY, R. & GWYNNE, J. A. JR. 1989. A guide to the birds of Panama, with Costa Rica, Nicaragua and Honduras. (2. ed.). Princeton University Press. RODRÍGUEZ-CABALLERO, R. F. & AL. 1896. Géneros de orchideas de Costa Rica. Editorial Universidad de Costa Rica. wissenschaftliches Werk über die wichtigsten Orchideengattungen C.R. mit künstlerisch gestalteten Detailzeichnungen. STILES, F.G. & SKUTCH, F. A. 1989. A Guide to the Birds of Costa Rica. – Comstock Publishung Associates, Ithaca, New York (US) WEBER, A., HUBER, W., WEISSENHOFER, A., ZAMORA, N., ZIMMERMANN, G., 2001: An introductory Field Guide to the Flowering Plants of the Golfo Dulce Rainforests - Corcovado Nationalpark and Piedras Blancas Nationalpark ("Regenwald der Österreicher"). – Linz: OÖ Landesmuseum Stapfia 78. Allgemeine Werke über Tropenbiologie AMERIKA-Zur Entdeckung-Kulturpflanzen-Lebensraum Regenwald. Katalog zur Ausstellung “Lebensraum Regenwald” im Schloßmuseum Linz. ISBN 3-900 746-53-2 Das Werk beschreibt die Regenwalderforschung vond der Brasilienexkursion Maximilians 1859-1860 bis zur Regenwaldproblematik der Gegenwart. Empfehlenswert! GEORGE, U. 1989. Regenwald-Vorstoß in das tropische Universum. Geo im Verlag Grunner +Jahr AG & Co., Hamburg. Populärwissenschaftliches Werk mit faszinierenden Fotografien. VARESCHI, V. 1980. Vegetationsökologie der Tropen. Ulmer Verlag. Wissenschaftliches Standardwerk über die Vegetationsformen der Tropen. Vom Tieflandregenwald bis zur Páramo. Karten Travel Map of Costa Rica. 1: 500.000. I.T.M. Prod. Reproduktionsstrategien bei Froschlurchen Daniel Philippi Das Fortpflanzungsgeschehen bei Anuren ist sehr vielfältig und weist einige äußerst sonderbare Formen auf. Der in Europa vorherrschende Normalfall einer Entwicklung der Eier im Wasser zu Kaulquappen und anschließendem Landgang nach der Metamorphose, wird beim Blick in fernere Länder (zum Beispiel Costa Rica) nur eine Möglichkeit von vielen. Ein Grundcharakteristikum des Fortpflanzungsgeschehens ist zunächst die Zeit in die es fällt. Diese hängt je nach Art und deren Lebensraum von verschiedenen Faktoren ab, zum Beispiel: 1. Temperatur: Sie muss hoch genug sein, damit Adulttiere aktiv werden und sich die Eier gut entwickeln. Hierbei gibt es erhebliche Unterschiede zwischen den Arten, bedingt durch ihre physiologischen Anpassungen und Toleranzgrenzen. 2. Feuchtigkeit: Frösche weisen keine vor Austrocknung schützenden Eischalen auf, weshalb die Entwicklung dieser auf ein vorwiegend feuchtes Milieu beschränkt ist (es gibt aber einige Ausnahmen). 3. Konkurrenzverhältnisse: Für die einen Arten mag es zielführender sein, möglichst bald zu laichen (bevor Insektenlarven oder andere Froscharten das Gewässer aufsuchen; etc.), für andere wiederum eher spät abzulaichen (Insektenlarven haben sich bereits zu Adulttiere entwickelt usw.). Hierbei spielt zum Beispiel die Giftigkeit der Eier eine Rolle (werden sie von Insekten überhaupt gefressen) oder die Menge der Eier die abgelegt werden (z.B: große Eiballen“teppiche“, die Verluste verkraften können und zudem den Ablaichplatz für andere Arten minimieren) Diese 3 Hauptfaktoren (und sicher noch einige andere) bedingen den Beginn und die Dauer des Ablaichgeschehens. Die Laichperiodendauer kann in 2 Grundtypen eingeteilt werden und zwar in den der Explosivlaicher (Art laicht ein oder mehrere Tage bis maximal 1 Monat) und den der Langzeitlaicher (Art laicht 1 oder mehrere Monate bis über das ganze Jahr). • • Bei Explosivlaichern befinden sich in der Regel alle am Fortpflanzunggeschehen beteiligten Individuen mehr oder weniger gleichzeitig am Gewässer. Häufig suchen sie über Jahre immer dasselbe Gewässer auf (Laichplatztreue), weshalb akustische Äußerungen oft ausbleiben (Lockwirkung nicht notwendig). Bei der Paarfindung spielen auch mehr optische als akustische Reize eine Rolle. Ein Sexualdimorphismus ist bei Explosivlaichern daher häufiger ausgeprägt. In erster Linier klammern die Männchen alles was nach Weibchen (oder nicht nach anderen Männchen) aussieht. Auf Grund der hohen Männchendichte können Weibchen kaum einen Partner wählen. Unter den Männchen kommt es oft zur so genannten scrambled competition (Drängeleien), wobei die Männchen einander attackieren oder versuchen andere Männchen, welche bereits ein Weibchen klammern an der Paarung zu hindern. Langzeitlaicher hingegen verteilen ihr Laichgeschehen über einen längeren Zeitraum, in welchem die Männchen die meiste Zeit am Gewässer bleiben und dort laut rufen um Weibchen anzulocken (eventuell bilden sich ganze Chöre). Die Weibchen tauchen vereinzelt auf und haben mehr Möglichkeiten einen bestimmten Partner auszuwählen. Bei manchen Arten treten bei hohen Männchendichten so genannte Satelittenmännchen auf. Diese rufen nicht selbst sondern fangen Weibchen ab, die von einem anderen Männchen angelockt werden und klammern es selbst. Bei geringer Männchendichte ist es jedoch günstiger selbst zu rufen. Die Weibchen kehren nach einmaligen Ablaichen eventuell später in der Saison noch einmal zurück. Als wichtigstes Kommunikationsmittel gelten bei Fröschen ihre Lautäußerungen. Diese spielen vor allem beim Fortpflanzungsgeschehen eine entscheidende Rolle. Als lautbildende Organe fungieren der Larynx (primärer Stimmapparat) und die Schallblasen (sekundärer Stimmapparat), sofern vorhanden. Der Mechanismus der Lautbildung ist eng gekoppelt mit der Atmung und basiert im Wesentlichen auf einem herauspumpen von Luft aus der Lunge in den Kehlsack (exspiratorischer Ruf) oder umgekehrt (inspiratorischer Ruf). Die Rufe werden bis auf so genannte Schreckrufe mit geschlossenem Mund geäußert. Die Schallblasen können verschieden ausgebildet sein und zwar: • • • • • paarig lateral (in den Mundwinkeln) paarig kehlständig (mit Septum oder ohne) unpaar kehlständig (unter Umständen 2fach ausgebuchtet) sie können auch nach Innen verlagert sein (also nicht dünnhäutig, sondern mit normal differenzierter Körperhaut bedeckt sein) oder sie fehlen ganz Die Rufe werden in verschiedene Typen unterteilt (welche selten alle von einer Art geäußert werden) und zwar: • • • • • • avdertisement calls (Anzeigerufe): werden von Männchen geäußert und sollen das Weibchen anlocken aber auch anderen Männchen ihre Anwesenheit klarmachen und diese fernhalten. courtship calls (Paarungsrufe): werden von Männchen geäußert; oft erst bei Sichtkontakt mit dem Weibchen. Diese Rufe richten sich ausschließlich an das Weibchen. response calls (Antwortrufe): werden von Weibchen mancher Arten als Antwort auf die Paarungsrufe eines Männchens geäußert encounter calls (Kampfrufe): wird von einem Männchen gegenüber anderen Männchen geäußert, die sich ihm nähern oder als Antwort auf Anzeigerufe und Kampfrufe anderer Männchen release calls (Befreiungsrufe): Werden von Männchen geäußert, die von anderen Männchen geklammert werden oder von Weibchen, die entweder nicht paarungsbereit sind oder von einem artfremden Männchen geklammert werden stress calls (Schreckrufe): werden bei Bedrohung und unter Stress mit offenem Mund geäußert Die Rufe sind artcharakteristisch, wobei es auch zu Dialekten und Variationen auf Grund von Hybridisierungen kommen kann. Zudem sind sie individuell verschieden und die Tonhöhe hängt unter anderem stark von der Größe des Tieres und der Lufttemperatur ab. Auch kann sich die Rufcharakteristik durch eine hohe Anzahl rufender Männchen (in Chören) verändern. Die hohen Frequenzen werden über das Trommelfell und nur einem Ohrknöchelchen (Columella) an die Papilla basiliaris weitergeleitet und dort in neuronale Signale transformiert. Die tiefen Frequenzen werden sehr wahrscheinlich über einen Beinmuskel an das Operculum und zur Papilla amphibiorum geleitet (ist noch unklar). Zeigt sich das Weibchen vom Werben des Männchens beeindruckt oder wird es einfach überrumpelt, kommt es zum so genannten Amplexus, bei dem das Männchen das Weibchen vor den Hinterbeinen (Amplexus inguinalisÆ bei ursprünglicheren Arten) oder in der Achselgegend (Amplexus axillarisÆ bei abgeleiteten Arten) klammert. Häufig bilden Männchen Brunftschwielen aus, welche einen besseren Halt ermöglichen oder sie scheiden eine klebende Flüssigkeit auf der Bauchseite aus, um so besser am Rücken des Weibchens zu haften. Während des Amplexus (die stark variieren kann) gibt das Weibchen in der Regel stoßweise ihre Eier ab, wobei das Männchen gleichzeitig seinen Samen abgibt. Der Laich kann verschiedenste Formen annehmen von einzeln abgegebenen Eiern, kleine oder große Ballen bis flache Eifilme, Schnüre etc. Ein Ei ist in der Regel von der Vitellarmembran und mehreren Gallerthüllen umgeben. Der Eiablage- und Entwicklungsort kann bei Froschlurchen sehr variabel sein. Grundsätzlich wird zwischen den 3 Formen *im Wasser*, *an Land* und *Eier werden im Eileiter zurückgehalten* unterschieden (abgeänderte Tabelle nach Duellman und Trueb- (CR) bedeutet, der Eiablagetyp kommt in Costa Rica vor). Die Eiablage im Wasser kann folgende Formen annehmen: 1. Die Eiablage erfolgt in Stillgewässern (CR) Æ Smilisca phaeota 2. Die Eiablage erfolgt in Fließgewässern (CR) Æ Bufo haematiticus 3. Die Eiablage erfolgt in natürlichen oder künstlich geschaffenen wassergefüllten Tümpeln. Die Larven entwickeln sich dort vollständig oder sie werden später entweder in größere Gewässer geschwemmt oder von den Elterntieren hingetragen. (CR) Æ Hyla rosenbergi 4. Die Eiablage erfolgt in Wasseransammlungen in Baumhöhlen oder Epiphytenblattachseln. Häufig werden sie dabei auch vom Muttertier mit Nähreiern oder ähnlichem versorgt. (CR) Æ Cruziohyla calcarifer 5. Die Eier werden in Nestern (in erster Linie Schaumnester, wobei die äußeren Eihüllen durch Ruderbewegungen zu Schaum geschlagen werden) im oder auf dem Wasser abgegeben. (CR) Æ Physalaemus pustulosus 6. Die Eier werden in den Rücken des Weibchens eingebettet. Dies geschieht bei der rein aquatisch lebenden Wabenkröte in deren Rücken sich beim Weibchen Dorsaltaschen befinden, wo sich die Larven entwickeln und teilweise mit Nährstoffen versorgt werden. 7. Die Eier werden im Wasser abgelegt und dann vom Weibchen geschluckt. Der Magen dieser Magenbrüterfrösche fungiert über einen Zeitraum von 2 Monaten als Uterus, in welchem sich bis zu 25 Jungtiere entwickeln. In dieser Zeit wird keine Nahrung aufgenommen und die Sekretion der Verdauungsenzyme minimiert. Die Eiablage an Land kann folgenderweise ablaufen: 1. Die Eiablage erfolgt in ausgehobenen Mulden (evtl. auch als Schaumnest). Die Kaulquappen werden daraufhin bei Regen ins Gewässer geschwemmt. (CR) Æ Leptodactylus labialis 2. Ein Schaumnest wird in einer Höhle abgelegt, wo sich die Tiere entweder ohne Nahrung fertig entwickeln oder als fressende Larven ins Gewässer gespült werden. 3. Die Eier werden einfach an dem Uferboden, Steinen oder Laub in Gewässernähe befestigt. Die Larven werden entweder von einem Elterntier zum Gewässer getragen oder schlängeln sich dorthin. (CR) Æ Colosthetus flotator 4. Die Eier entwickeln sich am Rücken oder in speziellen Taschen der Adulttiere. 5. Die Eier werden auf Blättern über Tümpeln, Fließgewässern und auch an Blättern über einer Epiphytenblattachsel abgelegt (evtl. als Schaumnest). Schlüpfen die Larven so fallen sie ins Wasser. In den Blattachseln werden sie häufig noch von einem Elterntier versorgt. (CR) Æ Hyalinobatrachium fleischmanni 6. Die Eier werden auf Blättern abgelegt und entwickeln sich entweder direkt oder werden von einem Elterntier zu einem Wasserkörper getragen. (CR) Æ Eleutherodactylus sp. ; Dendrobates auratus 7. Die Eier entwickeln sich in den Schallblasen der Männchen, wo sie ihre Entwicklung entweder komplett vollenden oder als Larven in ein Gewässer gespuckt werden. 8. Die Eier werden um die Füße des Männchens getragen und die Larven zum Gewässer gebracht. Werden die Eier im Eileiter zurückgehalten unterscheidet man die zwei Möglichkeiten: 1. Ovovivipar: die Embryos ernähren sich ausschließlich von dem Ei mitgegebenen Dottervorrat. Beim Schlupf schlüpfen die Larven aus den Eihüllen. 2. Vivipar: die Embryos ernähren sich im Uterus von einem Eileitersekret (plazentaähnlich). Abb.: verschiedene Formen der Eiablage Walter Hödl Je nach Entwicklungstyp und Ernährungsweise unterscheiden sich die Morphologien der Larven beträchtlich. Die Palette reicht von carnivoren Formen mit kräftigen Kiefern und großen Köpfen über Algen abgrasende Larven mit feinen Raspelzähnen bis zu unspezialisierten Larven bei Arten mit direkter Entwicklung. Zuletzt kommt es durch hormonelle Veränderungen zur Metamorphose. Sobald die Jungfrösche geschlechtsreif werden, beginnt der Zyklus von Vorne. Literatur Duellman WE (1992). Reproductive strategies of frogs. Scientific American (July). 58- 65 Nöllert A & Nöllert C (1992). Die Amphibien Europas. Bestimmung – Gefährdung – Schutz. Franckh- Kosmos, Stuttgart. 33-53 Savage JM (2002). The Amphibians and Reptiles of Costa Rica. A Herpetofauna between two continents, between two seas. The University of Chicago Press. 357-375 AmphibiaWeb: Information on amphibian biology and conservation. [web application]. 2006. Berkeley, California: AmphibiaWeb. Available: http://amphibiaweb.org/. (Accessed: Aug 10, 2007). Schaumnestbildung bei Anuren Andreas Benkö und Doris Kruder 0145066 0206909 1 Das Schaumnest Beschreibung Ein Schaumnest besteht bei Anuren aus einer zähflüssigen Schleimhülle, in die Luftblasen eingelagert werden. Dieser Schleim wird als eine viskose Flüssigkeit beschrieben, die aus der Kloake des Weibchens stammt, nämlich aus einer drüsenartigen Verdickung des Ovidukts. In das Schaumnest werden die befruchteten Eier abgegeben, die darin einen Teil ihrer Entwicklung durchlaufen. Der Schaum dient dabei dem Schutz vor Fressfeinden, vor Austrocknung und vor Verpilzung der Eier. Abb.: Ein Schaumnest Schaumnester im Tierreich Auch in anderen Gruppen werden Schaumnester gebildet, so z.B. bei der Schaumzikade und bei einigen Arten der Labyrinthfische. Die Larven der Schaumzikaden produzieren durch ausgeatmete Luft aus ihren Tracheen kleine Bläschen, die in einen flüssigen Schleim eintreten. Labyrinthfische hingegen schnappen an der Wasseroberfläche Luft auf, die sie unter Wasser wieder ausspucken und mit Schleim umgeben. Die Eier werden dann mit einem Öltröpfchen umgeben, sodass sie von selbst in das Schaumnest aufsteigen. Bildung Art der Bildung: Das Schaumnest wird während des Laichvorganges gebildet, und zwar durch das Schlagen einer gelatinösen Flüssigkeit mit den Extremitäten. Welche Extremitäten dabei verwendet werden ist artspezifisch: Entweder das Männchen oder das Weibchen schlagen ihre Hinterbeine oder das Weibchen schlägt mit seinen Vorderbeinen, oder aber beide Partner schlagen gemeinsam mit ihren Hinterbeinen. Ort der Bildung: Schaumnester wurden bisher an vier verschiedenen Bildungsorten beobachtet: a) auf der Wasseroberfläche b) am Boden c) im Boden d) auf Bäumen 2 Kommunaler Nestbau in der Gattung Physalaemus Unter kommunalem Nestbau versteht man den gemeinschaftlichen Nestbau von zwei oder mehr Paaren. Die einzelnen Schaumnester werden neben und übereinander platziert. Die kommunalen Schaumnester können beachtliche Ausmaße annehmen. Physalaemus pustulosus Hier werden sowohl einzelne als auch kommunale Schaumnester gebildet, die in der freien Wasserfläche positioniert werden. Um die Überlebenszeit der Larven in den Schaumnestern zu untersuchen, wurden die Nester, gebildet von einem, zweier oder dreier Paare, abgesammelt und jeweils in einen Plastikbehälter ohne Wasser gelegt. Daraufhin wurde die Zeit gestoppt, die die Larven in den Nestern überstehen konnten. Die Überlebenszeiten sahen wie folgt aus: Einzelnester: ~ 83 Stunden, kommunale Nester zweier Paare: ~ 98 Stunden und kommunale Nester dreier Paare: ~ 120 Stunden. Physalaemus fuscomaculatus Einzelnester werden eher in Ufernähe abgelegt, während die kommunalen Schaumnester in der Mitte des Gewässers liegen. Die gemeinschaftlichen Nester können beachtliche Ausmaße annehmen und aus bis zu 40 Ballen bestehen. Um die Überlebenszeit der Larven im Schaumnest zu ermitteln, wurden Einzel- und kommunale Nester in einem ausgetrockneten Tümpel beobachtet und auch hier konnte eine deutlich längere Überlebenszeit der Larven in den Gemeinschaftsnestern verzeichnet werden. Während die Larven in den Einzelnestern nur etwa 24 Stunden überstanden, so konnten die Larven in den kommunalen Nestern bis zu 72 Stunden länger überleben. Physalaemus nattereri Einzel- und auch kommunale Nester werden am Gewässerrand von temporären Gewässern und dann auch nur an steilen Ufern abgelegt. Das Paar häuft rund um das Schaumnest Erde an und verankert es am Boden. Nach Absinken des Wasserspiegels liegt das Nest am Ufer, wo es dann nach etwa 40 Stunden aufbricht und sich eine Spur aus Schaum in das Gewässer ergießt. Auf dieser Spur können die Larven in den Tümpel gleiten. Bei einem Vergleich von einzelnen und kommunalen Nestern zeigte auch hier eine deutlich längere Überlebenszeit in den Gemeinschaftsnestern (48 - 72 Stunden). Durch die größere Menge von Schaummaterial kann natürlich auch eine längere Schaumspur für den sicheren Transport der Larven in das Gewässer bereitgestellt werden. Vorteile von kommunalen Schaumnestern 1) Schutz vor Austrocknung Je größer das Nest ist umso länger können die Larven nach Austrocknung des Tümpels überleben. Je länger die Larven in den Nestern überstehen können umso wahrscheinlicher ist es, dass es während dieser Zeit wieder zu Niederschlägen kommt und das Gewässer sich wieder füllt. 2) Sichtschutz vor Land-Predatoren Die großen kommunalen Schaumnester bieten einen effektiven Sichtschutz gegen Land- Predatoren wie zum Beispiel gegen verschiedene reiherartige Vögel. Diese Nester dienen nicht nur den Larven als Schutz, sondern auch den adulten Tieren. Vorteil von Schaumnestern an Land 1) Schutz vor wasserlebenden Predatoren Durch das Absinken des Wasserspiegels wird das Schaumnest an Land verlegt und somit dem Einflussbereich von verschiedenen wasserlebenden Raubinsekten oder auch räuberischen Anurenlarven entzogen. 3 Unser Versuchsobjekt Vorname: pustulosus Nachname: Physalaemus Spitzname: „Túngara Frosch“ Größe: 25- 35mm Nationalität: Costa Rica (Aufenthalte möglich in: Belize, Kolumbien, Costa Rica, El Salvador, Guatemala, Honduras, Mexiko, Nicaragua, Panama, Venezuela, Trinidad und Tobago) EU- taugliches Passfoto Besondere Merkmale: Brauner Rücken, weißer Bauch mit dunklen Flecken, auffälliger Ruf! !Achtung! Das gesuchte Lebewesen ist vor allem nachts unterwegs! Ein Rufendes Männchen ist manchmal in der Nähe von Trachops cirrhosus (Fledermaus) anzutreffen. Hinweise -- zu jeder Tages- und Nachtzeit -- bitte an das Expertenteam weiterleiten: Andreas Benkö und Doris Kruder. Kopfgeld bzw. Belohnung wird bei Informationen zum Fundort übergeben. 4 Versuchsdurchführung in Costa Rica Fragestellungen 1) Verhalten unverpaarter Männchen in Anwesenheit von Schaumnest-bauenden Pärchen 2) Kommunaler Nestbau in Abhängigkeit von der Gewässergröße und von Pärchen im Amplexus Zu erhebende Daten vor Ort: Gewässergröße, Tiefe, Uferbeschaffenheit & Vegetation (im Uferbereich und im Gewässer), Anzahl der Paare, Anzahl unverpaarter Männchen, Größe & Position der Nester Anura in Costa Rica Michaela Kainz Es gibt 137 Arten in Costa Rica und insgesamt 8 Familien: Bufonidae, Centrolenidae, Dendrobatidae, Hylidae, Leptodactylidae, Microhylidae, Ranidae, Rhinophrynidae. Bufonidae Diese Familie besteht aus 3 Gattungen und 16 Arten; zwei Arten sind in Costa Rica ausgestorben. Laut IUCN Red List haben 7 Arten den Status Least Concern, 5 Arten sind ciritically endangered (Atelopus chiriquiensis, Atelopus senex, Atelopus varius, Bufo fastidiosus, Bufo holdridgei) und eine Art gilt als extinct (Bufo periglenes). Bufo marinus Cane toad Größte Amphib (♂ 85 bis 145mm; ♀ 90 bis 175mm) in Costa Rica, Weibchen können bis zu 1,5kg schwer werden. Biologie: nachtaktiv, hat ein sehr breites Nahrungsspektrum, frisst fast alles, sogar kleine Säugetiere. Habitat: Lowland und Premontane Zonen. Verbreitung: Sie hat ein sehr weites Verbreitungsgebiet, da sie im 19. und 20.Jahrhundert zur Schädlingsbekämpfung in andere Länder eingeführt wurde (Australien, Karibik, Hawaii, Fidschi). Heutzutage wird sie in diesen Ländern selbst als Schädling betrachtet. Interessantes: Aufgrund von dem Halluzinogen Bufotenin in ihrem Hautsekret, wird sie öfters als „Droge“ benutzt, entweder wird das Hautsekret direkt von der Kröte geleckt, oder vorher getrocknet und dann geraucht. Status: Least Concern. Centrolenidae 3 Gattungen, 13 Arten. Laut IUCN Red List haben 10 Arten den Status Least Concern und 2 Arten den Status Near Threatened. Centrolenella prosoblepon Emerald glass frog ♂ 21- 28mm; ♀ 25- 31mm. Biologie: nachtaktiv. Habitat: entlang fließender Gewässer zu finden; Lowland, Wet und Moist Forests. Verbreitung: Costa Rica, Ecuador, Honduras, Kolumbien, Nicaragua, Panama: Status: Least Concern Hyalinobatrachium fleischmanni Fleischmann‘s glass frog ♂ 19- 28mm; ♀ 23- 32mm Biologie: nachtaktiv Habitat: Lowland Moist und Wet Forests, Rainforests, weit verbreitet an fließenden Gewässern. Verbreitung: Mittel- und Südamerika Interessantes: Meist untersuchte Amphibienart von Mittelamerika Status: Least Concern Hyalinobatrachium valerioi Reticulated glass frog ♂ 19,5- 24mm; ♀ 22,5- 26mm Biologie: nachtaktiv, insektivor, ♂haben ein starkes Territorialverhalten Habitat: Lowland, Moist und Wet Forests und Premontane Wet Forest und Rainforests. Verbreitung: Costa Rica, vereinzelt in Panama und Kolumbien Status: Least Concern Dendrobatidae 3 Gattungen, 8 Arten; laut IUCN Red List haben 6 Arten den Status Least Concern, eine Art den Status Vulnerable und eine Art den Status Endangered. Dendrobates auratus Green and black poison-arrow frog ♂ 25- 40mm; ♀ 27- 42mm Biologie: Tagaktiv, insektivor (vor allem Arthropoden). Sind gute Kletterer. Ihre Färbung ist variabel: blau, blau-grün, grün, gelb-grün, etc… Habitat: Lowland Moist und Wet Forest Verbreitung: Zentralamerika und Hawaii (wurde zur Schädlingsbekämpfung eingeführt) Status: Least Concern Dendrobates granuliferus Granular poison-arrow frog 18 bis 25mm Biologie: Tagaktiv Habitat: Lowland Moist und Wet Forests Verbreitung: Costa Rica und Panama Status: Vulnerable Phyllobates vittatus Golfo Dulce poison-arrow frog ♂ 22,5- 26mm; ♀ 26- 31mm Biologie: Tagaktiv, insektivor (Arthropoden) Habitat: Lowland Moist und Wet Forests Verbreitung: endemisch in der Golfo Dulce Region Interessantes: Giftig! (P. terribilis: 1 Frosch kann mit seinem Hautgift 5- 10 Menschen töten) Status: Endangered Hyla ebraccata Hourglass tree frog ♂ 23- 27mm; ♀ 30- 35mm Biologie: Nachtaktiv Habitat: temporäre Gewässer, Lowland Moist und Wet Forests und Premontane Wet Forests, Premontane Rainforests Verbreitung: Mittelamerika (von Südmexiko bis Kolumbien) Status: Least Concern Leptodactylidae 5 Gattungen, 49 Arten; laut IUCN Red List haben 26 Arten den Status Least Concern, eine Art den Status Near Threatened, 5 Arten den Status Vulnerable, 3 Arten den Status Endangered und 6 Arten den Status Critically Endangered. Eleutherodactylus Größte Vertebraten-Gattung (600 Arten weltweit; 40 in Costa Rica) Arten teilweise schwer zu unterscheiden Größe: 12 bis 80mm Microhylidae 3 Gattungen, 3 Arten; laut IUCN Red List haben 3 Arten den Status Least Concern. Biologie: Nachtaktiv Verbreitung: Mittelamerika (im Norden bis nach Texas) Bsp.: Hypopachus variolosus (Bild) Ranidae 1 Gattung, 5 Arten; laut IUCN Red List haben 2 Arten den Status Least Concern, eine Art den Status Near Threatened und 2 Arten den Status Critically Endangered. Rana warszewitschii Brilliant forest frog ♂ 37- 52mm; ♀ 45- 63mm Biologie: Tagaktiv Habitat: sogar in Städten zu finden Verbreitung: Mittelamerika Interessantes: Riesige Kaulquappen bis zu 115mm Status: Near Threatened Rhinophrynidae 1 Gattung, 1 Art; laut IUCN Red List hat diese Art den Status Least Concern. Rhinophrynus dorsalis Burrowing Toad 60 bis 88mm groß Verbreitung: von Südtexas bis Costa Rica Status: Least Concern References • http://amphibiaweb.org • Savage, J. M. (2002): The amphibians and reptiles of Costa Rica. A herpetofauna between two continents, between two seas. The University of Chicago press. • Albert et al.: The Amphibians & Reptiles of the Golfo Dulce Region. Costa Rica. • www.fotocommunity.de Glasfrösche (Centrolenidae) Birgit Rotter Die Familie der Centrolenidea beherbergt momentan 146 Arten, davon 13 in Costa Rica. Sie wird in 3 Gattungen unterteilt, und zwar: • • • Centrolene Cochranella Hyalinobatrachium IUCN Red List Status: 50 Arten critically endangered, endangered oder vulnerable Alle Arten sind endemisch in der Neotropis und zwischen Mexiko und Argentinien verbreitet. Dort leben sie bevorzugt in feuchten Habitaten, besonders an Flussläufen oder anderen bewegten Gewässern. Sie kommen in Höhen vom Meeresspiegel bis 3800m darüber vor. Morphologie Glasfrösche sind vorwiegend sehr kleine Froschlurche, nur wenige Arten (z.B. Centrolene geckoideum) werden größer als 30mm. Ihr Charakteristikum ist eine mehr oder weniger transparente Ventralseite, durch die ein Großteil der Organe zu sehen ist. Auch die anderen Körperstellen sind mit einer semitransparenten Haut bedeckt. Die meisten Arten sind hellgrün gefärbt, und oft mit kleinen Punkten von gelb bis blau gemustert. Zusätzlich weisen sie, typisch für Frösche mit arborealer Lebensweise, scheibenförmige Verbreiterungen an ihren Fingern und Zehen auf, wodurch sie auch schnell z.B. mit Hyliden verwechselt werden können. Ihre großen Augen sind jedoch stärker nach vorne gerichtet. Das Blut der Larven hat einen hohen Hämoglobinanteil. Da sie außerdem große Blutsini besitzen, erscheinen sie pink bis rot. Biliverdin, ein Oxidationsprodukt von Hämoglobin, wird nach der Metamorphose in der Haut, den Knochen oder den Oocyten der Adulttiere eingelagert. Lebensweise Glasfrösche sind nachtaktiv, ihr bevorzugter Lebensraum liegt in der Vegetation an und über Gewässern. Die Fortpflanzung der Glasfrösche findet in der Regenzeit statt. Die Lockrufe der Männchen variieren zwischen den Arten, sind aber typischerweise einzelne, ansteigende Pfeiftöne von einer Dauer unterhalb einer Sekunde, oder hohe Triller bzw. eine Serie kurzer, hoher Pfiffe. In den meisten Fällen initiiert das Männchen bei Annäherung eines Weibchens den Amplexus, der oft für einige Stunden andauert. Alle bekannten Arten legen ihre Eier außerhalb des Wassers ab. Bei den meisten Arten wird der Laich als kleiner Ballen an über Fließgewässern hängenden Blättern fixiert, in einem Fall aber auch an Steinen. Bei manchen Arten betreiben die Männchen Brutpflege, indem sie die Eier bewachen. Nach dem Schlüpfen lassen sich die Kaulquappen in den Fluss fallen oder werden hineingespült. Als Grund für die Bevorzugung von schnell fließenden Gewässern wird eine schlechtere Sichtbarkeit für räuberische Fische vermutet. Es gibt wenig Information über das Verbleiben der Larven, die ihre weitere Entwicklung wahrscheinlich im Detritus eingegraben durchleben. Gattung Centrolene: 42 Arten, 2 Arten in Costa Rica (die anderen vorwiegend in Kolumbien, Peru, Ecuador) • • Centrolene ilex (Savage, 1967) Centrolene prosoblepon (Boettger, 1892a) Die meisten Arten dieser Gattung haben grüne Knochen, wobei die Färbung in Gefangenschaft oft schnell verschwindet. Sie haben Vomeralzähne und eine 3-lobige Leber. Ein besonderes Merkmal ist ein Haken oder Stachel, der aus dem Oberarmknochen aller Männchen und mancher Weibchen entspringt und deutlich von außen zu sehen ist. Möglicher Zweck dieser Strukturen liegt im Gebrauch bei agonistischen Handlungen (Ringkampf) oder bei der Verpaarung. Adulte Männchen haben paarige Stimmritzen und eine kehlständige externe Stimmblase. Die Eier werden in der Regel auf der Oberseite eines Blattes abgelegt. Die meisten Arten haben einen weißen Bauch, sodass die Organe nur schlecht zu sehen sind. Dies ist bei den beiden in Costa Rica beheimateten Arten jedoch nicht der Fall. Gattung Cochranella: 66 Arten, 4 Arten in Costa Rica (die anderen vorwiegend Brasilien, Peru und Bolivien) • • • • Cochranella albomaculata (Taylor, 1949a) Cochranella euknemos (Savage and Starrett, 1967) Cochranella granulosa (Taylor, 1949a) Cochranella spinosa (Taylor, 1949a) Auch in dieser Gattung haben die meisten Arten grüne Knochen, die in Gefangenschaft jedoch ebenfalls ihre typische Färbung verlieren. Die Lateral- und Ventralseite der meisten Arten ist weiß, weshalb von außen nur in einem kleinen Bereich die Organe zu sehen sind. Adulte Männchen haben paarige Stimmritzen und eine kehlständige externe Stimmblase. Die Frösche haben Vomeralzähne und ihre Leber ist meist 3-lobig. Sie legen ihre Eier auf der Oberseite von Blättern über Flüssen ab. Die Eier werden soweit bekannt nicht bewacht oder bebrütet. Gattung Hyalinobatrachium: 39 Arten: 7 Arten davon in Costa Rica (die anderen weit in den Neotropen verteilt) • • • • • • • Hyalinobatrachium chirripoi (Taylor, 1958) Hyalinobatrachium colymbiphyllum (Taylor, 1949) Hyalinobatrachium fleischmanni (Boettger, 1893) Hyalinobatrachium pulveratum (Peters, 1873) Hyalinobatrachium talamancae (Taylor, 1952) Hyalinobatrachium valerioi (Dunn, 1931) Hyalinobatrachium vireovittatum (Starrett & Savage, 1973) Die Frösche der Gattung Hyalinobatrachium haben in der Regel weiße Knochen und eine stark transparente Ventralseite, wodurch man die inneren Organe, wie das Herz, die Eingeweide und die Leber sieht. Sie haben keine Vomeralzähne. Die Leber ist birnenförmig. Adulte Männchen haben paarige Stimmritzen und eine kehlständige externe Stimmblase. Die Eier im Körper der Weibchen aller bekannten Arten sind grün und die Larven werden nach der Eiablage gelb-weißlich. Die Männchen aller bisher untersuchten Arten verweilen bei den Eiern. Sie rufen aus niedriger Vegetation, unter Tags verstecken sich beide Geschlechter in der Nähe des Flusses. In der Regenzeit rufen die Männchen fast jede Nacht in ihrer typischen Lautabfolge, einer Serie hoher einzelner Töne. Das Glasfrosch-Projekt während der Costa-Rica-Exkursion 2007 Unser Forschungsobjekt: Hyalinobatrachium valerioi IUCN Red List Status: LC (Stand 2001) Das Vorkommen von H. valerioi umfasst feuchte Niederungen und premontane Hügel im Nordosten und Südwesten Costa Ricas, sowie inselartige Populationen in Panama und Kolumbien, zwischen 6 und 1500m. Hintergrund und Fragestellung Männchen von Hyalinobatrachium valerioi rufen in der Regenzeit (von Mai bis Oktober) an der Unterseite von Blättern und zeigen ausgeprägtes Territorialverhalten. Aufdringliche Konkurrenten versucht ein Territoriumsinhaber zunächst durch einen Quieklaut zu vertreiben. Sollte der Eindringling nicht nachgeben, kann es zu kämpferischen Auseinandersetzungen kommen, die ebenfalls von Lautäußerungen begleitet sein können. Der Kampf ist üblicherweise beendet, sobald es einem der beiden Kontrahenten gelingt, den anderen mit der Bauchseite nach unten niederzuhalten. Weibchen werden durch Werbungsrufe der Männchen angelockt, damit sie ihre grünen, in Gallerte eingebetteten Eier an der Unterseite seines besetzten Blattes ablegen, wo sie in Folge von ihm bewacht werden. Nach der Eiablage beginnt das Männchen erneut Lockrufe abzugeben, bis es schließlich über mehrere (bis zu neun) Gelege unterschiedlicher Entwicklungsstufen von verschiedenen Weibchen wacht. Während die Weibchen den Flusslauf nach der Eiablage wieder verlassen, bleibt das Männchen laut Literatur Tag und Nacht bei den Gelegen (Savage 20029. Erst nach Schlüpfen der Jungtiere erlischt die väterliche Fürsorge. Da die Embryonalentwicklung bei H. valerioi zwischen 9 und 19 Tagen (je nach klimatischen Bedingungen) dauert und mehrere Gelege unterschiedlicher Entwicklungsstadien bewacht werden, bedeutet das Bewachen ein erhebliches väterliches Investment. Als maximale Verweildauer eines Männchens gelten bisher 49 Tage bei sieben Gelegen (Karpfen 2006). Mögliche Gründe für dieses Verhalten wurden in einer Verbesserung der Überlebensrate der Eier vermutet. Gelege von Glasfröschen sind durch eine Vielzahl an Räubern bedroht, wie beispielsweise parasitierende Wespen, Fliegen oder Ameisen, Heuschrecken und andere Arthropoden. Auch die Färbung der Art – gelbe Flecken auf grünem Grund – wird als evolutionäre Anpassung an das Bewachen bei Tageslicht diskutiert. Visuell agierende Räuber wie Fliegen könnten durch die Ähnlichkeit der Färbung mit einem Gelege in die Irre geführt und ihrerseits vom Frosch erbeutet werden. Ein Vergleich von H. valerioi mit H. colymbiphyllum deutete auf einen erhöhten Fortpflanzungserfolg bei H. valerioi hin. Männchen von H. colymbiphyllum bewachen ihre Eier nur während der Nacht, was zu vergleichsweise höheren Verlusten durch Räuber führen dürfte (McDiarmid, 1978). Um diese Hypothese zu überprüfen, wurden im Rahmen einer Studie auf La Gamba Männchen von ihren Gelegen entfernt und die Schlüpfrate zwischen bewachten und unbewachten Eiern verglichen. Es zeigte sich kein Unterschied im Überleben der Jungtiere, und selbst anwesende Männchen hinderten Eiräuber nicht an ihrem Mahl (Karpfen 2006). Der Schutz der Eier dürfte also nicht entscheidend für das Bewachen der Gelege sein. Es konnte auch nicht beobachtet werden, dass Männchen, wie beispielsweise bei H. fleischmanni, durch Entleeren der Blase oder sonstige Maßnahmen zum Feuchthalten der Eier als Schutz vor Austrocknung oder Parasitenbefall beitragen. Auffallend sind jedoch die großen individuellen Unterschiede im Paarungserfolg einzelner Männchen. Während die meisten Individuen zwei bis drei Gelege bewachen, erreichen manche bis zu neun erfolgreiche Verpaarungen. Diese Tatsache gab Anlass zur Vermutung, dass „female mate choice copying“, also eine erhöhte Attraktivität von Männchen mit vielen Gelegen, eine Rolle im Fortpflanzungsverhalten von H. valerioi spielen könnte. Noch ist aber unklar, anhand welcher Merkmale Weibchen ein rufendes Männchen auswählen, da auch der Brutplatz an sich wichtige Merkmale aufweisen könnte. Ellie Vockenhuber untersucht nun in Costa Rica im Rahmen ihrer Diplomarbeit diese Fragestellung. Wir wollen sie dabei unterstützen und der Frage nachgehen, auf welchen Blättern Männchen sitzen und rufen, und ob es Unterschiede in der Beschaffenheit und Lage der Blätter gibt. Ist ein Männchen tatsächlich attraktiver, wenn auf seinem Blatt schon Weibchen abgelaicht haben, oder gibt es vor allem eine Präferenz für verschiedene Blatttypen? Im Rahmen eines 24 Stunden Monitorings werden wir außerdem beobachten, ob Männchen tatsächlich stets bei den Eiern bleiben und ob sie während dieser Zeit Nahrung aufnehmen. Wir werden dabei ebenfalls untersuchen, wie hoch der Raubdruck auf die Gelege ist und ob von Seiten des bewachenden Männchens tatsächlich keinerlei Maßnahmen zum Schutz der Eier ergriffen werden. Nach Möglichkeit wollen wir versuchen, eine Paarung zu filmen. Literatur Greer BJ, Kentwood DW (1980). Territorial and reproductive behaviour of the tropical american frog Centrolenella fleischmanni. Herpetologica 35(4): 318-326 Jacobson SK (1985). Reproductive beaviour and male mating success in two species of glass frogs (Centrolenidae). Herpetologica 41(4): 396-404 Karpfen U (2006). Reproductive behaviour and male mating success in the glass frog Hyalinobatrachium valerioi. Diplomarbeit, Universität Wien McDiarmid RW (1987). Evolution of parental care in frogs. In: Burghardt GM, Bekoff M (Eds.), The development of behaviour: Comparative and evolutionary aspects. Garland Publishing Inc, New York. 127-147 Savage JM (2002). The Amphibians and Reptiles of Costa Rica. A Herpetofauna between two continents, between two seas. The University of Chicago Press. 357-375 Amphibia (Artenliste der Costa Rica Exkursion vom 30.8. – 17.9.07) Anura von Daniel Philippi Hylidae • Agalychnis callydrias (COPE, 1862) ! La Gamba • Dendropsophus ebraccatus (COPE, 1874) ! La Gamba • Hypsiboas rosenbergi (BOULENGER, 1898) ! La Gamba • Scinax boulengeri (COPE, 1887) ! La Gamba • Scinax elaeochrous (COPE, 1875) ! La Gamba • Smilisca phaeota (COPE, 1962) ! La Gamba • Smilisca sila (DUELLMAN and TRUEB, 1966) ! La Gamba • Smilisca sordida (PETERS, 1863) ? La Gamba Centrolenidae • Centrolene prosoblepon (BOETTGER, 1892) ! La Gamba • Hyalinobatrachium pulveratum (PETERS, 1873) ! La Gamba • Hyalinobatrachium valerioi (DUNN, 1931) ! La Gamba Dendrobatidae • Dendrobates auratus (GIRARD, 1855) ! Hacienda Barú Leptodactylidae • Craugastor crassidigitus (TAYLOR, 1952) ! La Gamba • Craugastor fitzingeri (SCHMIDT, 1857) ! La Gamba • Craugastor noblei (BARBOUR and DUNN, 1921) ? Hacienda Baru • • • • • • • • Craugastor stejnegerianus (COPE 1893) ? La Gamba, Hacienda Baru Engystomops pustulosus (COPE, 1864) ! La Gamba Leptodactylus bolivianus (BOULENGER, 1898) ! La Gamba Leptodactylus labialis (COPE, 1877) ! La Gamba Leptodactylus pentadactylus (LAURENTI, 1768) ! La Gamba Pristimantis diastema (COPE, 1875) ! La Gamba Pristimantis ridens (COPE, 1866) ? Valle bonito Mindestens weitere 3 unbestimmte Vertreter dieser Familie Bufonidae • Bufo coniferus (COPE, 1862) ! La Gamba • Bufo marinus (LINNÉ, 1758) ! La Gamba • Bufo melanochlorus (COPE, 1877) ! La Gamba Ranidae • Rana warszewitschii (SCHMIDT, 1857) ! Valle Bonito Caudata Plethodontidae • Bolitoglossa subpalmata (BOULENGER, 1896) ! Páramo (Alle aktuellen Artnamen von http://amphibiaweb.org/; != sehr sicher bestimmt, ? = nicht ganz abgesichert) Reptilia (Artenliste der Costa Rica Exkursion vom 30.8. – 17.9.07) Squamata Lacertilia Teiidae • Ameiva festiva (LICHTENSTEIN, 1856) ! La Gamba • Ameiva leptophrys (COPE, 1893) ! La Gamba • Ameiva quadrilineata (HALLOWELL, 1861) ! La Gamba • Ameiva undulata (WIEGMANN, 1834) ! Carara NP Scincidae • Mabuya unimarginata (COPE, 1862) ! La Gamba • Sphenomorphus cherriei (COPE, 1893) ! Valle Bonito Gekkonidae • Gonatodes albogularis (DUMÉRIL and BIBRON, 1836) ! La Gamba, Hacienda Baru • Hemidactylus frenatus (SCHLEGEL, 1836) ! Alajuela • Hemidactylus garnotii (DUMÉRIL and BIBRON, 1836) ! La Gamba • Thecadactylus rapicauda (HOUTTUYN, 1782) ? La Gamba Polychrotidae • Norops aquaticus (TAYLOR, 1956) ? Hacienda Baru • Norops biporcatus (WIEGMANN, 1834) ! La Gamba • Norops capito (PETERS, 1863) ! La Gamba • Norops lemurus (COPE, 1861) ? La Gamba • Norops limifrons (COPE, 1871) ! La Gamba, Hacienda Baru, Carara NP von Daniel Philippi • Norops pentaprion (COPE, 1863) ? Hacienda Baru • Norops polylepis (PETERS, 1874) ! La Gamba • Norops sp. La Gamba Iguanidae • Iguana iguana (LINNÉ. 1758) ! Mangroven, Rio Tarcoles • Ctenosaura similis (GRAY, 1831) ! Carara NP Corytophanidae • Basiliscus basiliscus (LINNÉ, 1758) ! La Gamba, Carara NP, Hacienda Baru Phrynosomatidae • Sceloporus malachiticus (COPE, 1864) ! Páramo Serpentes Colubridae • Leptodeira annulata (LINNÉ, 1758) ? La Gamba • Leptodeira septentrionalis (KENNICOTT, 1859) ! La Gamba • Oxyrhopus petola (LINNÉ, 1758) ! La Gamba • Rhadinaea decorata (GÜNTHER, 1858) ! Valle Bonito • eine unbestimmte Natter Carara NP Viperidae • Bothriechis schlegelii (BERTHOLD, 1846) ! La Gamba • Bothrops asper (GARMAN, 1883) ! La Gamba Elapidae • Micrurus alleni (SCHMIDT, 1936) ! Valle Bonito Boidae • Corallus hortulanus (LINNÉ, 1758) ? Hacienda Baru Testudinata Kinosternidae • Kinosternon scorpioides (LINNÉ, 1766) ! La Gamba Chelydridae • Chelydra serpentina (LINNÉ, 1758) ! La Gamba Crocodylia Crocodylidae • Caiman crocodilus (LINNÉ, 1758) ! La Gamba • Crocodylus acutus (CUVIER, 1807) ! Rio Tarcoles (Alle aktuellen Artnamen von http://www.tigr.org/reptiles/search.php; != sehr sicher bestimmt, ? = nicht ganz abgesichert) Frequency of three different species of glass frogs (Centrolenidae: Hyalinobatrachium valerioi, Hyalinobatrachium pulveratum, Centronella prosoblepon) in Costa Rica Praktikumsbericht Tropenbiologische Exkursion mit Projektpraktikum im Regenwald der Österreicher La Gamba Costa Rica 30.8. – 17.9.2007 ANDREAS BENKÖ MICHAELA KAINZ DORIS KRUDER DANIEL PHILIPPI BIRGIT ROTTER Unter Betreuung von Dr. Walter Hödl 1 Abstract Calls from three different species of glass frogs (Hyalinobatrachium pulveratum, Hyalinobatrachium valerioi, Centronella prosoblepon) were documented during nights in the rainy season. Their calling sites are leaves directly above flowing water. We wanted to explore the frequency of these glass frogs along the neotropical lowland stream „Quebrada Negra“. Their distribution within the habitat was our second question. And we wanted to know if the species live close to each other. Therefore we realized an audio monitoring classifying five different categories. Two groups of three persons starting from different places along the stream documented calling frogs in a defined transect. The results were similar. Both groups distinguished almost the same number of frogs and assigned them to nearly the same categories. H. pulveratum was the most common glass frog along this stream, followed by H. valerioi and C. prosoblepon. H. valerioi occurred several times in groups. And the habitats of the species hardly overlapped. Einleitung Centrolenidae sind baumlebende Frösche. Man erkennt sie vor allem an ihrem transparenten Parietalperitoneum am Bauch, wodurch es möglich ist einzelne innere Organe zu sehen. Bei manchen Arten ist es sogar möglich, den Herzschlag der Tiere zu beobachten. Glasfrösche sind nachtaktiv. Untertags schlafen sie meist in der Vegetation oder im Bodensubstrat in der Nähe von Flüssen. Daher sind sie schwer zu finden. Als einzige Art bewacht Hyalinobatrachium valerioi auch tagsüber seine Gelege (Dunn, 1931). Männliche Glasfrösche sind wegen ihrer nächtlichen Rufaktivität leichter zu lokalisieren als ihre weiblichen Artgenossen, die bekanntlich nicht rufen. Der Anzeigeruf hat einerseits die Funktion, die weiblichen Artgenossen anzulocken, andererseits soll er männliche Nachbarn möglichst auf Distanz halten. Glasfrösche rufen je nach Art an der Ober- oder Unterseite von Blättern über Bächen bzw. in der Nähe dieser fließenden Gewässer über ausgetrockneten Flussbetten. Zwei der in dieser Untersuchung genauer beobachteten Arten rufen an der Blattoberseite (Hyalinobatrachium pulveratum und Centrolene prosoblepon), eines (Hyalinobatrachium valerioi) ruft hingegen an der Blattunterseite (Savage, 2002) Die Rufaktivität von Glasfröschen ist auf feuchte Nächte während der Regenzeit beschränkt. Vor allem nach starken Regenfällen oder während leichten Regens kann man Glasfroschmännchen hören. Hayes (1991) konnte eine höhere Rufaktivität bei H. fleischmanni bei einer relativen Luftfeuchtigkeit von über 93% nachweisen. In sehr trockenen Nächten kann eine Glasfroschpopulation sogar inaktiv werden. (Greer, 1980). 2 Das Rufen dauert die ganze Nacht hindurch. Ulrike Karpfen (2006) beobachtete eine Rufaktivität des Glasfrosches Hyalinobatrachium valerioi von 16.45 bis 5.00 Uhr morgens. Männchen rufen von ausgewählten Plätzen, die auch günstig für die Eiablage sind. Sie sind mäßig territorial, das heißt sie bleiben meist mehrere Wochen am selben Standort und dulden keine anderen Männchen in der unmittelbaren Nachbarschaft. Kämpfe zwischen männlichen Glasfröschen sind zwar nicht üblich, Konfrontationen können jedoch vorkommen. Aus einer Einzelbeobachtung geht jedoch hervor, dass sich einige Männchen der Art H. valerioi ein einziges Bananenblatt „teilten“. Um die Häufigkeit verschiedener Glasfroscharten entlang eines fließenden Gewässers zu erheben, wurde ein Audiotransekt durchgeführt. Weiters sollte mit dieser Untersuchung die Verteilung der Arten im Habitat ermittelt werden und Klarheit darüber geschafft werden, ob die Arten einander ausschließen. Material und Methoden Versuchstiere Wir beschäftigten uns mit verschiedenen Glasfroscharten; allen voran mit Hyalinobatrachium valerioi, Hyalinobatrachium pulveratum und weiters mit Centrolene prosoblepon, der nicht eindeutig bestimmt werden konnte, da kein rufendes Individuum gesichtet wurde. Untersuchungsgebiet Die Audiotransekte wurden entlang des Baches „Quebrada Negra“ durchgeführt. Dieser liegt im Nationalpark Piedras Blancas (Regenwald der Österreicher), der in der Provinz Puntarenas im Südwesten Costa Ricas liegt (Julia Tschelaut, 2005). Der Quebrada Negra ist ein tropischer Tiefland-Bach mit geringer Tiefe, seine Quelle liegt im Esquinas Regenwald (einem Primärwald) 180 m über dem Meeresspiegel. Der Bach ist insgesamt 2,7 km lang und mündet in den Quebrada Gamba (20 m über dem Meeresspiegel). Der Quebrada Negra fließt nahe der Tropenstation La Gamba (Position: N 08 42,054 – W 083 12,085; 80 m über dem Meeresspiegel) (Christian Pichler, 2006). Versuchsdurchführung Die Untersuchungen wurden in zwei Nächten im September 2007 durchgeführt. In diesem Monat herrschte Regenzeit, was vor allem auf der pazifischen Küste Costa Rica’s mit sehr hohen Niederschlagsmengen korreliert ist. 3 In zwei Teams zu je 3 Personen wurde ein 570 m langer Abschnitt des Baches abgegangen. Team 1 startete bei der 0 m- Marke und ging stromaufwärts, Team 2 bei der 570 m- Marke und ging stromabwärts. Alle 10 m wurden die innerhalb einer Minute rufenden Frösche protokolliert. Diese wurden einer der fünf zuvor definierten Kategorien zugeordnet: 1. H. valerioi 2. Chuck (H. pulveratum) 3. 3x Chuck (H. pulveratum) 4. Triller (C. prosoblepon?) 5. Unsicher Jeder Frosch wurde nur einmal notiert, wobei sich Team 1 während der Datenaufnahme mit Handzeichen oder kurzen Phrasen auf die jeweilige Kategorie und Anzahl der rufenden Frösche einigte. Team 2 schwieg während der Datenaufnahme und jeder der 3 Personen beschloss für sich alleine, welche und wie viele Frösche zu hören waren. Nach einer Minute wurden die Ergebnisse verglichen und nur jene Rufe wurden notiert, die alle drei Personen hören konnten. Insgesamt gab es zwei Durchgänge in zwei verschiedenen Nächten. Auswertung Die erhobenen Daten wurden tabellarisch in Excel bearbeitet. Mittelwerte wurden in Excel berechnet und graphisch dargestellt. Ergebnisse Beide Teams konnten in den zwei Nächten annähernd gleich viele Frösche rufen hören und ordneten sie weitestgehend denselben Kategorien zu (Abb. 1 und 2). In der ersten Nacht hörte die erste Gruppe 108 Frösche, davon 51 Individuen der Art H. valerioi, insgesamt 51 von H. pulveratum (46 einfache Rufe, 5 dreifache) und 1 einziges Männchen von C. prosoblepon. Gruppe 2 konnte 95 Tiere unterscheiden, wobei sich die Tiere wie folgt aufteilten: insgesamt 38 H. pulveratum (36 einfach, 2 dreifach), 32 H. valerioi, 22 C. prosoblepon. 4 Audiotransekt 1 Anzahl der rufenden Individuen 80 70 Gruppe 1 60 Gruppe 2 51 46 50 40 36 32 30 22 20 10 5 2 5 1 3 0 H.valerioi H.pulveratum 1 H.pulveratum 3 C.prosoblepon unsicher Froschart Abbildung 1: Audiotransekt, Nacht 1, Vergleich gehörter Frösche beider Gruppen Die zweite Nacht lieferte ähnliche Ergebnisse. Gruppe 1 machte 151 Individuen ausfindig, davon 71 H. pulveratum (68 einfach, 3 dreifach), 40 Individuen der Art H. valerioi und 34- mal den Glasfrosch C. prosoblepon. Gruppe 2 konnte die Rufe von insgesamt 115 männlichen Fröschen vernehmen. Dazu zählten 51 H. pulveratum (zwischen den beiden Kategorien wurde nicht mehr unterschieden), 36 H. valerioi und 28 C. prosoblepon. Anzahl der rufenden Individuen Audiotransekt 2 80 68 70 Gruppe 1 60 50 40 Gruppe 2 51 40 36 34 28 30 20 10 3 6 0 0 0 H.valerioi H.pulveratum 1 H.pulveratum 3 C.prosoblepon unsicher Froschart Abbildung 2: Audiotransekt, Nacht 2, Vergleich gehörter Frösche beider Gruppen 5 Beim Vergleich der Ergebnisse beider Nächte fällt auf, dass in der ersten Nacht mehr Frösche der Art H. valerioi gehört wurden als in der zweiten Nacht. Die rufenden Männchen von H. pulveratum scheinen hingegen in der zweiten Nacht aktiver gewesen zu sein. Auch C. prosoblepon war in der zweiten Nacht öfter zu hören. Um Aussagen über die Häufigkeit der Frösche treffen zu können, wurden die aufgenommenen Daten beider Gruppen und Nächte verwendet, um einen Mittelwert für die jeweilige Art zu berechnen. Team Team Team Team 1/ Nacht 1 2/ Nacht 1 1/ Nacht 2 2/ Nacht 2 H. valerioi (1) 51 30 40 36 H. pulveratum (2) 46 34 68 51 H. pulveratum (3) 5 6 3 0 C. prosoblepon? (4) 1 26 36 28 Unsicher (5) 5 2 6 0 39 50 4 23 3 Mittelwert Tabelle 1: Rufende Frösche erfasst von Team 1 und Team 2 in zwei Nächten, berechneter Mittelwert. Zahlen in Klammern bezeichnen die den Rufen zugeteilte Kategorie. Vorkommen der verschiedenen Glasfroscharten entlang des Quebrada Negra Unsicher 3% 19% 1 2 4 5 3 33% C. prosoblepon H. valerioi 3% H. pulveratum 42% Abbildung 2: Prozentuelles Vorkommen der verschiedenen Glasfroscharten entlang des Quebrada Negra. 1= Kategorie 1 (H. valerioi), 2= Kategorie 2 (H. pulveratum), 3= Kategorie 3 (H. pulveratum?), 4= Kategorie 4 (C. prosoblepon?), 5= Kategorie 5 (unsicher). 6 H. pulveratum ist mit 42% (bzw. 45% mit den dreifachen Lautäußerungen) der rufenden Männchen entlang des Quebrada Negra vertreten. An zweiter Stelle kommt H. valerioi (33%) und an dritter Position liegt C. prosoblepon (19%). Weiters kommen die beiden Arten nicht gleichmäßig verstreut am Bach entlang vor, das heißt die einzelnen Arten kommen teils gar nicht, teils in Gruppen zu mehreren rufenden Individuen vor. Selten kommt es dazu, dass gleich viele Individuen beider Arten an einem Bachabschnitt vertreten sind. Es dominiert eine der beiden Arten (Abb. 3-6). Artverteilung H.valerioi und H.pulveratum Anzahl rufender Individuen 5 4 H.valerioi H.pulveratum 3 2 1 0 0 30 60 90 12 0 15 0 18 0 21 0 24 0 27 0 30 0 33 0 36 0 39 0 42 0 45 0 48 0 51 0 54 0 57 0 Standort im Flussverlauf (m) Abbildung 3: Team 1, Nacht 1: Vorkommen von H. valerioi und H. pulveratum entlang des Bachabschnitts. 7 Artverteilung H.valerioi und H.pulveratum Anzahl rufender Individuen 5 4 H. valerioi H.pulveratum 3 2 1 0 0 30 60 90 0 12 0 15 0 18 0 21 0 24 0 27 0 30 0 33 0 36 0 39 Standort im Flussverlauf (m) 0 42 0 45 0 48 0 51 0 54 0 57 Abbildung 4: Team 1, Nacht 2: Vorkommen von H. valerioi und H. pulveratum entlang des Bachabschnitts. Artverteilung H.valerioi und H.pulveratum Anzahl rufender Individuen 5 H. valerioi 4 H.pulveratum 3 2 1 0 0 30 60 90 12 0 15 0 18 0 21 0 24 0 27 0 30 0 33 0 36 0 39 0 42 0 45 0 48 0 51 0 54 0 57 0 Standort im Flussverlauf (m) Abbildung 5: Team 2, Nacht 1: Vorkommen von H. valerioi und H. pulveratum entlang des Bachabschnitts. 8 Artverteilung H.valerioi und H.pulveratum 5 Anzahl rufender Individuen H.valerioi 4 H.pulveratum 3 2 1 0 0 30 60 90 12 0 15 0 18 0 21 0 24 0 27 0 30 0 33 0 36 0 39 0 42 0 45 0 48 0 51 0 54 0 57 0 Standortverteilung Abbildung 6: Team 2, Nacht 2: Vorkommen von H. valerioi und H. pulveratum entlang des Bachabschnitts. Diskussion Zur Methodik der Datenaufnahme ist zu sagen, dass obwohl die zwei Gruppen auf unterschiedliche Art und Weise gearbeitet haben, die Ergebnisse sich doch sehr ähnlich sind. Team 1 konnte im Zuge der zwei Begehungen mehr Individuen lokalisieren als Team 2. Dies ist eventuell darauf zurückzuführen, dass die Mitglieder dieses Teams schon innerhalb der einen Minute per Handzeichen den Ort und die Art des rufenden Tieres anzeigten. In Team 2 wurde die Anzahl der einzelnen Individuen erst nach der einen Minute Beobachtungszeit festgehalten. Außerdem wurde eine Beobachtung nur dann in die Liste aufgenommen, wenn alle drei Mitglieder der gleichen Meinung waren. Dies war bei Team 1 nicht der Fall, hier wurde ein Datenpunkt bereits bei einer zwei Drittel Mehrheit aufgenommen. Da sich die Ergebnisse wie bereits erwähnt sehr ähnlich sind, kann man davon ausgehen, dass beide Methoden als geeignet angesehen werden können. Neben den unterschiedlichen Methoden ist außerdem anzumerken, dass die beiden Teams zu verschiedenen Zeitpunkten ihre Daten an einem Standort erhoben haben. Doch da die Tiere die ganze Nacht durch rufen, ist dieser Parameter zu vernachlässigen. Allgemein kann daher gesagt werden, dass sich diese Methode 9 als geeignet ausgezeichnet hat um Häufigkeiten einer oder mehrer Arten in einem Gebiet zu erheben. In Abbildung 6 ist ein eindeutiges geklumptes Vorkommen von Hyalinobatrachium valerioi zu sehen. Dieser Umstand könnte darauf zurückzuführen sein, dass sich nur an diesen Standorten geeignete Rufplätze für die Männchen befanden. Eine weitere mögliche Erklärung für dieses Auftreten wäre, dass die Männchen an geeigneten Standorten in Gruppen rufen um Weibchen anzulocken. Die Wahrscheinlichkeit, dass Weibchen auf eine Gruppe von rufenden Männchen reagieren ist erheblich größer, als wenn nur ein einzelnes männliches Tier ruft. Außerdem ist bei näherer Betrachtung zu erkennen, dass es nur zu wenigen Überschneidungen bei H. valerioi und H. pulveratum kam. Dieser Umstand könnte auf die im Untersuchungsgebiet vorkommende Vegetation zurückgeführt werden. Laut Literatur bevorzugt H. pulveratum Standorte in großer Höhe, während H. valerioi bereits in einer Höhe von einem Meter bis etwa 3,5 m in unserem Untersuchungsgebiet gefunden wurde. Man könnte somit annehmen, dass wenn in einem Gebiet geeignete Ruf- und Laichplätze nur in großer Höhe vorkommen, dieser Standort ideal für H. pulveratum wäre, während er für H. valerioi ungeeignet ist. Dieser Umstand kann jedoch nur durch weitere Untersuchungen bestätigt werden. Referenzen DUNN, E. R. 1931. New frogs from Panama and Costa Rica. Occas. Pap. Boston Soc. Nat. Hist. 5: 329-32. GREER, B. J. & WELLS, K. D. 1980. Territorial and reproductive behaviour of the tropical American frog Centronella fleischmanni. Herpetologica 36: 318-326. HAYES, M. P. 1991. A Study of Clutch Attendance in the Neotropical Frog Centrolenella Fleischmanni (Anura: Centrolenidae). Unpublished dissertation, University of Miami. KARPFEN, U. 2006. Reproductive behaviour and male mating success in the glassfrog Hyalinobatrachium. PICHLER, C. 2006. Habitat choice and trophic ecology of fishes in a neotropical low order river, Costa Rica. Diplomarbeit. SAVAGE, J. M. 2002. The Amphibians and Reptiles of Costa Rica: A Herpetofauna between Two Continents, between Two Seas. TSCHELAUT, J. 2005. Leaf litter decomposition and macroinvertebrates in a neotropical lowland stream, Q. Negra, Costa Rica. Diplomarbeit. 10 Rufplatzwahl bei Hyalinobatrachium valerioi Praktikumsbericht Tropenbiologische Exkursion mit Projektpraktikum im Regenwald der Österreicher La Gamba Costa Rica 30.8. – 17.9.2007 ANDREAS BENKÖ MICHAELA KAINZ DORIS KRUDER DANIEL PHILIPPI BIRGIT ROTTER Unter Betreuung von Dr. Walter Hödl Abstract We investigated calling sites of the glassfrog species Hyalinobatrachium valerioi (Centrolenidae) at a neotropical lowland river habitat in La Gamba, Costa Rica. Males of H. valerioi are known to exhibit substantial parental investment in guarding their clutches 24 hours a day. Individual reproductive success varies considerably, but reasons for female mate choice are still unclear. We hypothesized that glass frog presence could be influenced by specific characteristics of the calling sites and compared leaves which were occupied by H. valerioi with overall leaf availability at the riverbed. In 31 river transects, biometrical data of more than 1100 leaves were measured. Generalized linear modelling procedures were used to create a habitat use model comparing frog calling sites to randomly chosen parts of the river. Glass frog presence was influenced by various leaf characteristics such as leaf size, slope and surface. At our study site, the needs of H. valerioi appear to be best met by leaves of Carludovica drudei. Einleitung Die Familie der Centrolenidae beinhaltet momentan 149 Arten kleiner bis mittelgroßer Anuren, welche entlang von Bächen und anderen Fließgewässern vorkommen und eine arboreale Lebensweise aufweisen. Sie sind vorwiegend in den Feuchtwäldern Zentral- und Südamerikas anzutreffen. Ihre Verbreitung reicht vom Süden Mexikos bis in den Norden Argentiniens, Paraguays und Boliviens (SAVAGE 2002). Den Trivialnamen „Glasfrösche“ verdanken die Tiere ihrer mehr oder weniger durchsichtigen Ventralseite, durch welche meist die inneren Organe wie Herz, Lunge Leber oder Verdauungstrackt erkennbar sind. Die verschiedenen Arten der Gattung Hyalinobatrachium weisen als speziellere Merkmale ein durchsichtiges Parietalperitoneum und für gewöhnlich weiße Knochen auf. Hyalinobatrachium valerioi ist ein Vertreter dieser Gattung mit einer Körpergröße von ungefähr 20 - 26mm. Er kommt im Süden Costa Ricas an der Karibik- und Pazifikküste vor allem in den Tieflagen in eher geringen Dichten vor. Die Dorsalseite dieser Art weist große gelbe Flecken auf grünem Grund auf. Die grüne Grundfarbe ist häufig noch mit kleinen schwarzen Punkten durchsetzt (SAVAGE 2002). Die Tiere sind nachtaktiv und halten sich meist in der Vegetation entlang von Bächen auf. Während der Reproduktionsphase sitzen die Männchen vorwiegend auf der Unterseite von Blättern, welche über ein Fließgewässer ragen. Dort rufen sie vom 2 Einbrechen der Dunkelheit bis in die frühen Morgenstunden um Weibchen anzulocken und verteidigen das Blatt falls nötig auch gegenüber Konkurrenten (KUBICKI 2007). Entscheidet sich ein Weibchen für ein Männchen, kommt es zum Amplexus und schließlich zur Eiablage. Das Weibchen verlässt danach den Ablaichplatz, das Männchen hingegen bleibt in der Nähe des Geleges bis die Larven schlüpfen. Während dessen können weitere Gelege (bis zu 9) anderer Weibchen hinzukommen und somit einzelne Männchen bis zu 49 Tage am Stück auf einem Blatt verweilen (KARPFEN 2006). H. valerioi gilt momentan als die einzige Glasfroschart die permanent neben den Gelegen anzutreffen ist (KUBICKI 2007), dementsprechend ist das Investment der Männchen ein sehr hohes. Es ist nicht vollständig geklärt, welche Faktoren die Partnerwahl der Weibchen beeinflussen. Möglicherweise wählt das Weibchen nach Rufparametern aus, wie es häufig bei Anuren der Fall ist (SAVAGE 2002). Eine weitere Möglichkeit wäre das Auftreten von „female mate choice copying“, bei dem ein Weibchen sich in ihrer Partnerwahl auf die Wahl ihrer Vorgängerinnen verlässt. Befinden sich auf dem territorialen Blatt eines Männchens bereits weitere Gelege in gutem Zustand, könnte dies bedeuten, dass sich das Männchen gut um diese kümmert, wodurch es an Attraktivität für das Weibchen gewinnt. Eine dritte Möglichkeit wäre die Auswahl nach dem idealen Blatt als Laichplatz. Da das Investment des Männchens erheblich ist, wäre die Auswahl eines geeigneten Laichplatzes eine wichtige Vorentscheidung, welche massiven Einfluss auf den individuellen Fortpflanzungserfolg hätte. Um zu untersuchen, welche Charakteristika ein Blatt aufweisen muss, damit es von einem Männchen besetzt wird, verglichen wir im September 2007 in einem Lebensraum von H. valerioi an der Pazifikküste im Süden Costa Ricas das allgemeine Angebot an Blättern mit denjenigen, auf denen Frösche angetroffen wurden. Gibt es Präferenzen der Frösche für bestimmte Blattmerkmale oder nutzt H. valerioi Blätter allein entsprechend des Angebots? In welcher Weise unterscheiden sich Flussabschnitte, in denen H. valerioi Flussabschnitten? 3 vorkommt, von unbesiedelten Material und Methoden Nahe der Halbinsel Osa an der Pazifikküste Costa Ricas liegt die tropische Forschungsstation La Gamba. An dieser entlang fließt der Tieflandbach Quebrada negra (N 08 42,054 – W 083 12,085, TSCHELAUT 2005). Das Untersuchungsgebiet war ein 500m langer Abschnitt dieses Bachlaufes, in welchem H. valerioi bekanntermaßen vorkommt. Alle 25m wurde ein Transekt quer zum Bachlauf gezogen (n=21). An jedem Standpunkt wurde mit einem Maßband die Bachbettbreite, die Bachbreite sowie jeweils links und rechts Uferbreite, Uferhöhe und die Höhe der Uferabbruchkante gemessen. Der aktuelle Pegelstand wurde an der tiefsten Stelle pro Transekt gemessen. Zusätzlich durchschnittliche wurde Dauer die ermittelt, mittlere welche ein Strömungsgeschwindigkeit Holzstück benötigt, um als 5m zurückzulegen. In Folge wurde ein Maßband über den Bach gespannt und das Transekt mit einer Stange im 90° Winkel zum Maßband abgegangen. Jedes Blatt, welches bis zu einer Höhe von 3m mit der Stange gestreift wurde und sich innerhalb des Ufersandbankbereichs befand, wurde aufgenommen. Dabei wurden die Höhe des Blattes über der Wasseroberfläche und der Abstand zum linken Ufer notiert. Des weiteren wurde Länge und Breite des Blattes abgemessen und seine Form (lanzett-, eiförmig oder dreieckig) klassifiziert. Diese Parameter wurden zur Berechnung der korrespondierenden Blattflächen herangezogen. Die Blattneigung wurde in die 3 Kategorien 0° (vertikal), 45° (geneigt) und 90° (horizontal) eingeteilt. Ebenso wurde die Oberflächenbeschaffenheit (glatt oder rau) und der Zustand (lebend oder tot) des Blattes festgestellt. Aus dem Datenmaterial einer parallel durchgeführten Langzeitstudie (Vockenhuber, in prep.), welche sich mit dem Phänomen des female mate choice copying bei H. valerioi in dem von uns vermessenen Flussabschnitt befasst, wurden randomisiert 10 von 80 Blättern ausgewählt, auf welchen H. valerioi rufend gefunden wurde. Diese 10 Blätter wurden im Feld aufgesucht und genau an diesen Stellen Transekte gezogen (n=10), nach der oben beschriebenen Methode die Transekte charakterisiert, sowie alle Blätter im Einzugsbereich vermessen. Zusätzlich zu den oben angeführten Blattparametern wurde bei den mit Fröschen besetzten Blättern die Art der Pflanze bestimmt. 4 Die statistischen Auswertungen erfolgten mit dem Programm R, Version 2.4.1. Wir testeten mögliche Präferenzen der Frösche für bestimmte Pflanzenarten mit Generalized linear models (GLM) für Poisson-verteilte Häufigkeiten. Der Einfluss der erhobenen Fluss- und Blattparameter innerhalb des erhobenen Einzugbereichs bis 3m Höhe über der Wasseroberfläche wurde mit binomialen GLMs modelliert. Dafür erstellten wir eine binäre Antwortvariable, in der zufällig ausgewählte Flusstransekte (0) Transekten gegenübergestellt wurden, die Ruf- oder Laichplätze von H. valerioi aufwiesen (1). Zur Charakterisierung der tatsächlichen Laichplätze wurden mit Hilfe desselben Verfahrens von Fröschen besetzte Blätter (1) mit dem Angebot an vorhandenen Blättern (0) verglichen. Um eine adäquate Beschreibung der beobachteten Daten durch ein Modell mit möglichst wenigen Parametern zu erhalten, gingen wir in einem schrittweisen Modellierungsprozess von einem Startmodell aus, das alle erhobenen Einflussgrößen enthielt. Aus diesem gesättigten Startmodell wurden in einer Rückwärts-Elimination nacheinander jene Einflussgrößen herausgenommen, die keinen signifikanten Einfluss auf die Zielgröße (Anwesenheit eines Froschs) hatten. Die Entscheidung, ob eine Einflussgröße für die Modellbildung bedeutend ist, wurde mit Hilfe einer F-Statistik getroffen (Funktion „anova“ in R). Die Modellvereinfachung folgte dabei dem Prinzip der Parsimonie und basierte auf einer Minimierung des AIC-Werts, einer relativen Maßzahl für die Güte der Modellanpassung. Die Durchführung der statistischen Verfahren erfolgte nach Angaben von CRAWLEY (2005) sowie SACHS & HEDDERICH (2006). Ergebnisse Die Breite des Bachbetts an den verschiedenen Transektstellen lag in einem Bereich zwischen 300cm und 1055cm (n = 31, MW= 567 ± 195cm), während die tatsächliche Flussbreite zwischen 195cm und 600cm (n = 31, MW= 343 ± 97cm) schwankte. Die Uferbreite links oder rechts betrug zwischen 0cm (Uferabruchkante schließt direkt an den Wasserkörper an) bis 595cm (n = 62, MW= 112 ± 141cm). Die Uferabbruchkante schwankte links zwischen einer Höhe von 70cm und 240cm (MW= 169,5 ± 43,5cm) und rechts zwischen 45cm und 350cm (MW= 157,2 ± 57cm). Die Uferhöhe links oder rechts betrug zwischen 0cm und 60cm (n= 61, MW= 14 ± 16cm). Während des Untersuchungszeitraums lag der Wasserpegel über alle Transekte hinweg in einem Bereich zwischen 11 und 35cm (MW= 21,3 ± 6,2cm). Das Wasser 5 bewegte sich mit einer durchschnittlichen Strömungsgeschwindigkeit von 0,60 ± 0,32m/s. Die gemittelten Strömungsgeschwindigkeiten in den einzelnen Transekten lagen dabei zwischen 0,16m/s und 1,32m/s (n= 31). Beim Vergleich zwischen den zufällig ausgewählten Flusstransekten und den Transekten, in denen H. valerioi rufend gefunden wurde, zeigten sich keine signifikanten Unterschiede hinsichtlich der Flussbreite, Bachbettbreite und des Wasserpegels (Tab.1). Die Strömungsgeschwindigkeit war jedoch in Transekten mit Laichplätzen tendenziell höher (GLM, z = 1.954, P = 0.0507). Tabelle 1: Ergebnistabelle des Modells (GLM) für den Einfluss verschiedener Flussparameter auf die Anwesenheit von Männchen von H. valerioi . Verglichen wurden zufällig ausgewählte Flusstransekte (n= 21) mit Transekten, in denen H. valerioi gefunden wurde (n= 10). Parameter Steigung Std. Fehler z P Pegel 0.0072246 0.0786464 0.092 0.9268 Strömung 4.1216827 2.1097530 1.954 0.0507 . Flussbreite 0.0024806 0.0049647 0.500 0.6173 Bachbettbreite 0.0007364 0.0031428 0.234 0.8147 Insgesamt wurden 1186 Blätter über dem Bachbett des Quebrada negra vermessen. Davon lagen 747 in den zufällig ausgewählten Transekten und 359 in Transekten, die Laichplätze enthielten. Zusätzlich wurden biometrische Daten von 80 Blättern erhoben, die Männchen von H. valerioi als Ruf- bzw. Laichplatz nutzten oder genutzt hatten. Alle Frösche saßen auf Blättern über einer Höhe von 95cm über der Wasseroberfläche. Bei den von Fröschen besetzten Blättern handelte es sich um ausschließlich lebende Blattteile von Anthurium sp., Calathea lutea, Carludovica drudei, Casearia commersoniana, Cespedesia macrophylla, Cyclanthus bipartitus, Cymbopetalum costaricensis, Dieffenbachia concinna, Elaeis guanensis, Ficus tonduzii, Galathea insignis, Heliconia danielsiana, Heliconia imbricata, Heliconia latispata, Hibiscus arboreus, Nicolaia elatior, Philodendron sp., Psychotria solitudinum, Quiina schippii, Thelypteris decussata, Tovomita stylosa und Tovomita weddeliana in unterschiedlicher Häufgkeit (Abbildung 5). Die Frösche zeigten eine signifikante Präferenz für Blätter von Carludovica drudei (GLM, z = 3.064, P = 0.00218) und Heliconia imbricata (GLM, z = 2.148, P = 0.03174). 6 Von den 80 mit Fröschen besetzten Blättern waren 21 dreieckig, 6 eiförmig und 53 lanzettförmig (Abbildung 2). Die Neigung der Blätter nahm in 3 Fällen 0° (vertikal), in 66 Fällen 45° (geneigt) und bei 11 Blättern 90° (horizontal) ein (Abbildung 3). 75 der 80 Blätter wiesen eine glatte und 5 Blätter eine raue Oberfläche auf (Abbildung 4). Die Fläche der besetzten Blätter schwankte zwischen 15cm² und 4800cm² (MW= 1179 ± 1202cm²; Abbildung 1). Die Modellierung des Einflusses dieser Blattparameter auf die Anwesenheit von H. valerioi ergab in Relation zum Blattangebot eine deutliche Präferenz der Tiere für große Blätter (Tabelle 2). Ein negativer Zusammenhang zeigte sich hingegen zwischen dem Vorkommen von Fröschen und dem Neigungsgrad der Blätter. Da die Blattneigung als stetige Variable in das Modell einging, bedeutet dieses Ergebnis ein Meiden von Blättern mit einem Neigungswinkel von 90°, also horizontal stehende Blätter. Auch die Blattform hatte Einfluss auf die Nutzung durch H. valerioi. Im Vergleich zum Angebot wurden die Tiere unterproportional häufig auf ei- oder lanzettförmige Blättern angetroffen. Blätter, die eine raue Oberfläche aufwiesen, wurden gemieden. Keinen Einfluss auf die Anwesenheit von Männchen hatte hingegen der Zustand der ausgewählten Blätter (lebend oder tot) im Vergleich zum Blattangebot, ebenso wenig die Höhe der Blätter über der Wasseroberfläche. Tabelle 2: Ergebnistabelle des Modells (GLM) für den Einfluss verschiedener Blattparameter auf die Anwesenheit von Männchen von H. valerioi. Verglichen wurde das allgemeine Blattangebot (n= 1106) mit den von Fröschen besetzten Blättern (n= 51). Parameter Steigung Std. Fehler z P Fläche 0.0003894 0.0001034 3.767 0.00017 *** Neigung -0.0241034 0.0060410 -3.990 <0.0001 *** Form: ei -1.5281803 0.6267684 -2.438 0.01476 * Form: lanzett -1.0796668 0.3868160 -2.791 0.00525 ** Oberfläche: rau -1.7947321 0.6138170 -2.924 0.00346 ** 7 100 Blätter mit Frosch Blätter ohne Frosch Realtiver Anteil [%] 90 80 70 58,95 60 56,25 50 40 34,72 38,75 30 20 6,33 5 10 0 klein mittel groß Blattgröße in Kategorien Abb. 1: Größe der von Fröschen genutzten Blätter (n= 80) im Vergleich zum Blattangebot (n= 1106). Kategorien wurden wie folgt gewählt: Blattfläche kleiner als 50cm² = klein; Blattfläche größer als 50cm² aber kleiner als 700cm² = mittel; Blattfläche größer als 700cm² = groß. 100 Relativer Anteil [%] 90 75,33 80 70 Blätter mit Frosch Blätter ohne Frosch 66,25 60 50 40 26,25 30 19,7 20 4,97 10 7,5 0 lanzettförmig dreieckig eiförmig Blattform Abb. 2: Form der von Fröschen genutzten Blätter im Vergleich zum Blattangebot 8 ORDNUNG FAMILIE ART DEUTSCHER Artiodactyla Tayassuidae Tayassu pecari Weißbartpekari Procyon cancrivorus Krabbenwaschbär Procyon lotor Waschbär Nasua narica Nasenbär Potus flavus Kinkajou, Wickelbär Procyonidae Carnivora Felidae Balaenopteridae Cetacea Chiroptera Primates Herpailurus yagouaroundi Megaptera novaeangliae NAME Jaguarundi SPANISCHER NAME ORT Chancho de monte Fila-Trail Mapache (mapachín) Mangrove cangrejero Fahrt HB - La Gamba Mapache norteno Hacienda Barú, Pizote Vulkan Irazú direkt bei Station La Martilla oder marta Gamba am Quebrada Negra, León brenero, unweit der Station yaguarundi 10.9.07 3.9.07 2.9.07 z.B. 6.9.07 6.9.07 Buckelwal Ballena jorobada Ballena-NP 3.9.07 Delphinidae Tursiops truncatus Großer Tümmler Delfín mular, Tursión im Golfo Dulce 10.9.07 Emballonuridae (Glattnasenfreischwänze, Sac-Winged Bats) Saccopteryx bilineata Zweistreifentaschenfledermaus (Greater White-Lined Bat) Murciélago-saco de linéas blancas Weg zum Valle Bonito (in Riesenceiba) 5.9.07 oder Artibeus phaeotis/watsoni Zeltbauende Fledermaus (Common Tent-Making Bat) oder Fruchtfledermaus Murciélago (de tienda commún) Hacienda Barú (Pizote-Weg) 2.9.07, 3.9.07 Cebus capucinus Weißschulterkapuzineraffe Mono cariblanco Alouatta palliata Mantelbrüllaffe Mono congo Carara-NP, Hacienda Barú, am Valle Bonito Fahrt HB – La Gamba, Golfo dulce 1.9.07, 5.9.07 3.9.07, 10.9.07 Dasyproctidae Dasyprocta punctata Mittelamerikanisches Aguti Guatusa unweit Station 7.9.07 Sciuridae Sciurus sp. Hörnchen Ardilla Bradypodidae Bradypus variegatus Braunkehl-Dreifingerfaultier Megalonychidae Choloepus hoffmanni Hoffmann-Zweifingerfaultier Myrmecophagidae Tamandua mexicana Nördlicher Tamandua Phyllostomidae (Lanzennasen, Neuweltblattnasen, Tailless or Neotropical Fruit Bats) Uroderma bilobatum Cebidae Rodentia Xenarthra DATUM Perezoso de tres dedos Perezoso de dos dedos Oso hormiguero Fahrt zur Pazifikküste (Park) Fahrt HB – La Gamba Fahrt zur Pazifikküste (Park) Fahrt HB – La Gamba 1.9.07 3.9.07 1.9.07 3.9.07 Gesichtete Säugetierarten der Tropenbiologischen Exkursion nach Costa Rica von 30.8. - 17.9.2007, zusammengestellt von Birgit Rotter 100 90 Blätter mit Frosch Blätter ohne Frosch 82.5 Relativer Anteil [%] 80 70 60 52.53 50 43.49 40 30 20 10 13.75 3.98 3.75 0 0° 45° 90° Neigung des Blattes Abb. 3: Blattneigung der von Fröschen genutzten Blätter im Vergleich zum Blattangebot. 100 Relativer Anteil [%] 90 Blätter mit Frosch Blätter ohne Frosch 93.75 80 70 59.49 60 50 40.51 40 30 20 6.25 10 0 glatt rau Blattoberfläche Abb. 4: Oberfläche der von Fröschen genutzten Blätter im Vergleich zum Blattangebot. 9 C al nt hu a t r iu he m a s in p . C C ala sig ar ap the nis a a C C lu g a s ar t ea lud uia ea n r o e i C es a c vic nsi pe om a d s ru de m e d s C y m Cy i a r s o e i m n c bo la ac ia na pe nt r ta hu oph yl D lu m s b ie l ffe co ipa a nb st rtit ac ari us c h El ia ens ae co i n s is gu cin n i H el Fic nee a ic us n si on t s H ia d ond el ic an uzi H oni iels i el a ia M ic o i m n a br ni al va a ic vi l at at a sc is us p a th a N ic rbo a o Ps Ph lai reu yc ilo a e s ho de lat n i tr ia dro or so n sp Th Q lit el uii udi . yp n a n u te m ris sch To de ipp T o vo cu ii s vo m m ita sat ita st a w ylo ed s de a lia na A Absolute Häufigkeit 25 20 20 15 12 10 7 5 5 3 3 2 1 1 1 1 1 1 1 10 2 3 3 3 3 4 1 Abb. 5: Häufigkeiten der von H. valerioi als Ruf- oder Laichplatz genutzten Pflanzenarten 1 0 2 Diskussion Transekte, in denen H. valerioi rufend gefunden wurde, unterschieden sich hinsichtlich des Wasserpegels und Flussaufbaus nicht von den zufällig ausgewählten Flusstransekten am Quebrada negra. Der Vergleich zeigte jedoch eine starke Tendenz zu einer erhöhten Strömungsgeschwindigkeit in den Froschtransekten. Eine turbulentere Strömung könnte bereits geschlüpften Larven den Vorteil eines erhöhten Schutzes vor Prädatoren bieten. Es wird angenommen, dass die Larven nach dem Schlupf ihre weitere Entwicklung im Detritus vergraben oder zwischen Steinen versteckt durchleben (KUBICKI 2007). Eine turbulente Strömung kann nach dem Schlupf der Larven bedeutend für deren Überleben sein, da sie im bewegten Wasserkörper weniger leicht von Fischen aufgespürt werden können (MCDIARMID 1983), bis sie sich versteckt haben. Die mit Fröschen besetzten Blätter befanden sich alle erst ab einer Höhe von 95cm über dem Wasserspiegel. In Regenzeiten kann dieser stark ansteigen, worauf auch die Höhen der Uferabbruchkante hinweisen. Für den individuellen Fortpflanzungserfolg eines Froschs kann ein erhöhter Laichplatz daher von großer Bedeutung sein. Oberhalb der Mindesthöhe von 95cm gab es keine signifikante Höhenpräferenz mehr, jedoch wurden von uns auch nur Blätter bis zu 3m Höhe ausgewertet. Im Vergleich mit dem allgemeinen Angebot zeichneten sich die mit Fröschen besetzten Blätter durch einige spezifische Merkmale aus. So zeigten die Frösche eine deutliche Präferenz für große Blätter. Dies könnte mehrere Gründe haben. Ein großes Blatt bietet den Vorteil erhöhter Stabilität und somit Schutz gegen Regen und Wind. Unter Umständen kann auch der Fortpflanzungserfolg des Männchens durch die Wahl eines ausreichend großen Blattes erhöht werden. Vorhergehenden Studien zufolge bewachen einzelne Individuen von H. valerioi bis zu neun Gelege gleichzeitig (KARPFEN 2006). Je mehr Fläche vorhanden ist, umso mehr Platz wäre auch für zahlreiche Gelege. Ebenso wie die Größe der Blätter war auch deren Neigung von Bedeutung. Eine 45° Neigung des Blattes wurde den Neigungen 0° und 90° vorgezogen. Ein Grund dafür könnte das gezielte Abtropfen der Larven nach dem Schlupf sein. Bei 45° geneigten Blättern rinnen die Larven zu der Träufelspitze und tropfen genau dort ab. Den Schlupfvorgang erleichtert auch eine glatte Blattoberfläche (KUBICKI 2007), welche in 11 unserer Studie signifikant bevorzugt wurde. Neben der Erleichterung des Schlupfs spielt möglicherweise auch der Schutz vor Wettereinflüssen eine Rolle bei der Präferenz 45° geneigter Blätter. Bei einer 0°-Neigung könnten die Frösche und Gelege direkt beregnet werden, während bei einer horizontalen Blattstellung vielleicht die Erschütterungen des Blattes bei Regen zu groß sind. Obwohl H. valerioi ein breites Spektrum an Pflanzenarten nutzt, gibt es Unterschiede in der Nutzungshäufigkeit. In unserer Studie wurden Blätter von Carludovica drudei, und Heliconia imbricata signifikant bevorzugt. Diese beiden Arten scheinen folglich den Großteil der Ansprüche von H. valerioi zu erfüllen. Sie vereinen Charakteristika wie eine große Blattfläche, glatte Oberfläche und sind zudem meist etwas geneigt. Die am häufigsten genutzte Pflanze Carludovica drudei hat dreieckige Blätter, die im allgemeinen Angebot selten sind, aber eine große Fläche mit Träufelspitzen verbinden. Im Vergleich erklärt sich die negative Korrelation der Anwesenheit von Fröschen mit den häufig sehr kleinen lanzettförmigen Blättern, die in Relation zum Angebot weit seltener genutzt wurden. Lanzettförmige Blätter scheinen erst bei einer großen Blattfläche - wie von Heliconia imbricata - für Männchen attraktiv zu sein. Das ideale Froschblatt für die Wahl der Männchen als Rufplatz besitzt somit Eigenschaften wie eine große Blattfläche, eine leichte Neigung der Spitze Richtung Fluss, eine glatte Oberfläche, eine dreieckige Form, und liegt über leicht turbulenten Strömungsabschnitten. Zusätzlich könnten natürlich bioakustische Aspekte oder die Distanz zum nächsten Nachbarn einen Einfluss auf die Wahl des Territoriums der Männchen haben. Um abzusichern, ob auch die Wahl der Weibchen von diesen Merkmalen beeinflusst wird, wären weitere Studien von Interesse, die sich mit dem Paarungserfolg von Männchen auf bestimmten Blättern und dem Schlupferfolg der Larven beschäftigen. 12 Referenzen Crawley M.J. (2005); Statistics: An Introduction using R. John Wiley and Sons, Ltd. KARPFEN U. (2006); Reproductive behavior and male mating success in the glassfrog Hyalinobatrachium valerioi; Dipl.-Arb., Universität Wien. KUBICKI B. (2007); Ranas de vidrio: Costa Rica Glass frogs; Editorial INBio, Costa Rica. MCDIARMID, R.W. (1983); Centrolenella fleischmanni, S. 389 – 39, in JANZEN D.H. Costa Rican natural history; The University of Chicago Press, Chicago. Sachs L., Hedderich J. (2006); Angewandte Statistik: Methodensammlung mit R. Springer-Verlag, Berlin Heidelberg . Savage J.M. (2002); The amphibians and reptiles of Costa Rica: a herpetofauna between two continents, between two seas; The University of Chicago Press, London. TSCHELAUT J. (2005); Leaf litter decomposition and macroinvertebrates in a neotropical lowland stream, Q. Negra, Costa Rica; Dipl.-Arb., Universität Wien. 13 Ausgewählte Vogelarten der Golfo Dulce Region Bauer Alexandra, Baumgartner Gregor, Güttner Catarina, Schütz Claudia 1. Turkey Vulture Carthartes aura Truthahngeier 76 cm; Flügelunterseite ist grau und schwarz; nackter, roter Kopf; langer, schmaler Schwanz 2. Black Vulture Coragyps atratus Rabengeier 64 cm; Kopf größer, Hals länger und Körper kräftiger gebaut als 1; Gefieder schwarz, Flügelunterseite an den Enden weiß; kurzer, breiter Schwanz 3. Roadside Hawk Buteo magnirostris Wegebussard 38 cm; Rückengefieder braungrau; Hals und Brust hellgrau, Bauch weiß-braun gestreift; Schwungfedern rot-braun mit schwarzen Bändern; Beine gelb 4. Crested Guan Penelope purpurascens Rostbauchguan 86 cm; Rückengefieder dunkel olivbraun; Hals und Brust weiß gefleckt; hinterer Rücken, Bauch und Schwanz rotbraun; Beine, Augen und Halsfalte rot; Gesichtshaut blaugrau 5. Ruddy Ground-dove Columbina talpacoti Rosttäubchen 16 cm; Männchen: Kopf hellgraun, Stirn und Kehle weißlich, Hals, Brust, Rücken und Rumpf rotbraun; Weibchen: schlichter, eher bräunlich, Genick und Kopf grau 6. Orange-chinned Parakeet Brotogeris jugularis Tovisittich 18 cm; kleiner Papagei mit braunen Schultern; Flügel teilweise blau; Körper grün; oranger Punkt unter dem Schnabel; Augenring weiß; Beine fleischfarben 7. Smooth-billed Ani Cotophaga ani Glattschnabelani 35 cm; Gefieder glänzend schwarz; Gesicht, Schnabel und Füsse schwarz; Schnabel groß mit Höcker 8. Chestnut-mandibled Toucan Rhamphastos swainsonii Swainsontukan 56 cm; Körper schwarz; gelber Brustlatz; Schnabeloberseite gelb, sonst dunkelbraun 9. Red-crowned Woodpecker Melanerpes rubricapillus Rotkappenspecht 17 cm; Männchen: weiße Stirn, Kopf rot, Bauch weiß, Rücken, Flügel und Schwanz schwarzweiß quergestreift; Weibchen: ähnlich bis auf weißen Kopf 10. Orange-collared Manakin Manacus aurantiacus 10 cm; Männchen: Kopfoberseite, Rückenband und Flügel schwarz, Wangen, Kehle, Brust, Nacken und Schultern orange, hinterer Rücken und Schwanz olivegrün, Bauch gelb; Weibchen: Brustseiten und Flanken olivegrün, Rumpf und Schwanz gelblich, Bauch gellolivegelb 11. Great Kiskadee Pitangus sulphuratus Bentevie 23 cm; Gesicht schwarz mit weißem Streifen oberhalb der Augen und weißem Kehlfleck; Oberseite olivbraun; Flügel braun; Unterseite hellgelb; Spitze des oberen Schabels hackenförmig 12. Riverside Wren Thryothorus semibadius Uferzaunkönig 13 cm; Oberseite braun; Flügel und Schwanz braun mit schwarzen Streifen; Gesicht weiß mit schwarzen Längsstreifen; Kehle weiß; Unterseite weiß-braun mit schwarzen Querstreifen 13. Clay-coloured Robin Turdus grayi Gilbdrossel 23 cm; Körper olivebraun; Kehle hellbraun mit dunkleren Streifen; Schnabel gelbgrün 14. Great-tailed Grackle Quiscalus mexicanus Dohlengrackel 43 cm; Männchen: Körper und Kopf purpur-schwarz, Flügel und Schwanz schwarz-grün-blau schimmernd, Schwarz und Schnabel lang; Weibchen: Körper dunkelbraun, Flügel und Schwanz schwarzgrau 15. Cherri’s Tanager Rhamphocelus costaricensis Costaricatangare 16 cm; Männchen: Körper samt-schwarz, hinterer Rücken, Rumpf und obere Schwanzfedern leuchtend rot; Weibchen: Körper ocker mit breitem dunkel-orangen Brustband 16. Blue-gray Tanager Thraupis episcopus Bischofstangare 15 cm; unverwechselbar! Hals, Kopf, Kehle und Unterseite grau; an den Seiten blaugrau; Rumpf und Schwanz hellblau; Flügel himmelblau 17. Rufous-collared Sparrow Zonotirchia capensis 13 cm; Kopf hellgrau und schwarz gestreifet; schwarze Haube; weiße Kehle; Unterseite hellbraun; Flügel und Schultern braun mit schwarzem Streifen; zwei schmale weiße Flügelstreifen; Schwanz und hintere Rücken braun 18. Yellow-cowned Euphonia, Spotted-crowned Euphonia, Yellow- throated Euphonia, White-vented Euphonia und Thick-billed Euphonia Euphonia sp. Organisten 9-11 cm; Kopfoberseite, Brust und Bauch gelb; Kehle violett oder gelb; Rücken, Flügel und Schwanz violett; Genaue Artunterscheidung anhand Kopf- und Kehlfleck. Kolibris (Trochilidae) Bauer Alexandra, Baumgartner Gregor, Güttner Catarina, Schütz Claudia Kolibris sind typische Vertreter der Neuen Welt. Sie besiedeln von Alaska und Kanada im Norden bis Feuerland im Süden alle Festlandsterritorien und Inseln mit Ausnahme des Galapagos-Archipels. Das Gebiet mit der größten Artendichte liegt im nördlichen Südamerika, also im Bereich von Ecuador, Peru und Kolumbien. Auch in ihrer vertikalen Verbreitung weisen die sie eine erstaunliche Bandbreite auf: man findet sie von den tropischen Tieflandregenwäldern und Mangrovenwäldern bis in eine Höhe von 4000m, wobei sich die artenreichste Zone zwischen den Gebirgswäldern und den submontanen Wäldern in einer Höhe von 1800-2500 m befindet. Die Fam. der Kolibris oder Trochilidae wird in die Subfamilie Phaethornithinae oder „hermits“ und Trochilinae oder „non-hermits“ unterteilt. Der Großteil der Arten gehört zu den Trochilinae mit 294 Arten. Die restlichen 34 Arten werden in 6 Gattungen aufgeteilt und werden zu den Phaethornithinae gezählt. Phaethornithinae unterscheiden sich von den Trochilinae durch die vorwiegend braune, graue Färbung. Schillernde Farben kommen bei ihnen selten vor und wenn, dann nur auf der Körperoberseite. Für viele ist auch die dunkle Partie ums Auge, die beidseits von helleren Partien umgeben ist, typisch. Phaethornithinae sind nicht territorial und kommen in der Strauchschicht tropischer Wälder oder im Buschland vor. Sie besitzen normalerweise einen langen Schnabel und sind damit an Blüten mir röhrenförmigen Corollen angepasst. Die Nester aller Hermits sind hängend. Die Trochilinae stellen eine weitaus heterogenere Subfamilie dar. Die meisten zeigen einen deutlichen Sexualdimorphismus in ihrem Gefieder. Helle, schillernde Farben auf der Köperober- und -unterseite zeichnen das männliche Gefieder aus. Bei den Männchen einiger Arten können außerdem noch zusätzliche Verzierungen wie erweiterte Kehllappen, Federschöpfe an den Köpfen sowie verlängerte und modifizierte Schwanzfedern vorkommen. Die Weibchen sind meist unauffälliger gefärbt. Die Männchen der Trochilinae sind territorial. Die Nester sind meist schalenförmig und an Ästen oder Zweiggabelungen befestigt. Es sind aber auch hängende oder kuppelförmige Nester bekannt. Die Heterogenität dieser Gruppe macht sich auch in ihrer Habitatwahl bemerkbar. So findet man sie von Mangrovenwäldern und tropischen Regenwäldern bis zu den Wiesen unterhalb der Schneegrenze der Andengipfel. Ornithophilie Ist die Anpassung der Vogelblume an den Vogel. Die Anpassung findet hauptsächlich an der Blüte statt. Typisch sind auffällige Farben der Blüten und reichlich Nektar. Ornithophile Blumen sind ohne merkbaren Duft und haben keine typische Landeplattform.Kolibris stellen die wichtigsten Blütenbesucher unter den Vertebraten in neotropischen Wäldern dar. In Amerika sind 8000 Pflanzenarten aus über 60 Familien kolibribestäubt. Kolibris spielen als Bestäuber und Verbreiter eine wichtige Rolle in der Reproduktionsbiologie der Blütenpflanzen. Im Gegenzug erhalten sie von den Pflanzen Nektar um ihren Energiehaushalt zu decken. Die Pollenübertragung erfolgt meist über die Stirn bzw. den Kopf oder über den Schnabel des Kolibris. Ernährung der Kolibris: In den meisten tropischen Lebensräumen kann man Kolibris nach Art ihrer Futtersuche in vier verschiedene Gruppen einteilen: 1. Arten mit sehr spezialisiertem Schnabel, mit dem erfolgreich nur bei einem Teil der Blüten nach Nektar gesucht werden kann. Die Nektarsuche ist sehr erfolgreich, da andere Arten die Blüten nicht ausbeuten. Sie besuchen die ihnen bekannten Vogelblumen immer wieder, gründen aber keine Nahrungsterritorien, die sie verteidigen. 2. Arten mit kürzerem, geradem Schnabel, mit denen sie weniger spezialisierte Blüten ausbeuten. Die Vogelblumen liegen oft weit voneinander entfernt, daher haben diese Arten keine Territorien. Erfolg ist weniger lohnend als bei erster Gruppe. 3. Typische Inhaber und Verteidiger von Territorien, die innerhalb ihrer Reviergrenzen alle erreichbaren Blüten ausbeuten. 4. Die vierte Gruppe ist heterogen. Sie dringen in bestehende Nahrungsterritorien ein. Entweder große Arten, die ohne weitere Streitereien mit dem Territoriumsinhaber nach Nahrung suchen oder kleine schnelle Arten, die rasch und unbemerkt für kurze Zeit in ein Revier eindringen, nach Nahrung suchen und wieder verschwinden. Kolibris ernähren sich zu ca. 90% von Nektar und ca. 10% von verschiedenen Arthropoden, Pollen, Fruchtfleisch etc..Pflanzen die von Kolibris bestäubt werden, haben meist einen saccharosereichen Nektar. Der Darm der Kolibris ist in hohem Maße an Verdauung und Aufnahme von Saccharose angepasst. Wenn die vorhandenen Energiereserven einen homoiothermen Zustand über Nacht oder bei Schlechtwetterperioden nicht gewährleisten, werden Kolibris torpid. Torpidität ist aber nicht die Regel, sondern die Möglichkeit, Extremsituationen zu überwinden. Die Nektaraufnahme erfolgt mit einer verlängerbaren, zweigabeligen Zunge. Der Nektar wird durch kapillare Kräfte in die äußeren Rinnen aufgenommen. Die Hohlräume füllen sich passiv (kein Saugen). Flug der Kolibris: Die Frequenz des Flügelschlags ist im Vergleich zu anderen Vögeln enorm hoch. Je kleiner der Kolibri, desto höher diese Frequenzen. Die höchsten Werte die festgestellt wurden, waren 200 Flügelschläge pro Sekunde bei Archilochus colubris (Ruby-throated hummingbird). Es konnten bei Verfolgungsjagden zweier Kolibris Geschwindigkeiten von 150 km/h gemessen werden. Im Normalflug wurden Geschwindigkeiten zw. 50 und 65 km/h gemessen, im Sturzflug 95 km/h. Während dem Schwirrflug haben die Kolibris einen sehr hohen Energieverbrauch, daher muss die Nektaraufnahme rasch erfolgen. Kolibris im Stationsgarten Im Stationsgarten der Tropischen Forschungsstation La Gamba werden wir mit großer Wahrscheinlichkeit sowohl Vertreter der Phaethornithinae als auch der Trochilinae beobachten können. Die in den nachfolgenden Artbeschreibungen verwendeten Begriffe für Gefiederpartien und Körperteile sind in Abb.1 dargestellt. Abb. 1: Kurze Erläuterung der im folgenden Text verwendeten Körperteile und Gefiederpartien eines Vogels Subfamilie Phaethornithinae • Bronzy Hermit Glaucis aenea: Körperoberseite sowie zentrale Steuerfedern grünlichbronzefarben; abgerundeter Schwanz; die äußeren 4 Schwanzfedern sind an der Basis bräunlich gefärbt und werden von den weißen Spitzen durch ein schwarzes Subterminalband getrennt; Körperunterseite ist zimtbraun gefärbt; mäßig gebogener Schnabel; die dunkle Maske wird von einem braungelben Bartstreif und Postocularfleck begrenzt; • Band-tailed Barbthroat Threnetes ruckeri: sieht Glaucis aenea auf den ersten Blick ähnlich: auch bei Threnetes ruckeri sind die Körperoberseite und die zentralen Steuerfedern grünlich-bronzefarben gefärbt; der Schwanz ist ebenfalls abgerundet; die 4 äußeren Schwanzfedern sind jedoch an der Basis weiß gefärbt, aber auch hier werden die weißen Schwanzfederspitzen durch ein schwarzes Subterminalband getrennt; die Körperunterseite ist ebenfalls zimtbraun gefärbt, aber es liegt ein scharfer Kontrast zwischen dunkler Kehle und rötlich-oranger Brust vor; der Schnabel ist nicht so stark gebogen wie bei Glaucis aenea; • Long-tailed Hermit Phaethornis superciliosus: die Körperoberseite ist grünlichbronzefarben gefärbt; der Kopf ist dunkelbraun mit schwarzer Maske, die beidseits von hellen, braungelben Streifen begrenzt wird; sehr langer, gebogener Schnabel; die zentralen Steuerfedern sind verlängert und enden mit weißen Spitzen; die seitlichen Schwanzfedern sind überwiegend schwarz mit kleinen braungelben Spitzen; Subfamilie Trochilinae • White-necked Jacobin Florisuga mellivora: ♂: Kopf, Nacken und Kehle dunkelblau; Brust, restliche Körperoberseite und zentrale Steuerfedern hellgrün; Nacken und Bauch weiß; seitliche Steuerfedern weiß mit schwarzen Außenrändern und Spitzen; ♀: Körperoberseite einheitlich hellgrün; Kehle bläulich-grün, stark geschuppt mit weißen Schuppenrändern; Bauch weiß; Schwanz ist grün mit dunkelblauen Spitzen, die äußeren Steuerfedern mit weißen Rändern und Spitzen; • Violet-crowned Woodnymph Thalurania colombica: ♂: Krone, oberer Rücken, Schultern und Bauch dunkelviolett; restliche Körperoberseite ist dunkelgrün; Kehle und obere Brust glitzern grün; langer, tief gegabelter Schwanz ist schwarzblau gefärbt; ♀: Körperoberseite hellgrün; distales Ende des Schwanzes schwarzblau, die äußeren 2 Steuerfedern mit weißen Spitzen; Kehle und obere Brust hellgrau; Bauch ist grün gefärbt; • Long-billed Starthroat Heliomaster longirostris: ♂: langer, gerader Schnabel; relativ kurzer Schwanz; Stirn und Krone glitzern metallisch blau bis dunkelgrün; die restliche Körperoberseite ist dunkel grünbronzefarben; Steuerfedern am distalen Ende schwarz, die äußeren 2-3 Steuerfederpaare mit weißen Spitzen; der kleine Postocularfleck und und der breite Bartstreif sind weiß; die Kehle ist dunkel metallisch purpur gefärbt; Brust grau; untere Brust und Bauch weiß; ♀: Krone dunkelbronzefarben mit wenig oder ganz ohne Blau; Abbildungen zu ausgewählte Vogelarten der Golfo Dulce Region 1. Turkey Vulture 2. Black Vulture 4. Crested Guan 7. Smooth-billed Ani 5. Rudy Ground-dove 3. Roadside Hawk 6. Orange-chinned Parakeet 8. Chestnut-mandibled Toucan 9. Red-crowned Woodpecker 10. Orange-collared Manakin 11. Great Kiskadee 12. Riverside Wren 13. Clay-coloured Robin 14. Great-tailed Grackle 16. Blue-gray Tanager 15. Cherri’s Tanager (male/female) 17. Rufus-collared Sparrow 18. Thick-billed Euphonia Kolibriarten im Stationsgarten Phaethornithinae Bronzy Hermit Band-tailed Barbthroat Long-tailed Hermit Violet-crowned Woodnymph Long-billed Starthroat Trochilinae White necked Jacobin ORD. Pelecaniformes Costa Rica 2007 Fam. Fam. Pelecanidae: Pelecanidae: Brown Pelican Pelecanus occidentalis Beobachtete Vogelarten Von Gregor Baumgartner und Claudia Schü Schütz Dank an Prof. Harald Krenn, Krenn, Alexandra Bauer, Doris Kruder und allen anderen aufmerksamen Beobachtern Nur zum persö persönlichen Gebrauch!!!! Fam. Fam. Sulidae Brown Booby Sula leucogaster Pazifik Fam. Fam. Phalacrocoracidae Olivaceous Cormorant Phalacrocorax olivaceus Pazifik Pazifik ORD. Ciconiiformes Fam. Fam. Fregatidae Magnificient Fregatbird Fregata Magnificens Pazifik, Mangroven, Kü Küste Fam. Fam. Ardeidae Yellow Crowned Night heron Nyctanassa violacea Küste 1 Boat billed Heron Cochlearius cochlearius Cattle Egret Bubulcus ibis La Gamba Green backed (Green) heron Butorides striatus Küste Little Blue Heron Egretta caerulea Snowy Egret Egretta thula Hacienda Baru Hacienda Baru, Baru, La Gamba Küste, Mangroven Great Egret Casmerodius albus Hacienda Baru, Baru, La Gamba 2 Fam. Fam. Threskiornithidae: Threskiornithidae: White Ibis Eudocimus albus La Gamba, Kü Küste, Pazifik, Mangroven Roseate Spoonbill Ajaia ajaja ORD. Anseriformes ORD. Falconiformes: Falconiformes: Fam. Fam. Anatidae: Anatidae: BlackBlack-bellied whistling duck Dendrocygna autumnalis Turkey vulture Cathartes aura Fam. Fam. Cathartidae: Cathartidae: La Gamba Black Vulture Coragyps atratus Hacienda Baru Allajuela, Allajuela, Baru, Baru, La Gamba, Valle Bonito, Bonito, Kü Küste, Pazifik Allajuela, Allajuela, Baru, Baru, La Gamba, Valle Bonito, Bonito, Kü Küste, Pazifik King Vulture Sarcoramphus papa La Gamba 3 Fam. Fam. Pandionidae: Pandionidae: Fam. Fam. Accipitridae: Accipitridae: Osprey Pandion haliaetus Roadside Hawk Buteo magnirostris Küste La Gamba ORD. Galliformes: Galliformes: ORD. Gruiformes: Gruiformes: Fam. Fam. Cracidae: Cracidae: Fam. Fam. Rallidae: Rallidae: GrayGray-headed chachalaca Ortalis cinereiceps Rufous necked WoodWood-rail Aramides axillaries La Gamba La Gamba ORD. Charadriiformes: Charadriiformes: Fam. Fam. Scolopacidae: Scolopacidae: Fam. Fam. Jacanidae: Jacanidae: Whrimbel Numenius phaeopus Northern Jacana Jacana spinosa Küste Mangroven 4 Willet Catoptrophorus semipalmatus Küste, Mangroven Spotted Sandpiper Actitis macularia Küste Fam. Fam. Laridae: Laridae: Ruddy Turnstone Arenaria interpres Baru, Baru, Kü Küste Franklin’ Franklin’s Gull Larus pipixcan Küste, Pazifik Royal Tern Sterna Maxima Pazifik Brown Noddy Anous stolidus Pazifik 5 ORD. Columbiformes: Columbiformes: ShortShort-billed pigeon Columba nigrirostris Fam. Fam. Columbidae: Columbidae: PalePale-vented Pigeon Columba cayennensis Baru La Gamba RuddyRuddy-Ground dove Columbina Talpacoti Allajuela, Allajuela, Baru, Baru, La Gamba WhiteWhite-tipped dove Leptotila verreauxi La Gamba ORD. Psittaciformes: Psittaciformes: Fam. Fam. Psittacidae: Psittacidae: CrimsonCrimson- fronted parakeet Aratinga finschi Scarlet Macaw Ara macao Küste Baru 6 OrangeOrange-chinned Parakeet Brotogeris jugularis La Gamba Blue headed Parrot Pionus menstruus La Gamba ORD. Cuculiformes: Cuculiformes: Fam. Fam. Cuculidae: Cuculidae: SmoothSmooth-billed Ani Crotophaga ani Squirrel Cuckoo Piaya cayana Allajuela, Allajuela, La Gamba Baru, Baru, La Gamba ORD. Striginiformes: Striginiformes: ORD. Caprimulgiformes: Caprimulgiformes: Fam. Fam. Strigidae: Strigidae: Fam. Fam. Caprimulgidae: Caprimulgidae: BlackBlack-andand-white Owl Ciccaba nigrolineata Common Pauraque Nyctidromus albicollis Allajuela La Gamba 7 ORD. Apodiformes: Apodiformes: Fam. Fam. Apodidae: Apodidae: BandBand-rumped swift Chaetura spinicauda WhiteWhite-collared swift Streptoprocne zonaris Valle Bonito Fam. Fam. Trochilidae: Trochilidae: BandBand-tailed Barbthroat Threnetes ruckeri Bronzy Hermit Glaucis aenea La Gamba LongLong-tailed Hermit Phaetornis longirostris La Gamba Valle Bonito La Gamba Little Hermit Phaetornis striigularis La Gamba 8 WhiteWhite-necked Jacobin Florisuga mellivora Baru, Baru, La Gamba Green violetviolet-ear Colibri thalassinus Crowned Woodnymph Thalurania colombica La Gamba FieryFiery-Throated Hummingbird Panterpe insignis RufousRufous-tailed Hummingbird Amazilia tzacatl La Gamba La Georgina La Georgina Magnificent Hummingbird Eugenes fulgens La Georgina 9 PurplePurple-Crowned Fairy Heliothryx barroti La Gamba Long billed Starthroat Heliomaster longirostris La Gamba ORD. Trogoniformes: Trogoniformes: Fam. Fam. Trogonidae: Trogonidae: Volcano Hummingbird Selasphorus flammula La Georgina Baird’ Baird’s Trogon Trogon bairdii La Gamba ORD. Coraciiformes: Coraciiformes: Fam. Fam. Alcedinidae BlackBlack-headed Trogon Trogon melanocephalus La Gamba Ringed Kingfisher Ceryle torquata Valle Bonito 10 Amazon Kingfisher Chloroceryle amazona Belted Kingfisher Ceryle alcyon Baru Green Kingfisher Chloroceryle Americana La Gamba Valle Bonito American pygmy Kingfisher Chloroceryle aenea La Gamba ORD. Piciformes: Piciformes: Fam. Fam. Momotidae: Momotidae: Fam. Fam. Ramphastidae: Ramphastidae: BlueBlue-crowned Motmot Momotus momota La Gamba ChestnutChestnut-mandibled toucan Ramphastos swainsonii La Gamba 11 Fam. Fam. Picidae: Picidae: Hoffmann’ Hoffmann’s Woodpecker Melanerpes hoffmannii GoldenGolden-naped woodpecker Melanerpes chrysauchen Baru RedRed-Crowned Woodpecker Melanerpes rubricapillus La Gamba Baru PalePale-billed Woodpecker Campephilus guatemalensis La Gamba ORD. Passeriformes: Fam. Fam. Dendrocolaptidae: Dendrocolaptidae: BlackBlack-striped Woodcreeper Xiphorhynchus lachrymosus WedgeWedge-billed Woodcreeper Glyphorhynchus spirusus La Gamba La Gamba 12 Fam.Formicariidae: Fam.Formicariidae: StreakedStreaked-headed Woodcreeper Lepidocolaptes souleyetii La Gamba ChestnutChestnut-backed Antbird Myrmeciza exsul Baru Fam. Fam. Tityridae: Tityridae: Fam. Fam. Tityridae: Tityridae: Masked Tityra Tityra semifasciata Masked Tityra Tityra semifasciata La Gamba La Gamba Fam. Fam. Pipridae: Pipridae: OrangeOrange-collared Manakin Manacus aurantiacus RedRed-Capped Manakin Pipra mentalis La Gamba La Gamba 13 Fam. Fam. Tyrannidae: Tyrannidae: GrayGray-capped Flycatcher Myiozetetes granadensis Tropical Kingbird Tyrannus melancholicus La Gamba La Gamba Fam. Fam. Hirundinidae: Hirundinidae: Great Kiskadee Pitangus sulphuratus Allajuela, Allajuela, Baru, Baru, La Gamba GrayGray-breasted Martin Progne chalybea Valle Bonito Fam. Fam. Troglodytidae: Troglodytidae: Mangrove swallow Tachycineta albilinea Valle Bonito Plain Wren Thryothorus modestus Baru 14 Riverside Wren Thryothorus semibadius Baru House Wren Troglodytes aedon La Gamba Fam. Fam. Turdidae: Turdidae: Sooty Robin Turdus nigrescens ClayClay-colored Robin Turdus grayi Allajuela, Allajuela, Baru, Baru, La Gamba La Georgina Fam. Fam. Coerebidae: Coerebidae: Fam. Fam. Icteridae: Icteridae: Bananaquit Coereba flaveola GreatGreat-tailed Grackle Quiscalus mexicanus Baru, Baru, La Gamba Allajuela, Allajuela, La Gamba 15 Fam. Fam. Thraupidae: Thraupidae: ThickThick-billed Euphonia Euphonia laniirostris YellowYellow-crowned Euphonia Euphonia luteicapilla La Gamba SpottedSpotted-crowned Euphonia Euphonia imitans La Gamba GoldenGolden-hooded Tanager Tangara larvata BayBay-headed Tanager Tangara gyrola La Gamba La Gamba La Gamba BlueBlue-gray Tanager Thraupis episcopus Allajuela, Allajuela, Baru, Baru, La Gamba 16 FlameFlame-colored Tanager Piranga bidentata Cherrie’ Cherrie’s Tanager Ramphocoelus costaricensis Baru, Baru, La Gamba, Valle Bonito Allajuela Fam. Fam. Emberizidae: Emberizidae: SootySooty-capped BushBush-Tanager Chlorospingus pileatus La Georgina BuffBuff-throated Saltator Saltator maximus BlueBlue-black Grosbeak Cyanocompsa cyanoides La Gamba Baru Variable Seedeater Sporophila aurita Baru, Baru, La Gamba 17 Slaty Flowerpiercer Diglossa plumbea La Georgina LargeLarge-footed Finch Pezopetes capitalis YellowYellow-thighed finch Pselliophorus tibialis La Georgina BlackBlack-striped Sparrow Arremonops conirostris StripedStriped-headed Sparrow Aimophila ruficauda Baru, Baru, La Gamba La Georgina La Georgina Volcano Junco Junco vulcani La Georgina 18 RufousRufous-collared Sparrow Zonotrichia capensis Allajuela, Allajuela, La Georgina 19 Fam. Scolopacidae: Whrimbel Numenius phaeopus 8 Willet Catoptrophorus semipalmatus 5,8 Spotted Sandpiper Actitis macularia 5 Ruddy Turnstone Arenaria interpres 2,5 Fam. Laridae: Franklin’s Gull Larus pipixcan 5,6 Royal Tern Sterna Maxima 6 Brown Noddy Anous stolidus 6 ORD. Columbiformes: Fam. Columbidae: Pale-vented Pigeon Columba cayennensis 2 Short-billed pigeon Columba nigrirostris 4,5 Ruddy-Ground dove Columbina Talpacoti 1-4 White-tipped dove Leptotila verreauxi 3 ORD. Psittaciformes: Fam. Psittacidae: Scarlet Macaw Ara macao 5 Crimson- fronted parakeet Aratinga finschi 2 Orange-chinned Parakeet Brotogeris jugularis 3 Blue headed Parrot Pionus menstruus 3 ORD. Cuculiformes: Fam. Cuculidae: Squirrel Cuckoo Piaya cayana 1,3 Smooth-billed Ani Crotophaga ani 2,3 ORD. Striginiformes: Fam. Strigidae: Black-and-white Owl Ciccaba nigrolineata 1 ORD. Caprimulgiformes: Fam. Caprimulgidae: Common Pauraque Nyctidromus albicollis 3 ORD. Apodiformes: Fam. Apodidae: White-collared swift Streptoprocne zonaris 4 Band-rumped swift Chaetura spinicauda 4 Fam. Trochilidae: Bronzy Hermit Glaucis aenea 3 Band-tailed Barbthroat Threnetes ruckeri 3 Long-tailed Hermit Phaetornis longirostris 3 Little Hermit Phaetornis striigularis 3 White-necked Jacobin Florisuga mellivora 2,3 Green violet-ear Colibri thalassinus 7 Crowned Woodnymph Thalurania colombica 3 Fiery-Throated Hummingbird Panterpe insignis 7 Rufous-tailed Hummingbird Amazilia tzacatl 3 Magnificent Hummingbird Eugenes fulgens 7 Purple-Crowned Fairy Heliothryx barroti 3 Long billed Starthroat Heliomaster longirostris 3 Volcano Hummingbird Selasphorus flammula 7 ORD. Trogoniformes: Fam. Trogonidae: Baird’s Trogon Trogon bairdii 3 Black-headed Trogon Trogon melanocephalus 3 ORD. Coraciiformes: Fam. Alcedinidae Ringed Kingfisher Ceryle torquata 4 Belted Kingfisher Ceryle alcyon 2 Amazon Kingfisher Chloroceryle amazona 4 Green Kingfisher Chloroceryle Americana 3 American pygmy Kingfisher Chloroceryle aenea 3 Fam. Momotidae: Blue-crowned Motmot Momotus momota 3 ORD. Piciformes: Fam. Ramphastidae: Chestnut-mandibled toucan Ramphastos swainsonii 3 Fam. Picidae: Golden-naped woodpecker Melanerpes chrysauchen 2 Hoffmann’s Woodpecker Melanerpes hoffmannii 2 Red-Crowned Woodpecker Melanerpes rubricapillus 3 Pale-billed Woodpecker Campephilus guatemalensis 3 ORD. Passeriformes: Fam. Dendrocolaptidae: Wedge-billed Woodcreeper Glyphorhynchus spirusus 3 Black-striped Woodcreeper Xiphorhynchus lachrymosus 3 Streaked-headed Woodcreeper Lepidocolaptes souleyetii 3 Fam.Formicariidae: Chestnut-backed Antbird Myrmeciza exsul 2 Fam. Tityridae: Masked Tityra Tityra semifasciata 3 Black-crowned Tityra Tityra inquisitor 3 Fam. Pipridae: Red-Capped Manakin Pipra mentalis 3 Orange-collared Manakin Manacus aurantiacus 3 Fam. Tyrannidae: Tropical Kingbird Tyrannus melancholicus 3 Gray-capped Flycatcher Myiozetetes granadensis 3 Great Kiskadee Pitangus sulphuratus 1-3 Fam. Hirundinidae: Gray-breasted Martin Progne chalybea 4 Mangrove swallow Tachycineta albilinea 4 Fam. Troglodytidae: Plain Wren Thryothorus modestus 2 Riverside Wren Thryothorus semibadius 2 House Wren Troglodytes aedon 3 Fam. Turdidae: Clay-colored Robin Turdus grayi 1-3 Sooty Robin Turdus nigrescens 7 Fam. Coerebidae: Bananaquit Coereba flaveola 2,3 Fam. Icteridae: Great-tailed Grackle Quiscalus mexicanus 1,3 Fam. Thraupidae: Yellow-crowned Euphonia Euphonia luteicapilla 3 Thick-billed Euphonia Euphonia laniirostris 3 Spotted-crowned Euphonia Euphonia imitans 3 Golden-hooded Tanager Tangara larvata 3 Bay-headed Tanager Tangara gyrola 3 Blue-gray Tanager Thraupis episcopus 1-3 Cherrie’s Tanager Ramphocoelus costaricensis 2,3 Flame-colored Tanager Piranga bidentata 1 Sooty-capped Bush-Tanager Chlorospingus pileatus 7 Fam. Emberizidae: Buff-throated Saltator Saltator maximus 2 Blue-black Grosbeak Cyanocompsa cyanoides 3 Variable Seedeater Sporophila aurita 2 Slaty Flowerpiercer Diglossa plumbea 7 Large-footed Finch Pezopetes capitalis 7 Yellow-thighed finch Pselliophorus tibialis 7 Black-striped Sparrow Arremonops conirostris 7 Striped-headed Sparrow Aimophila ruficauda 2,3 Volcano Junco Junco vulcani 7 Rufous-collared Sparrow Zonotrichia capensis 1,7 1….. Allajuela 2….. Hacienda Baru, NP Carara 3….. La Gamba, Esquinas Rainforest 4 …..Valle Bonito 5 …..Küste (Golfo Dulce, Baru) 6….. Meer 7….. La Georgina 8….. Mangroven Beobachtete Vogelarten bei der Costa Rica Exkursion im September 2007 Gregor Baumgartner ORD. Pelecaniformes Fam. Pelecanidae: Brown Pelican Pelecanus occidentalis 5,6 Fam. Sulidae Brown Booby Sula leucogaster 6 Fam. Phalacrocoracidae Olivaceous Cormorant Phalacrocorax olivaceus 6 Fam. Fregatidae Magnificient Fregatbird Fregata Magnificens 6 ORD. Ciconiiformes Fam. Ardeidae Yellow Crowned Night heron Nyctanassa violacea 5 Boat billed Heron Cochlearius cochlearius 3 Cattle Egret Bubulcus ibis 2,3 Green backed (Green) heron Butorides striatus 5 Little Blue Heron Egretta caerulea 5,8 Snowy Egret Egretta thula 2 Great Egret Casmerodius albus 2,3 Fam. Threskiornithidae: White Ibis Eudocimus albus 3, 5-8 Roseate Spoonbill Ajaia ajaja 2 ORD. Anseriformes Fam. Anatidae: Black-bellied whistling duck Dendrocygna autumnalis 3 ORD. Falconiformes: Fam. Cathartidae: Turkey vulture Cathartes aura 1-6 Black Vulture Coragyps atratus 1-6 King Vulture Sarcoramphus papa 3 Fam. Pandionidae: Osprey Pandion haliaetus 5 Fam. Accipitridae: Roadside Hawk Buteo magnirostris 3 ORD. Galliformes: Fam. Cracidae: Gray-headed chachalaca Ortalis cinereiceps 3 ORD. Gruiformes: Fam. Rallidae: Rufous necked Wood-rail Aramides axillaries 3 ORD. Charadriiformes: Fam. Jacanidae: Northern Jacana Jacana spinosa 5 Tagesaktivität und Blütenbesuch von Kolibris in Costa Rica Alexandra Bauer, 0204324, [email protected] Gregor Baumgartner, 0104051, [email protected] Catarina Güttner, 0204347, [email protected] Claudia Schütz, 0301272, [email protected] Tropenbiologische Exkursion mit Projektpraktikum im “Regenwald der Österreicher” La Gamba (Costa Rica) 30.8.2007 – 18.9.2007 0 Inhaltsverzeichnis Abstract Seite 2 Einleitung Seite 3 Material und Methoden Seite 4 Beobachtungsgebiet Seite 4 Kurzcharakteristik der untersuchten Kolibriarten Seite 5 Kurzcharakteristik der untersuchten Pflanzengattung Heliconia Seite 6 Datenaufnahme Seite 6 Datenauswertung Seite 7 Ergebnisse Seite 7 Diskussion Seite 9 Danksagung Seite 10 Literaturverzeichnis Seite 10 1 Abstract Hummingbirds need a lot of nectar because of their high energy use. They are very important pollinators in the new world. The observation took place in Costa Rica, the Tropical Research Station La Gamba. The daily activity, the choice of forage plants and the number of visitation of the inflorecence based on H. latispatha and H. stricta. We found that hummingbirds visited the forage plants more often in the morning and the number of visitations decreased during the day. Some species (for example Glaucis aenea) prefered H. stricta, others (for example Heliothryx barroti) prefered H. latispatha. Keywords: Hummingbirds, Heliconia, daily activity, forage plants 2 1. Einleitung Kolibris bilden eine der größten Vogelfamilien der Neuen Welt. Die Familie wird in 102 Gattungen mit etwa 328 Arten und 684 Taxa unterteilt. Kolibris sind relativ kleine, schnell fliegende Vögel, häufig mit einem stark schillernden Gefieder. Der dünne Schnabel ist bei den einzelnen Arten sehr variabel. Er kann sehr kurz bis extrem lang und gerade oder stark gebogen sein (Kastinger, 2005). In Costa Rica gibt es insgesamt 51 Arten der Familie Trochilidae (Stiles & Skutch, 1989), davon 19 Arten in La Gamba. Im Stationsgarten wurden am Untersuchungsstandort 7 Arten bestimmt. Die höchsten von einem Wirbeltier gemessenen Werte des Energieverbrauchs sind von fliegenden Kolibris bekannt. Kolibris gehören zu den leichtesten und kleinsten warmblütigen Wirbeltieren. Mit Körpergewichten von 2g ist die Grenze des warmblütigen Lebens fast erreicht. Je kleiner und leichter ein warmblütiger Körper wird, umso größer wird im Verhältnis seine wärmeabstrahlende Oberfläche. Die Energiezufuhr in Form von Nahrung erreicht immense Werte, gleichzeitig wird Energie für die Erbeutung der Nahrung verbraucht. Der enorme Energieverbrauch und die geringe Speicherkapazität der Energie erfordern eine optimale Regulation des gesamten Energiehaushalts. Da die tagaktiven Vögel während der Nacht keine Nahrung aufnehmen können, müssen sie in der Lage sein, am Tag zusätzliche Energie für die Nacht zu speichern. Die Aufnahme der Nachtenergie erfolgt gleichmäßig über den ganzen Tag (Poley, 1994). Von Interesse ist daher der Tagesverlauf der Kolibris am Untersuchungsstandort. Wird der Standort zu jeder Tageszeit gleich oft besucht? Der durchschnittliche Anteil von Nektar an der Gesamternährung der Kolibris beträgt 90%. Ein 4-5g schwerer Kolibri benötigt 30-35 kJ Energie am Tag. Um diese Menge zu erreichen, müssen sie 1000-2000 Blüten jeden Tag besuchen (Kastinger, 2005). Die Größe der Tiere hängt eng mit der Auswahl der Blüten zusammen. Während des Schwirrfluges haben die Kolibris einen sehr hohen Energieverbrauch, daher muss die Nektaraufnahme rasch erfolgen. Die Dauer der Nektaraufnahme ist vom Gewicht unabhängig, nicht jedoch die Menge der in der Zeit aufgenommenen Nahrung. Größere Kolibris haben einen noch höheren Energieverbrauch im Schwirrflug als kleinere, daher nehmen die Tiere mit zunehmendem Gewicht zwar weniger häufig, dafür in gleicher Zeit mehr Nahrung auf (Poley, 1994). 3 Da der Blütennektar für Kolibris die wichtigste Energiequelle darstellt, spielt es eine Rolle, wie viele Blüten pro Besuch angeflogen werden. Die Beobachtung und Zählung der Blütenanflüge sollen Aufschluss über den Zusammenhang zwischen Körpergröße und Blütenanzahl geben. Bei den meisten vogelbestäubten Pflanzen ist die Farbe der Blüten sehr auffällig. Die typische „Vogelfarbe“ ist Rot mit unterschiedlichsten Abstufungen. Kolibris haben vermutlich eine gewisse Rotvorliebe, eine feste Bindung an eine bestimmte Blütenfarbe ist jedoch trotzdem nicht wahrscheinlich (Poley, 1994; Kastinger, 2005). Anhand selbst entworfener Futtertankstellen in den Farben Rot, Gelb und Blau, wollen wir die Farbpräferenz der Kolibris von Blüten untersuchen. Die Anpassung der Kolibrischnäbel an Blüten, sowie die Anpassung der Pflanze an Kolibris ist coevolutiv. (Huber W., Weissenhofer A., 2007) Die Weite des Blütenschlundes spielt eine wichtige Rolle bei der Ausbeutung von Blüten durch Kolibris. Blüten mit einer langen und weiten Kronröhre können sowohl langschnäbelige als auch kurzschnäbelige Kolibris zur Nektaraufnahme nutzen. Blüten mit einer langen, schmalen Kronröhre jedoch nur von langschnäbeligen Kolibris (Kastinger, 2005). In dieser Arbeit wird anhand der Helikonienarten Heliconia latispatha und Heliconia stricta dokumentiert, ob die verschiedenen Kolibriarten am Untersuchungsstandort dieselben Helikonienarten besuchen. Es stellt sich weiters die Frage, ob die Morphologie der Blüten im Zusammenhang mit den verschiedenen Schnabelformen stehen. 2. Material und Methoden Die Beobachtungen wurden am 7., 8., 9., 11. und 12.9.2007 im Stationsgarten der Tropenstation La Gamba (Costa Rica) durchgeführt. Pro Beobachtungstag wurden 12 Stunden (5.00 Uhr-17.00 Uhr) beobachtet. Beobachtungsgebiet Unsere gesamte Beobachtungsfläche wurde in die Areale A, B und C unterteilt (Abb.1). Jeweils ein Beobachter nahm die Daten von Areal A und B auf. Bei Areal C erfolgte die Datenaufnahme aufgrund des verstärkten Kolibribesuchs durch 2 Beobachter. In jedem Areal war eine Futtertankstelle montiert (Abb.1), die aus jeweils drei Fotofilmdosen bestand. Auf jedem Deckel war eine runde (Durchmesser: 5,5cm) Moosgummischeibe in den Farben Rot, Gelb und Blau befestigt. In die Mitte jedes Deckels wurde eine kleine Öffnung 4 geschnitten, in die eine kleine Eprouvette gesteckt wurde. Die Filmdosen wurden mit Draht entweder an einem Holzpfosten (Areal A) oder an einer Helikonienpflanze (Areal B und C) befestigt. Alle 3 Futtertankstellen befanden sich 1,50m über dem Boden. Die Eprouvetten der Futtertankstellen wurden mit 20 %iger Zuckerlösung gefüllt. Im Areal B befand sich neben der Futtertankstelle auch noch die Heliconia-Art H. latispatha. In Areal C befanden sich H. rostrata und H. stricta (Abb.1). Areal A Areal B Areal C 4 5 7 1 2 3 6 8 Abbildung 1: Überblick über das Beobachtungsgebiet mit Einteilung in die Areale A, B, C (rotes Dreieck: Futtertankstelle, oranger Kreis Nr. 1 und 2: Heliconia latispatha; blauer Kreis Nr. 3, 6 ,7 und 8: Heliconia stricta; grüner Kreis Nr. 4 und 5: Heliconia rostrata). Kurzcharakteristik der untersuchten Kolibriarten Kolibris zeichnen sich durch eine sehr hohe Stoffwechselrate aus und müssen daher regelmäßig und oft Nahrung zu sich nehmen. Den Großteil ihres Nahrungsbedarfs decken sie dabei mit Nektar, der sehr energiereich ist. Dadurch werden Kolibris zu wichtigen Bestäubern v. a. von jenen Pflanzen, die rote, tiefe, röhrenförmige Blüten aufweisen. In unsere Untersuchungen wurden alle Kolibriarten miteinbezogen, die wir im Beobachtungsgebiet bzw. an den einzelnen Helikonienpflanzen beobachten konnten. Dabei handelte es sich um folgende Arten: • Bronzy Hermit (Glaucis aenea): besucht v. a. Blüten von Heliconia und Bananenpflanzen; • Band-tailed Barbthroat (Threnetes ruckeri): besucht v. a. Blüten von Costus, Heliconia und Bananenpflanzen; betreibt oft Nektarraub, v. a. an Blüten von Calathea; 5 • Long-tailed Hermit (Phaethornis longirostris): seine präferierten Futterpflanzen sind Heliconia, Costus und Passiflora vitifolia; er besucht Blüten entlang regelmäßiger Foragierrouten, die oft 1km oder länger sind; • Little Hermit (Phaethornis strigulariis): besucht viele kleine, oft insektenbestäubte Blüten; Experte im Nektarraub; • Rufous-tailed Hummingbird (Amazilia tzacatl):besucht eine Vielzahl von Blüten, z.B. Hamelia, Heliconia, Banane etc.; sehr aggressiv und oft territorial an Orten, an denen Blüten stark geklumpt auftreten; • Purple-crowned Fairy (Heliothryx barroti): betreibt oft Nektarraub; ist nicht territorial, aber ziemlich aggressiv; ist fähig den Angriffen der meisten territorialen Kolibris Widerstand zu leisten; • Long-billed Starthroat (Heliomaster longirostris): präferiert Blüten von Erythrina mit langen Korollen; verteidigt große Bäume-die reich an Blüten sind-gegen alle anderen Kolibris oder er fliegt zwischen kleinen, über große Distanzen verstreuten Bäumen hin und her; er besucht auch Blüten von Bananenpflanzen und Heliconia; Kurzcharakteristik der untersuchten Pflanzengattung Heliconia Helikonien sind aufrechte, krautige, rhizombildende Pflanzen. Das auffälligste Merkmal dieser Pflanzen sind ihre Infloreszenzen, die aufrecht oder hängend ausgebildet sein können. Jede Infloreszenz besteht aus mehreren Tragblättern, die meist rot, gelb oder rotgelb gefärbt sind. Jedes Tragblatt beinhaltet wiederum mehrere Blüten (bis zu 50). Obwohl jede Blüte nur einen Tag geöffnet ist, kann die Pflanze ihrem Bestäuber über lange Zeit Nahrung liefern, da die Blüten in einem Tragblatt nicht gleichzeitig geöffnet werden. Die Helikonien der Neotropis werden nur von Kolibris bestäubt. Der Kolibribesuch an Heliconia wurde von uns an den Arten H. latispatha (spiralig angeordnete Blütenstände) und H. stricta (parallel angeordnete Blütenstände) untersucht. Zu Beginn der Beobachtungen wurde die Anzahl der Blütenstände ermittelt. Datenaufnahme Für jedes Areal verwendeten wir Protokollblätter, in denen bei jedem Kolibribesuch die Uhrzeit, die Kolibriart und die Anzahl der besuchten Blüten notiert wurden. Die besuchten Blüten wurden jedoch nur gezählt, wenn der Kolibri H.latispatha (oranger Kreis Nr.1 und 2, Abb.1) oder H. stricta (blauer Kreis Nr. 7, Abb.1) besuchte. Damit wurde auch gleichzeitig festgehalten, welche Kolibriarten H. latispatha bzw. H. stricta besuchten. 6 Die Beobachtungen erfolgten teils mit freiem Auge und teils mit Ferngläsern. Zur Bestimmung diente uns das Bestimmungsbuch „A Guide to the Birds of Costa Rica“ (Stiles & Skutch, 1989). Datenauswertung und Ergebnisse Daten wurden zu Beginn in Microsoft Excel 2002 eingegeben und bearbeitet, ausgewertet wurde mit SPSS 10.0 unter Anwendung von Friedmann-Test und Wilcoxon-Test. Als ein „Anflug“ wurde in den Ergebnissen das Einfliegen, Nektaraufnahme und das Verlassen des jeweiligen Areals definiert. 3. Ergebnisse Die Futtertankstellen wurden von keiner Art an keinem Areal angenommen. Bei den untersuchten Kolibriarten konnte an beiden Arealen (B, C) eine erhöhte Besuchsfrequenz in den Morgenstunden festgestellt werden (Abb. 2). Die Zahl der Anflüge wurde im Laufe des Tages weniger. Tagesgang Anzahl der Kolibris 14 12 10 8 Areal C 6 Areal B 4 2 05 :0 0 06 :0 0 07 :0 0 08 :0 0 09 :0 0 10 :0 0 11 :0 0 12 :0 0 13 :0 0 14 :0 0 15 :0 0 16 :0 0 0 Tageszeit Abb. 2: Tagesgang der beobachteten Kolibriarten. Areal B (Heliconia latispatha) wurde vermehrt von Trochilinae besucht, bei Areal C (Heliconia stricta) wurden hauptsächlich Phaethornithinae beobachtet (Tab. 1). 7 Tab. 1: Auflistung der beobachteten Kolibriarten, den Standorten zugeordnet. Areal B (Heliconia latispatha) Amazilia tzacatl Heliomaster longirostris Heliothryx barroti Phaethornis longirostris Phaethornis striigularis Areal C (Heliconia stricta) Amazilia tzacatl Glaucis aenea Phaethornis striigularis Phaethornis longirostris Threnetes ruckeri Die Anzahl der Blütenstände der beiden Helikonien-Arten wurden ermittelt. H. latispatha bestand aus 2 Superblütenständen mit 18 Blütenständen und H. stricta bestand aus 11 Superblütenständen mit 82 Blütenständen. Die Zahl der besuchten Blütenstände (pro Anflug) unterscheidet sich bei den beobachteten Kolibriarten. Bei Areal C hat Threnetes ruckeri signifikant mehr Blütenstände während eines Anflugs besucht als die anderen Arten (Tab. 2). Amazilia tzacatl hat signifikant weniger Blütenstände besucht als die meisten Arten. Kein signifikanter Unterschied konnte zwischen Phaethornis striigularis und Amazilia tzacatl sowie zwischen Phaethornis longirostirs und Glaucis aenea gefunden werden (Wilcoxon: Z1= -2.979, p1= 0.003; Z2= -2.530, p2= 0.011; Z3= -0.577, p3= 0.564; Z4= -3.414, p4= 0.001; Z5= 0.567, p5= 0.571, Z6= -2.911, p6= 0.004; Z7= -3.304, p7= 0.001; Z8= -2.539, p8= 0.011; Z9= -3.153, p9= 0.002; Z10= -3.411, p10= 0.001; n= 15; 2-tailed). Bei Areal B hat Amazilia tzacatl signifikant eine andere Anzahl an Blütenständen pro Anflug besucht als die anderen Arten. (Tab. 3) (Wilcoxon: Z1= -2.371, p1= 0.018; Z2= -2.371, p2= 0.018; Z3= -2.375, p3= 0.018; Z4lia= -2.314, p4= 0.021; Z5= 0.680, p5= 0.496; Z6= -1.841; p6= 0.066; Z7= 0.000, p7= 1.000; Z8= -2.251, p8= 0.024; n= 9; 2-tailed). Tab. 2: Durchschnittliche Anzahl der besuchten Blütenstände/Anflug im Areal C. Die signifikanten Unterschiede sind mit *= <0.05, **= <0.01 und ***= <0.001 oberhalb der Linien gekennzeichnet. Kolibriart Besuchte Blütenstände /Anflug im Durchschnitt Amazilia tzacatl Glaucis aenea Phaethonis longirostris Phaethornis striigularis Threnetes ruckeri 1,8 4,8 3,3 4,1 6,9 ** ** * ** ** ** ** * 8 Tab. 3: Durchschnittliche Anzahl der besuchten Blütenstände/Anflug im Areal B. Die signifikanten Unterschiede sind mit *= <0.05, **= <0.01 und ***= <0.001 oberhalb der Linien gekennzeichnet. Kolibriart Besuchte Blütenstände /Anflug im Durchschnitt Amazilia tzacatl Heliomaster longirostris Heliothryx barroti Phaethornis longirostris Phaethornis striigularis 3,8 3,3 4,1 4 4,7 * * * * * 4. Diskussion Die Annahme, dass Kolibris regelmäßig über den ganzen Tag verteilt Blüten besuchen müssen um ihren hohen Nektarbedarf abzudecken (Poley, 1994), konnte in der Untersuchung nicht bestätigt werden. Die Tiere besuchten vermehrt in den Morgenstunden die beobachteten Pflanzen und die Zahl der Anflüge nahm im Laufe des Tages ab. Möglicherweise kommen die Vögel vermehrt in den Morgenstunden, weil ein hoher Konkurrenzkampf um den Nektar herrscht. Umso früher der Kolibri zu dem Futterstandort kommt, desto bessere Chancen hat er, Nektar aufzunehmen. In der Nacht verbraucht der tagaktive Kolibri seine vom Tage gespeicherte Energie und muss die Reserven so schnell als möglich wieder auffüllen (Poley, 1994). Im Laufe des Nachmittags setzte während der Beobachtung starker Regen ein und auch das könnte ein Grund für die Abnahme der Anflüge sein. Nicht alle Kolibriarten besuchten dieselben Helikonienarten. Bei der Wahl der Futterpflanze spielt möglicherweise die Schnabelform in Verbindung mit der Blütenform eine Rolle, doch konnte das in dieser Untersuchung aufgrund Zeitmangels nicht festgestellt werden. Die Schnabelform unterscheidet sich bei den Arten der Kolibris in der Länge und der Krümmung. Kolibris mit gebogenen Schnäbeln konnten hauptsächlich bei H. stricta beobachtet werden, die Arten mit längeren, geraden Schnäbeln wurden vermehrt bei H. latispatha beobachtet. Kolibris können Territorien verteidigen (Poley, 1994). In Areal C besuchte Threnetes ruckeri signifikant mehr Blütenstände pro Anflug als andere Arten. Ein Individuum hatte dort höchstwahrscheinlich (pers. Beobachtung) sein Territorium, verteidigte dieses gegen andere Arten und war deshalb längere Zeit dort anzutreffen. Dadurch konnte dieses Individuum ungestört mehrere Blütenstände während eines Anflugs besuchen. Areal B wurde signifikant am häufigsten von Amazilia tzacatl besucht. Auch dies könnte möglicherweise auf ein Territorium in der Nähe des Areals zurückgeführt werden. 9 Danksagung: Einen herzlichen Dank an die mitgereisten Professoren Harald Krenn, Walter Hödl und Werner „Walter“ Huber, die uns mit Rat und Tat zur Seite standen. Bei der Ausführung des Berichts wurden wir von Claudia Wascher und Benjamin (in Costa Rica) unterstützt – Danke! Literaturverzeichnis: Huber, W., Weissenhofer, A., 2007. Hummingbirds and their Interactions with plants. In: Sauberer, M., Tebb, G., Huber, W. & Weissenhofer, A. (eds) 2007. The Birds of the Golfo Dulce Region Costa Rica. Verein zur Förderung der Tropenstation La Gamba, Vienna, pp. 5253. Kastinger, Ch., 2005. Bestäubungsbiologie der Columnea- Arten (Gesneriaceae) im Piedras Blancas Nationalpark, Costa Rica, Wien. Poley, D., 1994. Kolibris. 3. Auflage. Die Neue Brehm- Bücherei Bd. 484, Westarp Wissenschaften, Magdeburg, pp. 53 ff. Stiles, F.G., & Skutch, A.F., 1989. A Guide to the Birds of Costa Rica. 1.Auflage. B&T Verlag, Ort, pp. 208 ff. 10 Tagfalterfauna Costa Ricas Hufnagl Silvia 1.) Systematik Fam. Papilionidae (Ritterfalter) Papilionidae erkennt man an ihren auffallend großen Flügeln; viele Arten tragen Schwanzanhänge an den Hinterflügeln. Fam. Pieridae (Weißlinge) Die für diese Familie charakteristische helle Färbung erhalten sie durch das in den Schuppen abgelagerte Stoffwechselabbauprodukt Guanin. Fam. Riodinidae (Würfelfalter) sitzen meist auf der Blattunterseite mit ausgebreiteten Flügeln. Der Großteil der Arten lebt im Wald, einige Arten sind in Höhenlagen über 1400m vorzufinden. Fam. Lycaenidae (Bläulinge) Gruppe Zipfelfalter: haben Schwanzanhänge auf den Hinterflügelrändern und leuchtende Augenflecken, die am Hinterende einen “Kopf” vortäuschen und so Angreifer von der wirklichen Kopfpartie ablenken. Fam. Nymphalidae (Fleckenfalter) Bei allen Nymphalidae ist das erste Beinpaar zu bürstenartigen Putzbeinen umgewandelt, nur die letzten beiden Beinpaare haben Lauffunktion. 2.) Artenzahlen von Tagfalterfamilien, Vergleich Österreich, Costa Rica und andere tropische Länder Die Abbildung 1 weist auf den besonders hohen Artenreichtum an Tagfaltern in Costa Rica hin. Abbildung 1: Vergleich der Artenzahlen dreier Tagfalterfamilien in Ländern verschiedener Kontinente in Relation zur Landesfläche. Fam. Papilionidae Insgesamt sind zurzeit 551 Arten weltweit entdeckt. Die meisten Arten leben in den Tropen, in Ö ist die Familie aber nur mit fünf Arten vertreten. Fam. Nymphalidae Der Schwerpunkt der Biodiversität dieser Familie liegt in den Tropen Südamerikas. In Ö kommen nur 105 Arten, in ganz Europa 244 Arten und Unterarten vor. 3.) Biologie 3.1.) Eier Schmetterlingseier können sehr unterschiedlich in Form und Oberfläche sein. Weibchen legen die Eier zw. 11-13 Uhr ab. In Habitaten mit wenigen Sonnenstunden können die Eier jedoch zu jeder Tageszeit, in der Sonne vorhanden ist, ablegt werden. 3.2.) Raupen Nahrung Fast alle Schmetterlingsraupen sind herbivor, außer die der Lycaenidae (Raupen fressen z.B. Ameisenlarven). Die meisten Arten fressen nur ein paar nahe verwandte Pflanzenarten, wobei verwandte Schmetterlingsgruppen verwandte Pflanzentaxa fressen (hostplant relationship). Lebensweise Schmetterlingsraupen können gesellig oder solitär leben. Solitäre Raupen nutzen zur Abwehr Krypsis, Mimikry, giftige Chemikalien, Blatt- oder Seidenhäuser. Gesellige Raupen fressen in Gruppen, sind auffälliger gefärbt, weisen synchrone Häutungen auf und reagieren bei Gefahr als Einheit zur intensiveren Abwehr von Parasiten oder Predatoren. Häutungen Bei den meisten Schmetterlingsfamilien treten 5 Häutungen auf. Die Dauer des Larvalstadiums ist artabhängig und zwischen 10-60 Tagen. Besonderheiten • Fam. Papilionidae: Die Raupen besitzen zwischen dem Kopf und dem ersten Thorakalsegment eine Nackengabel (Osmaterium), die bei Gefahr ausgestülpt werden kann. Diese Nackengabel ist grell gefärbt und verströmt einen schlechten Geruch, der neben der optischen Abschreckung, Räubern und Parasiten den Appetit verderben soll. • Fam. Riodinidae und Fam. Lycaenidae: Die Raupen leben myrmekophil. Das heißt, dass sie gemeinsam mit Ameisen in deren Bau leben und sich entweder von deren Larven ernähren oder von den Ameisen gefüttert werden. Die meisten Raupen haben sich im Laufe der Zeit an das Leben mit Ameisen angepasst und besitzen neben speziellen Drüsen die Honigtau aussondern z.B. den gleichen Geruch wie die Ameisenlarven. Einige Arten haben zum Schutz vor Ameisenbissen eine verdickte Cuticula, einen unter den Prothorakalschild zurückziehbaren Kopf und/oder eine starke Behaarung. 3.3.) Puppen Jede Schmetterlingsgruppe hat eine charakteristische Puppenform und Art der Verpuppung, die bei der Klassifikation der Schmetterlinge hilfreich ist: Puppen von Papilionidae und Pieridae hängen mit dem Kopf nach oben; bei Nymphalidae ist der Kopf nach unten gerichtet. Wenn der Schmetterling voll entwickelt ist ändert sich die Farbe der Puppe und der Schmetterling schlüpft 1-2 Tage später. Dauer des Puppenstadiums: 1 Woche - über 1 Monat. 3.4.) Imago Geschlechtsdimorphismus Bei den meisten Arten, wo Männchen und Weibchen gleich aussehen, ist das Weibchen größer, die Vorderflügelspitze ist runder und die Färbung nicht so kräftig. sek. Geschlechtsmerkmale (Androkonien) Bei vielen Arten haben die Männchen und manchmal auch die Weibchen sekundäre Geschlechtsmerkmale, wie z.B.: • Duftschuppen sind Schuppen, die einen Sexuallockstoff freisetzen, sich meist auf den Vorderflügeln befinden und dunkler oder mehliger wirken als die umgebenden Schuppen. Diese kommen bei Pieridae und vielen Nymphalidae vor. • Büschel sind auf den Hinterflügeln von Nymphalidae zu finden und werden während der Balz aufgerichtet. • Falten sind am Innenrand der Hinterflügel bei Papilionidae vorhanden und bestehen oft aus weißen Schuppen, die beim Öffnen des Hinterflügels zum Vorschein kommen. • Haarpinsel sind abdominale Duftorgane (Duft auch für Menschen wahrnehmbar) aus Büschel von Haaren, die von der Costa der Hinterflügel abstehen. Nahrung Die Nahrung der Tagfalter reicht von Nektar, Pollen, Saft von verfaulenden Früchten über Wasser und Urin bis hin zu Aas oder Kot. Blumen, die von Schmetterlingen besucht werden, sind meist rot. • Männchen der Papilionidae und Pieridae: besuchen Sand, der durch Wasser oder Urin nass ist oder trinken aus Pfützen, um Natriumsalze zu gewinnen - möglicherweise als notwendiger Nährstoff oder als Vorläufer in ihrer Biosynthese von Sexualhormonen. • Männchen der U- Fam. Danainae (Fam. Nymphalidae): sammeln Pflanzensäfte und Nektar von Hundsgiftgewächsen (Apocynaceae) um Pyrrolizidin- Alkaloide aufzunehmen. Sie nutzen diese Gifte für die Verteidigung gegen Fressfeinde oder als Vorläufer in ihrer Biosynthese um Sexuallockstoffe herzustellen. 4.) Habitate Costa Rica kann aufgrund seines Klimas und seiner Topographie in 6 Zonen unterteilt werden, die sich durch ihre charakteristische Fauna voneinander unterscheiden: • Pacific Lowland Deciduous Forest • Pacific Lowland Evergreen Forest • Pacific Mid-Elevation • High-Elevation Pacific and Atlantic • Atlantic Lowland • Atlantic Mid-Elevation Im Folgenden wird jedoch nur auf die drei Zonen der Pazifikküste (das sind jene Zonen in die uns unsere Exkursion führt) eingegangen. Die Pazifikküste weist eine ausgeprägte Saisonalität (Regenfälle von Mai- Oktober) auf. Die Saison bestimmt wann Pflanzen wachsen, blühen oder Früchte tragen und damit einhergehende Fluktuationen von Insektenpopulationen. In allen Habitaten sind Juni und Juli die Monate höchster Dichte an Imagos. Abbildung 2: Vergleich der Schmetterlingsdiversität in den 6 Zonen Costa Ricas. 4.1.) Pacific Lowland Deciduous Forest Beinhaltet tropisch trockene und feuchte Zonen bis 600m Seehöhe, weshalb es zu einer stark ausgeprägten Saisonalität und damit zu einer offensichtlichen Fluktuation von Arten kommt (Die anderen Zonen sind feuchter, weshalb Saisonalität und Fluktuationen nicht so stark ausgeprägt sind). In der Trockenzeit ist die Vegetation laubwerfend und die Schmetterlingsvielfalt stark reduziert. Eine große Schmetterlingsvielfalt tritt vier Wochen nach den ersten Regenfällen auf. Mit Fortschreiten der Regenzeit ist ein schneller Wechsel in der Artenzusammensetzung bemerkbar. Arten die mit hohen Niederschlägen pro Jahr assoziert werden und die die Trockenzeit nicht aushalten weisen eine geringe Diversität in dieser Zone auf (siehe Abb.2). 4.2.) Pacific Lowland Evergreen Forest Beinhaltet tropisch feuchte sowie tropisch und prämontan nasse Zonen bis 800m Seehöhe. Diese Zone hat zwar eine Trockenzeit, trocknet aber nie komplett aus und beinhaltet Arten mit ausgeprägter Mimikry sowie endemische Arten. 4.3.) Pacific Mid- Elevation Beinhaltet tropisch und niedermontan feuchte sowie niedermontan und prämontan nasse Zonen in 700- 1 600m Seehöhe sowie komplexe Mikrohabitate und Habitate. Relativ trockene Gebiete stellen einen Korridor zwischen der Pazifik- und Atlantikküste dar, in dem eine Mischung aus atlantischen und pazifischen Arten vorkommt. Außerdem kommen eine Mischung aus Arten der niederen und hohen Höhenlagen und viele endemische Arten vor, weshalb diese Zone sehr artenreich ist. 5.) Literaturverzeichnis • Carter, D. (2002) Schmetterlinge, Naturbibliothek, Dorling Kindersley Verlag GmbH, Starnberg, deutschsprachige Ausgabe 2006 • DeVries, P.J. (1983) Checklist of Butterflies in Janzen, D.H. (ed.) Costa Rican Natural History, The University of Chicago Press • DeVries, P.J. (1987) The Butterflies of Costa Rica and their Natural History • Krenn, H.W. (2006) Biodiversität neotropischer Tagfalter und die Vielfalt ihrer Nahrung in Borsdorf, A. & Hödl, W. (Hg.) Naturraum Lateinamerika, Jahrbuch des österreichischen Lateinamerika- Instituts, ¡Atención! Lit Verlag, Wien • Krenn, H.W. (2007) Pollen Feeding in Butterflies: Evolution of a New Mechanism of Nutrient Extraction, unveröffentlichtes Manuskript • http://www.wikipedia.org • http://www.tolweb.org/tree • http://www.butterflycorner.net • http://www.lepiforum.de Heliconius-Falter Demetz Agnes 1.) Allgemeine Informationen zur Gattung Heliconius Die Heliconius-Falter gehören zur Familie der Nymphalidae. Alle Falter sind giftig. Sie synthetisieren Cyanverbindungen aus Aminosäuren, die sie aus Pollen extrahieren. Auf ihre Giftigkeit weisen auch ihre prächtigen und kräftigen Farbmuster hin. Bei den Heliconius-Faltern treten viele verschiedene geographische Rassen mit Mimikry auf. Weiters zeichnen sich die Falter durch relativ große Gehirne mit besonders vergrößertem Lernzentrum aus. Dadurch lässt sich auch ihr sehr gutes Erinnerungsvermögen und die Tatsache, dass man sie kaum zwei Mal am selben Ort fangen kann, erklären. Als Futterpflanzen für die Raupen dienen Passionsblumen (Gattung: Passiflora). Eine wichtige Besonderheit der Heliconius-Falter ist ihre Fähigkeit des „Pollenfressens“. Weibchen sammeln weit mehr Pollen als Männchen, da sie die daraus gewonnene Energie für die Eiproduktion benötigen. Heliconius-Weibchen legen nämlich ihr ganzes Leben Eier, und nicht, wie die meisten anderen Tagfalter nur kurz vor ihrem Tod. Die Larval- bzw. Raupenentwicklung erfolgt bei den Faltern äußerst rasch. Sie ist nach rund zwei Wochen abgeschlossen und es folgt die Verpuppung. Die Falter können sich dieses verkürzte Raupenstadium deshalb leisten, weil sie auch als Adulttiere Proteine und Aminosäuren aus Pollen aufnehmen können. Andere Falter zehren ihr ganzes Leben von den Proteinressourcen, die sie sich als Raupen angelegt haben. Eine weitere Folgeerscheinung des Pollenfressens ist ihre lange Lebenserwartung. Der Rekord eines frei lebenden Heliconius-Falters liegt bei neun Monaten. Dies ist 25 Mal länger als normale Schmetterlinge leben können. Ein weiterer interessanter Aspekt der Falter ist das so genannte „pupal-mating behaviour“. Dieses wurde bei den Arten Heliconius erato und H. sapho beschrieben. Hierbei verpaaren sich die Männchen mit den Weibchen entweder während sie noch verpuppt sind oder kurz nach beziehungsweise während des Schlüpfens. Die Männchen werden hierbei durch, vom Weibchen ausgesandte, Pheromone angelockt. 2.) Pollenfressen Pollenfressen ist bisher nur bei Tagfaltern der Gattungen Heliconius und Laparus bekannt. Das Pollenfressen funktioniert folgendermaßen: • Der Pollen wird am Rüssel gesammelt. • Von der Rüsselspitze wird eine Flüssigkeit auf den Pollen abgegeben. • Durch Ein- und Ausrollen des Rüssels wird an dessen Basis ein feuchter Pollenklumpen gebildet. • Dieser Klumpen wird stundenlang geknetet. • Durch das Kneten werden Proteine und Aminosäuren extrahiert. • Diese werden vom Schmetterling aufgesaugt. • Die Pollen bleiben also außerhalb des Körpers. • Pollen fällt nach einiger Zeit vom Rüssel ab. Die Morphologie des Rüssels unterscheidet sich zu denen anderer nicht-pollenfressender Tagfalter folgendermaßen, dass die borstenförmigen Sensilla trichodea, die von der Basis des Rüssels bis zu seiner Mitte vorkommen, verlängert und in größerer Zahl vorhanden sind. Die Sensilla styloconica, die vor allem an der Rüsselspitze vorkommen, sind im Gegensatz zu anderen Faltern kleiner und in geringerer Anzahl vorhanden. Man kann somit sagen, dass für das Pollenfressen vorhandene Strukturen modifiziert wurden und es zu keinen Neubildungen kam! Die Stelle an der die Borstensensillen am Rüssel vorhanden sind ist exakt die Stelle, an der der Pollenklumpen gebildet wird beziehungsweise hängen bleibt. 3.) Mimikry Grundsätzlich unterscheidet man zwei Formen von Mimikry: • Bates´sche Mimikry • Müller´sche Mimikry Von Bates´scher Mimikry spricht man, wenn giftige Tiere von ungiftigen imitiert werden. Diese Art der Mimikry kann nur so lange funktionieren, so lange der Nachahmer seltener ist als der Modellorganismus. Ist nämlich der Nachahmer häufiger, werden diese häufiger von Prädatoren gefressen und somit bietet zum Beispiel die Warnfärbung keinen Schutz mehr. Müller´sche Mimikry bedeutet, dass verschiedene giftige Arten gleich aussehen. Somit wird dem Prädator ein bestimmtes Farbmuster angelernt, das er in der Folge meiden wird. Bei Heliconius-Faltern gibt es viele verschiedene geographische Rassen (Farbmorphen). Hierbei fällt auf, dass Rassen verschiedener Arten, die in der gleichen geographischen Region beheimatet sind, fast identisch aussehen. Da alle Heliconius-Arten giftig sind, ist dies ein klarer Fall von Müller´scher Mimikry. Weiters gibt es auch noch so genannte „mimicry rings“. Davon spricht man, wenn in einer Region sowohl giftige als auch ungiftige Falter mehr oder weniger gleich aussehen. Die ungiftigen Falter imitieren somit die giftigen. Demnach spricht man in diesem Fall von Bates´scher Mimikry. 4.) Passionsblumen (Passiflora sp.) Die Passionsblumen sind eine Pflanzengruppe, die sich mit Cyanverbindungen vor potenziellen Fressfeinden schützen. Dies funktioniert auch weitläufig. Nur die HeliconiusFalter sind gegen dieses Gift immun. Somit haben sich die Passionsblumen im Laufe einer Koevolution mit den Faltern einige Tricks zur Abwehr dieser einfallen lassen. 4.1.) Scheineier Bei einigen Passiflora-Arten fallen knallgelbe Strukturen auf den Blättern oder Blattstielen auf, die stark an Heliconius-Eier erinnern. Bei diesen Strukturen handelt es sich um so genannte Scheineier. Um deren Funktion zu erläutern, sei zunächst erwähnt, dass manche Heliconius-Arten kannibalische Raupen haben. Um ihre Nachkommen nicht zu gefährden legen diese Arten ihre Eier einzeln ab. Es werden also Pflanzen gemieden, auf denen sich bereits Eier befinden. Die Falter erkennen die Eier vor allem optisch. Dies ist auch leicht möglich, da die einzelnen Eier knallgelb sind und meist an den Triebspitzen abgelegt werden, wo sie leicht sichtbar sind. Somit fungieren diese Scheineier als eine Art Besetztzeichen. Bisher hat man bei rund 2% der 500 Passiflora-Arten Scheineier entdeckt. 4.2.) Extraflorale Nektarien Auch diese dienen als Schutz vor Heliconius-Eiern und –Raupen. Aufgrund der extrafloralen Nektarien werden Ameisen und Wespen angelockt, die Eier und Raupen von den Blättern entfernen. 4.3.) Antiei-Maßnahme Bei Passiflora ambigua wurde festgestellt, dass sie die Nebenblätter sehr rasch nach dem Sprießen wieder abwerfen. Dadurch werden auch Eier, die auf diesen abgelegt wurden, mit abgeworfen. 4.4.) Antiraupen-Maßnahme Die Blätter von Passiflora adenopoda sind mit feinen, hakigen Pflanzenhaaren übersäht. Wenn Raupen über diese Blätter krabbeln wollen, bleiben sie an diesen Haken hängen und werden durchlöchert. 5.) Literatur • Eberhard, S.H. & Krenn, H.W. (2003) „Pollen als Nahrung: Schlüssel für ökologische Besonderheiten der Heliconius-Falter“, Verh. Westd. Entom. Tag 2001, S.97-102, Löbbecke-Mus., Düsseldorf • Estrada, C. & Jiggins, C.D. (2002) „Patterns of pollen feeding and habitat preference among Heliconius species“, Ecological Entomology, 27, S.448-456 • Gilbert, L.E. (1982) „Koevolution: Wie ein Falter seine Wirtspflanzen formt“, Spektrum der Wissenschaft, Okt. 1982, S.72-82 • Murawski, D.A. (1993) „Passion vine butterflies: A taste for poison“, National Geographic, Vol.184, No.6, Dec. 1993, S.123-137 • http://www.tolweb.org/tree?group=Heliconius&contgroup=Heliconiini Pollen als Nahrung bei Heliconius Falter Buchegger Tina 1.) Aufgaben Da wir nicht alle Heliconius Falter beobachten können, spezialisieren wir uns auf eine Pflanze, nämlich Psychotria. da diese wahrscheinlich von Heliconidae bevorzugt wird. Sie wächst an den unterschiedlichsten Standorten rund um die Tropenstation La Gamba. Bei Psychotria gibt es die verschiedensten Arten. Viele davon sind giftig und werden daher als Bestandteil für Drogen oder Medikamente genutzt. Bei uns handelt es sich um Psychotria elata, sie trägt rote Blüten. Angeblich blüht diese Pflanze gleichmäßig über das ganze Jahr, daher ist sie für unsere Beobachtungen bestens geeignet. Wir werden beobachten, wie lange die Heliconius Falter auf der Blüte verharren und Pollen sammeln, dazu verwenden wir zwei Stoppuhren. Mit einer wird die Gesamtzeit gemessen, die der Falter von Blüte zu Blüte fliegt und auf diesen verharrt, mit der anderen die Zeit der Nahrungsaufnahme. Wir beobachten die Schmetterlinge auf der einen Seite der Pflanze und nehmen ihnen auf der anderen Seite die Pollenpakete ab. Wie bereits zuvor erwähnt, kehren die Falter nicht an Orte zurück, an denen sie gefangen wurden. Somit ist diese Aufteilung notwendig. Um an den Pollen heranzukommen, werden die Schmetterlinge mit einem Netz gefangen. Mit Hilfe einer Präpariernadel werden ihnen die Pollenpakete abgenommen. Danach werden die Heliconius Falter mit Lackstift markiert (wahrscheinlich nummeriert) und wieder freigelassen. Dies geschieht mehrmals am Tag, weil wir die unterschiedliche Struktur der Pollenladungen von Vormittag und Nachmittag vergleichen wollen. Zu Vergleichszwecken werden auch von den Blüten Pollenproben genommen. Aus der Pollenladung wird dann sofort ein Präparat angefertigt, um die Pollenstruktur nicht zu verändern. So gut wie möglich werden diese in der Station mit einem eigenen Schlüssel bzw. dem Pollenatlas, aber auch mit der Pollendatenbank bestimmt. Bei unseren Beobachtungen konzentrieren wir uns auf 6 Arten: H. pachinus: Auf der Pazifikseite Costa Ricas und im Westen Panamas endemisch. Er ist leicht mit H. hewitsoni zu verwechseln. Adult: schwarz mit breiten, gelben Streifen. H. hecale: Die Eier werden von Ameisen angegriffen, weil sie durch süßes Wasser angelockt werden. Flügel dunkelorange und schwarz mit weißen oder gelben Flecken. H. sara: ist eine bunte Art, die Flügeloberfläche hat einen mittel großen blau-schwarz metallischen Fleck, der durch zwei weiße Bänder eingerahmt ist. Die Gesamtflügelspannweite beträgt ca. 55-60mm. H. melpomene: ist eine weit verbreitete neotropische Art, bekannt für ihre geografisch uneinheitlichen Farbmuster. Sie meiden direktes Sonnenlicht. H. hewitsoni: kann man leicht mit H. pachinus verwechseln. Beide haben ein gelbes Band auf der Flügeloberseite und rote Streifen auf der Unterseite. Diese befinden sich jedoch bei H. pachinus an einer anderen Stelle! H. charitonius: (Zebrafalter) ist eine sehr weit verbreitete Art. Sie kommt vom Süden der USA bis nach Südamerika und auf den Antillen vor. Die ins Auge stechende schwarz-gelbe Zebrastreifung auf der Oberfläche ist kennzeichnend für diese Art. Unterseite: rote Punkte an den Flügelansätzen, sonst ähnlich der Oberseite gemustert. 2.) Ziele Wir wollen herausfinden, wie groß das Pollenspektrum ist. Außerdem sehen wir uns die Strukturunterschiede der Pollenpakete von Vormittag und Nachmittag bzw. Rüssel und Blüte genau an. Unsere Beobachtungen sollen Aufschluss geben, ob Psychotria bevorzugt wird und wie die Handlingzeiten aussehen. Pollen als Nahrung der Heliconius-Schmetterlinge Abschlussbericht zur tropenbiologischen Exkursion mit Projektpraktikum in Costa Rica SS 2007 Tina Buchegger 0302166, A437, [email protected] Agnes Demetz 0303109, A439, [email protected] Silvia Hufnagl 0100070, A439, [email protected] Abstract Pollen feeding has only occurred once in the evolutionary development of butterflies. The only two genera that use this strategy are Heliconius and Laparus (Nymphalidae). Through coiling and uncoiling the proboscis they extract amino acids and proteins out of the pollen. We investigated if the structure of the collected pollen changes during the day due to this extraction process. Pollen was taken from the proboscis and preparations were made. Later, pollen was determined and the percentual ratio of intact pollen was calculated. The output showed a significant difference between morning and afternoon for Psiguria and Psychotria preparates. Thus, pollen structure changed during processing. On the other hand, there was no significant difference found in Lantana and Tournefortia. The reason for this may is that the different stages of pollen were not easy to distinguish. keywords: Heliconius, pollen feeding, Psiguria, Psychotria, Lantana, Tournefortia. 1). Einleitung Heliconius-Falter gehören zur Familie der Nymphalidae. Diese Familie zeichnet sich dadurch aus, dass das erste Beinpaar zu so genannten Putzbeinen reduziert ist. Alle Heliconius-Falter sind giftig, da sie Cyanverbindungen aus Aminosäuren synthetisieren, welche sie aus Pollen zuvor extrahieren. Auf ihre Giftigkeit weisen ihre prächtigen und kräftigen Farbmuster hin (Estrada & Jiggins, 2002). Ihre Berühmtheit erlangten Heliconius-Falter dadurch, dass sie befähigt sind Pollen zu „fressen“. Dies ist nur bei Tagfaltern der Gattungen Heliconius und Laparus bekannt (Eberhard & Krenn, 2001). Das „Pollenfressen“ erfolgt folgendermaßen: Der Pollen wird am Rüssel gesammelt und mit Flüssigkeit, die von der Rüsselspitze abgegeben wird, vermengt. Durch Ein- und Ausrollen des Rüssels bildet sich an dessen Basis ein feuchter Pollenklumpen. Dieser wird stundenlang geknetet, wodurch Proteine und Aminosäuren extrahiert und in der Folge vom Falter aufgesaugt werden. Die Pollen bleiben also während des „Pollenfressens“ außerhalb des Körpers. Nach einiger Zeit fällt der bearbeitete Pollenklumpen vom Rüssel ab (Murawski, 1993). 2 Die Morphologie des Rüssels unterscheidet sich zu denen anderer nichtpollenfressender Tagfalter folgendermaßen, dass die borstenförmigen Sensilla trichodea, die von der Basis des Rüssels bis zu seiner Mitte vorkommen, verlängert und in größerer Zahl vorhanden sind. Die Sensilla styloconica, die vor allem an der Rüsselspitze vorkommen, sind kleiner und in geringerer Anzahl vorhanden. Man kann somit sagen, dass für das Pollenfressen vorhandene Strukturen modifiziert wurden und es zu keinen Neubildungen kam. Die Stelle an der die Borstensensillen am Rüssel vorhanden sind, ist exakt die Stelle, an der der Pollenklumpen gebildet wird beziehungsweise hängen bleibt (Eberhard & Krenn, 2001). Aufgrund des „Pollenfressens“ haben die Falter eine sehr lange Lebenserwartung. Der Rekord eines frei lebenden Heliconius-Falters liegt bei neun Monaten; also bis zu 25 Mal länger als normale Schmetterlinge. Weibchen sammeln weit mehr Pollen als Männchen, da sie die daraus gewonnene Energie für die Eiproduktion benötigen. Im Gegensatz zu anderen Tagfaltern legen Heliconius-Falter ihr ganzes Leben lang Eier und nicht nur kurz vor ihrem Tod. Die Larval- bzw. Raupenentwicklung erfolgt bei den Faltern äußerst rasch. Sie ist nach rund zwei Wochen abgeschlossen und es erfolgt die Verpuppung. Die Falter können sich dieses verkürzte Raupenstadium deshalb leisten, weil sie auch als Adulttiere Proteine und Aminosäuren aus Pollen aufnehmen können. Andere Falter zehren ihr ganzes Leben an den Proteinressourcen, die sie sich als Raupen angelegt haben (Murawski, 1993). Wir wollten nun in der Tropenstation La Gamba im SW Costa Ricas herausfinden, ob sich der Zustand des Pollens am Rüssel der Heliconius-Falter im Laufe des Tages verändert. Weiters wollten wir die Zusammensetzung des Pollenpaketes feststellen. 2.) Material und Methoden 2.1.) Versuchstiere Heliconius-Falter wurden rund um die Tropenstation La Gamba im Nationalpark Piedras Blancas in Costa Rica gefangen. Mit Hilfe des Bestimmungsbuches „The Butterflies of Costa Rica and their Natural History“ von DeVries (1987) konnte zwischen H. erato, H. melpomene, H. doris, H. sara, H. pachinus, H. hewitsoni und 3 H. hecale (siehe Abb.1-7) unterschieden werden. Insgesamt wurde 19 Stunden lang an sieben Tagen zwischen 8-16h (wenn regenfrei) - versucht Falter zu finden und zu fangen. Es konnten 34 Schmetterlinge gefangen werden. Drei davon wurden ein zweites Mal an der selben Stelle wiedergefangen. Abb.1: H. erato Abb.2: H. melpomene Abb.3: H. doris Abb.4: H. sara Abb.7: H. hecale Abb.4: H. sara Abb.5: H. H. pachinus pachinus Abb.5: Abb.6: H. hewitsoni 2.2.) Anfertigen der Präparate Zuerst wurden die Tiere mit Hilfe eines Schmetterlingsnetzes eingefangen, an der Costa gehalten und mit einer Präpariernadel der Pollen vom Rüssel des Schmetterlings abgenommen (siehe Abb.8). Dieser wurde daraufhin auf einem Objektträger mit einem Tropfen Glycerin abgestreift. Auch bei Heliconius- Faltern, die scheinbar keinen Pollen am Rüssel hatten, wurde versucht ein Präparat anzufertigen. Bei der späteren Auswertung der Präparate stellte sich jedoch heraus, dass auch diese ausreichend Pollen aufwiesen, um in die Auswertung miteinbezogen werden zu können. Abschließend wurden die Schmetterlinge durchlaufend auf der Unterseite des Vorderoder Hinterflügels an einer hellen Stelle nummeriert (siehe Abb.9) und freigelassen. Die angefertigten Präparate wurden mit einem Deckglas versehen und beschriftet (Artname, Datum, Uhrzeit, Fangort und Nummer des Falters). Zuletzt wurden die Deckgläser mit Nagellack auf den Objektträgern fixiert. Es konnten insgesamt 37 Präparate wie beschrieben angefertigt werden. 4 Abb.8: Abnahme des Pollens mit einer Präpariernadel vom Rüssel des Heliconius- Falters Abb.9: Nummerierung von H. sara auf der Unterseite des Hinterflügels 2.3.) Auszählen der Präparate Mit einem Nikon Eclipse 100 Mikroskop wurden in der Folge die Präparate auf Pollen von Gurania/Psiguria (Cucurbitaceae), Psychotria (Brechwurzel; Rubiaceae, siehe Abb.10), Lantana (Wandelröschen; Verbenaceae, siehe Abb.11) und Tournefortia (Boraginaceae) untersucht. Es konnten drei Stadien in der Verarbeitung des Pollens unterschieden werden: Als Stadium 1 wurden unveränderte, d.h.: intakte, geschlossene Pollen mit homogenem Inhalt, gewertet. Pollen des Stadiums 2 waren verändert, d.h.: geöffnet und mit inhomogenem Inhalt. Stadium 3 zeichnete sich durch stark veränderte, d.h.: verbeulte, offene Pollen mit ausgetretenem Inhalt, aus. Die Pollen wurden den unterschiedlichen Stadien zugeordnet und ausgezählt. Übersichtsfotos der einzelnen Präparate sowie Fotos der Pollen in den genannten Stadien wurden angefertigt (siehe Abb.12-20). Abb.10: Psychotria Abb.11: Lantana 5 Abb.12-14: Pollen von Gurania/Psiguria, Stadium 1-3 (Pollendurchmesser: 95µm) Abb.15-17: Pollen von Psychotria, Stadium 1-3 (Pollendurchmesser: 115µm) Abb.18-20: Pollen von Lantana und von Tournefortia, Stadium 1 (Pollendurchmesser: 30µm und 22µm) sowie Übersichtsfoto eines Präparates 2.4.) Auswertung Für die Auswertung wurde zwischen Vormittags- (8-11h, 27 Präparate) und Nachmittagspräparaten (11-16h, 10 Präparate) unterschieden. Zusätzlich wurden Daten vom Februar 2007 herangezogen (2 Vormittags- und 11 Nachmittagspräparate), um einen annähernd gleichmäßig verteilten Stichprobenumfang zu erzielen. Es wurden maximal die ersten 100 Pollen einer Pflanzenart ausgezählt und anschließend die prozentuelle Verteilung der drei Stadien errechnet. Da eine Unterschiedung zwischen Stadium 2 und 3 - vorallem bei Lantana und Tournefortia schwierig war, wurden diese beiden Stadien zusammengefasst. Nicht jedes Präparat enthielt Pollen von den vier Pflanzenarten auf die wir unser Hauptaugenmerk legten. 6 In diesem Fall wurde deren Verteilung mit 0% bewertet und nicht in die Auswertung mit einbezogen. Außerdem wurden nur Präparate gewertet, die mindestens zehn Pollenkörner der jeweiligen Pollenart enthielten. Die statistische Auswertung erfolgte mit Hilfe von SPSS 11.5. Dabei wurde nur der prozentuelle Anteil an intakten Pollen jeder Pflanze berücksichtigt und Unterschiede in diesen zwischen Vor- und Nachmittag mit Hilfe des Mann-Whitney-U-Tests geprüft. Die Anfertigung der dazugehörigen Abbildungen erfolgte durch die Verwendung des Mittelwertes des prozentuellen Anteils an intakten Pollen von Vormittags- und Nachmittagspräparaten. 3.) Ergebnisse 100% 80% 60% 40% 20% relativer Anteil der Pollenstadien (%) Uhrzeit Psiguria 1 14:00-15:00 Psiguria 2+3 Tournefortia 2+3 Tounefortia 1 Lantana 2+3 Lantana 1 11:00-12:00 Psychotria 1 08:00-09:00 Psychotria 2+3 0% Pollenart und -stadium Abb.21: 3D-Übersicht über den relativen prozentuellen Anteil der Pollenstadien und ihrer zeitlichen Verteilung im Tagesverlauf. 7 Uhrzeit Abb.22: 2D-Übersicht über den relativen prozentuellen Anteil der Pollenstadien und ihrer zeitlichen Verteilung im Tagesverlauf zur besseren Veranschaulichung von Abb.21 Den Abbildungen 21 und 22 kann man entnehmen, dass die Anzahl der intakten Pollen im Laufe des Tages deutlich abnehmen. Bei Psiguria, Psychotria und Lantana nimmt das Stadium 1 ab, Stadium 2+3 nehmen zu. Tournefortia-Pollen wurden nur in den Vormittagsproben gefunden. 3.1.) Psiguria 80% * 70% 60% 50% 40% 30% 20% 10% 0% V ormittag Nachmittag Abb.23: Vergleich von Vormittag und Nachmittag an intakten Pollen (Stadium 1) von Psiguria 8 Es bestand ein signifikanter Unterschied zwischen Vormittags- und Nachmittagspräparaten bei Psiguria (U-Test, p= 0,034; n= 3/4). Am Nachmittag sind bei Psiguria nur mehr ein Drittel der gesammelten Pollen intakt. 3.2.) Psychotria 45% 40% * 35% 30% 25% 20% 15% 10% 5% 0% Vormittag Nachmittag Abb.24: Vergleich von Vormittag und Nachmittag an intakten Pollen (Stadium 1) von Psychotria Auch bei Psychotria bestand ein signifikanter Unterschied zwischen Vormittags- und Nachmittagspräparaten (U-Test, p= 0,025; n= 3/5). Nach 11h findet man nur mehr die Hälfte der gesammelten Pollen im intakten Zustand. 3.3) Lantana 90% 80% 70% 60% 50% 40% 30% 20% 10% 0% Vormittag Nachmittag Abb.25: Vergleich von Vormittag und Nachmittag von intakten Pollen (Stadium 1) von Lantana 9 Bei Lantana besteht kein signifikanter Unterschied der Pollenstadien im Tagesverlauf (U-Test, p= 0,285; n=3/4). 3.4) Tournefortia 100% 95% 90% 85% 80% 75% 70% Vormittag Nachmittag Abb.26: Vergleich von Vormittag und Nachmittag von intakten Pollen (Stadium 1) von Tournefortia Auch bei Tournefortia-Pollen wurde kein signifikanter Unterschied der Pollenstadien im Laufe des Tages festgestellt (U-Test; p= 0,18; n= 3/1). 4.) Diskussion Es konnten 37 Schmetterlinge gefangen werden- drei davon wurden ein zweites Mal an der selben Stelle wiedergefangen. Laut Literatur (Mallet & Singer, 1987) haben Adulttiere eine sehr gute Erinnerung und vermeiden es einige Tage an eine Stelle zurück zu kehren an der sie zuvor gefangen wurden. Dadurch, dass es sich bei unserem bevorzugten Fangort wahrscheinlich um die einzige größere Ansammlung von Lantana handelte, scheinen die Tiere möglicherweise keine andere Wahl gehabt zu haben, als immer wieder hierhin zu fliegen. Bei Psiguria und Psychotira konnte eine Abnahme des prozentuellen Anteils an intakten Pollen in Laufe des Tages festgestellt werden. Dies lässt vermuten, dass sich die Struktur der Pollenkörner durch das Ein- und Ausrollen des Rüssels verändert. 10 Aufgrund des geringen Durchmessers von Lantana- und Tournefortia- Pollen (30µm bzw. 20µm) war eine Unterscheidung der drei Stadien kaum möglich. Die Vermutung besteht, dass daher kein signifikanter Unterschied zwischen Vormittag und Nachmittag im Anteil an intakten Pollen - im Gegensatz zu Psiguria und Psychotria festgestellt werden konnte. Abschließend ist zu erwähnen, dass die geringe Stichprobengröße am Nachmittag auf die Regenzeit (Regenbeginn meist um 14h) zurückzuführen ist. Folgedessen wurden auch Daten aus dem Februar herangezogen und die Trennung zwischen Vormittag und Nachmittag erfolgte um 11h, um eine gleichmäßige Verteilung des Stichprobenumfangs zu gewährleisten. 5.) Literaturverzeichnis DeVries, P.J., 1987. The Butterflies of Costa Rica and their Natural History, vol. 1. Princeton Univ. Press, Princeton. Eberhard, S.H. & Krenn, H.W., 2001. Pollen als Nahrung: Schlüssel für ökologische Besonderheiten der Heliconius-Falter (Nymphalidae, Heliconiinae). Verh. Westd. Entom. Tag, 97-102. Estrada, C. & Jiggins, C. D., 2002. Patterns of pollen feeding and habitat preference among Heliconius species. Ecological Entomology 27, 448-456. Murawski, D.A., 1993. A Taste for Poison. National Geographic, vol. 184, No.6, Dec.1993, pp. 123-137. Mallet, J. & Singer, M.C., 1987. Handling effects in Heliconius: where do all the butterflies go? J. Animal Ecology 56, 377-388. Roubik, D.W. & Moreno, J.E., 1991. Pollen and Spores of Barro Colorado Island. Missouri Botanical Garden, pp. 269. Zheludev, A., http://neutron.ornl.gov/~zhelud/cool/lepidoptera/moths.htm, 24.9.2007 (Abb.1-3 und 5-8) http://www.afftis.or.jp/konchu/chinki/morpho/morpho.html, 24.9.2007 (Abb.4) http://de.wikipedia.org, 24.9.2007 11 SYMBIOSE ZWISCHEN PSEUDOMYRMEX SP. UND ACACIA SP. Kerstin Olbrich ACACIA: In der Systematik findet man die Gattung der Acacia innerhalb der: → (Kl.) Rosopsida → (Fam.) Fabaceae → (UnterFam.) Mimosideae → (Gat.) Acacia Generelle Merkmale der Gattung Acacia: • • • • • • • Man findet sie hauptsächlich in Australien, aber auch in Amerika und Afrika sind sie verbreitet. Sie besitzen entweder einen strauch- oder baumförmigen Habitus. Ihre Blätter können paarig gefiedert oder in Form von Phyllodien (verbreiterter Blattstiel der die Funktion der Blattspreite übernimmt, wodurch diese oft stark reduziert ist) vorkommen. Die Blüten sind meist winzig, gelblich-weiß oder orange bis fast rot. Die Infloreszenzen sind kugelförmige oder zylindrische Ähren oder Köpfchen. Bei den Früchten handelt es sich um runde oder abgeflachte Hülsen, wobei manche Samen australischer Arten erst ein Buschfeuer benötigen um dann auskeimen zu können. Vor allem Pionierarten in den australischen Wüsten besitzen N-Knölchen an den Wurzeln, wodurch sie auch in Stickstoffarmen Böden keimen können. Einige Arten der Gattung Acacia besitzen Stipulardornen, die man in zwei Typen einteilen kann: o Typ A: Die Dornen sitzen auf langen Trieben und sind eher homogen gestaltet. o Typ B: Hier sitzen sie auf kurzen Trieben und sind morphologisch oft sehr verschieden gestaltet. Acaia allenii: Diese Akazienart ist in Costa Rica endemisch verbreitet und lebt mit Pseudomyrmex sp. in Symbiose. Sie ist eine der Arten, auf die sich die Experimente konzentrieren werden. Spezielle Merkmale: • • Sie haben einen baumförmigen Habitus und können zwischen 8 und 25 m hoch werden. Die meisten gefundenen Individuen im Piedras Blancas Nationalpark hatten jedoch eine Größe von max. 50 cm (Burger Sandra, 2003) Sie besitzen Stipulardornen (immer paarweise angeordnet da dicotyl – zum Teil stark sklerifiziert), die an der Basis stark angeschwollen sind. o Diese sogenannten Bullhörner stellen die Domatien der Ameisen dar. Kerstin Olbrich; 0403013, A 444 • Doppelt gefiederte Blätter: o Auf der Mittelrippe (Abb. 1), an der Basis der Blattstiele, befinden sich die EXTRAFLORALEN NEKTARIEN (EFN). Sie sind reich an Glucose und Fructose (aber keine Saccharose!). o An Spitze der Fiederblätter (Abb. 2) sitzen die BELT´SCHEN KÖRPERCHEN. Es sind kleine, gelbe, längliche Fortsätze mit sehr hohem Protein- und Lipidgehalt und außerdem die einzigen Proteinquellen der Ameisen. Abb. 1: extraflorale Nektarien PSEUDOMYRMEX: → Formicidae → Pseudomyrmecinae → Pseudomyrmex Abb. 2: Belt´sche Körperchen Morphologische Merkmale (Abb. 3): • • • Abb. 3: Pseudomyrmex sp. • • • Sie besitzen sehr große längliche Augen und sind daher auch sehr gut visuell orientiert. Ihr Postpetiolus ist gut ausgebildet und leicht erkennbar. Ihr Stachel besitzt ein Gift, dass auch für den Menschen sehr schmerzhaft ist. Sie haben relativ kleine Mandibeln. Die Antenne besteht aus12 Segmenten. Meist sind sie rotbraun bis dunkelbraun gefärbt. Eigenschaften: • • • • • Der Großteil der Pseudomyrmex sp. ist baumlebend, wobei sie aber nicht immer in Symbiose leben. Mit ihren riesigen Komplexaugen folgen sie jeder Bewegung und sind daher auch sehr agil und angriffslustig. Ein Ameisenstaat kann auf mehreren Akazien leben, aber auf einer Akazie sind auch mehrere Staaten möglich. Sowohl monogyne als auch polygyne Staaten sind möglich. Die Arten, die mit den Akazien in Symbiose leben, fehlt das Saccharose – Verdauungsenzym (Invertase), wodurch sie kaum Invertase-Aktivität zeigen. Daher besitzen die EFN´s der Acacia sp. keine Saccharose, wodurch sie wiederum für unspezialisierte Ameisen unattraktiv werden. Kerstin Olbrich; 0403013, A 444 PSEUDOMYRMEX SP. UND ACACIA SP. IN SYMBIOSE: Da es bei dieser Art des Zusammenlebens für beide Arten Vorteile gibt, handelt es sich hierbei um einen MUTUALISMUS! Vorteile für Pseudomyrmex sp.: • • • Domatien: solange die Dornen jung und grün sind, beißen die Ameisen eine apikale Öffnung hinein → die inneren Parenchymzellen werden von den Ameisen entfernt (teilweise sterben diese auch im adulten Zustand ab – AUTOLYSE) Nahrung: o Der extrafloraler Nektar stellt das Grundnahrungsmittel der adulten Tiere dar. o Die Belt`sche Körperchen sind hauptsächlich für die Brut gedacht. Sie werden aufgesammelt, wobei von den Körperchen Flüssigkeit abgesondert wird, die auch die adulten Tiere fressen. Die Belt`schen Körperchen stellen die einzige Proteinquelle für die Ameisen dar. Tierisches Protein wird von ihnen nicht angenommen! Schutz: die Pflanze bietet ihnen Schutz vor Witterung und zu intensiver Sonneneinstrahlung. Vorteile für Acacia sp.: • • Konkurrenz-Kampf ums Licht: Ameisen patroullieren auf und um die Pflanze herum und beißen alle eindringende Triebe ab. Auch am Boden halten sie einen bestimmten Radius(Basalkreis) um die Acacia frei von fremden Pflanzen. Fraßschutz: Fremde Insekten werden sofort mit Hilfe des Stachels vertrieben. o Die Pflanzeneigene Abwehr wird daher unnötig. Die daraus gewonnene Energie wird ins Wachstum investiert. o Da sie keinen eigenen Schutz haben sind die Triebe sehr zart und verletzlich, können dafür aber sehr schnell wachsen und mehr Licht für die Photosynthese absorbieren. EXPERIMENT VON DANIEL H. JANZEN: Es war lange umstritten ob es sich wirklich um einen Mutualismus handelt oder ob sich dieses Zusammenleben nur für die Ameisen lohnt. Daher verglich Janzen ein Jahr lang Akazien die von Pseudomyrmex „gesäubert“ wurden, mit Pflanzen die ihre Partner noch hatten. Das Ergebnis war ziemlich eindeutig: • • Die „gesäuberten“ Pflanzen hatten keinen Schutz mehr und wurden von Phytophagen angegriffen. Zusätzlich wurden sie von anderen Pflanzen überwuchert und überschattet. Alles in allem verkümmerten die Akazien ohne Pseudomyrmex, während die Kontrollpflanzen gut gediehen. Somit wurde zweifelsfrei bewiesen, dass es sich um einen echten Mutualismus handelt! Kerstin Olbrich; 0403013, A 444 Literatur: Hölldobler and Wilson, 1990: "The Ants"; Bert Hölldobler, Edward O. Wilson; Harvard University Press, Cambridge Massachusetts, 1990 M. Heil, et al., 2005 “Postsecretory Hydrolysis of Nectar Sucrose and Specialization in Ant/Plant Mutualism” Science 308, 560 (2005); DOI: 10.1126/science.1107536 Sandra Burger, 2003 „Vergleichende Bestandsaufnahme von Ameisenpflanzen entlang eines Transekts im tropischen Tieflandregenwald Costa Ricas“ http://entomology.ucdavis.edu/faculty/ward/psfergp.html The Ward ANT Lab 17.06.2007, 10:00 Uhr Kerstin Olbrich; 0403013, A 444 Untersuchungen zur Symbiose zwischen Pseudomyrmex sp. und Acacia allenii im Piedras Blancas National Park mit dem Hauptaugenmerk auf der Proteinaufnahme von Pseudomyrmex sp. Michael Lagler 1. Einleitung 1.1. Zahlen und Fakten Weltweit gibt es etwa 132 000 Hymenopteren-Arten, wovon rund 35 000 in Costa Rica beheimatet sind. Rezent sind ca. 12 000 Ameisenarten bekannt. Schätzungen gehen aber von bis zu 20 000 Arten aus. Über Costa Rica sind keine exakten Informationen bezüglich der Anzahl der dort lebenden Ameisen bekannt. Laut Literatur sind es aber zumindest mehrere Tausend Arten. Genauere Informationen findet man jedoch über die Individuendichte der Ameisen in Costa Ricanischen Regenwäldern. Rund 9 Mio. Individuen leben durchschnittlichen auf 1 ha Regenwald, wo sie die individuenreichste Insektengruppe darstellen und rund 50 % der Entomofauna ausmachen (Hölldobler, x, Westheide, 2007, www.centralamerica.com, www.si.edu, www.insectscience.com). 1.2. Systematik Die Insektenordnung der Hymenopteren weist eine Reihe von Autapomorphien auf. Zu den wichtigsten gehören: 1. Eine physiologische Zweiflügeligkeit, bei der während des Fluges Vorder- und Hinterflügel über Hamuli miteinander gekoppelt werden. 2. Eine innerhalb der Insekten einzigartige Körpergliederung, bei der der Metathorax mit dem 1. Abdominalsegment zum Propodium verschmolzen ist und das 2. Abdominalsegment als Petiolus bezeichnet wird. Die abdominalen Segmente 3 bis 11 werden unter dem Begriff „Gaster“ zusammengefast, der somit einem funktionalen Hinterleib entspricht. Des Weiteren sind Pronotum und Mesothorax fest verbunden. 3. Eine schuppenartige Überlappung der Tergite und Sternite abdominaler Segmente und 4. Eine haplo-diploide Geschlechtsbestimmung, bei der Männchen aus hapoliden, unbefruchteten und Weibchen aus diploiden, befruchteten Eiern hervorgehen. Als Charakteristikum der Hautflügler innerhalb der holometabolen Insekten und als Symplesiomorphie mit den hemimetabolen lässt sich das orthopteroide Legerohr erwähnen (Westheide, 2007). Die Hymenopteren werden in 2 Unterordnungen gegliedert: die ursprünglicheren, monophyletischen Symphyta und die Apocrita. Letztere weisen eine Einschnürung zwischen dem 1. und 2. Abdominalsegment, eine so genannte Wespentaille auf, welche die Beweglichkeit des Gasters erhöht. Die Apocrita werden ihrerseits wiederum in 2 Familienreiher unterteilt, wobei es die Terebrantia von den Aculeata zu unterscheiden gilt. Im Gegensatz zu den weitgehend parasitoiden Terebrantia haben die aculeaten Hymenopteren ihr Legerohr zu einem Wehrstachel umgebildet, der wie im Falle vieler Ameisen auch wieder reduziert werden kann. Darüber hinaus weisen die Aculeata vielfach madenartige Larven auf und die Staatenbildung ist mehrfach unabhängig unter ihnen entstanden (Westheide, 2007). Unter den Aculeata wird die Überfamilie der Vespoidea gezählt, worunter die Familie der Formicidae, das heißt der Ameisen zu finden ist. Mit Ausnahme der Geschlechtstiere zeichnen sich Ameisen durch Flügellosigkeit aus, wobei die Königinnen nach erfolgter Paarung ihre Flügel an Solbruchstellen abwerfen. Bis auf die Polgebiete und Polynesien haben Ameisen alle terrestrischen Lebensräume der Erde besiedelt. Nach Bolton gibt es 25 Ameisenunterfamilien, wobei 4 davon als fossil gelten. Ein Großteil der Unterfamilien ist auch in Costa Rica zu finden, aber zwecks Beibehalt einer gewissen Überschaulichkeit werden nur 4 Unterfamilien exemplarisch hervorgehoben; zum Teil, weil wir sie mit besonders großer Sicherheit während der Exkursionen im Regenwald antreffen werden, zum Teil deswegen, weil so von unmittelbarer Relevanz für unsere Versuche sind (Bolten, 2003, Hölldobler, x, Westheide 2007). 1. Myrmicinae (Knotenameisen): Der Petiolus und der Postpetiolus sind knotenartig verengt. Das Ausbilden eines Wehstachels ist bei den Knotenameisen weit verbreiten. Zu dieser Unterfamilie zählen die beiden Gattungen Atta und Acromyrmex, die unter dem Begriff „Blattschneiderameisen“ zusammengefasst werden (Hölldobler, x). 2. Ecitoninae (Neuwelttreiberameisen): Sie zeichnen sich durch eine abwechselnde nomadische und stationäre Lebensweise aus (Hölldobler, x). 3. Dolichoderinae (Drüsenameisen): Der Petiolus ist wie bei den Vertreter der Formicinae schuppenartig verlängert. Im Gegensatz zu ihnen weist ihr Gaster jedoch, der nur schwach eingeschnürt sein kann, 4 statt 5 von außen sichtbare Segmente auf. Als Beispiel dieses Taxons wird in weiterer Folge die Gattung Azteca angeführt (Hölldobler, x). 4. Pseudomyrmecinae: Ameisen dieser Unterfamilie haben einen Myrmecinaeähnlichen Habitus und tragen stets einen Wehrstachel. Außerdem werden ungewöhnlich große Komplexaugen ausgebildet, wie dies beispielsweise bei der von uns untersuchten Gattung Pseudomyrmex der Fall ist (Hölldobler, x). 1.3. Endokrinologie Der gemeinsame endokrinologische Nenner aller Ameisen ist sehr klein, denn gleiche Drüsenkomplexe können bei unterschiedlichen Taxa, auch bei näher verwandten, sehr unterschiedliche Sekrete produzieren und somit unterschiedlichen Funktionen dienen. Nichtsdestotrotz lassen sich 3 grundlegende funktionelle Komplexe unterscheiden. Zum einen sind dies Futtersaftdrüsen, wie Maxillar-, Labial-, Pharyngial- und Mandibulardrüsen, die vor allem Sekrete der Verdauung bilden. Letztere bilden als Ausnahme auch Wehrsekrete. Im Gegensatz zu den Futtersaftdrüsen versorgen die sich am Körperhinterende befindlichen Gift und Dufour’sche Drüsen den Giftstachel und produzieren Spurpheromone. Zu einem weiteren Drüsenkomplex zählen Rectal-, Pygidial- und Sternaldrüsen, die neben Spur- auch Alarmpheromone sezernieren. Darüber hinaus gibt es Drüsen, die bei den jeweiligen Taxa sehr spezifische Funktionen erfüllen. Als Beispiel seien hier die Metathorakaldrüsen der Blattschneiderameisen erwähnt, die unter anderem Stoffe wie Phenylessigsäure ausscheiden. Dabei handelt es sich um eine bakterizide und fungizide Substanz, die das Wachstum unerwünschter Pilze hemmt (Hölldobler, x, www.wikipedia.com) Neben der chemischen Zusammensetzung ist auch die Flüchtigkeit eines Pheromons ein entscheidender Faktor, der dessen Funktion, Wirkungsradius und -dauer bestimmt. Alarmpheromone sind stets flüchtiger als Spurpheromone, die beispielsweise bei Lasius fuliginosus aus hochmolekularen Fettsäuren bestehen und über Wochen hinweg wirksam bleiben. Die Mandibulardrüsen von Oecophylla longinoda scheiden unterschiedlich flüchtige Alarmpheromone aus. Hexanal ist das am stärksten flüchtige, das nach etwa 20 s einen Umkreis von 10 cm abdeckt, wogegen 2-Butyl-2-octanal weitaus weniger flüchtig ist und somit nur die nächst benachbarten Stockgenossen alarmiert. Darüber hinaus kann auch das Mischungsverhältnis von 2 oder mehreren Pheromonen die Wirkung bestimmen. So zum Beispiel bei Tetramorium caespitum. Hier zeigt erst das Gemisch zweier Pyrazine im Verhältnis von 7:3 biologische Wirksamkeit (www.wikipedia.com). Ein besonders wichtiger Aspekt der chemischen Kommunikation bei Ameisen ist der so genannte Nestgeruch. Dieser ist allen Individuen einer Kolonie eigen und lässt somit intraspezifische Unterscheidung unterschiedlicher Kolonien zu. Informationsweitergabe erfolgt bei den Vertretern der Formicidae aber nicht nur auf chemischem Weg, sondern auch taktil, das heißt durch das Betasten mit den Antennen. 2 besonders prominente Beispiele der taktilen Kommunikation sind bekannt. Zum einen sind dies das Anfordern von Kropfnahrung und zum anderen die als Tandemlauf bezeichnete Weitergabe von Rauminformationen. Letztere wird dann eingesetzt, wenn die Intensität der chemischen Spur noch nicht ausrecht, um effizient verfolgt zu werden (www.wikipedia.com). 1.4. Staatenbildung Nach einer Theorie Hamiltions zufolge liegt die Grundlage der Entstehung der Eusozialität in der haplo-diploiden Geschlechtsbestimmung; natürlich nur sofern diese vorhanden ist, was auch gleich auf den 1. Kritikpunkt hinweist, denn Termiten zeigen eusoziales Verhalten ohne haplo-diploider Geschlechtsbestimmung. Eindeutig ist aber, dass eine haplo-diploide Geschlechtsbestimmung zu einem höheren Verwandtschaftsgrad zwischen den Arbeiterinnen, das heißt zwischen den Töchtern einer Königin, als zwischen einer Arbeiterin und der Königin oder zwischen einer Arbeiterin und ihren hypothetischen Nachkommen führt. Folglich wird die Fitness bei Unterschützung anderer Arbeiterinnen in Relation zur Produktion eigener Nachkommen erhöht. Neben dem bereits erwähnten Kritikpunkt lassen sich auch Untersuchungen, die zeigten, dass 1 Königin in der Regel von mehreren Männchen begattet wird, was zu einem durchschnittlichen Verwandtschaftsgrad zwischen den Arbeiterinnen anstelle von theoretischen 0,75 zu 0,35 führt, als zusätzliche Einschränkungen der Theorie anführen (Hamilton, 1964, www.wkipedia.com). Ameisenstaaten können entweder 1, oder mehrere Königinnen haben, was als monobzw. polygyn bezeichnet wird. Nur ein geringer Anteil, ein beispielhafter Vertreter ist Temnothorax sp., weist monogyne Staaten auf, was vermutlich daran liegt, dass nicht nur die Reproduktionsrate einer polygynen Kolonie wesentlich höher ist, sondern auch daran, dass die Mortalitätsrate der gesamten Kolonie dadurch drastisch gesenkt werden kann. Die Gründung einer Ameisenkolonie kann auf sehr vielfältige Weise erfolgen. Als einfachste, kostengünstigste, jedoch auch als jene mit den höchsten Ausfallsquoten gilt die unabhängige Koloniegründung einzelner Königinnen. Diese Form wird von 65 % der mitteleuropäischen Arten durchgeführt. Wesentlich komplexer hingegen sind die Formen der abhängigen Koloniegründung. Ebenfalls von einzelnen Königinnen durchgeführt werden Formen mit temporärem Sozialparasitismus, wo Königinnen der Gattung Lasius beispielsweise getarnt durch ein bestimmtes Nestgeruchimitat in die Kolonie anderer zum Teil nicht näher verwandter Ameisen eindringen, die eigentliche Königin der Kolonie töten und die Fremdindividuen dann als Arbeiterinnen 1. Generation einsetzen. Die beiden anderen Formen der abhängigen Koloniegründung, nämlich Zweignestbildung und Nestteilung, lassen sich nur bei Ameisen mit polygynen Staaten finden. Bei der Zweignestbildung, die bei Formica-Arten bekannt ist, wächst die Kolonie und somit die Anzahl an Königinnen bis zu einem bestimmten Schwellenwert der Kapazität, bei dessen Überschreitung einzelnene Königinnen samt Teile der Kolonie beginnen Zweignester zu bilden, die nicht selten nur wenig voneinander entfernt sein können und im Extremfall sogar in Summe eine mehrere hundert Meter große Superkolonie bilden können. Die Nestteilung ist die charakteristische Form der Koloniegründung bei den Treiberameisen. Wird hier eine neue Königin gebildet, so teilt sich die Kolonie in 2 unabhängig voneinander funktionierende Hälften, was gerade bei Treiberameisen von entscheidender Bedeutung ist, weil die Königin zu jeder Zeit, das heißt auch vor der Produktion der 1. Arbeitergeneration, eine vollständig funktionierende Kolonie zum Überleben benötigt (www.wikipedia.com). 2. Beispiele Es werden in diesem Kapitel kurz 3 Gruppen von Ameisen exemplarisch vorgestellt, bei denen besonders große Wahrscheinlichkeit besteht sie im Piedras Blancas Nationalpark anzutreffen. 2.1. Blattschneiderameisen (Atta sp., Acromyrmex sp.) Bei diesen beiden myrmecinaen Gattungen sind 39 Arten bekannt, die eine Verbreitung in den Tropen und Subtropen der Neuen Welt aufweisen. Namensgebend ist die blattaberntende Lebensweise, wobei die zerkauten Blätter nicht gefressen, sondern als Pilzsubstrat verwendet werden. Eine Besonderheit der Blattschneiderameisen stellt die Vielzahl an zum Teil hoch spezialisierten Kasten dar, was sich anhand der Komplexität der Pilzzucht erklären lässt. Die Kastenbildung reicht von großen, mit mächtigen Mandibeln ausgestatteten Soldaten bis zur kleinsten Kaste, den Gärtnern, die aufgrund ihrer geringen Masse sich auf dem Pilz bewegen können ohne dessen Oberfläche zu zerstören (www.wikipedia.com). Große bis zu mehrere Mio. Individuen umfassende Kolonien können auch erheblichen Schaden an Nutzpflanzenplantagen anrichten, wobei die jährliche Blatternte einer Kolonie bei bis zu 35 t liegen kann. Andererseits wird der Boden durch den ständigen Abbau pflanzlichen Materials gedüngt (www.wikipedia.com). 2.2. Neuwelttreiberameisen (Ecitoninae) Die Verbreitung dieser etwa 150 Arten umfassenden Unterfamilie liegt in den Tropen und Subtropen der Neuen Welt, wobei unter dem Begriff Treiberameisen auch 2 Unterfamilien, die in Afrika beheimatet sind, angeführt werden. Charakteristisch für Treiberameisen sind abwechselnde nomadische und stationäre Phasen. Letztere treten nur dann auf, wenn sich die Larven verpuppen und die Königin neue Eier legt, was zeitlich exakt koordiniert sein muss. Im Gegensatz zu nomadischen werden bei der stationären Phase auch fixe Behausungen gebaut. Während der nomadischen Phase legt die Kolonie tagsüber weite Strecken zurück und baut bei Einbruch der Dämmerung ein aus den Leibern der Arbeiterinnen bestehendes Biwak. Dies ist ein hoch komplexes Konstrukt, das von innen nach außen aus immer älteren Individuen besteht und sowohl Kammern als auch Gänge aufweist (www.wikipedia.com). 2.3. Azteca sp. Diese Gattung ist gerade im Vergleich zu unserem Untersuchungsobjekt von Bedeutung, da diese Ameisen genauso wie Vertreter der Gattung Pseudomyrmex eine Symbiose mit einer Pflanze aufweisen. Im Fall von Azteca sp. sind es Ameisenbäume (Cecropia sp.), die proteinreiche Strukturen, die so genannten Müller’schen Körperchen, an der Blattbasis bilden. Diese dienen in erster Linie den Larven als Nahrung. Rezent sind in etwa 70 Arten bekannt, die zur Unterfamilie der Dolichoderinae gezählt werden. Ihr Verbreitungsgebiet liegt in Mittel- und Südamerika (www.wikipedia.com). Obwohl es sich um eine Symbiose zwischen Azteca sp. und Cecropia sp. handelt, erkennt man bei differenzierter Betrachtung, dass sich sowohl für Tier, als auch für Pflanze nicht nur Vor-, sondern auch Nachteile ergeben. Bei der Vorteilen für die Ameisen stehen klar das Nahrungsangebot und der relative geschützte Lebensraum in den Sprossachsen der Ameisenbäume im Vordergrund. Vor die Pflanze von Vorteil ist die Produktion von tierischen Abfällen und natürlich der Schutz vor Schädlingen, wie die bereits erwähnten Blattschneiderameisen. Da die blattschneidenden Kasten von Atta sp. und Acromyrmex sp. wesentlich kräftiger sind als die stärksten Kasten der Azteca-Ameisen bedienen sich letztere so genannter Kartonfallen (www.wikipedia.com). Als nachteilig für die Ameisen ist der höhere Fraßdruck und der größere Energieverbrauch zur Verteidigung der Pflanze zu bezeichnen, welcher insbesondere bei jungen, das heißt kleineren Kolonien, des öfteren dazu führt, dass der Grad zwischen Schaden und Nutzen in Richtung Schaden verlassen wird (www.wikipedia.com). 3. Literatur BOLTON B (2003) Synopsis and classification of Formicidae. - Memoirs of the Amer Entomol Institute HÖLLDOBLER B, WILSON E O (1990) The Ants. Belknap Press, Cambridge, Massachusetts WESTHEIDE W, RIEGER R M (2007) Spezielle Zoologie. Spektrum Akademischer Verlag, Heidelberg www.wikipedia.com (16.08.2007) www.centralamerica.com (03.08.2007) www.si.edu (26.07.2007) www.insectscience.com (26.07.2007) Protein consumption of Pseudomyrmex sp. on Acacia allenii Protein Fütterungsexperiment *) Acacia allenii ist eine Akazienart die endemisch in der Region um den Piedras Blancas Nationalpark und den Corcovado ist; sie ist mit Pseudomyrmex sp. vergesellschaftet. Nach einer Arbeit von Heil, Baumann et al. (Heil et al., 2004) an anderen Akazienarten in der untersucht wurde ob die Ameisen neben den Beltkörperchen auch externes Protein aufnehmen, kann die Aufnahme von zusätzlichem Protein ausgeschlossen werden. Gilt dasselbe auch für Acacia allenii? *) (Heil et al. 2004) widmete sich auch der biochemischen Fragestellung der Zusammensetzung der Beltkörperchen – es konnte deutlich ein hoher Gehalt an Protein und freien Aminosäuren und in einem Fall auch an Fetten nachgewiesen werden. Wir werden an Acacia allenii vorerst keine weiteren biochemischen Untersuchungen durchführen – ein positives Ergebnis unserer Arbeit könnte jedoch weitergehende biochemische Untersuchungen sinnvoll erscheinen lassen. Das Experiment von Heil, Baumann et al. im Detail: Um eine möglichst hohe Vergleichbarkeit unserer Ergebnisse mit denen von Heil, Baumann et al. zu gewährleisten lehnen wir unseren experimentellen Setup so nah als möglich am Originalexperiment an. *) Es werden für mindestens 3 Pflanzen a 40 Futterkörperchen dargeboten, und zwar für jede Pflanze aus 4 Futterarten (Stück Vegetation, Stück gekochtes Ei, Stück eines Insekts, Beltkörperchen) jeweils 10 Proben die auf der Blattrachis abgelegt werden. *) Klasseneinteilung der Events (Heil et al., 2004): nach dem Auflegen eines der 4 Futterkörperchen wird beobachtet ob die Ameise das Futterstück: a) nicht findet b) findet und veträgt, ohne es in die Domation einzutragen c) von der Pflanze entfernt d) in ein Domatium einträgt *) Die Insektennahrung muss von frisch getöteten Insekten aus der unmittelbaren Umgebung der Pflanze stammen – Verwesungsgeruch oder flüchtige Fettsäuren würden die Ameisen u.U. dazu bringen das Futter zurückzuweisen. *) Jeder Testlauf dauert maximal 5 Minuten, danach erfolgt der Abbruch und die Einteilung in die Klasse a) wenn das Körperchen nicht gefunden wurde. *) Es wird notiert nach welcher Zeit das Futterkörperchen gefunden wurde *) Die Belt Körperchen werden nur von einem anderem Pflanzenindividuum genommen (mit Ausnahme der ersten angetroffenen Pflanze wo das natürlich noch nicht möglich ist). Die Motivation dazu ist, dass bei Annahme der Beltkörperchen gezeigt ist, dass der Koloniegeruch der Ameisen der den Beltkörperchen anhaftet KEINE Rolle spielt, da es sich ja maximal um den Geruch einer fremden Kolonie handeln kann. Eine Zurückweisung der Beltkörperchen könnte natürlich sehr wohl dadurch verursacht werden, wurde aber im Autor: Harald Nowak, 8800274 Experiment von Heil, Baumann et al. nicht beobachtet. *) Wir randomisieren die Reihenfolge der Darbietung anhand vorbereiteter Listen – die Zufallszahlen werden vom Computer vorab erstellt. Wir tun dies um die Möglichkeit zur Habituation gering zu halten. *) Der Experimentator hat natürlich bei dem System Acacia/Pseudomyrmex einen erheblichen Einfluss: aus eigener Beobachtung wissen wir dass die Ameisen sehr nervös reagieren, und visuell gut orientiert sind. Die bloße Anwesenheit eines Menschen in der Nähe der Pflanze führt zu Alarmverhalten der Ameisen, vermutlich sowohl durch Geruch als auch ausgeatmetes CO2 sowie durch die optische Wahrnehmung (die Ameisen richten sich nach einer nahe über einem Ast gehaltenen Hand auch auf!). Es ist klar, dass diese Einflüsse soweit als möglich reduziert werden müssen wenn wir eine Aussage über die typische Ernährung der Ameisen treffen wollen. Wie können wir diese Einflüsse reduzieren? – – – zu jedem Zeitpunkt befindet sich immer nur 1 Person in der Nähe der Pflanze, die sich nach Auflegen des Testköpers rasch zurückzieht wir geben den Ameisen nach unserer Ankunft eine Gewöhnungszeit (ca. 15 Minuten, bei Bedarf mehr - in dieser Zeit machen wir uns mit der Pflanze vertraut und beobachten frei) wir bieten nur möglichst frische Nahrung an; die Nahrung wird nur mit einer Pinzette angegriffen und aufgelegt Erwünschtes Ergebnis: ein Diagramm zur Illustration der Proteinaufnahme nach (Heil et al., 2004) wie etwa das folgende rechts dargestellte aus der Originalarbeit: Motivation: *) Ameisen sind üblicherweise carnivor; die Ausnahmen sind eher selten und selten ist die Herbivorie vollständig - wie vollständig ist sie im System Akacia/Pseudomyrmex? *) Nach Heil,Baumann et al. gibt es keinen Hinweis auf die Nutzung externer Proteinquellen bei Akazien die an eher trockenen, sonnigen Standorten stehen – ein systematischer Unterschied zu Regenwaldstandorten wäre daher besonders Autor: Harald Nowak, 8800274 interessant, da er Hypothesen aus evolutionstheoretischen oder ökologischen Bereichen triggern könnte. *) Es existieren Hinweise auf mögliche zusätzliche Proteinaufnahme durch persönliche Beobachtungen von Fr. Dr. Veronika Mayer (Department für Palynologie und Strukturelle Botanik, Universität Wien) *) Die Proteinanalyse von Belt Körperchen durch Fr. Dr. Mayer ergab Hinweise auf einen geringeren Proteingehalt als bei jenen Akazien die von Heil, Baumann et al. untersucht wurden *) Die Anzahl der Beltkörperchen ist bei Akazien die an Regenwaldstandorte angepasst sind üblicherweise geringer als bei anderen Ameisenakazien – dafür sind diese oft größer. Warum ist das so, wie ist die Wechselwirkung zur Proteinaufnahme der Ameisen? *) Verschiedene Pseudomyrmex Arten können sehr wohl verschiedenes Verhalten bei Konfrontation mit externen Proteinquellen zeigen. So ist z.B. bekannt dass sowohl Pseudomyrmex sp. als auch andere Gattungen die Symbiose parasitieren - sollten wir an solch einen Parasiten gelangen, ist die Frage nach der Proteinaufnahme besonders interessant. Weitere Experimente mit dem System erfolgen nach der Durchführung des Fütterungsexperiments. Artbestimmung (Ameise UND Pflanze) Motivation: *) Die bisherige Artbestimmung als "Pseudomyrmex ferruginea, Janzen" ist nach heutiger Taxonomie nicht bis auf das Artniveau exakt und ferner heute nicht mehr korrekt: Der alte Name Pseudomyrmex ferruginea ist nach (Ward, 1993) ein Synonym für den Pseudomyrmex ferrugineus Komplex, der aus mehreren Arten besteht. Aufgrund von Karten (siehe Abbildung unten) der bisher aufgefundenen Pseudomyrmex Arten aus (Ward, 1993) die eine allopatrische Artbildung vermuten lassen erwarten wir im Piedras Blancas Nationalpark auf folgende 2 Arten zu treffen: Pseudomyrmex spinicola oder Pseudomyrmex particeps. Autor: Harald Nowak, 8800274 (Ward, 1993) Artbestimmung der Akazie direkt im Feld - dazu Schublehre und vegetativer Schlüssel nötig; - Schlüssel der auf Blüten basiert kann die Bestimmung abkürzen. Artbestimmung der Arbeiterinnen im Labor dazu benötigen wir: - Binokular - Okularmikrometer - Objektmikrometer da viele arttypischen Eigenschaften Maße und Verhältnismaßzahlen bestimmter Körperteile sind (wie etwa die Kopfbreite, die Kopfhöhe, Augenbreite/Augenhöhe etc.) Ameisen samples (Arbeiterinnen) werden präpariert (ein Papierdreieck wird an das Mesosoma unter die hinteren Coxen geklebt; das Papierdreieck wird genadelt). Nach der Bestimmung werden die Individuen beschriftet und in der Tropenstation hinterlegt. Autor: Harald Nowak, 8800274 Weitere interessante Details bzw. Fragestellungen zu Pseudomyrmex sp.: *) es existieren keine körperlichen Kasten (der Unterschied Königin / Arbeiterinnen zählt per Definitionem nicht als Kastenunterschied); existieren evtl. temporäre Kasten?! Dies wäre stark anzunehmen, da solche temporären Kasten bei vielen anderen Hymenopteren existieren – meist kümmern sich die Jungtiere um die Brut, während die älteren Individuen sich um die Verteidigung und die Nahrungsbeschaffung kümmern. *) Pseudomyrmex sp. besitzt als eine der wenigen baumlebenden Ameisen ein Stridulationsorgan (eine Schrillleiste zwischen Postpetiolus und Gaster) - wie wird dieses verwendet? Bei erdbewohnenden Ameisen dient dieses schallerzeugende Organ oft zur Alarmierung wenn sie verschüttet wurden – evtl. dient es bei Pseudomyrmex zur Alarmierung – sollte dem so sein müsste es möglich sein das Stridulationsverhalten der Ameisen triggern zu können. *) Pseudomyrmex sp. besitzt eine gut ausgebildete Metapleuraldrüse die bei erdlebenden Arten oft zur Ausbringung von antimyzetischen Substanzen dient - im Gegensatz zu anderen baumlebenden Ameisen wie etwa vielen Camponotus Arten. Wozu wird diese Drüse verwendet? *) Taxonomische Besonderheiten: schlanke Carinae, ohne Wulst über den Frontalloben; erstes Antennensegment (Scapus) relativ kurz (ca. halbe Kopfhöhe), 12 Antennensegmente, gut ausgebildeter Stachel (der ein sehr schmerzhaftes Gift injiziert – Vorsicht bei Kontakt!), gut ausgebildeter Postpetiolus Experiment: Absammeln und "wiederbesiedeln" (dient zur Specimen Gewinnung UND dem Abschätzen der Effizienz des Patroullierens: wie lange dauert die "Wiedereroberung" des Astes) - Von einem geeigneten Ast auf dem ca. ein dutzend Ameisen sichtbar patroullieren werden alle Ameisen abgesammelt (eingelegt in alkoholgefüllte Sammelröhrchen) - Es erfolgt eine Zeitaufnahme jeweils zu Beginn und zum Ende des Absammelns. - Danach erfolgt die Zählung der pro Zeiteinheit erneut anwesenden Ameisen - Nach ca. 15-30 Minuten wird abgebrochen. Frage: Ergebnis: liegt die Dauer einer effektiven Neuaufbau der Abwehr im Bereich von Minuten oder eher Stunden Kurve der Anzahl der sichtbare Ameisen als Funktion der Zeit seit Beginn des Absammelns auf der gewählten Struktur. Qualitative Beobachtungen Diese werden die ganze Zeit während unsere Anwesenheit bei der Pflanze gemacht, auch und vor allem aber in der Gewöhnungsphase da wir in der Zeit nach der Ankunft ohnedies keine anderen Experimente durchführen können. Alles was beobachtet wird wird genau notiert. Mögliche interessante Fragen in diesem Zusammenhang: *) Sollte ein Hinweis auf Carnivorie gegeben sein, ist die Frage nach dem Konflikt zwischen Bestäuber und Ameise besonders interessant: Autor: Harald Nowak, 8800274 – – – die Pflanze favorisiert maximal viele Bestäuber UND möglichst viele Ameisen die Ameise reduziert den Bestäubungserfolg wenn die Ameisen aktiv externe Proteinquellen nutzen haben sie in dieser Hinsicht was die Bestäuber betrifft diametral gegenteilige Interessen als die Pflanze selbst *) Gibt es ein effektives Alarmsystem gegen Eindringlinge außer der "persönlichen" Wahrnehmung jeder einzelnen Ameise (optisch, chemisch und mechanisch)? Stridulieren die Ameisen? Rekrutieren sie? Benutzen sie Duftspuren die sie mit dem Gaster ausbringen? Experiment: Aufbringen eines lebenden Insekts Ein noch lebendes Insekt wird auf die Pflanze aufgebracht und fixiert (etwa mit Superkleber) - es erfolgt Dokumentation des Verhaltens der Ameisen sowie: - die Aufnahme der Zahl der Ameisen beim Insekt / Zeiteinheit Ergebnis: Fotos, Beobachtungen zu den Themen: Proteinaufnahme (sofern diese erfolgt) und Rekrutierung, Kurve: Anzahl Ameisen beim Insekt eingetroffen Fragestellung: Rekrutieren die Ameisen? Stridulieren sie? Laufen sie zurück um Verstärkung zu holen, ist ein exponentielles Wachstum der # Ameisen / t erkennbar? Ein exponentielles Wachstum deutet zumindest auf ein Alarmsystem hin) Experiment: Markierungsexperimente (Weganalyse) Wir werden versuchen einzelne Individuen am Gaster mit einem farbigen Punkt zu markieren und in weiterer Folge ihre Trajektorien auf der Pflanze zu verfolgen, sowohl kurzfristig (ohne eine so markierte Ameise lange aus den Augen zu verlieren) als auch langfristig (über 24h mit dem Versuch die markierten Ameisen danach wiederaufzufinden) Motivation: Die Ameisen bewohnen einen in 2erlei Hinsicht ungewöhnlichen Bau: - der Bau ist gewissermaßen ein nach außen gestülpter Ameisenbau (im vergleich zu einem Erdbau) der eine Beobachtung wann sich die Ameisen wo aufhalten und wohin sie sich bewegen sehr leicht macht – diese Tatsache wollen wir nutzen um etwas über die Logistik im Bau zu erfahren - im Vergleich zu Erdbauten ist der Raum für die Brut erstens sehr klein (Dornen im cm Größe) und zweitens auf viele kleine Kompartimente verteilt. Es stellt sich somit die Frage wie die Ameisen dieses logistische Problem lösen. Unsere Arbeitshypothese ist, dass alle Dornen maximal genutzt werden und die Größe eines Pseudomyrmex Volkes durch den Raum limitiert wird. Hinweise darauf, dass auch bei bodenlebenden Ameisen meistens der Raum limitierend ist und nicht die Resourcen finden sich etwa in "The Ants" (Hölldobler and Wilson, 1990) Ferner hypothetisieren wir, dass die Königin in einem Dorn sitzt den sie nicht oder kaum verlässt und dort ihre Eier legt - von dort werden die Eier von Arbeiterinnen zu anderen Dornen verbracht. Diese Hypothese werden wir u.U. modifizieren wenn wir die Königinnen beobachten können. Autor: Harald Nowak, 8800274 - Techniken zur Wegverfolgung und zum Markieren sollen erprobt werden. Die Markierung ist bei Ameisen besonders problematisch, da durch das sog. Allogrooming ständig Düfte und Substanzen auf der Cuticula der Individuen über die ganze Kolonie verteilt werden und auf diese sehr spezifisch und oft auch aggressiv reagiert wird; ferner werden Fremdsubstanzen dadurch oft "abgeleckt". Wir werden mit einigen Farben experimentieren, darunter Nagellack, Hinterglasfarben ("Plaid GlassColor" wurde etwa von Hölldobler bei seinen Experimenten an Harpegnathos sp. in Würzburg erfolgreich verwendet) und handelsüblicher Lackstift. Laut Wojcik, Burges et al. (Wojcik et al., 2000) ist es am besten wenn die Farbe beim Kontakt mit anderen Ameisen noch feucht ist - das passiert bei uns ohnedies. Experiment: Wegaufnahme Markieren einer Arbeiterin und verfolgen ihrer Bewegungen für ca. 15 - 30 Minuten. (Protokollierung der Positionen nach jeweils 10 Sekunden auf einer groben Skizze der Pflanze); Fotografie der Pflanze aus mindestens 3 Richtungen, davon eine Richtung des Beobachters; Durchführung für 2 Arbeiterinnen parallel (2 Farben) ausgehend von selben Zweig; ein Student sagt alle 10 Sekunden die laufende Nummer an. Erwünschtes Ergebnis: Fotografie mit farbig eingezeichnetem Weg der Ameise (2 Wege) Danach entfernen dieser Arbeiterinnen. Fragestellung: Wie bewegen sich die Ameisen? Gibt es einen Bezug der Ameise zu bestimmten Pflanzenteilen, oder lässt sich der Aufenthalt der Ameise auf der Pflanze eher durch ein Diffusionsmodell beschreiben? (random walk). Diese qualitative Beobachtung soll auch helfen weitere Frage sinnvoll zu formulieren Experiment: Kurzzeitanalyse der Affinität zu bestimmten Dornen - Markieren einer Arbeiterin die Dorn verlässt und Markieren des Dorns mit Farbe; nachfolgende Beobachtung für 15-30 Minuten: alle anderen besuchten Dornen werden ebenfalls markiert und gezählt; Durchführung für 3 Arbeiterinnen parallel (3 Farben) Ergebnis: Zahl der besuchten Dornen als Funktion der Zeit. Die Markierung der besuchten Dornen kann evtl. unterbleiben da sie das Experiment stark stört (ein stark nach Lack duftender Dorn kann positiv oder negativ taktisch auf die Ameisen wirken!) Fragestellung: gibt es eine Zuordnung der Arbeiterinnen zu bestimmten Dornen oder zumindest zu einer räumlich begrenzten Gruppe von Dornen? ("hat die Ameise einen Arbeitsplatz?") (Die Anzahl der besuchten Dornen pro Zeiteinheit würde in ersterem Fall 1 sein, in zweiterem zumindest konvergieren und ansonsten konstant anwachsen) Experiment: 24 h Analyse der Affinität zu Dornen - Markieren eines Dorns und aller ein- und ausgehenden Arbeiterinnen für ca. 15 Minuten; notieren der Gesamtzahl. - Tags darauf erfolgt eine Zählung wie viele der so markierten Arbeiterinnen in der Nähe dieses Dorns sind; dazu wird der Dorn mit einem Seitenschneider eröffnet und das Ausströmen der Ameisen abgewartet; danach erfolgt die Zählung der markierten Ameisen. Autor: Harald Nowak, 8800274 Fragestellung: gibt es eine langfristige Zuordnung der Arbeiterinnen zu bestimmten Dornen oder zumindest zu einer räumlich begrenzten Gruppe von Dornen? Gibt es bevorzugte Aufenthaltsorte auf der Pflanze? Experiment: Gegenprobe - Markieren eines Astes mit Farbe und Beobachtung ob Farbmarkierung ohne Hemmung überschritten wird - Zählung von Ameisen die sich nähern und die Markierung überschreiten vs. jenen die die zurücklaufen vs. jenen die bei der Markierung stehen bleiben. Die beiden letzteren Zahlen sollten nahezu 0 sein. Warum: Farbe kann hemmend oder anziehend auf Ameisen wirken; würde mögliches Clustern der Ameisen um einen Dorn oder komplette Zerstreuung der Gruppe ebenso erklären. Benötigte Ausrüstung - Schmetterlingsnetze zum Fliegenfang (als Nahrung für die Ameisen) - Binokular - Okularmikrometer - Objektmikrometer - 3-4 Farben, evtl. Wachsfarben, Nagellack, Lackstift, Hinterglasfarben - Sammelröhrchen - dünner Pinsel und Präpariernadel (zum markieren des Gasters) - Papier, Bleistift, Nadeln (zur Dokumentation und zum Präparieren) - Superkleber - Stoppuhr - Schiebelehre (Pinnulae Dicken Bestimmung im Feld, wenn keine Blüten) - Maßband oder Lineal (Blattlängenbestimmung) - Seitenschneider (zum schnellen und hoffentlich schmerzlosen Eröffnen von Dornen - Fotoausrüstung (qualitative Dokumentation und Weganalyse) Literatur: Hölldobler and Wilson, 1990: "The Ants"; Bert Hölldobler, Edward O. Wilson; Harvard University Press, Cambridge Massachusetts, 1990 Ward, 1993: "Systematic studies on Pseudomyrmex acacia-ants"; Philip S.Ward, Journal of Hymenoptera Research 2(1), p. 117-168, 1993 Heil et al., 2004: "Main nutrient compounds in food bodies of Mexican Acacia ant-plants."; Martin Heil, Birgit Baumann, Ralf Krüger, K. Eduard Linsenmair; Chemoecology, 14(1), p. 45-52, 2004 Wojcik et al., 2000: "An Improved and Quantified Technique for Marking Individual Fire Ants (Hymenoptera: formicidae)"; Daniel P. Wojcik, Richard J. Burges, Chantal M. Blanton, Dana A. Focks, Florida Entomologist (vol. 83, no. 1, p. 74 ff), March 2000 Raine, Willmer et al., 2002 "Spatial structuring and floral avoidance behavior prevent ant-pollinator conflict in a Mexican ant-acacia" – Raine, Willmer, Stone – 2002, Ecology-(Washington-D-C), 83(11): 3086-3096 Autor: Harald Nowak, 8800274 Untersuchungen zur Assoziation von Pseudomyrmex sp. mit Acacia allenii im Piedras Blancas Nationalpark mit besonderer Rücksichtnahme auf die Proteinaufnahme der Ameisen vom 6. bis 13. September 2007 Michael Lagler (0400121, A439, [email protected]) Harald Nowak (8800274, A 439, [email protected]) Kerstin Olbrich (0403013, A 444, [email protected]) 1. Abstract According to today’s state of knowledge it’s unknown if Pseudomyrmex sp., which is associated with the lowland rainforests acacia species Acacia allenii, uses external protein sources besides the Beltian bodies, that are offered by the host plant. We found out that the acacia antspecies Pseudomyrmex spinicola does not show any intake of animal protein. This observation is compatible with the results of Heil et al. (2004). Every single P. spinicola colony we have observed in the rainforest around the “Tropenstation La Gamba” accepted the offered Beltian bodies exclusively. The other items (egg, insect) offered as external food source were either ignored, or removed from the plant. As far as our results are concerned, they don’t prove that there are no other ants living in association with A. allenii, which use external protein sources. We assume that the ant species and not the host plant, the availability or the biochemical composition of the Beltian bodies has the most important effect on the answer to the question whether the ants are consuming additional protein apart from Beltian bodies. 1.1. Keywords ant-plant-association, protein intake, Pseudomyrmex spinicola, pit like impression, median clypeal lobe, Acacia allenii, Beltian bodies 2. Einleitung Die Vielfalt an unterschiedlichen Lebensweisen ist bei Ameisen so hoch wie bei nahezu keiner anderen Tiergruppe. Sie reicht von den noch stark wespenartigen und individuell nach Nahrung suchenden Formen wie Pachycondyla sp. bis hin zu jenen als Treiberameisen bekannten Arten, deren Erfolg ausschließlich in der Masse ihres Auftretens zu finden ist. Sie reicht von überzentimeter großen und goldglänzenden Ameisen wie Camponotus sericeiventris bis hin zu Formen wie Apterostigma sp., an deren Vielzahl von cuticulären Haaren zur Verbesserung der Tarnung Substrat haften bleibt. Sie reicht von 1 / 12 wenigen Millimeter kleinen, parasitierenden Arten bis hin zu den allgemein bekannten Blattschneiderameisen, deren Nahrungsbeschaffung so komplex ist, dass dazu fast 30 zum Teil morphologische zum Teil rein funktionale Kasten notwendig sind (Hölldobler 1990). Bis auf Ausnahme der zuletzt genannten ist ein Großteil der Ameisen vollständig oder zumindest teilweise karnivor, wodurch eine ausschließlich herbivore Lebensweise eine gewisse Besonderheit darstellt; und eine solche wurde von Heil et al. (2004) für Pseudomyrmex sp. auf 4 Acacia-Arten (A. cornigera, A. chiapensis, A. hindsii und A. collinsii) nachgewiesen (Heil et al. 2004). In allen 4 Fällen wurde tierisches Eiweiß in Form von gekochtem Ei bzw. totem Insekt zurückgewiesen und lediglich die von der Pflanze angebotenen Proteine, die neben Fetten in den so genannten Belt-Körperchen enthalten sind, eingetragen, um sie an die Brut zu verfüttern (Heil et al. 2004). Alle von Heil et al. (2004) untersuchten Acacia-Arten wachsen bevorzugt an Trockenstandorten, wodurch die im Piedras Blancas Nationalpark und auf der Halbinsel Osa endemisch vorkommende A. allenii (einzige Acacia-Art, die im Tieflandregenwald vorkommt) in der Analyse nicht enthalten war. Darüber hinaus wurde Harald Nowak im Rahmen eines persönlichen Gesprächs von Veronika Mayer mitgeteilt, dass sie im Piedras Blancas Nationalpark auf A. allenii Ameisen beobachten konnte, die dargebotene Insektenteile in die Domatien eintrugen. Somit lag im Zuge des Projektpraktikums im Regenwald der Österreicher vom 6. - 13. September 2007 eine Überprüfung dieser Beobachtung nahe (Heil et al. 2004, persönliche Mitteilung Mayer 2005). Da bei allen zuvor durchgeführten Untersuchungen mit Akazien assoziierte Pseudomyrmecinae als P. ferruginea (Janzen 1967) angesprochen wurden und da diese Art aber bereits 1993 durch eine Arbeit von Ward in 10 Arten (Artenkomplex P. ferrugineus) aufgegliedert wurde, war es für uns ein besonderes Anliegen die von uns beobachteten Ameisen einer bestimmten Art zuordnen zu können (Ward 1993). In den folgenden Untersuchungen werden die von uns gesammelten Pseudomyrmecinae taxonomisch bestimmt und deren Proteinaufnahme auf A. allenii analysiert. 2.1. Fragestellung und Hypothesen Um welche Art handelt es sich bei den von uns auf A. allenii gesammelten Ameisen? Aufgrund der in der Literatur angegebenen Informationen bezüglich der Verbreitung und einer bekannten Assoziation mit A. allenii, rechnen wir zum einen mit P. particeps und zum 2 / 12 anderen mit P. spinicola. Letztere erscheint jedoch, wegen der höheren Häufigkeit, wahrscheinlicher. Angesichts der Nähe unseres Untersuchungsgebiets zur panamesischen Grenze scheint auch ein Vorkommen der an sich in Panama endemisch verbreiteten Art P. satanicus möglich. Eine Interaktion mit A. allenii ist hier allerdings nicht bekannt. Erfolgt bei den mit A. allenii assoziierten Ameisen ein Eintrag tierischen Proteins? Lassen sich aufgrund der Ergebnisse Rückschlüsse auf A. allenii im Vergleich zu den von Heil et al. (2004) untersuchten Acacia-Arten ziehen. Ist der Grund eines etwaigen Eintrages von tierischem Protein bei den Ameisen oder bei der Pflanze zu finden? Aus der Literatur ist bekannt, dass die Anzahl und der Proteingehalt der Beltkörperchen von A. allenii im Vergleich zu anderen Acacia-Arten geringer sind. Dies wiederum würde die Überlegung schlüssig erscheinen lassen, dass ein tierischer Proteineintrag auf A. allenii wahrscheinlich ist (Ebinger & Seigler 1995). 3. Material und Methoden 3.1. Versuchstier und Versuchspflanze Bei den Versuchstieren handelte es sich um Ameisen der Gattung Pseudomyrmex, bei den von uns untersuchten Pflanzen um Akazien der Art A. allenii, die sich am „Riverbed Trail“ bzw. „Fila Trail“ rund um die „Tropenstation La Gamba“ befanden. 3.2. Artbestimmung 3.2.1. Sammlung und Präparation Auf allen von uns untersuchten Akazien wurden Arbeiterinnen gesammelt und in ein mit Ethanol gefülltes Sammelröhrchen eingelegt. Die Ameisen wurden nach dem Trocknen am Thorax zwischen dem 1. und 2. Extremitätenpaar auf einen schmalen Karton geklebt und in der „Tropenstation La Gamba“ als Belegexemplare hinterlegt. Zur Bestimmung der Palpenformel wurden durch leichtes Drücken mit einer Pinzette an der Hinterseite der Kopfkapsel des abpräparierten Kopfes die Mundwerkzeuge herausgepresst. Diese verblieben auch nach Absetzen der Pinzette in der vorgestreckten Lage. 3.2.2. Material Bei dem von uns verwendeten Stereomikroskop handelte es sich um das Modell Nikon SMC 10 mit Okularmikrometer, mit dessen Hilfe die zur Artbestimmung erforderlichen metrischen Absolutwerte bestimmt wurden. Die Skalierung des Okularmikrometers wurde 3 / 12 anhand eines Objektmikrometers für die höchste Vergrößerungsstufe des Stereomikroskops (40-fach) geeicht. 1 Teilstrich des Okularmikrometers entsprach 0,025 mm. Eine Digitalkamera des Modells Samsung V50 wurde mittels eines Okularadapters auf das Stereomikroskop aufgesetzt. Abb. 1: Dargestellt ist der Kopf von P. spinicola in Frontalansicht. Der obere Kreis markiert die „pit like impression“, der untere den „median clypeal lobe“. HW bezeichnet die maximale Kopfbreite, MFC die Distanz zwischen den Stirnleisten und ASD die Distanz zwischen den Antennenplatten (Lagler & Nowak 2007). 3.2.3. Bestimmung und Fotografie Die Artbestimmung erfolgte nach einem Schlüssel von Ward (1993), wobei folgende Begriffe/Strukturen von wesentlicher Bedeutung waren: Die „pit like impression“ stellt eine grubenartige Vertiefung des Kopfes dar. Der Rand des „median clypeal lobe“ war, wie dies in Abbildung 1 ersichtlich ist, bei getrockneten Präparaten nur schwierig zu erkennen. Deshalb empfahl es sich, wie in Abbildung 2 dargestellt, das in Alkohol eingelegte Präparat zu betrachten. Die maximale Kopfbreite (HW) inkludiert die Komplexaugen. Die minimale Distanz zwischen den frontalen Stirnleisten (Carinae) wird als MFC, die maximale Distanz zwischen den lateralen Rändern der Antennenplatten als ASD bezeichnet. Der FCI2 entspricht dem Verhältnis von MFC und ASD (siehe Abb. 1). Die Palpenformel gibt die Segmentzahl der Maxilar- und Labialpalpen (Zahl nach dem Komma) an. Außerdem wurden von jeder bestimmten Pseudomyrmex-Art bzw. vom weiblichen Geschlechtstier nach der Präparation zumindest eine Frontal- und eine Lateralaufnahme gemacht. Abb. 2: Die Abbildung zeigt den abpräparierten und in Alkohol eingelegten Kopf von P. spinicola in Frontalansicht. Der Rand des „median clypeal lobe“ (rot eingerahmt) ist hier deutlich zu erkennen (Lagler & Nowak 2007). 4 / 12 3.3. Proteinaufnahme Um eine Vergleichbarkeit der Ergebnisse herzustellen, lehnen sich die von uns durchgeführten Experimente zur Proteinaufnahme von Pseudomyrmex auf A. allenii unmittelbar an die Versuche von Heil et al. (2004) an. 3.3.1. Futterkörper Vor Beginn jedes Versuchs wurden je 10 Beltkörperchen gesammelt und je 10 der 3 restlichen Futterkörper (gekochtes Ei, totes Insekt und Pflanzenmaterial (= Vergleichskörper)) so zugeschnitten, dass sie der ungefähren Größe der Beltkörperchen entsprachen. Das Abtöten der Insekten erfolgte in unmittelbarer Umgebung der gerade untersuchten Pflanze. Im Gegensatz dazu wurden die Beltkörperchen jeweils von einer gerade nicht befütterten Pflanze eingesammelt, um Reaktionen auf den eigenen Koloniegeruch ausschließen zu können. 3.3.2. Versuchsdurchführung Nachdem eine geeignete Akazie gefunden wurde, wurde von den Versuchsteilnehmern eine Adaptierungszeit von etwa 30 Minuten in rund 1,5 m Entfernung von der Pflanze abgewartet. Anschließend wurden die 4 x 10 Futterkörper in einer zufallsverteilten Abfolge mittels einer Pinzette jeweils auf ein Fiederblatt in der Nähe der Mittelrippe gelegt, wobei darauf zu achten war, dass sich pro Versuch immer nur eine Person unmittelbar der Pflanze näherte. Störende Einflüsse sollten nicht nur insofern, sondern auch dadurch möglichst gering gehalten werden, dass die Futterkörper stets mit einer möglichst reinen Pinzette aufgetragen wurden. Zeigten die Ameisen nach einer Zeit von 5 Minuten keine Reaktion auf den angebotenen Futterkörper wurde der Versuch abgebrochen und als „nicht gefunden“ gewertet. Fand hingegen eine Reaktion statt, so war das folgende Verhalten entweder mit „gefunden und nicht eingetragen“ („auf der Pflanze verschoben“ bzw. „von der Pflanze entfernt“) oder mit „gefunden und in Domatium eingetragen“ zu beschreiben (Heil et al. 2004). 3.3.3. Datenanalyse Um die Reaktionen der Versuchstiere auf die jeweiligen Futterkörper vergleichen zu können, wurden die Ergebnisse der 3 x 10 Beobachtungen pro Futterkörper summiert und der Mittelwert sowie die Standardabweichung berechnet. Außerdem wurde überprüft, ob zwischen den Reaktionen der Ameisen auf die jeweiligen Futterkörper ein signifikanter Unterschied besteht. Dazu wurde sowohl im Falle der Funde, als auch der Einträge ein 5 / 12 einfaktorieller ANOVA-Signifikanztest zum simultanen Vergleich mehrerer Stichproben bei parametrischer Situation durchgeführt. 4. Ergebnis 4.1. Artbestimmung Die Bestimmung erfolgte an Individuen von 5 unterschiedlichen Pflanzen (Nummer 15 (siehe Anhang)). Auf allen Pflanzen wurde die Art zweifelsfrei als P. spinicola identifiziert (siehe Abb. 3). Darüber hinaus wurde auf der Pflanze 1 ein geflügeltes, männliches und auf der Pflanze 3 ein bereits ungeflügeltes, weibliches Geschlechtstier gefunden und ebenfalls zweifelsfrei als P. spinicola bestimmt (siehe Abb. 4). Das weibliche Geschlechtstier wurde gemeinsam mit 5 anderen weiblichen Geschlechtstieren und Individuen der Gattung Crematogaster auf der besagten Pflanze entdeckt, die sich noch in einem unbesiedelten Zustand befand. Eine Besonderheit war die bei allen als P. spinicola bestimmten Individuen schwach ausgeprägte, jedoch eindeutig vorhandene „pit like impressen“ (siehe Abb. 1). Abb. 3: Eine Arbeiterin von P. spinicola wurde von frontal und lateral fotografiert (Lagler & Nowak 2007). Abb. 4: Abgebildet ist ein weibliches Geschlechtstier von P. spinicola in Frontal-, Lateral- und Dorsalansicht (Lagler & Nowak 2007). Eher durch Zufall fanden wir am Boden unter der Pflanze 5 eine Pseudomyrmex von im Vergleich zu P. spinicola ungewöhnlicher Größe. Der Habitus und die ungleichmäßige Fortbewegung erinnerten an P. gracilis, jedoch wäre die orangbraune Färbung zumindest für mittelamerikanische Formen von P. gracilis laut Literatur ungewöhnlich gewesen. In der Station wurde das besagte Individuum durch den bereits angesprochenen Schlüssel von Ward 6 / 12 (1993) als P. boopis identifiziert. Auffällig im Vergleich zu P. spinicola sind die größeren Augen, der breitere Kopf und die schwächere Behaarung an Kopf und Alitrunk (siehe Abb. 5, (Ward 1993)). Abb. 5: Vergleicht man P. boopis (links) mit P. spinicola (rechts), so fallen vor allem die wesentlich größeren Augen auf (Lagler & Nowak 2007). 4.2. Proteinaufnahme 3 A. allenii-Pflanzen, auf denen jeweils P. spinicola-Kolonien lebten, wurden erfolgreich befüttert. Die Daten (N = 30) der 3 untersuchten Assoziationen wurden in der Folge gemittelt, wobei im Durchschnitt gekochtes Ei 8,0-mal (SD = 1,73), frisch getötetes Insekt 9,3-mal (SD = 0,58), Pflanzenmaterial 9,0-mal (SD = 1,00) und Beltkörperchen 9,3mal (SD = 0,58) von den Ameisen gefunden wurden (siehe Abb. 6). Der Unterschied war nicht signifikant (1-faktorielle ANOVA (2-seitig): F3df=1,024, p=0,43). Eingetragen wurden ausschließlich Beltkörperchen, was im Mittel 7,0-mal (N = 28, SD = 1,00) beobachtet wurde (1-faktorielle ANOVA (2-seitig): F3df=147,000, p<0,001). Das entsprach 70 % aller dargebotenen Beltkörperchen. 25 % der gefundenen Beltkörperchen 2 0 Abb. 6: Dargestellt sind die bei 3 unterschiedlichen A. allenii/P. spinicolaAssoziationen beobachteten und gemittelten Fälle (N = 30) gefundener sowie gefundener und eingetragener Objekte in Abhängigkeit der dargebotenen Objektart. Auf der Ordinate ist die Anzahl der angebotenen Futterkörper aufgetragen (SDEi = 1,73, SDInsekt = 0,58, SDVergleichskörper = 1,00, SDBeltkörperchen gefunden = 0,58, SDBeltkörperchen eingetragen = 1,00). 4 6 8 10 wurden zurückgewiesen (siehe Abb. 6). Ei 7 / 12 Insekt Vergleichskörper Beltkörperchen 5. Diskussion 5.1. Artbestimmung Obwohl laut Literatur eine „pit like impression“ ein typisches Merkmal von P. satanicus ist und diese bei den von uns als P. spinicola identifizierten Individuen mehr oder weniger eindeutig auftrat, kann aufgrund der Tatsache, dass die „pit like impression“ in schwächerer Ausprägung auch bei P. spinicola auftreten kann bzw., dass alle anderen bestimmungsrelevanten Merkmale auf P. spinicola verwiesen haben, an der Artbestimmung trotzdem nicht gezweifelt werden (siehe Abb.1, 3 (Ward 1993)). Ein Grund für das Vorhandensein dieser „pit like impression“ bei einer Reihe von P. spinicola-Kolonien rund um die „Tropenstation La Gamba“ könnte in deren Nähe zur panamesischen Grenzen zu finden sein. Ein gegenwärtiger oder vor evolutionsgeschichtlich kurzer Zeit noch vorkommender Genfluss zwischen lokalen P. spinicola-Populationen im Süden Costa Ricas und der in Panama endemisch verbreiteten Art P. satanicus erscheint uns denkbar. 5.2. Proteinaufnahme Am Boden liegen gelassenes Ei wurde nach kurzer Zeit unter anderem von C. sericeiventris aufgesucht und angenommen. Dies ist ein Beweis, dass Ei offensichtlich eine geeignete Proteinquelle für Ameisen darstellt und somit zu Recht als Futterkörper bei Pseudomyrmex angeboten wurde. Zudem sind die Unterschiede in den Funden zwischen Ei und den der 3 anderen Futterkörper nicht signifikant. Wie die von uns erhobenen Daten zeigen kann das Ergebnis der Arbeit von Heil et al. (2004) auch für die Assoziation A. allenii/P. spinicola ungeändert voll bestätigt werden. Ameisen der Art P. spinicola sind daher gleich jenen Arten, die ebenfalls obligat in Assoziation mit A. cornigera, A. chiapensis, A. hindsii und/oder A. collinsii leben, als rein herbivor zu bezeichnen (siehe Abb. 6). Wir können nun darauf schließen, dass den heute bekannten Informationen zufolge die Antwort auf die Frage, ob neben der pflanzlichen zusätzlich auch tierische Proteinquellen erschlossen werden, vom Proteingehalt der Beltkörperchen unabhängig ist. Inwiefern das geringe Nährstoffangebot des Regenwaldbodens ein Grund für den Bedarf an externen Proteinquellen sein kann, müsste anhand anderer Assoziationen untersucht werden (2 mögliche Beispiele werden in der Folge angeschnitten). Natürlich wären auch den Ameisen endogene Faktoren, wie eine geringere Dauer der jeweiligen Assoziation oder eine noch nicht vollständig abgeschlossene Umstellung auf die rein herbivore Lebensweise, als Erklärung für einen etwaigen Eintrag tierischen 8 / 12 Proteins nicht außer Acht zu lassen. Zieht man nun in Betracht, dass P. spinicola neben A. allenii hauptsächlich auch auf A. collinsii vorkommt, so rückt die Überlegung immer mehr in den Vordergrund, dass die Ameisenart und nicht die Art der Wirtspflanze, die Verfügbarkeit und/oder die biochemische Zusammensetzung der Beltkörperchen den ausschlaggebenden Faktor zur Klärung dieser Problematik darstellt. Wir verweisen in diesem Zusammenhang auch auf den Umstand, dass zum Zeitpunkt der Untersuchung sowohl solche Pflanzen, die reichlich, als auch solche, die gar keine Beltkörperchen ausgebildet hatten, zu finden waren (Heil 2004, Ward 1993). Kommt man nun nochmals auf den eingangs erwähnten, von Veronika Mayer beobachteten Fall zurück (persönliche Mitteilung Mayer 2005), so wären zumindest nach unserem Wissensstand 2 Alternativen denkbar. Erstere Hypothese würde besagen, dass es sich bei der besagten Beobachtung um eine parasitische Pseudomyrmex-Art gehandelt haben könnte, die laut Literatur typischerweise nicht oder nicht besonders aggressiv sind und größtenteils auf eine Verteidigung der Pflanze verzichten (Ward 1993). Nun wurde eine Kolonie einer solchen Art von uns zwar nicht gefunden, aber der Fund von P. boopis (siehe Abb. 5) in unmittelbarer Nähe von einer von uns untersuchten P. spinicola-Kolonie könnte einen durchaus interessanten Hinweis liefern. Möglicherweise parasitiert P. boopis in unserem Untersuchungsgebiet die Assoziation P. spinicola/A .allenii, denn nach Ward (1993) tritt P. boopis als fakultativer Bewohner von Acacia sp. auf. Sollte je eine Assoziation P. boopis/A. allenii gefunden werden, so wären natürlich insbesondere hier Fütterungsexperimente von besonderem Interesse. Die 2. Hypothese würde eine andere obligat mit A. allenii in Assoziation lebende Pseudomyrmex-Art inkludieren, bei der die Frage nach dem Erschließen externer Proteinquellen noch ungeklärt ist. Denkbar wäre beispielsweise P. particeps, die neben der bekannten Verbreitung auf der Halbinsel Osa auch im Piedras Blancas Nationalpark vorkommen könnte, da sie mit der dort ebenfalls vorkommenden A. allenii in Assoziation lebt und bisher ausschließlich auf dieser Pflanze beobachtet wurde (Ward 1993). 9 / 12 6. Literatur Ebinger, J. E., Seigler, D. S. (1995) Taxonomic revision of the ant-acacias (Fabaceae: Mimosoideae, Acacia, series Gummiferae) of the New World. Annals of the Missouri Botanical Garden 82: 117-138 Heil, M., Baumann, B., Krüger, R., Linsenmair, E. K. (2004) Main nutrient compounds in food bodies of Mexican Acacia ant-plants. Chemoecology 14: 45-52. Hölldobler, B., Wilson E. O. (1990) The Ants. The Belknap Press: Cambridge, Massachusetts. Janzen, D. H. (1967) Interaction of the bull’s horn acacia (Acacia corniger L.) with an ant inhibitant (Pseudomyrmex ferruginea F. Smith) in eastern Mexico. Kans. Univ. Sci. Bull. 47:315-558. Ward, P. S. (1993) Systematic studies on Pseudomyrmex acacia-ants. Journal of Hymenoptera Research 2:117-168. 7. Anhang 7.1. Charakterisierung der Untersuchungspflanzen 7.1.1. Pflanze 1 a) Standort: ca. 5 Minuten nach Einstieg in den „Riverbed Trail“ (Piedras Blancas Nationalpark), befand sich mittig am Weg b) Höhe: ca. 10 m c) Zustand der Dornen: ausgebildet d) Zustand der Beltkörperchen: aufgrund der Höhe der Pflanze nicht ersichtlich gewesen e) Zustand der Blüten: nicht ausgebildet 7.1.2. Pflanze 2 a) Standort: ca. 10 Minuten nach Einstieg in den „Riverbed Trail“ (Piedras Blancas Nationalpark) b) Höhe: 85 cm c) Zustand der Dornen: 6 ausgebildet d) Zustand der Beltkörperchen: nicht ausgebildet 10 / 12 e) Zustand der Blüten: nicht ausgebildet 7.1.3. Pflanze 3 a) Standort: 10 Minuten von Pflanze 2 entfernt auf einem Kamm am „Riverbed Trail“, (Piedras Blancas Nationalpark) b) Höhe: 50 cm c) Zustand der Dornen: nicht ausgebildet d) Zustand der Beltkörperchen: in geringer Zahl ausgebildet e) Zustand der Blüten: nicht ausgebildet 7.1.4. Pflanze 4 a) Standort: „Riverbed Trail“ (Piedras Blancas Nationalpark), im Bereich der Pflanze 2 einer Wegabbiegung nach rechts folgen und vor der nächsten Wegabbiegung am Wegrand in einem Gap b) Höhe: ca. 10 m c) Zustand der Dornen: ausgebildet, Typ A- und B-Dornen konnten gut unterschieden werden, eine Vielzahl an Typ B-Dornen befanden sich am Stamm d) Zustand der Beltkörperchen: ausgebildet e) Zustand der Blüten: nicht ausgebildet f) Besonderheiten: Stamm lag in nahezu horizontaler Lage 7.1.5. Pflanze 5 a) Standort: in den „Fila Trail“ (Piedras Blancas Nationalpark) am Aufgang neben dem neu angelegten Teich folgen, der Abzweigung in das „Valle Bonito“ folgen, danach „Fila Trail“ ca. 20 Minuten folgen b) Höhe: 1,4 m c) Zustand der Dornen: 14 ausgebildet, nur Typ A-Dornen d) Zustand der Beltkörperchen: befanden sich am jüngsten Blatt während der Untersuchungszeit gerade in Entwicklung e) Zustand der Blüten: nicht ausgebildet 11 / 12 7.2. Probleme bei der Versuchsdurchführung des Fütterungsexperiments Um etwaigen Nachfolgeuntersuchungen Mühen zu ersparen, wollen wir an dieser Stelle die aufgetreten Probleme bei den Fütterungsexperimenten nicht unerwähnt lassen. In einem 1. Fall wurden die Beltkörperchen von Pflanze 3 gesammelt. Auf dieser befanden sich 6 weibliche Geschlechtstiere von P. spinicola gemeinsam mit mehreren Individuen der Gattung Crematogaster. In einem 2. Fall erfolgte das Einsammeln an einer nicht näher beschriebenen, jedoch kürzlich gefällten A. allenii. Sowohl die an Pflanze 3, als auch die an der kürzlich gefällten Akazie gesammelten Beltkörperchen wurden allesamt in den nachfolgenden Fütterungsexperimenten an anderen Pflanzen zurückgewiesen. Es fielen somit 2 Fütterungsexperimente für die Datenerhebung vollständig aus. Unsere Hypothese zur Erklärung des Fehlschlages bezüglich des 1. Falls verläuft dahingehend, dass entweder die weiblichen Geschlechtstiere, oder Individuen von Crematogaster sp. Pheromone abgesondert haben, die die nachfolgend befütterten Ameisen in Alarmbereitschaft versetzt und dazu veranlasst haben, jegliche Objekte von der Pflanze zu entfernen. Insbesondere die Geschlechtstiere scheinen mit hoher Wahrscheinlichkeit Pheromone, vielleicht sogar Sexualpheromone, abgesetzt zu haben, da wir beobachten konnten, dass sie ihren Gaster immer wieder in die Höhe streckten. Den 2. Fall betreffend, gehen wir ebenfalls davon aus, dass die gesammelten Beltkörperchen mit Pheromonen besetzt waren; hier jedoch vermutlich mit Alarmpheromonen als Reaktion auf das Fällen der Akazie. Die Alarmpheromone von P. spinicola sind an ihrem zimtartigen, nahezu ätherischen Geruch leicht zu erkennen. Dies kann durch das Zerquetschen eines Ameisenkopfes mit einer Pinzette leicht nachvollzogen werden. Gerade dies führte in einer nicht beabsichtigten Form zu weiteren unerwarteten Zurückweisungen von Beltkörperchen, was gleich den zuvor genannten Fällen nicht in die Ergebnisse miteinbezogen wurde. Wenn man nun neben der Tatsache, dass jeder Versuchstag während des Untersuchungszeitraumes aufgrund des nachmittäglichen Regens (bei einsetzendem Regen zogen sich alle Ameisen in die Dornen zurück, wodurch ein Fortführen der Versuche de facto unmöglich wurde) auf etwa 6 Stunden beschränkt war, die möglichen Ausfälle in Rechnung stellt, ergibt sich ein etwa 3-tägiger Aufwand für das erfolgreiche Befüttern dreier Pflanzen. 12 / 12 Artenliste - Insecta / Exopterygota (Costa Rica 30.08.07 - 18.09.07) Odonata Zygoptera Odonata Zygoptera Odonata Anisoptera Mantodea Blattodea Blaberidae Blaberus giganteus Blattodea Blattidae Periplaneta sp. Heteroptera Heteroptera Reduviidae Triatoma dimidiata Heteroptera Pentatomidae Heteroptera Alydidae Auchenorrhyncha Fulgoridae Auchenorrhyncha Auchenorrhyncha Membracidae Caelifera Caelifera Acrididae Tropidacris cristata Ensifera Conocephalidae Conocephalus angustifrons Ensifera Phaneropteridae Phasmatodea Heteronemiidae Isoptera Termitidae Nasutitermes sp. Artenliste - Insecta / Endopterygota (Costa Rica 30.08.07 - 18.09.07) Coleoptera Passalidae Odontotaenius disjunctus Coleoptera Scarabaeidae Dynastes hercules Coleoptera Scarabaeidae Megasoma elephas Coleoptera Buprestidae Euchroma gigantea Hymenoptera Formicidae Myrmicinae Atta sp. Hymenoptera, Formicidae, Myrmicinae Apterostigma collare Hymenoptera Formicidae Myrmicinae Crematogaster sp. Hymenoptera Formicidae Ecitoninae Nomamyrmex esenbeckii wilsoni vs. Soldat von Atta sp. (Pfeil) Hymenoptera Formicidae Dolichoderinae Azteca sp. auf Cecropia sp. Hymenoptera, Formicidae, Ecitoninae Nomamyrmex esenbeckii wilsoni Hymenoptera Formicidae Ecitoninae Eciton sp. Hymenoptera Formicidae Ecitoninae Eciton sp. vs. Cicadidae Hymenoptera Formicidae Formicinae Camponotus sericeiventris Hymenoptera Formicidae Ponerinae Pachycondyla verenae Hymenoptera, Formicidae, Pseudomyrmicinae Pseudomyrmex spinicola (Königin) Hymenoptera, Formicidae, Pseudomyrmicinae Pseudomyrmex gracilis Hymenoptera Formicidae Pseudomyrmicinae Pseudomyrmex boopis (links) Pseudomyrmex spinicola (rechts) Hymenoptera Mutilidae Pseudomethoca areta Hymenoptera Apidae Euglossini Exaerete frontalis Hymenoptera Apidae Euglossini Euglossa sp. Hymenoptera Apidae Meliponini Diptera Hippoboscidae Alexandra Bauer [email protected] Costa Rica 2007 Buckelwale Megaptera novaeangliae, Humpbackwhale Buckelwale werden zur Familie der Furchenwale (Balaenopteridae) gezählt, unterscheiden sich aber deutlich in Form und Verhalten von diesen, weshalb sie in eine eigene Gattung, Megaptera (= großer Flügel), gestellt werden. Die durchschnittliche Körperlänge eines erwachsenen Tieres beträgt 12,9 m bei Männchen bis 13,7 m bei Weibchen und das Gewicht schwankt zwischen 25 und 30 t. Charakteristisch sind die sehr langen Flipper, die 1/3 der Körperlänge erreichen. Buckelwale haben ein riesiges Verbreitungsgebiet, das über alle Ozeane bis zu den Packeisgrenzen liegt. Innerhalb dieses Gebietes führen sie saisonale Wanderungen über Tausende von Kilometern durch. Den Winter verbringen sie in den Tropen, bzw. Subtropen, und im Sommer halten sie sich in nährstoffreicheren polaren Gebieten auf. Die Äquatorgrenze wird nicht überschritten, mit Ausnahme eines Bestandes im nördlichen indischen Ozean. Die nordatlantischen Populationen scheinen immer dasselbe Gebiete aufzusuchen, wohingegen die pazifischen Populationen durchaus neue Überwinterungsgebiete erobern und auch zwischen diesen wechseln. Obwohl Buckelwale sich zur Fortpflanzung und auch zum Beutefang zu größeren Gruppen zusammenschließen haben sie geringe soziale Beziehungen zueinander. Innerhalb dieser Gruppen existieren Sozialverbände von 2-4 Individuen, die unterschiedlich lange, je nach Zweck, halten. Die Nahrung wird ausschließlich in den kalten Gebieten aufgenommen und besteht bei der Südpopulation überwiegend aus Krill, wohingegen die Nordpopulation zusätzlich Schwarmfische wie Sardinen, Heringe und Makrelen jagt. Buckelwale ernähren sich wie alle Furchenwale als Schluckfiltrierer und haben zur Jagd auf Schwarmfische eine einzigartige Methode entwickelt. In Gruppen umschwimmen die Tiere den Fischschwarm und stoßen dabei Luft aus, so dass die glitzernden Luftblasen die Fische zusammentreiben und die Wale das „Netz“ aus Luftblasen spiralig immer enger ziehen können, um dann synchron (bis zu 24 Tiere) mit geöffnetem Maul in den Schwarm hinein zu stoßen. Während dem Aufenthalt in den Überwinterungsgebieten findet keine Nahrungsaufnahme statt und das Leben ist auf Paarung und Aufzucht der Jungen ausgerichtet. Buckelwale sind polygam, paaren sich zufällig miteinander und mit mehreren Partnern. Während der Paarungszeit spielt auch Gesang eine große Rolle, der aus einer großen Vielfalt von Stimmäußerungen besteht. Der Gesang gehört zu den facettenreichsten Tierlauten überhaupt und wird hauptsächlich von den Männchen produziert. Er besteht aus individuentypischen Einzelstrophen, die sich regelmäßig wiederholen und sich im Laufe der Jahre verändern. Die Fortpflanzung der verschiedenen Populationen ist um ein halbes Jahr verschoben, wodurch keine Vermischung dieser passieren kann. Weibchen gebären alle 2-3 Jahre bei einer Tragzeit von 11-11,5 Monaten. Junge sind bei der Geburt 4-5 m lang, saugen 6-10 Monate und wachsen in dieser Zeit auf 7,5-9 m Länge heran. Buckelwale sind aufgrund der Fischerei in allen Ozeanen gefährdet und wurden fast ausgerottet. Seit 1966 sind aber schlussendlich alle Populationen geschützt und durch drastische Rettungsprogramme konnte die Individuenzahl wieder stabilisiert werden. Die IUCN stuft Buckelwale als vulnerable ein. Literatur: http://www.iucnredlist.org/search/details.php/13006/summ ; 11.10.2007 http://de.wikipedia.org/wiki/Buckelwal ; 11.10.2007 Martin, A.R. (1992): Das große Buch der Wale und Delphine; Donauland Kremayr & Scheriau, Wien, und die Bertelsmann Club GmnH; 80-83. Wandrey, R. (1997): Die Wale und Robben der Welt: Vorkommen, Gefährdung und Schutz; KosmosNaturführer, Stuttgard; 57-61. Corallus hortulanus Systematik: Ordnung: Squamata Unterord.: Serpientes Familie: Boidae Unterfamilie: Boinae Gattung: Corallus Abb. 1: C. hortulanus besitzt eine sehr große Variabilität in ihren Färbungen Verbreitung: Corallus hortulanus hat eine sehr weite geographische Verbreitung auf dem neotropischen Festland und kontinentalen und ozeanischen Inseln. Nach Robert W. Henderson (1997) kann man den Corallus hortulanus Complex in vier Arten unterteilen die in folgenden Regionen vorkommen: C. hortulanus in französisch Guayana, Amazonasbecken bis südöstliches Brasilien; C. ruschenbergerii im südlichen Costa Rica, Panama und einigen vorgelagerten Inseln, nördliches Venezuela (Isla Margarita inkludiert), Trinidad und Tobago; C. cooki auf St. Vincent und C. grenadensis auf Grenada Färbung: Es gibt eine enorme Vielfalt an Farben und Muster, wodurch es häufig zu taxonomischen Verwirrungen kam. Die Grundfarbe reicht von verschiedenen grau/braun Abstufungen über grün und gelb bis hin zu orange. Wobei orange gefärbte Individuen ihre Farbe rasch verlieren und daher eher selten gesichtet werden. Vor allem das dorsale Muster weist eine sehr hohe Variabilität auf, kann aber auch komplett fehlen. Morphologie und Biologie: Es handelt sich hierbei um nachtaktive Würgeschlangen, die eine Länge zwischen 150 und 300 cm erreichen können. Im Gegensatz zu den Phytons sind alle Vertreter der Boinae ovovivipar und können zwischen 2 und 15 Junge gebären. Da Corallus hortulanus sich bevorzugt in Bäumen aufhält, ist der Körper, um besseren Halt zu haben, seitlich etwas zusammengedrückt und generell relativ schlank gebaut. Sie besitzt eine große Anzahl von Rückenschuppenreihen. Die Bauchschilder sind sehr klein, was vermutlich ebenfalls eine Anpassung and das Leben in den Bäumen darstellt. Ihre Nahrung besteht hauptsächlich aus Vögeln und kleinen Säugetieren. Um diese Aufzuspüren besitzt sie Labialgruben mit denen sie Infrarotstrahlung wahrnehmen können. Sie können so Temperaturdifferenzen von bis zu 0,026 °C registrieren. Äußerlich nicht sichtbar, aber auch typisch für alle Vertreter der Boinae, sind die rudimentär vorhandenen Hinterbeine und das Fehlen von Zähnen am Zwischenkiefer. Literatur: ("A Taxonomic Review of the Corallus hortulanus Complex of Neotropical Tree Boas“, Caribbean Journal of Science, Vol. 33, No. 3–4, 198–221, 1997) http://de.wikipedia.org/wiki/Labialgruben Silvia Hufnagl Faultier Tier des Tages vom 1.9.2007 gesehen im Park von San Mateo Systematik: Klasse: Säugetiere (Mammalia) http://de.wikipedia.org Überordnung: Nebengelenktiere (Xenarthra) Ordnung: Zahnarme (Pilosa) Unterordnung: Faultiere (Folivora) • Familie: Zweifinger-Faultiere (Megalonychidae) * Zweifinger-Faultier oder Unau (Choloepus didactylus) * Hoffmann-Zweifinger-Faultier (Choloepus hoffmanni) Kopf-Rumpf-Länge: 55-70cm Gewicht: 4-8kg Schwanz: fehlt • Familie: Dreifinger-Faultiere (Bradypodidae) * Dreifinger-Faultier oder Ai (Bradypus tridactylus) * Braunkehl-Dreifinger-Faultier (Bradypus variegatus) * Kragenfaultier (Bradypus torquatus) Kopf-Rumpf-Länge: 55-60cm Gewicht: 3-5kg Schwanz: stummelartig zurückgebildet, 6-7cm lang Dreifingerfaultiere haben 9 statt - wie bei anderen Säugetieren - 7 Halswirbel, was ihnen eine größere Beweglichkeit des Kopfes ermöglicht. Die beiden Familien sind trotz der äußerlichen Ähnlichkeiten nicht sehr nahe miteinander verwandt, sondern haben sich zum Teil konvergent entwickelt. Verbreitung: Faultiere leben in den tropischen Regenwäldern von Mittel- und Südamerika. Lebensweise: Einzelgänger Zweifinger-Faultiere sind vorwiegend nachtaktiv; Dreifinger-Faultiere haben keine festen Aktivitätszeiten - die wenigen Stunden, die sie nicht schlafen, können sowohl am Tag als auch in der Nacht liegen. Lebenserwartung: in freier Wildbahn: 15- 20 Jahre; in menschlicher Obhut: bis zu 40 Jahre Nahrung: Faultiere ernähren sich fast ausschließlich von Laub (nur die Zweifinger-Faultiere fressen hin und wieder auch Früchte und wirbellose Kleintiere). Diese faserige, nährstoffarme Kost wird ganz allmählich zersetzt, so dass der Mageninhalt der Tiere fast ein Drittel des Körpergewichts ausmacht. Dementsprechend haben Faultiere eine um 40-45% niedrigere Stoffwechselrate als Säugetieren vergleichbarer Größe. Nur etwa alle 7-10 Tage werden Kot und Urin abgesetzt - die einzige Tätigkeit, zu der sie auf den Boden herabklettern (abgesehen von etwaigen Baumwechseln). Man vermutet, dass sie auf diese Weise die Bäume düngen. Fortpflanzung: Schlaf, Nahrungsaufnahme sowie Paarung und Gebärvorgang erfolgen in der hängenden Lebensweise. Faultiere bauen keine Nester für ihre Jungen. Nach rund sechsmonatiger Tragzeit wird einmal im Jahr ein Junges geboren. Dieses ist ca. 25cm lang und wiegt ca. 300-400g. Die ersten Lebenswochen verbringt es an den Bauch der Mutter geklammert, mit 4 Monaten nimmt es erstmals feste Nahrung zu sich. Endgültig selbstständig wird es mit 6-9 Monaten. Weibchen werden mit rund 3 Jahren geschlechtsreif, Männchen mit 4-5 Jahren. Anatomie: An den Hinterbeinen haben beide Familien 3 Zehen, so dass die alte Bezeichnung Zweizehen- und Dreizehen-Faultiere irreführend ist. Finger und Zehen tragen große, sichelförmig gebogene, 8-10cm lange Klauen, die als Haken fungieren. Die Zähne wachsen das ganze Leben lang; Schneide- und Eckzähne fehlen. Faultiere sind erstaunlich gute Schwimmer. Auch bei einem Angriff ihrer Feinde Raubvögel (Harpyien), Katzen (Jaguar, Puma, Ozelot) und Schlangen (Anakondas) können sie plötzliche Hiebe mit ihren Klauenarmen austeilen. Sie verlassen sich jedoch bevorzugt auf ihre Tarnung. Das Fell ist braun (Zweifinger-) bis grau(Dreifinger-Faultier) gefärbt und aufgrund der darin lebenden Algen und Cyanobakterien macht es oft einen grünlichen Eindruck. Der Haarstrich ihres langen dichten Felles verläuft vom Bauch zum Rücken, damit das Regenwasser besser ablaufen kann. Faultier weisen eine niedrige Körpertemperatur von 30-34°C auf, die in den kühleren Nachtstunden und bei Inaktivität - um bis zu 10°C - absinkt. Sie haben wenige Muskeln, weshalb sie es nicht schaffen durch Zittern Wärme zu erzeugen. Daher regulieren sie ihre Körpertemperatur, indem sie sich abwechselnd in der Sonne oder im Schatten aufhalten. Literatur: • Schröer, T. & Thiesmeier, B. (Hrsg.), 1999. Harenberg- Enzyklopädie der Tiere. Harenberg Lexikon Verlag, Dortmund • Macdonald, D. (Hrsg.), 2001. Die große Enzyklopädie der Säugetiere, deutsche Ausgabe 2004. Könemann im Tandem Verlag, Königswinter • http://de.wikipedia.org, 24.9.2007 Micrurus alleni Klasse: Reptilia Ordnung: Squamata Unterordnung: Serpentes Familie: Elapidae Gattung: Micrurus Färbung Die Art M. alleni weist eine gebänderte Musterung auf, wobei jeder rote und schwarze Abschnitt durch ein helles (weiß oder gelblich) Band abgegrenzt ist. Der Kopf ist schwarz gefärbt mit hellen Seiten und heller Färbung der beiden Parietale an der Kopfoberseite. Der Nacken des Tieres besitzt einen breiten schwarzen Abschnitt gefolgt von einem roten Abschnitt. Die Kopf- und Nackenfärbung ist artspezifisch und kann als sicheres Bestimmungsmerkmal herangezogen werden. Beschreibung Es handelt sich hierbei um eine Korallenschlange mittlerer Größe. Die Adulttiere erreichen in der Regel eine Länge von 500 bis 800 mm. Der Schwanz ist kurz (12 - 19 % der Gesamtlänge bei Männchen und 7,5 - 11 % bei Weibchen). Die Schuppen der helleren Ringe haben eine schwarze Spitze. Die Männchen von M. alleni besitzt 209 -224 ventrale und 47 – 59 subcaudale Schuppen, während die Weibchen 221 – 244 ventrale und 32 – 43 subcaudale Schuppen aufweisen. Habitat Feucht- und Regenwälder des Tieflandes Verbreitung Atlantische Tiefländer und angrenzende prämontane Gebiete vom Osten Honduras’ bis in den Westen Panamas, Pazifische Tiefländer sowie prämontane und montane Zonen im Südwesten Costa Ricas und dem anschließenden Panamas, Meseta Central Occidental in Costa Rica und die Tiefländer im Osten Panamas. Michaela Kainz Sceloporus malachiticus Malachit-Stachelleguan Beschreibung: Der Malachit-Stachelleguan ist eine eher kleine Art und wird in etwa 19 cm lang. Die KopfRumpflänge beträgt bei Männchen 67 bis 98 mm und bei Weibchen 64 bis 94 mm. Der Schwanz hat circa Körperlänge. Die Rückenfärbung variiert von bläulich/grünlich bis zu grau oder schwarz. Die Kehle bei Adulten ist blau gefärbt, Männchen haben am Bauch longitudinal blaue Bereiche die schwarz umrandet sind, bei Weibchen sind keine schwarzen Begrenzungen vorhanden. Habitat: Die Art kommt vor allem an offenen sonnigen Stellen vor, z.B.: auf Felsen, Lichtungen, Weiden, Zäunen, Baumstämmen, Holzhaufen. Sie leben in der prämontanen, lower-montanen, montanen und subalpinen Zone. Biologie: Diese Tiere sind heliotherm, frühmorgens wärmen sie sich in der Sonne auf, später wechseln sie in den Schatten über. Sie nehmen dabei eine vertikale Position ein, mit dem Kopf nach unten schauend um schnell vor möglichen Prädatoren flüchten zu können. Während ihrer Aktivitätsphase erreicht ihre Körpertemperatur 20 bis 35°C, 7 bis 15°C mehr als die Lufttemperatur. Juvenile haben eine terrestrischere Lebensweise als Adulte, jedoch sind Adulte in höheren Lagen terrestrischer als in der prämontanen Zone. Die Ernährung besteht hauptsächlich aus Arthropoden, vor allem Insekten. Sie sind territorial und verteidigen ihre Homerange (einige Quadratmeter). Das Territorium eines Männchens kann sich mit Territorien mehrerer Weibchen überlappen. Die einzelnen Männchenterritorien liegen aber weit verstreut. Der Malachit-Stachelleguan ist vivipar, bei Tieren unterhalb von 1500 Höhenmetern ist die Reproduktion saisonal, bei Tieren über 1500 m reproduzieren sie sich das ganze Jahr über. Sie bekommen in der Regel 6 bis 12 Junge, Neugeborene sind 28 bis 30 mm (KopfRumpflänge) groß. Geschlechtsreife tritt bei Individuen bis zu 1500 m mit 8 bis 9 Monaten ein, bei höher vorkommenden Individuen wird sie erst mit 18 Monaten erreicht. Prädatoren des Stachelleguans sind verschiedene Vögel, Schlangen und kleinere Säugetiere. Michaela Kainz Vorkommen: Sie kommen in Costa Rica, dem westlichen Panama, El Salvador, dem westlichen Honduras und Nicaragua vor. Abb.1. Sceloporus malachiticus, links die Ventralansicht, rechts dorsale Ansicht. Literatur: Savage, J. M. (2002): The amphibians and reptiles of Costa Rica. A herpetofauna between two continents, between two seas. The University of Chicago press, S.441f. Blue-crowned Motmot (Momotus momota) Tier des Tages am 4.9.2007 Gesehen: 2 Individuen (1 Paar?) am 4. 9. 2007 im Stationsgarten der Tropenstation La Gamba Wissenswertes: Die Fam. der Momotidae sind in ihrer Verbreitung auf die Neotropis (v. a. Zentral- und Südamerika) beschränkt. Die 10 Arten der kleinen bis mittelgroßen, auf Bäumen lebenden Vögel besitzen einen relativ großen Kopf, einen leicht gebogenen Schnabel und kurze Beine. Doch das wohl charakteristische Merkmal der Motmots sind ihre zwei zentralen, verlängerten Steuerfedern. Sie enden mit einer spatelförmigen Spitze und werden vom Rest der Steuerfedern durch ein mehr oder weniger langes Stück kahlen Federschaftes getrennt (Abb.1, Abb. 2). Diese Abbildung 1: Blue-crowned charakteristische Federform ist jedoch bei den Motmots nicht Motmot (Momotus momota); von Geburt an zu finden, sondern entsteht erst im Laufe der Quelle: www.fermatainc.com Zeit, wenn die schwach befestigten Federäste nahe der Spitze abgetragen werden. Wie auch wir beobachten konnten, werden die Schwanzfedern oft wie ein Pendel von Seite zu Seite geschwungen, was vermuten lässt, dass die besonders geformten Schwanzfedern als optisches Signal dienen. Die Momotidae besiedeln eine Vielzahl mehr oder weniger bewaldeter Habitate, wobei der Blue-crowned Motmot in seinen Habitatansprüchen am anpassungsfähigsten ist. Man findet ihn in Primär- und Sekundärwäldern, aber auch in Plantagen und sogar Gärten. Unabhängig davon, welches Habitat die Motmots besiedeln, brauchen sie stets Erdbänke, in die sie ihre 3-5m langen Brutröhren graben können. Blue-crowned Motmots im südl. Costa Rica graben bereits von Sept./Okt. bis Nov. ihre Brutröhren, obwohl sie sie erst vier oder fünf Monate später benutzen. Der Grund dafür ist vermutlich der Boden, der in der nassen Herbstsaison leichter zu bearbeiten ist, als in der trockenen Saison, die mit der Brutzeit einhergeht. Genauso vielfältig wie sie in ihrer Habitatwahl sind, sind die Motmots auch in ihrer Nahrungswahl. Neben Früchten und Insekten, nimmt der Blue-crowned Motmot z.B. kleine Reptilien, Säugetiere und selten auch Vögel zu sich. Selbst die Nestlinge der Motmots werden oft mit Reptilien versorgt. Abbildung 2: Schwanzfeder von Momotus momota mit So wurde z.B. beim Turquoise-browed Motmot beobachtet, charakteristisch spatelförmiger dass die Eltern (bei Motmots übernehmen beide Elternteile Federspitze die Brutpflege) den Kopf von Eidechsen abbeißen, um dann die Innereien des Reptils über das offene Genick herauszupressen und diese an die Jungen zu verfüttern. Die leeren Eidechsenhäute wurden am Boden der Nesthöhle gefunden. Der Blue-crowned Motmot als Vertreter der Momotidae hat also seinen Titel „Tier des Tages“ mehr als verdient! ☺ Literatur: Del Hoyo J., Elliott A. & Sargatal J. (2001): Handbook of the Birds of the World - Vol.6. Lynx Edicions, Barcelona Verfasser: Claudia Schütz O.Carnivora ÜF. Canoidea Fam. Procyonidae Gattung Nasua Nasua narica (L., 1766) White-nosed Coati Weißrüssel-Nasenbär Der Weißrüssel-Nasenbär gehört zu den Kleinbären (Procyonidae). Die Procyoniden sind eher klein mit einer Gesamtkörperlänge von 60 bis 135 cm, haben fünf Zehen und sind Sohlengänger. Die Kleinbären sind dämmerungs- bzw. nachtaktiv mit Ausnahme der Nasenbären. Der Weißrüssel-Nasenbär hat kurze Beine mit langen Krallen, eine spitze Nase, kurze, fast im Fell verborgene Ohren und einen langen, geringelten Schwanz für mehr Balance am Baum. Das Fell ist meist graubraun gefärbt, typisch sind weiße Flecken an der Schnauze, an den Wangen, an der Kehle und am Bauch. Die Füße sind dunkler, fast schwarz. Nasua narica kommt häufig von Arizona und Texas (USA) bis nach Ecuador meist in tropischen Regenwäldern und Gebirgswäldern (bis zu 3500m) vor. Ihre einzige Bedrohung stellen natürliche Feinde wie z.B. Felidae oder Boa constrictor dar. Sie verbringen die meiste Zeit am Boden, aber auch auf Bäumen, um sich Früchte zu holen oder zu schlafen. Der Weißrüssel-Nasenbär findet sein Futter mit Hilfe des Geruchsinns. Sie sind Allesfresser und fressen Arthropoden, Früchte, Schildkröteneier und kleine Vertebraten. Die Nahrung variiert saisonal. Coatis haben ein interessantes Sozialsystem. Weibchen und Junge leben in Gruppen mit etwa 25 Individuen, während adulte Männchen solitär leben und territorial sind. Die Gruppenmitglieder bieten sich gegenseitig Schutz, denn adulte Männchen sind gefährlich für die Jungen. Adulte Männchen dürfen sich während einer zweiwöchigen Paarungszeit der Gruppe anschließen. Während dieser Zeit übernimmt das Männchen die Rolle als Verteidiger gegen Konkurrenten, sind aber den Weibchen untergeordnet. Die Tragzeit beträgt 10 bis 11 Wochen. Trächtige Weibchen verlassen die Gruppe ungefähr eine Woche vor Geburt und bauen ihre Nester in Bäumen. Sie kommen zur Gruppe zurück, wenn ihre zwei bis sieben Jungen stark genug sind, um mit der Gruppe Schritt zu halten. Die Jungen verlassen im Alter von fünf bis sechs Wochen das Nest (ein bis zwei Monate früher als die Jungen anderer Procyoniden). Die Jungen sind mit etwa 15 Monaten ausgewachsen und mit 2 Jahren erreichen sie ihre Geschlechtsreife. Zu diesem Zeitpunkt verlassen die männlichen Jungtiere die Gruppe. Ältere Weibchen bekommen keine Jungen mehr, sondern helfen den weniger erfahrenen Weibchen beim Aufziehen und Schützen der Nachkommen. Coatis werden bis zu 17 Jahre alt. Literatur: Wainwright, M.,2002. The Natural History of Costa Rican Mammals. Verlag, Ort, pp. 225-229 Eisenberg, J.F., & Redford, K.H.,1999. Mammals of the Neotropics – The Central Neotropics. 3. Auflage. Verlag, Ort, pp. 287-290 http://de.wikipedia.org/wiki/Weißrüssel-Nasenbär: letzter Zugriff am 15.10.2007 Rotaugenlaubfrosch Agalychnis callidryas Größe: ♂ 5cm, ♀ 8cm Aussehen: - große Augen mit roter Iris, Pupille senkrecht - intensive grüne Färbung - blau-gelbe Seitenfläche - Oberextremitäten blau, Schenkelinnenseiten blau, Finger und Zehen rot- orange Lebensraum: Tieflandregenwälder und die kühleren Hanglagen der Bergketten (um 970 m über dem Meeresspiegel), bei Tagestemperaturen um 23- 29°C. Habitat: Baumkronen (in einer Höhe von 2 - 25 Meter); Steigt nur nach ausgedehnten Regenfällen und zur Fortpflanzung nach unten Verbreitung: vom südöstlichen Mexiko bis an die kolumbianische Grenze von Panama Aktivitätszeit: Nachtaktiv Nahrung: Fliegen, Grillen, Heuschrecken, kleine Frösche Prädatoren: Vögel, Fledermäuse, Schlangen Reproduktion: Mai bis Juni (am Beginn der Regenzeit) ♂ ruft, ♀ reagiert, Amplexus, Ablage von 29 bis 42 Eiern an der Unterseite eines Blattes, ♀ befeuchtet Eier mit Wasser aus der Harnblase. Systematik: Klasse: Amphibien / Lurche (Amphibia) Ordnung: Froschlurche (Anura) Unterordnung: Moderne Froschlurche (Neobatrachia) Familie: Laubfrösche (Hylidae) Unterfamilie: Greiffrösche (Phyllomedusinae) Gattung: Rotaugenlaubfrösche (Agalychnis) Art: Rotaugenlaubfrosch (Agalychnis callidryas)