Maligne epitheliale Tumoren - Derma-Net
Werbung

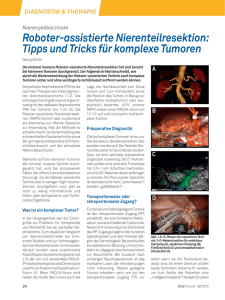
1.2 Maligne Tumoren 1 1.2.2 Maligne epitheliale Tumoren von <T.J. Brill und R. Kaufmann> Inhalt Basalzellkarzinom (BCC) Plattenepithelkarzinome der Haut (SCC) Das Basalzellkarzinom (BCC) und das Plattenepithelkarzinom der Haut (SCC) sind als Hauptvertreter des „hellen Hautkrebses“ die weitaus häufigsten Hauttumore. Sie gehören zudem zu den häufigsten malignen Erkrankungen des Menschen überhaupt. BCC und SCC zeigen in den letzten Jahrzehnten eine deutlich steigende Inzidenz, wobei das Sonnenlicht als wichtigster Risikofaktor für beide Erkrankungen gilt. Während Plattenepithelkarzinome vor allem auf dem Boden von Präkanzerosen und präinvasiven malignen Vorstufen wie den aktinischen Keratosen entstehen, entwickeln sich die Basalzellkarzinome weitgehend ohne Vorstufen. Unter den nichtmelanozytären Tumoren der Haut machen die Basalzellkarzinome etwa 80% aller Fälle aus (Rubin 2005). Histogenetisch ist die Herkunft der Tumorzellen beider Erkrankungen unterschiedlich. Während das Plattenepithelkarzinom seinen Ursprung von Keratinozyten der Epidermis nimmt, stammen die Basalzellkarzinome nach heutigem Wissenstand eher von Zellen der äußeren Haarwurzelscheide ab als von Zellen der epidermalen Basalzellschicht (Breuninger 2005). Tumorbiologisch verhalten sich Basalzellkarzinom und Plattenepithelkarzinom gänzlich anders: Während das Basalzellkarzinom fast immer nur lokal destruierend wächst, kommt es beim fortgeschrittenen Plattenepithelkarziom zur Metastasierung. Daher weisen Basalzellkarzinome im Vergleich zu Plattenepithelkarzinomen der Haut eine geringere Mortalität auf. Dennoch bedürfen auch Basalzellkarzinome einer sorgsamen und fachgerechten Behandlung, um Folgeschäden des lokal destruierenden Wachstums frühzeitig zu verhindern. Basalzellkarzinom (BCC) Synonyme: Basaliom, Epithelioma basocellulare; engl.: basal cell carcinoma Das BCC macht ca. 80% aller nichtmelanozytären Hauttumore aus (Rubin 2005). Seine Inzidenz unterliegt großen geographischen Schwankungen. Während in den westeuropäischen Ländern (z.B. England) von etwa 100 Neuerkrankungen pro 100.000 Einwohner und Jahr berichtet wird, beträgt die geschätzte Inzidenz in den USA in der weißen Bevölkerung etwa 200 bis 400 Neuerkrankungen pro 100.000 Einwohner und Jahr (Miller 1994). In Australien geht man sogar von regionalen Inzidenzen bis zu 2 Prozent pro Jahr aus. Männer und Frauen sind dabei in etwa gleich häufig betroffen. Das Durchschnittsalter der Erkrankung liegt bei ca. 60 Jahren, wobei eine Tendenz zu einer früheren Manifestation besteht. Ultraviolettes Licht wird als wichtigster Risikofaktor für die Entwicklung eines BCC gesehen. Während beim SCC das Auftreten stark mit der kumulativen Lichtdosis korreliert, ist der Zusammenhang beim BCC komplexer. Das Krankheitsrisiko ist bei intensiver, intermittierender UV-Exposition höher, als bei kontinuierlicher UVExposition (Zanetti 2006). Menschen der Hauttypen I bis II sind besonders gefähr- 2 1.2.2 Maligne epitheliale Tumoren det, ein BCC zu entwickeln. Daneben existieren verschiedene weitere exogene und genetische Faktoren (Tab. 1) wie z.B. das Basalzellnävussyndrom, die als Risikofaktoren für die Entstehung eines BCC gelten (Rubin 2005). Bei Manifestation eines BCC ist das Risiko für die Entwicklung weiterer BCC etwa um den Faktor 10 gegenüber der Normalbevölkerung gesteigert (Marcil 2000). Vor allem bei superfiziellen BCC am Rumpf ist das Risiko für die Entwicklung weiterer Tumore dieser Art erhöht. Tabelle 1: Risikofaktoren für die Entstehung von Basalzellkarzinomen Genetische Faktoren Physikalische Faktoren Hauttyp I/II UV-Licht Ionisierende Strahlung Sonstige Umweltfaktoren Arsen Teer Zigarettenrauch Zustand nach Organtransplantation Gorlin-Goltz-Syndrom (Basalzellnävussyndrom), Basex-Dupré-Christol-Syndrom Rombo-Syndrom Multiple infundibulozystische Basalzellkarzinome (Requena) Albinismus, Xeroderma pigmentosum Immunsuppression Genodermatosen mit Basalzellkarzinomen Genodermatosen mit allgemeiner UVEmpfindlichkeit Klinik Etwa 80% aller BCC entstehen im Kopf-Hals-Bereich, gefolgt vom Rumpf (15%) und den Extremitäten (Rubin 2005). Das klinische Erscheinungsbild ist sehr vielfältig. Folgende Formen werden unterschieden: • Noduläre BCC: Häufigste Form. Beginnen mit einer glasigen Papel, z.T. mit perlschnurartigem Randsaum und Teleangiektasien (Abb. 1). • Ulzerierende BCC: Entwickeln sich meist aus nodulären BCC durch zunächst zentrale Ulzeration (Ulcus rodens), später Ausdehnung der Ulzeration auf tieferliegende Strukturen (Ulcus terebrans). (Abb. 2). • Pigmentierte BCC: In einigen Fällen findet man Melaninablagerungen bei nodulären Basalzellkarzinomen (Abb. 3). • Superfizielle BCC: Vorzugsweise am Rumpf („Rumpfhautbasaliome“), schuppende, erythematöse Flecken und Plaques (Abb. 4). • Sklerodermiforme BCC: Weißliche, narbige Plaques, meist sehr unauffällig (Abb. 5). Die in der WHO-Klassifikation beschriebenen histologischen Subtypen (Tab. 2), die am häufigsten als Mischformen zu finden sind, können über das klinische Verhalten Auskunft geben. Während die nodulären und superfiziellen Varianten wenig aggressiv sind, zeigen mikronoduläre und infiltrative Basalzellkarzinom ein deutlich aggressiveres Verhalten, wobei das destruierende Wachstum auf die Tumorlokalisation begrenzt bleibt. Die Metastasierung eines Basalzellkarzinoms stellt eine Rarität dar (<1:1000) (Breuninger 2005). 1.2 Maligne Tumoren 3 © H. Schöfer, FFM Abb. 1 Noduläres (solides) BCC, glasige Papel mit Teleangiektasien © H. Schöfer, FFM Abb. 2 Ulzerierendes BCC 4 1.2.2 Maligne epitheliale Tumoren © H. Schöfer, FFM Abb. 3 Pigmentiertes BCC, am Oberarm © H. Schöfer, FFM Abb. 4 Rumpfhaut-BCC 1.2 Maligne Tumoren 5 © H. Schöfer, FFM Abb. 5 Sklerodermiformes, teils noduläres BCC © H. Schöfer, FFM Abb. 6 Exophytisch wachsendes, metatypisches BCC 6 1.2.2 Maligne epitheliale Tumoren Histologie BCC sind histologisch gekennzeichnet durch basaloid differenzierte Zellverbände mit chromatindichten Kernen, die von dermalem Stroma umgeben sind (Abb. 7). Häufig zeigt sich eine Spaltbildung zwischen Tumorepithel und umgebenden Stroma. Im Randbereich findet man, vor allem beim nodulären BCC, regelhaft eine palisadenartige Anordnung der Tumorzellen. Das nodulär-solide BCC zeigte sich als asymmetrisch knotiger Tumorzellverband, die klinisch superfizielle Variante ist durch breitbasig mit der Epidermis in Verbindung stehende multifokale Tumorzellverbände charakterisiert. Das sklerodermiforme BCC zeigt sich histologisch als Proliferation von schmalen Tumorzellsträngen, die von einem dichten fibroblastenreichen Stroma umgeben sind. Durch Melanineinlagerungen in die Tumorzellen und das Stroma kann sich klinisch ein pigmentiertes BCC zeigen. Weitere seltenere histologische Varianten sind Tabelle 2 zu entnehmen (Tab. 2). © R. Kaufmann, FFM Abb. 7 Basalzellkarzinom Differenzialdiagnosen Besonders im Gesicht können solide BCC Talgdrüsenhyperplasien oder dermalen melanozytären Nävi ähneln. Weitere wichtige Differenzialdiagnosen sind das Fibroma nasi, das Trichoblastom und das Trichoepitheliom. Daneben können zystische Tumore wie das Hidrozystom ein BCC imitieren. Pigmentierte BCC sind differenzialdiagnostisch vom malignen Melanom, aber auch von pigmentierten seborrhoischen Keratosen abzugrenzen. Bei ulzerierten oder stark exophytischen BCC (Abb. 5) kann eine klinische Abgrenzung zum Plattenepithelkarzinom oder malignen Adnextumoren schwierig sein. Die schuppende, erythematöse Plaque als typische Manifestation eines superfiziellen BCC ähnelt in vielen Fällen klinisch einem Morbus Bowen, einem nummulären Ekzem oder einer Psoriasis-Plaque. Sklerodermiforme BCC bereiten die größten diagnostischen Schwierigkeiten und werden daher häufig erst in einem fortgeschrittenen Stadium erkannt. Sie sind abzugrenzen von vielen anderen narbigen Läsionen und der zirkumskripten Sklerodemie. 1.2 Maligne Tumoren 7 Diagnostik Die Diagnose eines Basalzellkarzinoms wird in den meisten Fällen klinisch gestellt. Der Verdacht sollte durch eine Probebiopsie mit histologischer Untersuchung bestätigt werden. Bei kleineren Tumoren kann dies im Rahmen einer Exzisionsbiopsie erfolgen. Beim multifokalen superfiziellen BCC kann auf die histologische Diagnosesicherung oftmals verzichtet werden. Vor allem bei pigmentierten BCC erlaubt die Auflichtmikroskopie eine Abgrenzung melanozytärer Tumore. Bei tiefen, ulzerierenden Tumoren wie auch beim seltenen Verdacht auf Metastasierung können bildgebende Verfahren zur Untersuchung der lokalen Tumorausbreitung nötig werden. Tabelle 2: WHO-Klassifikation der Basalzellkarzinome (Heenan 1996) • Multifokales superfizielles BCC • Noduläres BCC (solide, adenoid, zystisch) • Infiltratives BCC (nicht-sklerosierend, sklerosierend, desmoplastisch, morphea-artig) • Fibroepitheliales BCC • BCC mit adnexoider Differenzierung (follikulär, ekkrin) • Basosquamöses BCC • Keratotisches BCC • Pigmentiertes BCC • BCC beim Basalzellnävussyndrom • Mikronoduläres BCC Therapie Bei nahezu fehlendem Metastasierungspotenzial besteht die Therapie des BCC in der lokalen Tumorkontrolle. Es existieren verschiedene chirurgische und nichtchirurgische Therapieansätze. Für die Wahl des geeigneten Verfahrens sind Tumorgröße, Lokalisation, histologischer Subtyp sowie der Allgemeinzustand und die Begleiterkrankungen des Patienten ausschlaggebend. Der Standard der operativen Therapie des Basalzellkarzinoms ist die Schnittrandkontrollierte Chirurgie (mikrographische Chirurgie). Durch vollständige operative Entfernung kann dabei eine anhaltende Heilung in etwa 95% der Fälle erreicht werden (Breuninger 2005). Die Aufarbeitung der topographisch markierten Exzidate kann dabei sowohl mittels Paraffinschnittverfahren erfolgen wie auch durch das Kryostatschnittverfahren. Letzteres ermöglicht zwar oftmals einen schnelleren Abschluss der Behandlung, ist aber in seiner Aussagekraft der konventionellen Methode unterlegen. Prinzipiell kann das operative Vorgehen einzeitig oder mehrzeitig erfolgen. Erfolgt die Exzision des BCC ohne Randschnittkontrolle mit Sicherheitsabstand und konventioneller Histologie, ist mit einem erhöhten Rezidivrisiko zu rechnen. Weiterhin besteht die Möglichkeit der Horizontalexzision, bei der der Tumor tangential mit dem Skalpell abgetragen wird. Aufgrund besonderer Lokalisation oder Tiefenausdehnung des Tumors kann ein interdisziplinäres Vorgehen nötig sein. 8 1.2.2 Maligne epitheliale Tumoren Bei inoperablen Tumoren oder Tumorresten bzw. Kontraindikationen für ein operatives Vorgehen kann eine Strahlentherapie mit Röntgenstrahlen oder schnellen Elektronen durchgeführt werden. Die Heilungsraten dieser Therapien sind weitgehend mit der konventionellen Chirurgie vergleichbar, wobei das kosmetische Ergebnis zum Teil als ungünstiger angesehen wird (Avril 1997). Die Gesamtdosis beträgt dabei 50 bis 70 Gy bei Einzeldosen von 2-5 Gy (Details siehe Kap. 17.3.2). Bei der photodynamischen Therapie wird nach Applikation eines Photosensitizers (z.B. δ-Aminolävulinsäure) eine Bestrahlung mit Rotlicht durchgeführt (Details siehe Kap. 17.3.4). Indikationen sind hier vor allem histologisch gesicherte, oberflächliche BCC bzw. für eine Operation ungeeignete BCC (Vinciullo 2005). Die Ergebnisse sind mit den lokal destruierenden Verfahren wie Kryotherapie vergleichbar Bei der Kryotherapie wird flüssiger Stickstoff durch Kontakt oder Aufsprayen appliziert. Das Verfahren wird vor allem bei Kontraindikationen für eine Operation angewandt, kann aber bei wiederholter Anwendung hohe Heilungsraten erzielen (Mallon 1996). Andere destruierende Verfahren sind die Kürettage mit Elektrodesikkation oder die CO2-Laser-Evaporisation (Breuninger 2005). Als weitere Therapiealtnativen kommen die lokale Immuntherapie mit Imiquimod und die topische Chemotherapie mit 5-Fluorouracil in Betracht. Insbesondere Imiquimod konnte bei superfiziellen BCC seine Wirksamkeit mehrfach in klinischen Studien unter Beweis stellen (Schulze 2005). Bei den seltenen metastasierten BCC führten systemische Chemotherapien, u.a. mit Cisplatin und 5-Fluorouracil, nur zu temporären Remissionen (Moeholt 1996). Prognose Die Prognose von Basalzellkarzinomen ist im Allgemeinen gut aufgrund der fehlenden Metastasierungsfähigkeit. Die Heilungsraten liegen für primäre Tumore bei Anwendung von mikrographischer Chirurgie deutlich über 90%. Engmaschige Nachsorgeuntersuchungen sind vor allem in den ersten 3 Jahren anzuraten, da hier das Risiko für Rezidive und Zweittumore am höchsten ist (Reifenberger 2005). Literatur Avril MF, Auperin A, Margulis A, et al. Basal cell carcinoma of the face: surgery or radiotherapy? Results of a randomized study. Br J Cancer 1997; 76:100-6 Breuninger H, Sebastian G, Kortmann RD, Schwipper V, Werner J, Garbe C. Deutsche Leitlinie: Basalzellkarzinom; in: Garbe C. Interdisziplinäre Leitlinien zur Diagnostik und Behandlung von Hauttumoren. Georg Thieme Verlag Stuttgart 2005; Seiten 1-11 Heenan PJ, Elder DJ, Sobin LH. Histological typing of skin tumours. 26. WHO International Histological Classification of Tumours. Berlin, Heidelberg, New York, Tokyo: Springer, 1996. Mallon E, Dawber R. Cryosurgery in the treatment of basal cell carcinoma. Assessment of one and two freeze-thaw cycle schedules. Dermatol Surg 1996; 22:854-8 Marcil I, Stern RS. Risk of developing a subsequent nonmelanoma skin cancer in patients with a history of nonmelanoma skin cancer: a critical review of the literature and meta-analysis. Arch Dermatol 2000; 136:1524-30 Miller DL, Weinstock MA. Nonmelanoma skin cancer in the United States: incidence. J Am Acad Dermatol 1994; 30:774-8 Moeholt K, Aagaard H, Pfeiffer P, Hansen O. Platinum-based cytotoxic therapy in basal cell carcinoma - a review of the literature. Acta Oncol 1996; 35:677-82 Reifenberger J, Ruzicka T. Basalzellkarzinom. In: Braun-Falco O, Plewig G, Wolff HH, Burgdorf HC, Landthaler M. Dermatologie und Venerologie. Springer Heidelberg 2005; S1250-9 Rubin AI, Chen EH, Ratner D. Basal-cell carcinoma. N Engl J Med 2005; 353:2262-9 1.2 Maligne Tumoren 9 Schulze HJ, Cribier B, Requena L, et al. Imiquimod 5% cream for the treatment of superficial basal cell carcinoma: results from a randomized vehicle-controlled phase III study in Europe. Br J Dermatol 2005; 152:939-47 Vinciullo C, Elliott T, Francis D, et al. Photodynamic therapy with topical methyl aminolaevulinate for ´difficult-to-treat´ basal cell carcinoma. Br J Dermatol 2005; 152:765-72 Zanetti R, Rosso S, Martinez C, et al. Comparison of risk patterns in carcinoma and melanoma of the skin in men: a multi-centre case-control study. Br J Cancer 2006; 94:743-51 Plattenepithelkarzinome der Haut (SCC) Synonyme: Spinozelluläres Karzinom, Spinaliom, Epithelioma spinocellulare; engl.: squamous cell carcinoma Das Plattenepithelkarzinom der Haut ist nach dem Basalzellkarzinom der zweithäufigste kutane Tumor. In den USA wird eine Inzidenz von etwa 100 bis 150 Neuerkrankungen pro 100.000 Einwohner und Jahr, mit deutlicher Zunahme in den letzten Jahrzehnten, beschrieben (Gray 1997). Die Tumore treten überwiegend in lichtexponierten Arealen auf. Ca. 90% aller SCC sind im Gesichtsbereich lokalisiert (Breuninger 2005). Prinzipiell kann das Plattenepithelkarzinom jedoch überall auf der Haut und den Schleimhäuten vorkommen. Das Durchschnittsalter der Patienten beträgt ca. 70 Jahre; Männer sind häufiger betroffen als Frauen. Die SCC der Haut wachsen lokal infiltrierend und destruierend mit typabhängig sehr unterschiedlicher Geschwindigkeit. Im Gegensatz zum BCC können SCC metastasieren. Bei ca. 5% der Patienten mit einem SCC der Haut finden sich Metastasen, meist zu Beginn in den regionalen Lymphknoten (Breuninger 2005). Der weitaus wichtigste ätiopathogenetische Faktor für die Entwicklung eines kutanen SCC ist das UV-Licht, wobei die Tumore meist auf dem Boden von Präkanzerosen (präinvasiven Frühformen wie den aktinischen Keratosen) entstehen. In etwa 5% gehen aktinsche Keratosen in ein manifestes Plattenepithelkarzinom über (Marks 1988). Neben der UV-Strahlung kann auch ionisierende Strahlung, in der Regel nach jahrzehntelanger Latenz, zur Entwicklung eines Plattenepithelkarzinoms auf dem Boden einer chronischen Radiodermatits führen. Daneben können sich die Tumore auch aus chronisch-entzündlichen Hautveränderungen wie Lichen ruber mucosae oder Lichen sclerosus et atrophicus entwickeln, selten auch auf dem Boden chronischer Wunden wie einem Ulcus cruris. Der Morbus Bowen (Carcinoma in situ) geht über in das so genannte Bowen Karzinom. Die entsprechende Präkanzerose im Schleimhautbereich wird als Erythroplasie Queyrat bezeichnet (Details siehe Kap. 1.2.1). Orale Karzinome scheinen auch mit Alkohol- und Tabakkonsum assoziiert zu sein. Plattenepithelkarzinome entwickeln sich zudem auf älteren straffen Narben, vor allem nach Verbrennungen. Als chemische Risikofaktoren gelten Arsen und Teer. Über thermische Faktoren wie lange Hitzeeinwirkung wurde berichtet. Verschiedene humane Papillomviren – insbesondere die Typen 16 und 18, sind mit der Entwicklung von Plattenepithelkarzinomen assoziiert. Bei immunsupprimierten Patienten, z.B. nach Organtransplantation, ist das Risiko für die Entwicklung eines Plattenepithelkarzinoms der Haut stark erhöht (siehe Kapitel 10.5.2). Zudem sind verschiedene Genodermatosen (z.B. Xeroderma pigmentosum) mit einem erhöhten Risiko für Plattenepithelkarzinome behaftet (Tab. 3). 10 1.2.2 Maligne epitheliale Tumoren Tabelle 3: Risikofaktoren für die Entwicklung eines Plattenepithelkarzinoms der Haut (modifiziert nach Alam 2001) • • • • • • • • • • • • • • • • • • • • • Nicht-ionisierende Strahlung UVA, UVB, Psoralen plus UVA Ionisierende Strahlung Hyperthermie Genodermatosen Albinismus Xeroderma pigmentosum Humane Papillomaviren (HPV), Typen 16 und 18 u.a. Chemische Faktoren (Arsen, Teer, polyzkl. aromatische Kohlenwasserstoffe) Morbus Bowen, Erythroplasie Queyrat Radioderm Präkanzeröse Keratosen Aktinische Keratosen Arsenkeratosen Röntgenkeratosen Narben Chronisch-entzündliche Dermatosen (Lichen ruber mucosae, Lichen sclerosus et atrophicus, Epidermolysis bullosa dystrophica, Lupus vulgaris) Chronische Wunden, Ulzera Immunsuppression, immunsuppressive Medikamente (Organtransplantation) Hämatologische Grunderkrankungen (Lymphome, Leukamien) Ernährung (Alkohol, Tabak) Klinik Das klinische Bild hängt von der zuvor bestehenden Präkanzerose ab und wird durch verschiedene Faktoren wie Wachstumsform oder Entdifferenzierungsgrad bestimmt. Zu Beginn erscheinen SCC meist als erythematöse Plaques oder Knoten, häufig unscharf begrenzt. Die Oberfläche präsentiert sich oft verrukös oder papillomatös, z.T mit Ulzerationen und hämorrhagischen Krusten (Abb. 8). Die Ausbreitung erfolgt invasiv sowohl zur Tiefe als auch im Durchmesser und gelegentlich entlang von Nervenbahnen (Leibovitch 2005). Bei fortgeschrittenen Tumoren beeinträchtigen Verwachsungen die Verschieblichkeit. Entstehen SCC auf dem Boden von präkanzerösen Keratosen, so zeigt sich charakteristischerweise eine anhaftende Schuppung, bei Entwicklung aus vorbestehenden Narbenarealen sind Erosionen und Ulzerationen typisch. Thermisch induzierte Karzinome präsentieren sich als retikuläre, braun-rötliche Flecken mit Teleangiektasien. Karzinome der Unterlippe (Abb.7) beginnen meist als hyperkeratotische Plaques bzw. als Leukoplakie. Mundschleimhautkarzinome können sich als Leukoplakie bzw. noch häufiger als begleitende oder alleinige Erythroplakie präsentieren (Mashberg 1995). Für Vulvakarzinome sind erosive erythematöse Plaques, meist solitär an den großen Labien typisch. Skrotale SCCs manifestieren sich gerne 1.2 Maligne Tumoren 11 als verruziforme Knötchen und am Penis treten sie am ehesten als erythematöse Plaques in Erscheinung. © H. Schöfer, FFM Abb. 8 Kutanes Plattenepithelkarzinom (SCC) am Oberhaupt Das verruköse Plattenepithelkarzinom als niedrig-maligner Subtyp mit geringer Metastasierungstendenz kommt am häufigsten plantar vor (Epithelioma cuniculatum). Die floride orale Papillomatose, die Papillomatosis cutis carcinoides und die Condylomata gigantea werden ebenso zu den verrukösen Karzinomen gezählt. Die floride orale Papillomatose präsentiert sich meist als Leukoplakie mit verruziformen Vegetationen. Bei der Papillomatosis cutis carcinoides zeigen sich großflächige Vegetationen vor allem an den Unterschenkeln im Bereich chronischer Ulzera oder Entzündungen. Condylomata gigantea (Buschke-Löwenstein-Tumore) entwickeln sich aus Verrucae im Genitalbereich und sind mit den humanen Papillomviren Typ 6 und 11 assoziert (s. Kap. 2.1.2). 12 1.2.2 Maligne epitheliale Tumoren © H. Schöfer, FFM Abb. 9 Plattenepithelkarzinom der Unterlippe (SCC) Histologie Plattenepithelkarzinome der Haut zeigen sich histologisch als Stränge squamös differenzierter atypischer Keratinozyten, die von der Epidermis bzw. dem Schleimhautepithel ausgehen (Abb. 10). Durch das destruierende Wachstum wird die Basalmembranzone zerstört und zunächst die Dermis infiltriert. Man findet eine ausgeprägte Zellpleomorphie, Hyperchromasie und Mitosen der Tumorzellen. Gut differenzierte Formen neigen zur Ausbildung eines verhornenden Plattenepithels. Man findet ein lymphozytäres und plasmazellreiches Infiltrat in der Umgebung des Tumors. Gemäß der WHO-Klassifikation werden folgende histologische Typen unterschieden (Heenan 1996): • Spindelzelliges Plattenepithelkarzinom • Akantholytisches (pseudoglanduläres) Plattenepithelkarzinom • Verruköses Plattenepithelkarzinom • Plattenepithelkarzinom mit Hornbildung • Lymphoepitheliomartiges Plattenepithelkarzinom. Das desmoplastische Plattenepithelkarzinom mit ausgeprägt infiltrativem Wachstum ist in diese Einteilung noch nicht aufgenommen. 1.2 Maligne Tumoren 13 © R. Kaufmann, FFM Abb. 10 Plattenepithelkarzinom der Haut (SCC) Differenzialdiagnosen Initiale Plattenepithelkarzinome der Haut sind differenzialdiagnostisch in erster Linie von aktinschen Keratosen (histologisch analog in-situ Karzinom) abzugrenzen, aus denen sie sich am häufigsten entwickeln. Das Keratoakanthom (Abb. 11) ist klinisch und histologisch zum Teil von einem hochdifferenzierten Plattenepithelkarzinom schwer zu unterscheiden, wegweisend ist aber das rasche Wachstum. Andere Differenzialdiagnosen sind Morbus Bowen, Verrucae vulgares und Verrucae seborrhoicae. Zudem kommen klinisch auch andere benigne und maligne Hauttumoren wie das Basalzellkarzinom, das amelanotische Melanom oder verschiedene Adnextumore in Betracht. 14 1.2.2 Maligne epitheliale Tumoren Abb. 11 Keratoakanthom Tabelle 4: TNM Klassifikation von Plattenepithelkarzinomen der Haut TNM-Klassifikation Merkmale TX Primärtumor kann nicht beurteilt werden T0 Kein Anhalt für Primärtumor Tis Carcinoma in situ T1 Tumor ≤2cm in größter Ausdehnung T2 Tumor >2cm und ≤ 5cm in größter Ausdehnung T3 Tumor > 5cm in größter Ausdehnung T4 Tumor infiltriert extradermale Strukturen NX Regionäre Lymphknoten können nicht beurteilt werden N0 Keine regionären Lymphknotenmetastasen N1 Regionäre Lymphknotenmetastasen MX Fernmetastasen können nicht beurteilt werden M0 Keine Fernmetastasen M1 Fernmetastasen 1.2 Maligne Tumoren 15 Tabelle 5: Stadieneinteilung von Plattenepithelkarzinomen der Haut (UICC 2002) Stadium Primärtumor Lymphknoten Fernmetastasen 0 Tis N0 M0 I T1 N0 M0 II T2 N0 M0 T3 N0 M0 T4 N0 M0 Jedes T N1 M0 Jedes T Jedes N M1 III IV Diagnostik Nach dem klinischen Verdacht auf ein Plattenepithelkarzinom erfolgt zur Diagnosesicherung die Probebiopsie, ggf. auch eine Exzisionsbiopsie, bei differenzialdiagnostischem Verdacht auf ein Keratoakanthom auch eine Querschnittsbiopsie. Die Einteilung der kutanen Plattenepithelkarzinome erfolgt gemäß der TNMKlassifikation bzw. der UICC-Stadieneinteilung (Tabelle 4,5) (Wittekind 2002). Die klinische Untersuchung sollte die Palpation der regionalen Lymphknoten umfassen. Bei fortgeschrittenen Tumoren (ab T2) sollte eine bildgebende Diagnostik zum Ausschluss von Lymphknotenmetastasen (Sonographie) erfolgen. Bei Verdacht auf Fernmetastasen ist eine weiterführende bildgebende Diagnostik erforderlich. Therapie Als Standard in der Behandlung des Plattenepithelkarzinoms der Haut gilt die mikrographische Chirurgie mit Schnittrandkontrolle. Dieses Verfahren, bei dem eine dauerhafte Heilung in etwa 90% der Fälle erreicht werden kann, ist der Exzision mit konventioneller Histologie überlegen, da hierbei größere Sicherheitsabstände eingehalten werden müssen (Rowe 1992). Bei flächenhaftem Befall im Sinne der „Feldkanzerisierung“ mit multiplen in-situ Karzinomen unter dem klinischen Bild aktinischer Keratosen und initialen Tumorfrühformen (z.B. bei immunssupprimierten Patienten) kann der Einsatz von destruierenden Verfahren wie Kürettage, Kryotherapie, photodynamische Therapie und Lasertherapie ohne histologische Kontrolle sinnvoll sein. Ebenso kann bei diesem Patientenkollektiv eine lokale Immuntherapie oder Chemotherapie mit Imiquimod bzw. 5-Fluorouracil erfolgen (Breuninger 2005). Die Strahlentherapie stellt eine weitere Option zur Behandlung von Plattenepithelkarzinomen der Haut dar (Details siehe Kap. 17.3.2). Sie ist vom Ergebnis mit der Exzision mit konventioneller Histologie vergleichbar. Bei erwarteter vollständiger Resektion ist die mikrographische Chirurgie jedoch vorzuziehen (Locke 2001). Bei Verdacht auf Lymphknotenmetastasen sollte eine Lymphadenektomie durchgeführt werden. Eine Wächterlymphknotenbiopsie kann im Rahmen der Ausbreitungs- 16 1.2.2 Maligne epitheliale Tumoren diagnostik erfolgen. Bei inoperablen Lymphknotenmetastasen bietet die Strahlentherapie eine Alternative. Bei inoperablen oder metastasierten Plattenepithelkarzinomen kann eine systemische Chemotherapie erwogen werden. Trotz guter Ansprechraten stellen diese Therapieoptionen in der Regel keinen kurativen Ansatz dar. Neben einer MethotrexatMonotherapie sind Kombinationen, bestehend unter anderem aus Cisplatin und 5Fluorouracil oder Cisplatin und Doxorubicin, eingesetzt worden (Breuninger 2005). Über eine erfolgreiche Anwendung von Interferon-α und Retinoiden wurde in Einzelfällen berichtet (Lippmann 1997). Prognose Klinische Faktoren für die Prognose von Plattenepithelkarzinomen der Haut sind Lokalisation, Tumorgröße, der Lymphknotenstatus, das Ausbreitungsstadium, das Vorkommen von Rezidiven und eine mögliche Immunsuppression des Patienten. Was die Lokalisation betrifft, haben Plattenepithelkarzinome der Helix und der Unterlippe mit 10% bzw. 8% Metastasenhäufigkeit eine etwas schlechtere Prognose gegenüber sonstigen Lokalisationen mit etwa ca. 6% Häufigkeit (Breuninger 2005). Die Prognose ist im Falle einer Metastasierung generell ungünstig. Bei lymphogener Metastasierung beträgt die 10-Jahresüberlebensrate weniger als 20%, bei Fernmetastasierung weniger als 10% (Alam 2001). Histopathologisch relevant sind die Tumordicke, der Tumortyp, der Differenzierungsgrad und die Resektionsränder (Breuninger 2005). Nachsorge Die Nachsorge mit klinischer Untersuchung und Lymphknoten-Sonographie sollte beim kutanen Plattenepithelkarzinom in der Regel über 5 Jahre erfolgen. Bei Patienten mit erhöhtem Risiko, z.B. nach Organtransplantation, werden dreimonatige Nachsorgeintervalle in den ersten 2 Jahren empfohlen, danach halbjährliche im 3. Jahr und ab dem 4. Jahr lediglich klinische Kontrolluntersuchungen. Bei niedrigem Risiko werden halbjährliche Kontrollen angeraten, ab dem 3. Jahr kann auf die Lymphknotensonographie verzichtet werden (Breuninger 2005). Literatur Alam M, Ratner D. Cutaneous squamous-cell carcinoma. N Engl J Med 2001; 344:975-83 Breuninger H, Sebastian G, Kortmann RD, Wolff K, Bootz F, Garbe C. Deutsche Leitlinie: Plattenepithelkarzinom der Haut, der Lippen und der Augenlider. In: Garbe C. Interdisziplinäre Leitlinien zur Diagnostik und Behandlung von Hauttumoren. Georg Thieme Verlag Stuttgart 2005; Seiten 12-22 Gray DT, Suman VJ, Su WP, Clay RP, Harmsen WS, Roenigk RK. Trends in the populationbased incidence of squamous cell carcinoma of the skin first diagnosed between 1984 and 1992. Arch Dermatol 1997; 133:735-40 Heenan PJ, Elder DJ, Sobin LH. Histological typing of skin tumours. 26. WHO International Histological Classification of Tumours. Berlin, Heidelberg, New York, Tokyo: Springer, 1996. Leibovitch I, Huilgol SC, Selva D, Hill D, Richards S, Paver R. Cutaneous squamous cell carcinoma treated with Mohs micrographic surgery in Australia II. Perineural invasion. J Am Acad Dermatol 2005; 53:261-6 Lippman SM, Lotan R, Schleuniger U. Retinoid-interferon therapy of solid tumors. Int J Cancer 1997; 70:481-3 Locke J, Karimpour S, Young G, Lockett MA, Perez CA. Radiotherapy for epithelial skin cancer. Int J Radiat Oncol Biol Phys 2001; 51:748-55 Marks R, Rennie G, Selwood TS. Malignant transformation of solar keratoses to squamous cell carcinoma. Lancet 1988; 1:795-7 1.2 Maligne Tumoren 17 Mashberg A, Samit A. Early diagnosis of asymptomatic oral and oropharyngeal squamous cancers. CA Cancer J Clin 1995; 45:328-51 Rowe DE, Carroll RJ, Day CL Jr. Prognostic factors for local recurrence, metastasis, and survival rates in squamous cell carcinoma of the skin, ear, and lip. Implications for treatment modality selection. J Am Acad Dermatol 1992; 26:976-90 Wittekind C, Meyer HJ, Bootz F. UICC (International Union against Cancer), TNM Klassifikation maligner Tumoren. 6. Auflage, Berlin, Heidelberg, New York, Tokio: Springer 2002 Zurück zum Inhaltsverzeichnis: DNO © BBS-Verlag Wiesbaden