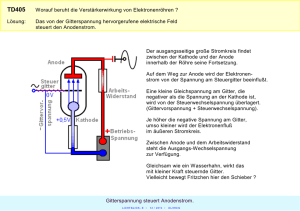
Einrichten von Redoxgleichungen
Werbung

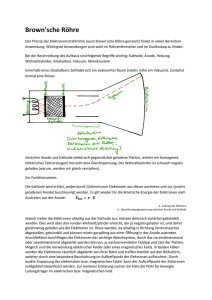
Ch KS2/ Zop Elektrochemie Zitronenbatterie Problemstellung Nehmen Sie Stellung zu folgender Aussage: Die Zitronenbatterie ist DIE Energiequelle des 21. Jahrhunderts: Sie funktioniert absolut emissionsfrei und ist zu 100% regenerativ, denn sie produziert Strom aus einem nachwachsenden Rohstoff: Zitronen! Auftrag Verwenden Sie als Argumentationsgrundlage die Erkenntnisse aus folgenden Versuchen: Material/Chemikalien: Kartoffel, Zitrone, Eisennägel, Kupfernägel, Phenolphthalein, Spannungsmessgerät, Elektromotor Durchführung: Eisennagel und Kupfernagel in nicht allzu großer Entfernung voneinander in eine halbe Kartoffel bzw. eine halbe Zitrone stecken. 1. Kartoffel-Batterie Spannung zwischen den Elektroden messen. Beobachtungen, Erklärung durch Elektrodenreaktionen. 2. Kartoffel vs. Zitrone Mit halber Zitrone, Eisen- und Kupfernagel eine Zitronenbatterie bauen. Spannung messen. Vergleich der Spannungen von Kartoffel und Zitrone, Erklärung 3. Kartoffel/ Zitronen-Kraftwerk Versuchen Sie, mit einem „KartoffelKraftwerk“ oder einem „Zitronen-Kraftwerk“ einen Elektromotor zum Laufen zu bringen (ohne Gewähr auf Erfolg…). Ch KS2/ Zop Elektrochemie Lösung Zitronenbatterie Steckt man ein Kupferblech und ein Zinkblech in eine Zitrone oder einen Apfel, erhält man eine galvanische Zelle. Die saure Lösung in der Zitrone wirkt als Elektrolyt. Der Lösungsdruck an der Zinkelektrode ist größer als an der Kupferelektrode, da Zink ein unedleres Metall ist. Das Zink wird eher oxidiert als das Kupfer, es entstehen am Zink Elektronen, die zum Kupferblech fließen. Die Zinkelektrode als Ort der Oxidation funktioniert als Anode und ist bei dieser Batterie der Minuspol. Enthält das Kupferblech noch Kupferoxid auf der Oberfläche, werden zunächst die Kupferionen aus dem Kupferoxid reduziert. Diese Reaktion an der Kathode ist aber nur eine unbedeutende Nebenreaktion: Oxidation (Anode) Reduktion (Kathode) Zn Zn2+ + 2eCu2+ + 2e Cu Sind die Kupferionen aus dem Kupferoxid aufgebraucht, werden bei der Zitronenbatterie am Kupferblech, das als Kathode funktioniert, Oxoniumionen aus dem Zitronensaft reduziert. Oxidation (Anode) Reduktion (Kathode) verkürzt: Zn Zn2+ + 2e 2 H3O+ + 2e 2 H2O + H2 + 2H + 2e H2 In der Zitronenbatterie ist außerdem noch eine weitere Reaktion möglich. Die Reduktion von Sauerstoff an der Kathode. Sie erzeugt die größte Spannung. Oxidation (Anode) Reduktion (Kathode) verkürzt: 2 Zn 2 Zn2+ + 4e O2 + 4 H3O+ + 4e 6 H2O + O2 + 4 H + 4e 2 H2O In der Kartoffelbatterie ist nur die Reaktion im neutralen Bereich mit geringerem Standardpotential möglich, da keine Säure in der Kartoffel vorliegt. Die Spannung ist deshalb geringer als in der Zitronenbatterie. Oxidation (Anode) Reduktion (Kathode) 2 Zn 2 Zn2+ + 4e O2 + 2 H2O + 4e 4 OH- Ch KS2/ Zop Elektrochemie Weitergehende Information: Der gleiche Prozess wie an der Kupferelektrode läuft auch an der Zinkelektrode ab. Daher arbeitet die Zitronenbatterie nicht sonderlich effektiv, denn nur ein Teil der Elektronen, die bei der Zinkelektrode durch das Auflösen des Zinks freigesetzt werden, fließt zum Pluspol. Ein anderer Teil dieser Elektronen reagiert mit den Oxoniumionen der Lösung zu Wasser und Wasserstoff.