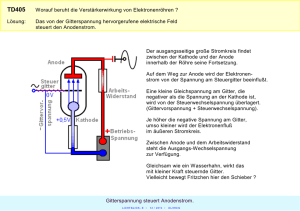
Document
Werbung
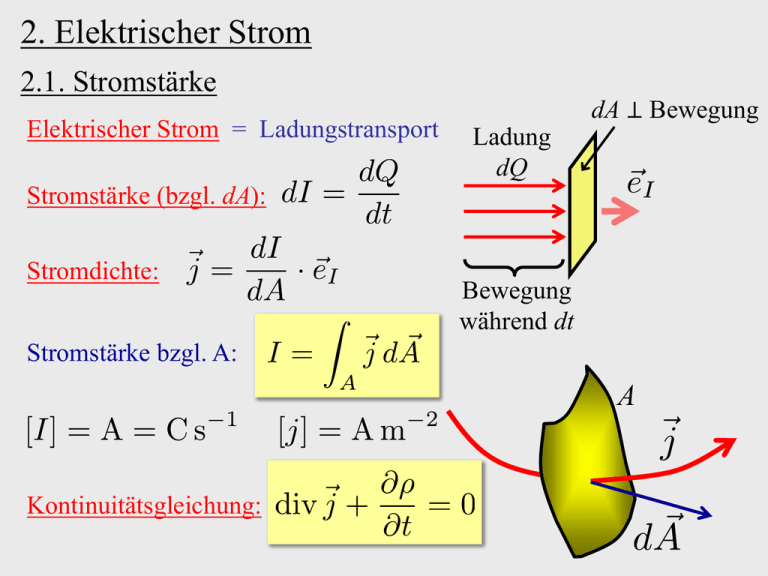
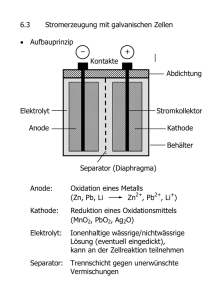
2. Elektrischer Strom 2.1. Stromstärke Elektrischer Strom = Ladungstransport dA ⊥ Bewegung Ladung dQ Stromstärke (bzgl. dA): Stromdichte: Bewegung während dt Stromstärke bzgl. A: A Kontinuitätsgleichung: Beweis der Kontinuitätsgleichung: (→ Tafel) Ladungserhaltung ⇒ Oberfläche ∂V Beliebiges Volumen V Gaußscher Satz ⇒ Folgerung: für beliebige V ☐ Leitungsmechanismen: • Elektronische Leiter: Metalle, Halbleiter Ladungsträger hauptsächlich Elektronen • Ionen-Leiter: Elektrolyte, Isolatoren mit Fehlstellen Ladungsträger hauptsächlich positive und negative Ionen • Gemischte Leiter: Plasmen Ladungsträger: Elektronen und Ionenrümpfe; z.B. in Gasentladungen Mikroskopische Theorie: n±: Anzahldichte positiver (negativer) Elementarladungen : zugehörige Transportgeschwindigkeiten 2.2. Ohmsches Gesetz Bahn eines Leitungselektrons Betrachte elektronische Leiter (Metalle) a) typische instantane Geschwindigkeit (T-abhängig): Stöße an Atomen des Festkörpers ⇒ ungeordnete Bewegung mittlere freie Weglänge ( zwischen zwei Stößen ): 𝚲 mittlere Zeit zwischen zwei Stößen: Beispiel: Kupferdraht bei Zimmertemperatur b) Bahn eines Leitungselektrons Bsp.: Cu-Draht, E = 100 V/m Def.: Driftgeschwindigkeit Pro Ladungsträgersorte folgt: Stöße ⇒ völlige Randomisierung der Bewegungsrichtung ⇒ Ladungstransport Bahn eines Leitungselektrons Stöße ⇒ völlige Randomisierung der Bewegungsrichtung Definition: elektrische Leitfähigkeit Beweglichkeit → stark T-abhängige Materialparameter; oft unabhängig von Folgerung: Ohmsches Gesetz Spezialfall: homogener Leiter, konstanter Querschnitt über Querschnitt homogen A L U Ohmsches Gesetz elektrischer Widerstand A L U spezifischer Widerstand (Materialparameter) Allgemein: Seien U, I = Spannung, Strom zwischen zwei Kontakten. Dann wird der elektrische Widerstand zwischen den Kontakten definiert durch: R Schaltzeichen Beispiel: quasistatisches Auf-/Entladen eines Kondensators ≈ Folge statischer Situationen I R U0 schließt bei t = 0 UR I Q C UC UC Bemerkung: I U0/R Lösung: 𝜏 t I R U0 schließt bei t = 0 UR I Q C UC UC I U0/R Kondensatorspannung: 𝜏 t 𝜏 t UC U0 2.3. Stromleistung und Joulsche Wärme R Arbeit des E-Feldes: Q Elektrische Leistung: 𝜙1 U=𝜙1 − 𝜙2 𝜙2 Umwandlung in Wärme U = const. Ohmsches Gesetz ⇒ Einheiten: 2.4. Kirchhoffsche Regeln Analyse von Netzwerken von Leitern, (allgemeinen) Widerständen, Spannungs- / Stromquellen, … a) Knotenregel: Knoten = punktförmige Leiterverbindung (ungeladen) I1 I 2 I5 I3 V→0 I4 Ladungserhaltung: auslaufend: I>0 einlaufend: I<0 b) Maschenregel: Masche = geschlossener Weg offener Weg U 𝜙1 𝜙2 Masche 𝜙1 = 𝜙2 Zerlegung in Teilspannungen entlang der Masche ⇒ c) Anwendung: Masche = Schleife in der Schaltung I1 I1 − + I1 Q2 R1 I5 I2 I3 C Masche + − I5 + − I4 I3 R2 R3 I4 I3 I3 Anwendung (1): Reihenschaltung ohmscher Widerstände I R1 I R2 I Rn I I I + U0 Maschenregel ⇒ I − Anwendung (2): Parallelschaltung ohmscher Widerstände U0 I U0 0 Knotenregel ⇒ I1 I2 R1 U0 R2 In U0 Rn Anwendung (3): Spannungsteiler U0 I U(x) Potentiometer I d R I x 0 I U0 Ix = 0 U(x) 0 d x Anwendung (4): Wheatstonesche Brückenschaltung Nullabgleich: U0 x A R1 I U 1 d R U2 Rx 0 „Amperemeter” 2.5. Messgeräte a) Wärmewirkung: Hitzdraht-Amperemeter I I l δl Erhitzung ⇒ l b) Magnetische Wirkung: Galvanometer Drehbare Spule Zeiger Drehspulgerät: (analog: Dreheisengerät) N S I I Permanentmagnet Innenwiderstand des Amperemeters: A ̂ A Ri Innenwiderstand real ideal I Beispiel: R R + U − + Ri − U ⇒ Ri sollte möglichst klein sein! A Indirekte Spannungsmessung mit Amperemetern: A Rp Ip I R Ip U Spannung ohne Messgerät: gesucht! Spannung mit Messgerät: gemessen! ⇒ Innenwiderstand eines Voltmeters sollte möglichst groß sein! 2.6. Elektrolytische Leitung von Strom Elektrolyt: Flüssigkeit mit frei beweglichen Ionen (geladene Moleküle) z.B. Salzlösungen, Säuren, Laugen Bildung eines Elektrolyts: − Molekül mit Ionenbindung O ̂ − + + H H Wasser-Molekül Dissoziation ( Aufspaltung in Wasser da energetisch günstiger ) − U0 + + − Elektrolyt Anion Kation Kathode (Minuspol) Anode (Pluspol) − Neutralisierung der Ionen an Elektroden ⇒ U0 + • Ablagerungen auf Elektroden + − • Aufsteigen von Gasbläschen an Elektroden • Auflösen von Elektroden Elektrolyt Kathode (Minuspol) Anode (Pluspol) Spezialfall: Dissoziation von Wasser H 2O H OH ⇒ (geringe) Leitfähigkeit von Wasser Erhöhung der Leitfähigkeit durch Zugabe von Salz etc. Knallgaserzeugung mit Kochsalzlösung: Dissoziation von Kochsalz: Na Cl → Na+ + Cl− Kathode: 2 Na+ + 2 H2O + 2 e− → 2 Na OH + H2↑ Anode: 4 Cl− + 2 H2O → 4 H Cl + O2↑ + 4 e− ⇒ 2 H2-Moleküle + 1 O2-Molekül ⇒ Knallgas Knallgaserzeugung mit verdünnter Schwefelsäure: Dissoziation Schwefelsäure: H2 SO4 → 2 H+ + SO42− Kathode: 2 H+ + 2 e− → H2↑ Anode: SO42− + H2O → H2 SO4 + ½ O2↑ + 2 e− ⇒ 2 H2-Moleküle pro O2-Molekül ⇒ Knallgas Kupferbeschichtung ( Rostschutz ): Dissoziation Kupfersulfat: Cu SO4 → Cu2+ + SO42− Kathode (z.B. Nickel): Cu2+ + 2 e− → Cu (galvanische Beschichtung) Anode: SO42− → SO4 + 2 e− a) Kohlestab 2 H2O + 2 SO4 → 2 H2 SO4 + O2↑ b) Kupfer (Opferelektrode) Cu + SO4 → Cu SO4 (Auflösung) Bleibaum: Dissoziation Bleiacetat: Pb ( CH3COO )2∙3H2O Pb2+ Bleikathode: CH3COO− Pb – Ablagerung (Bleibaum) Bleianode (Opferanode): Pb + 2 CH3COO− → Pb ( CH3COO )2 + 2 e− Leitfähigkeit und Ionenkonzentration: 𝜎el A: Ladungsträgerdichte steigt B: Beweglichkeit nimmt ab (Anziehung von Kationen und Anionen) A B Def.: Faraday-Konstante n Folgerung: 1 Mol eines Ions mit Ladg. Z·e transportiert die Ladg. Z·F Definition: Elektrochemisches Äquivalent = Proportionalitätsfaktor zwischen abgeschiedener Masse und transportierter Ladung 2.7. Stromquellen Ri Klemmspannung: U0 = EMK U V U0 heißt ElektroMotorische Kraft Ra Stromquelle Messung von U(Ra) ⇒ Messung von Ri und EMK Beispiele für Stromquellen: a) Elektrodynamische Generatoren (Dynamo, → Elektrodynamik, s. u.) b) Solarzellen ( → Halbleiterphysik ) c) Galvanische Elemente: Lösung von Metall in Elektrolyt Metall + −− −− Ion e e + Elektrolyt DiffusionsGleichgewicht Metall − + +− − + +− + − − − + + Elektrolyt abschirmendes E-Feld ⇓ Potentialdifferenz Galvanisches Element (Prinzip): poröse Wand 0 Metall1 Elektrolyt1 Elektrolyt2 Metall2 U Referenzelektrode: H2-umspülte Platinelektrode in 1-normaler Säure 1 Mol H+ /l Spannungsreihe: Galvanische Spannung gegenüber Referenzelektrode (Metalle in 1-normalem Elektrolyt mit gleichem Metallion) 1 Mol Metallionen /l Edle Metalle: U > 0 (Cu, Ag, Au,…) geben schwer Elektronen ab Unedle Metalle: U < 0 (Fe,…) geben leicht e− ab ⇔ oxydationsfreudig Daniell-Element: 0 Cu poröse Wand Cu SO4 Zn SO4 2e− 2e− H2SO4 / H2O Cu + + + + + + + + Cu++ + + U Zn + + + + + SO42−+ + Zn + + + + + + Zn+++ + + + + 𝛥𝜙 = 𝛥E = E( Cu-Abscheidung ) − E( Zn-Auflösung ) Bemerkung: Cu SO4 als gemeinsames Elektrolyt möglich, aber ZnElektrode würde sich mit Kupfer überziehen! d) Akkumulatoren: Wiederaufladbare Stromquellen Pb Pb SO4 Schicht Beispiel: Bleiakku H2SO4 /H2O Aufladen: Anode: Pb SO4 + 2 H2O → Pb O2 + H2SO4 + 2 H+ + 2 e− Kathode: Pb SO4 + 2 H+ + 2 e− → Pb + H2SO4 ⇒ Anode = Pb O2 ; Kathode = Pb Entladen: Anode: Pb O2 + SO42− + 4 H+ + 2 e− → Pb SO4 + 2 H2O Kathode: Pb + SO42− → Pb SO4 + 2 e− ⇒ Anode = Pb SO4 ; Kathode = Pb SO4 Analog: Trockenbatterie (Leclanché-Element) Pb e) Thermoelektrizität Energieniveaus der Energie freier Elektornen (ruhend) Leitungselektronen E − − WA − − − − − − − − MetallOberfläche Austrittsarbeit Vakuum Def.: Kontaktpotential U12 = 𝛥WA zwischen zwei sich berührenden Metallen 1, 2 stark Temperaturabhängig Thermoelement: (Seebeck-Effekt) Metall 1 Metall 2 > T1 Metall 1 T2 V Thermospannung: Uth Peltier-Effekt: T1 Metall 1 T2 Metall 2 I Metall 1 I + − Uext