6.3 Stromerzeugung mit galvanischen Zellen • Aufbauprinzip
Werbung

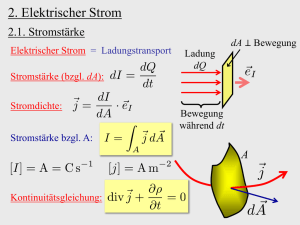
6.3 Stromerzeugung mit galvanischen Zellen • Aufbauprinzip – + Kontakte Abdichtung Elektrolyt Stromkollektor Anode Kathode Behälter Separator (Diaphragma) Anode: Oxidation eines Metalls 2+ 2+ + (Zn, Pb, Li Zn , Pb , Li ) Kathode: Reduktion eines Oxidationsmittels (MnO2, PbO2, Ag2O) Elektrolyt: Ionenhaltige wässrige/nichtwässrige Lösung (eventuell eingedickt), kann an der Zellreaktion teilnehmen Separator: Trennschicht gegen unerwünschte Vermischungen • Arten von galvanischen Zellen Primärzellen sind Einmal-Zellen, bei denen keine Wiederaufladung möglich ist. Sekundärzellen (Akkumulatoren) sind Zellen, bei denen die Ausgangsstoffe durch einen Aufladeprozess regeneriert werden können. Entladen - galvanische Zelle Laden - elektrolytische Zelle Batterien sind eine aus mehreren Zellen bestehende Einheit. Der Begriff wird ebenfalls umgangssprachlich für eine einzelne galvanische Zelle verwendet (Primärbatterie, wieder aufladbare Batterie). Galvanische Zellen sollten eine möglichst hohe elektrische Leistung abgeben - möglichst hohe Zellspannung - hoher Stromfluss über lange Zeit Dabei sollten sie ein geringes Volumen und eine geringe Masse besitzen. Die lieferbare Energiemenge wird vor allem durch Art und Masse der Elektroden bestimmt. Überblick über galvanische Zellen (Schmidt, 2003) Zelle Typ Anode (-) Leclanché-Element (saure Zink-Braunstein-Zelle, "Zink-Kohle-Batterie") P Alkali-Mangan-Zelle (alkalische Zink-Braunstein-Zelle) P Zink-Silberoxid-Knopfzelle Elektrolyt Kathode (+) Zellspannung NH4Cl, ZnCl2 MnO2 1,5 - 1,6 V KOH MnO2 1,58 V P KOH Ag2O 1,85 V Zink-Luft-Knopfzelle P KOH O2 1,67 V Blei-Akkumulator S Pb H2SO4 PbO2 2,04 V Nickel-Cadmium-Akkumulator S Cd KOH NiO(OH) 1,35 V Nickel-Metallhydrid-Akkumulator S "H2" KOH NiO(OH) 1,35 V Brennstoff-Zelle P H2 KOH O2 1,3 V Lithium-Zelle P Li LiClO4, LiBF4 MnO2 3V Lithium-Ionen-Akkumulator S LixC6 LiClO4, LiBF4 LixMn2O4 4,1 V Zn • Einige Primärzellen Alkali-Mangan-Zelle (alkalische Zink-Braunstein-Zelle) ∆E = 1,5 V Selbstentladung 3 - 5 % / Jahr Heute frei von Hg, Zn-Pulver statt dessen mit Pb, In legiert (sonst H2-Bildung) Anwendung in Elektrokleingeräten wie Uhren, Radios, Spielzeug, Taschenlampen u. a. m. Weltweiter Verkauf 1997 ca. 35 Mrd. Zellen! - - Anode: Zn + 2 OH Kathode: 2 MnO2 + 2 H2O + 2 e J 2 MnO(OH) + 2 OH Gesamt-: reaktion Zn + 2 MnO2 + 2 H2O J Zn(OH)2 + 2 MnO(OH) Elektrolyt: KOH J Zn(OH)2 + 2 e - Zink-Luft-Knopfzelle ∆E = 1,4 V Selbstentladung 6 - 7 % / Jahr Mehr Raum für Anodenmaterial als Zn/Ag2O- oder Zn/HgO-Zelle Verklebte Luftlöcher während der Lagerung, Zellreaktion läuft erst nach Abzug der Klebefolie ab Lange Lagerfähigkeit Anwendung häufig in Hörgeräten - - Anode: Zn + 2 OH Kathode: ½ O2 + H2O + 2 e J 2 OH- Gesamt-: reaktion Zn + ½ O2 + H2O J Zn(OH)2 Elektrolyt: KOH J Zn(OH)2 + 2 e - • Sekundärzellen (Akkumulatoren) Bleiakkumulator ∆E = 2,0 V; bei 6 Zellen in Reihe 12 V Selbstentladung bei 0,1 - 0,5 % / Tag Lebensdauer von maximal 1500 Ladezyklen Aufladen bei Entladeschlussspannung ab 1,75 V notwendig erste Batterie bereits 1859 konstruiert (Gaston Planté) Elektrolyt Schwefelsäure von 37 M.-% (4,8 mol/L, ρ = 1,28 g/mL, höchste Leitfähigkeit); im entladenen Zustand 8 M.-% (c = 0,8 mol/L, ρ = 1,05 g/mL) Anwendung als Starterbatterie für KFZ, Notstromaggregate u. a. m. ePb e- U – 0 ∆E = 2 V + PbO2 H2SO4 Anode Kathode 2 H+ + SO42- Anode: Pb (s) + SO42- J Kathode: PbO2 (s) + SO42- + 4 H+ + 2 e- J PbSO4 (s) + 2 H2O Entladen PbO2 + Pb +2 H2SO4 Laden 2 PbSO4 + 2 H2O Gesamtreaktion: Elektrolyt: PbSO4 (s) + 2 e- H2SO4 Technischer Aufbau Anode: Bleigitter mit Bleischwamm gefüllt Kathode: Bleigitter mit PbO2 gefüllt Lithium-Ionen-Akkumulator ∆E = 3,6 V / 3,8 V Lebensdauer von 500 Ladezyklen, geringe Selbstentladung von 1 % / Monat Als Anode metallisches Lithium in Graphit-Schichtgitter eingelagert (Einschlussverbindung LixC6) Verschiedene Bauarten je nach Kathodenmaterial (Oxidationsmittel LixMn2O4, Li1-xCoO2) Reversible Einlagerung von Li+-Ionen! Aufladen bei Entladeschlussspannung ab 2,5 V notwendig Kein Memory-Effekt, aber Kapazitätsverlust bei Tiefentladung (unterhalb Entladeschlussspannung) Elektrolyte in nichtwässrigen (organischen) Lösungsmitteln Relativ leicht, Anwendung in Mobiltelefonen, Digitalkameras, Notebooks, Elektrofahrzeugen! - J Li+ + e Anode: Li Kathode: LixMn2O4 + Li+ + e- J Lix+1Mn2O4 Entladen Gesamt-: reaktion Li + LixMn2O4 Elektrolyt: Li[BF4], LiClO4, Li[PF6] Laden Lix+1Mn2O4 • Brennstoffzellen Brennstoffzellen sind galvanische (Primär)Elemente, bei denen Reduktionsmittel (Brennstoff) und Oxidationsmittel (Sauerstoff) den porösen Elektroden kontinuierlich von außen zugeführt werden. Sie benötigen eine hohe hohe Arbeitstemperatur (80 - 100 °C). Kalte Verbrennung mit hohem Wirkungsgrad von bis zu 70 % Systeme auf Basis H2/O2, CH4/O2 und CH3OH/O2 umweltfreundlich, leise, effizient Antrieb von Verkehrsmitteln - Straße, Wasser, Luft, Weltraum Stromversorgung mit dezentraler / zentraler Kraft-Wärme-Kopplung Funktionsprinzip saure Brennstoffzelle ∆E0 = 1,23 V H2 e- U O2 e- Pt Pt - + Anode H+ Oxidation H+ SO42- H2SO4 - Lösung Anode: 2 H2 J 4 H+ + 4 e- Kathode: O2 + 4 H+ + 4 e- J 2 H2O Gesamtreaktion: 2 H2 + O2 J 2 H2O Elektrolyt: H2SO4 Kathode Reduktion ⋅ Moderne Brennstoffzellen mit Membran-ElektrodenEinheit (MEA) Kathode Anode + H2O Gasdiffusionselektrode, z. B. Ruß/Platin – H2 Dicke 0,1 – 0,5 mm H+ O2 H2O H+ H2 H+ H2 O2 H2O O2 Elektrodenreaktion An-und Abtransport fest, flüssig Elektrolyt 2 H2 J 4 H+ + 4 eO2 + 4 H+ + 4 e- J 2 H2O Ruhespannung: 0,9 – 1,2 V Betriebsspannung : 0,5 – 0,7 V Oxidation Reduktion Zellenstapel (Stack) Reihenschaltung von Zellen für hohe Spannungen und Leistungen Trennung der MEA´s mit Bipolarplatten gasdichte Separierung, Gasversorgung und Stromableitung Übersicht über verschiedene Typen von Brennstoffzellen (BZ) Typ Elektrolyt Betriebstemperatur Elektrischer Wirkungsgrad Verwendung Alkalische BZ (AFC) KOH < 100 °C max. 65 - 70 % Kleinanlagen 5-150 KW Polymerelektrolytmembran BZ (PEMFC) protonenleitende Membran 60 – 120 °C max. 50 – 68 % Kleinanlagen 5 - 250 KW Phosphorsaure BZ (PAFC) H3PO4 160 – 220 °C max. 55 % Kraftwerke 50 KW - 11 MW Carbonatschmelzen BZ (MCFC) Li2CO3 K2CO3 Schmelze 600 – 660 °C max. 65 % Kraftwerke 100 KW - MW Oxidkeramische BZ (SOFC) ZrO2 mit Y2O3 800 – 1000 °C max. 60 – 65 % Kraftwerke 100 KW - MW Alkalische Brennstoffzelle ∆E0 = 1,23 V - H2 e- + O2 OH- OH- OHH2O Anode Elektrolyt Kathode KOH Anode: 2 H2 + 4 OH- J 4 H2O + 4 e- Kathode: O2 + 2 H2O + 4 e- J 4 OH- Gesamtreaktion: 2 H2 + O2 J 2 H2O