Chemie Zusammenfassung 26.04.10
Werbung

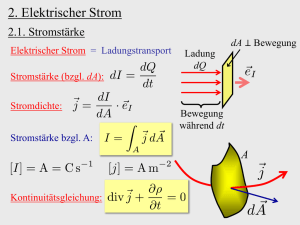
Chemie Zusammenfassung Mark Kremer 28.04.10 Elektrolyse und Galvanische Zelle als Anwendung bei Primär- sowie Sekundärelementen Volta Element Wie bei der Maschenregel ergibt sich beim Hintereinanderschalten der Spannungsquellen U ges U 1 U 2 U 3 Elektrische Arbeit definiert sich wie folgt: Wel P T U I T , es gilt: Wel 1Kwh 1KWh 3,6 10 6 J Primärzellen Primärzellen bzw. Primärelemente sind Spannungsquellen, welche nicht wiederaufladbar sind. Zink – Luft Batterie: Minuspol: Zinkpulver Pluspol: luftdurchlässige, mehrschichtige Gasdiffusionselektrode Hauptreaktionen: Minuspol: 2Zn( s ) 2Zn(2aq ) 4e Pluspol: O2( g ) 2 H 2 O(l ) 4e 4OH (aq) Nebenreaktion: Zn(2aq ) 4OH (aq) Zn(OH ) 24 Lithium Batterie Minuspol: Lithiumperchlorat (LiClO4) Pluspol: Mangan(IV)-oxid (MnO2) oder Kupfersulfid oder Silberchlorid Hauptreaktionen: Minuspol: Li( s) Li e Pluspol: Li e Mn O2( s ) Li Mn O2( s ) IV III Sekundärelemente Sekundärelemente sind, im Gegensatz zu Primärelementen, wiederaufladbar, wobei die Anzahl der Wiederaufladungen begrenzt sind. Beim Sekundärelement findet Elektrolyse statt: -1- Chemie Zusammenfassung Mark Kremer 28.04.10 Fakten - Chemische Zerlegung von Stoffen durch das anlegen einer Spannung Es ist eine erzwungene chemische Reaktion Endothermer Verlauf Elektrische Leitfähigkeit durch den Ladungstransport der freibeweglichen hydratisierten Elektronen Damit eine Reaktion stattfinden kann, muss eine gewisse Spannung (Energie) aufgebracht werden, sog. Zersetzungsspannung Ablauf - - Ein Gleichstrom wird an zwei Elektroden, getaucht in eine leitfähige Flüssigkeit (Elektrolyt) angelegt es findet eine Redoxreaktion statt o Redoxreaktion: Chemische Reaktion bei der gleichzeitig Elektronen abgegeben und aufgenommen werden An der Anode findet eine Oxidation statt (Elektronenabgabe) An der Kathode findet eine Reduktion statt (Elektronenaufnahme) Der Blei-Akku Die Hauptsächliche Verwendung ist als Autobatterie, da zum Starten ein hoher Strom benötigt wird, weshalb zudem die Oberfläche sehr groß ist. Durch die Temperatur wird die Leistung ebenso gemindert, da durch die geringe Ionenbeweglichkeit und der Verlangsamung der Reaktion der Innenwiederstand steigt. Beim Entladevorgang laufen die Reaktion wie bei einem Galvanischem Element ab: Anode (Oxidation): Pb( s ) SO42(aq) PbSO4( s ) 2e IV II VI II Kathode (Reduktion): Pb O2( s ) SO42(aq) 4H (aq) 2e Pb S O 4( s ) 2H 2 O(l ) Beim Aufladen werden die Reaktionen umgekehrt: II VI II IV Anode (Oxidation): Pb S O 4( s ) 2H 2 O(l ) Pb O2( s ) SO42(aq) 4H (aq) 2e Kathode (Reduktion): PbSO4( s ) 2e Pb( s ) SO42(aq) Redoxpotential des Bleiakkus Nernst Gleichung für die Anode (Aufladen): PbO H SO H 0,059V 2 2 4 E A E ( Pb( II ) / Pb( IV )) log 2 PbSO 4 0 -2- 2 Chemie Zusammenfassung Mark Kremer 28.04.10 Nernst Gleichung für die Kathode (Aufladen): PbSO H 2 0,059V 4 E K E ( Pb(0) / Pb( II )) log 2 H 2 SO4 Pb 0 Merke: Da Pb , PbSO4 und PbO2 Festkörper sind, sind sie Konzentrationsunabhängig, also ist die Aktivität 1. 0,059V E E 0 ( Pb( II ) / Pb( IV )) log H 2 E E 0 0,059 log H 2 SO4 V 2 H 2 0,059V 0 H 2 SO4 E ( Pb(0) / Pb( II )) log H 2 SO4 2 Zersetzungsspannung Zum zersetzen eines Materials braucht man eine Zersetzungsspannung, weicht die Spannung von der erwarteten Spannung ab, so nennt man die Überspannung oder Überpotential. Die Überspannung [EÜ] ist von folgenden Foktore abhängig: 1. Die Stromdichte [J] in A cm² 2. Es bildet sich eine Gegenspannung (Polarisationsspannung) durch z.B. die Reaktion mit Hydronium Ionen bei bereits niedrigen Spannungen 3. Der Weg/Durchtritt der Elektronen von der Elektrodenoberfläche bis an den Rand der Schicht der bereits entladenen Gasatome ist land, was einen hohe Widerstand zur Folge hat. Bei Metallen ist die Überspannung gering, da keine „Sperrschicht“ entsteht. Es gilt: Das tatsächliche Abscheidungspotential EA EA = E(Red/Ox) + EÜ Zersetzungsspannung: UZ = EA (Anode/Pluspol) – EA (Kathode/Minuspol) Merke: Es läuft der Gesamtvorgang ab, welcher die kleinste Zersetzungsspannung erfordert Entladungsstrom Entnehmbare Elektrizitätsmenge eines Akkumulators. Entladedauer tn, zugehöriger Entladestrom In, Dichte und Temperatur des Elektrolyten sind für Kn festgelegt. Die Entladeschlussspannung Us wird dann nicht unterschritten. Es bedeutet z.B. K20= 44Ah, dass 20h lang eine Stromstärke von 2,2 A entnommen werden kann ( 20h 2,2 A 44 Ah ) Es gilt für I = konstant I t Q [Q] = As -3-