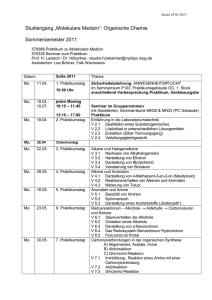
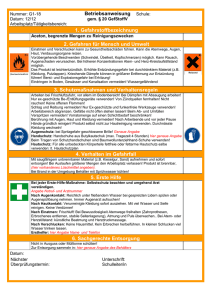
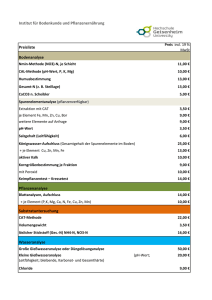
allgemeines - Justus-Liebig
Werbung

JUSTUS-LIEBIG-UNIVERSITÄT GIESSEN ANLEITUNG ZUM BLOCKPRAKTIKUM EINFÜHRUNG IN DIE ALLGEMEINE CHEMIE FÜR STUDIERENDE DER LEBENSMITTELCHEMIE, DES LEHRAMTS (L3) SOWIE DER PHYSIK Einführung in die Allgemeine Chemie Allgemeines ALLGEMEINES Voraussetzung für die Teilnahme am Praktikum ist die ausgefüllte und abgegeben Einzugsermächtigung sowie der Personalbogen mit Passbild. Das Praktikum findet als Blockpraktikum in der Zeit vom 17. bis 31. März 2008, jeweils von 8:15 bis 18:00 Uhr statt. Im Praktikum sind einfache chemische Reaktionen von allgemeiner Bedeutung qualitativ und quantitativ mit dem Ziel durchzuführen, elementare präparative Arbeitsgänge zu erlernen und die Grundlagen in anorganischer Chemie zu vertiefen. Im Einzelnen ist das Praktikum wie folgt aufgebaut. Montag 17.03.2008 8:15-12:00 Seminar: Vorbesprechung, Arbeitssicherheit, chem. Grundlagen, Präparate 13:00-18:00 Labor: Platzübergabe, Präparate Dienstag 18.03.2008 8:15-10:00 Seminar: Säure/Base, pH, Puffer Mittwoch 19.03.2008 8:15-10:00 Seminar: Redoxreaktionen Donnerstag 20.03.2008 8:15-10:00 Seminar: Elektrochemie Freitag 21.03.2008 10:00-18:00 Labor: Säure/Base, pH, Puffer 10:00-18:00 Labor: Redoxreaktionen 10:00-18:00 Labor: Elektrochemie Montag 24.03.2008 Dienstag 25.03.2008 8:15-12:00 Seminar: Komplexchemie Mittwoch 26.03.2008 8:15-10:00 Seminar: Qualitative Analyse (Anionen) Donnerstag 27.03.2008 8:15-10:00 Seminar: Qualitative Analyse (Kationen) Freitag 28.03.2008 8:15-12:00 Labor: Nachholtermin 13:00-18:00 Labor: Komplexchemie, Präparate 10:00-18:00 Labor: Qualitative Analyse (Anionen) 10:00-18:00 Labor: Qualitative Analyse (Kationen) 13:00-18:00 Labor: Laborputz Karfreitag Ostermontag Das Seminar zum Praktikum findet vormittags im Hörsaal HEG03 statt. Der praktische Teil des Praktikums wird im Anschluss in den Labors 201 oder 301 durchgeführt. Die Mittagspause (etwa eine Stunde) sollte an die Versuche angepasst werden. Am letzten Praktikumstag findet kein Seminar statt, da der Vormittag als Nachholtermin genutzt werden kann. Am Nachmittag ist für alle Laborputz. Jeder Praktikant erhält eine für die Arbeit notwendige Ausrüstung am ersten Praktikumstag. Sie wird an Hand der beigefügten Liste auf Vollständigkeit und Funktionsfähigkeit aller Arbeitsgeräte überprüft und gegebenenfalls ergänzt. 1. Die Platzausrüstung steht während des Praktikums einer Zweiergruppe zur Verfügung. Kosten, die durch Zerstörung oder Verlust von Arbeitsgeräten entstehen, sind von den Platzbenutzern zu tragen. 2. Bei der Übernahme der Platzausrüstung ist auf Vollständigkeit und die Funktionstüchtigkeit jedes einzelnen Arbeitsgerätes zu prüfen. Bei allen Glasgeräten ist besonders darauf zu achten, dass im Glaskörper keine Sprünge vorhanden sind. Sollte ein Arbeitsgerät Mängel aufweisen, so ist dies sofort dem Assistenten bekanntzugeben. Nach der Übernahme der Platzausrüstung werden Reklamationen nicht mehr berücksichtigt. 3. Die persönliche Schutzausrüstung (Kittel und Schutzbrille) ist von jedem Praktikanten, vor Beginn des Praktikums, selbst zu besorgen. Darüber hinaus sollte jeder Praktikant über Küchenrolle, Spülmittel, einen wasserfesten Filzschreiber, ein Feuerzeug und Spülhandschuhe verfügen. 4. Es ist darauf zu achten, dass die zum Platz gehörenden Arbeitsgeräte am Ende jedes Praktikumstages gereinigt und eingeräumt werden. Die am Praktikumstag zu bewältigenden Aufgaben sind dem Skript zu entnehmen und werden in dem vorhergehenden Seminar besprochen. Die für die Versuche benötigten Chemikalien werden vom Institut für Anorganische Chemie kostenlos zur Verfügung gestellt. 1 Einführung in die Allgemeine Chemie Allgemeines Für eine sinnvolle und gewinnbringende Durchführung der Praktikumsaufgaben ist es notwendig, dass sich die Praktikanten auf die Versuche vorbereiten. So müssen die Eigenschaften (z.B. Giftigkeit, Brennbarkeit) der verwendeten Reagenzien und der Reaktionsprodukte bekannt sein. Dazu gehören auch charakteristische Daten der eingesetzten Substanzen soweit sie im Zusammenhang mit der Versuchsdurchführung von Bedeutung sind. Darüber hinaus müssen die durchgeführten Reaktionen an Hand von Reaktionsgleichungen dargestellt werden können. Die Assistenten werden sich über den Vorbereitungsgrad der Praktikanten informieren, bei der Durchführung der Aufgaben jede notwendige Hilfe gewähren und durch Fachgespräche das Wissen der Praktikanten vertiefen. Sie werden weiter darauf achten, dass die Sicherheit am Arbeitsplatz gewährleistet ist. Es steht den Assistenten frei, bei nicht ausreichender Praktikumsvorbereitung oder aus Sicherheitsgründen einen Fehltag zu vergeben. Die praktischen Arbeiten im Labor werden in Zweiergruppen durchgeführt. Der Praktikumstag ist beendet, wenn alle Versuche durchgeführt, das Protokoll abgegeben und der Laborplatz von einem Assistenten abgenommen wurde. Protokolle Von allen durchgeführten Versuchen ist ein mit Tinte, Kugelschreiber oder dünnem Filzstift leserlich geschriebenes Protokoll abzugeben. Mit dem Computer geschriebene Protokolle werden nicht akzeptiert. Die graphischen Darstellungen können mit Bleistift angefertigt werden. Da von jeder Zweiergruppe nur ein Protokoll abgegeben wird, ist es sinnvoll sich mit der Anfertigung des Protokolls abzuwechseln. Alle Protokolle sollten in der Vergangenheitsform abgefasst werden und müssen wie folgt aufgebaut sein: Namen der Praktikanten Datum Angabe des Praktikumstages Titel der Versuche Reaktionsgleichung, Beobachtungen, Farbänderungen, Niederschläge, Messwerte, Tabellen usw. (Es befinden sich Hinweise für das Protokoll in den Versuchsbeschreibungen.) Die Beschreibungen der Versuchdurchführungen (wenn nicht von ihr abgewichen wurde) ist nicht im Protokoll anzugeben. Die Protokolle können zuhause vorbereitet werden und sind am gleichen Praktikumstag abzugeben (Ausnahme ist der erste Praktikumstag). Mangelhafte Protokolle können einmal korrigiert werden. Nichtabgegebene oder unzureichend korrigierte Protokolle führen zu einem Fehltag. Fehltage Ein Fehltag, der durch Krankheit (mit Attest) oder durch einen Assistenten (mangelhafte Protokolle, schlechte Vorbereitung, aus Sicherheitsgründen) vergeben wurde, kann am letzten Praktikumstag (vormittags) nachgeholt werden. Ein zweiter Fehltag kann nicht nachgeholt werden und führt zum Ausschluss aus dem Praktikum. Klausur Das Praktikum wird durch eine Klausur abgeschlossen. Voraussetzung für die Teilnahme an der Klausur ist der bestandene praktische Teil des Praktikums (alle Versuche, alle Protokolle). Die Klausur wird am 4. Mai um 14:00 Uhr, die Nachklausur am 15. Juni um14:00 Uhr geschrieben. Die Abmeldung vom Praktikum ist bis zum 5. April möglich. 2 Einführung in die Allgemeine Chemie Arbeitssicherheit ARBEITSSICHERHEIT Laborordnung und Umgang mit Gefahrstoffen Für alle Arten von Laboratorien gilt die „Verordnung über gefährliche Stoffe“ vom 01.01.2005 zu beachten („Gefahrstoffverordnung“). Im Oktober 1991 hat das Bundesministerium für Arbeit und Soziales die vom Ausschuss für Gefahrstoffe aufgestellte „Technische Regel für Gefahrstoffe“ im Bundesarbeitsblatt bekanntgegeben („TRGS Nr. 451“). Diese Technische Regel stellt eine Auslegung der Rechtsnorm dar und enthält Regelungen zur Anwendung der Rechtsnorm im Einzelfall. Die nachfolgenden Verhaltensregeln für das Laboratorium sind dieser Technischen Regel entnommen. Bitte lesen Sie diese Ordnung aufmerksam durch. Sie sind gehalten, die Bestimmungen der Laborordnung genau zu befolgen. Bedenken Sie, daß bei Unfällen, die immer wieder im Labor vorkommen, nur dann für Sie Versicherungsschutz besteht, wenn Sie die Laborordnung, die den Vorschriften der Berufsgenossenschaft der Chemischen Industrie entspricht, eingehalten haben. Bei Nichtbefolgen können Sie juristisch sogar für den entsprechenden Schaden haftbar gemacht werden. Helfen Sie bitte mit, Unfälle im Labor und die damit verbundenen gesundheitlichen und materiellen Schäden zu vermeiden! Grundsätzliche Regeln für das Arbeiten im Laboratorium 1) Wenn bei einzelnen Versuchen Gefahrstoffe verwendet werden, muss sich jeder vor dem Versuch über die Eigenschaften des Gefahrstoffes und den Umgang mit dem Gefahrstoff informieren. Gefahrstoffe im Sinne der Vorschriften sind gefährliche Stoffe oder Zubereitungen, die eine oder mehrere der folgenden Eigenschaften besitzen: explosionsgefährlich, brandfördernd, hochentzündlich, leichtentzündlich, entzündlich, sehr giftig, giftig, gesundheitsschädigend, ätzend, sensibilisierend, krebserzeugend, erbgutverändernd, fortpflanzungsgefährdend, sonst chronisch schädigend, umweltgefährlich. Diese Eigenschaften des Gefahrstoffes sind den Gefahrensymbolen zu entnehmen; dazu gehören Gefahrenhinweise („R-Sätze“) und Sicherheitsratschläge („S-Sätze“). Bereits kleine Gefäße müssen mit den Gefahrensymbolen versehen sein, größere Gefäße zusätzlich mit den R- und S-Sätzen. So ist beispielsweise eine wässrige Natriumhydroxidlösung mit einer Konzentration größer als 5% als ätzend eingestuft, es gelten die Sätze R 35 und S 2-26-27-37/39. Dazu sind zu fast allen Versuchen die zur Verwendung kommenden Chemikalien in dieser Praktikumsanleitung mit ihren Gefahrenbezeichnungen und den jeweiligen R- und S-Sätzen zusammengestellt. Die besonderen Gefahren und Sicherheitsratschläge gemäß den R- und S-Sätzen sind als Bestandteil dieser Betriebsanweisung verbindlich. 2) Personen, die nicht als Praktikanten beschäftigt sind, ist der Aufenthalt in den Labors untersagt. 3) Das Essen, Trinken, Rauchen und Mobiltelefonieren ist in den Laborräumen verboten! 4) In den Labors ist das Tragen von Laborkitteln aus Baumwolle und Schutzbrillen vorgeschrieben. Es darf nur festes, geschlossenes und trittsicheres Schuhwerk getragen werden! 3 Einführung in die Allgemeine Chemie 5) 6) 7) 8) Arbeitssicherheit Sorgfältiges, umsichtiges Arbeiten ist gefordert. Jeder führe seine experimentellen Arbeiten nach den vorliegenden Anweisungen mit solcher Sorgfalt aus, daß für niemanden eine Gefährdung eintritt. Hautkontakt mit Chemikalien ist zu vermeiden. Lösungen dürfen nicht mit dem Mund angesaugt werden. Chemikalien dürfen nicht aus den Laborräumen entfernt werden. Entstandene Wasserlachen auf Fußböden oder Tischen sind sofort zu beseitigen. Alle Geräte, besonders die Waagen, sind mit großer Sorgfalt zu behandeln. Speziellen Bedienungsanweisungen ist Folge zu leisten. Auftretende Mängel bitte sofort dem zuständigen Assistenten melden. Tragen der Schutzbrille Um die Gefahr von Augenverletzungen zu vermindern, hat jeder Praktikant in allen Laborräumen ständig eine Schutzbrille zu tragen. Die gewöhnliche Korrekturbrille sehbehinderter Personen stellt keinen ausreichenden Schutz dar. Beseitigung von Abfällen Ausgüsse und Kanalnetz sind vor Verunreinigungen und Verstopfung zu schützen. Wässrige Lösungen, welche giftige Schwermetalle (z.B. Cu, Cr) enthalten und organische Lösungsmittelabfälle (insbesondere halogenhaltige Lösungsmittel) dürfen nicht in den Ausguß, sondern müssen in die dafür vorgesehenen Sammelbehälter gegeben werden. Halogenhaltige Lösungsmittelabfälle werden dabei gesondert gesammelt. Wenn nötig, sind Hinweise bei den Versuchen angegeben. In die Ausgüsse dürfen also nur wasserlösliche, ungiftige Stoffe gegeben werden. Dazu gehören die im Praktikum verwendeten Säuren und Basen, die in der hauseigenen Anlage neutralisiert werden, ebenso wie wässrige Lösungen ungiftiger Salze, wie z.B. die Salze der Alkalimetalle, des Eisens und des Mangans in kleinen Mengen. Gas, Wasser, Elektroeinrichtungen Bei Verlassen des Arbeitsplatzes sind alle Gas- und Wasserhähne sorgfältig zu schließen und elektrische Geräte auszuschalten. Verhalten in Gefahrensituationen Beim Auftreten gefährlicher Situationen, z.B. Feuer, Austreten giftiger Gase, Auslaufen gefährlicher Flüssigkeiten, sind folgende Anweisungen zu beachten: Ruhe bewahren und überstürztes, unüberlegtes Handeln vermeiden ! Gefährdete Personen warnen, gegebenenfalls zum Verlassen der Räume auffordern. Assistenten benachrichtigen. Wenn die Lüftungsanlage ausfällt, ist das Arbeiten mit Gefahrstoffen, die in die Atemluft eintreten können, einzustellen. Erste Hilfe bei Notfällen Alle Praktikanten sind angehalten, sich über den Aufbewahrungsort des dem Arbeitsplatz nächstliegenden Verbandskastens, des Feuerlöschers sowie über die Handhabung der Löschbrause und der Augenduschen zu informieren. Bei allen Hilfeleistungen auf die eigene Sicherheit achten! Kleiderbrände löschen, dazu Notduschen benutzen. Mit Chemikalien verschmutzte Kleidung entfernen, die Haut mit Wasser reinigen. Alle akuten Störungen der Bewusstseinslage, der Atmung und des Kreislaufs sowie entsprechende Verletzungen sind Hinweise für eine (potentielle) Lebensgefahr. In allen Fällen ist unbedingt ein Arzt hinzuzuziehen! 4 Einführung in die Allgemeine Chemie Arbeitssicherheit Notruf Setzen Sie einen Notruf gemäß folgendem Schema ab: Wo geschah der Unfall? Was geschah? Welche Verletzungen? Wie viele Verletzte? Warten auf Rückfragen Ortsangabe Feuer, Verätzung, Vergiftung... niemals auflegen, bevor die Rettungsleitstelle das Gespräch beendet hat, es könnten wichtige Fragen zu beantworten sein Notrufnummern: DRK / Notarztwagen Feuerwehr Polizei 112 112 110 Vorgehen beim Auffinden einer Person Auffinden eines Notfallpatienten Feststellen des Bewusstseins nicht ansprechbar ansprechbar Atemwege freimachen Atemkontrolle Pulskontrolle/Hals Atmung vorhanden Atmung nicht vorhanden Puls vorhanden Puls vorhanden Puls nicht vorhanden Seitenlagerung Atemspende Herz-Lungen- Maßnahmen Wiedernach belebung Notwendigkeit: Maßnahmen nach Notwendigkeit Kontrolle der Vitalfunktionen Blutstillung Schockbekämpfung Personen aus dem Gefahrenbereich bergen, dazu Rettungsgriff anwenden: 5 Einführung in die Allgemeine Chemie Arbeitssicherheit Bei Bewusstlosigkeit aber vorhandener Atmung den Verletzten in die stabile Seitenlage bringen: Bei fehlendem Puls muß sofort mit Herz-Lungen-Wiederbelebung Herzdruckmassage und Atemspende im Wechsel. begonnen werden. Häufige Unfall- oder Verletzungsfolge ist ein Schock. Kennzeichen sind schneller und schwächer werdender, schließlich kaum noch tastbarer Puls, fahle Blässe, kalte Haut, Frieren, Schweiß auf der Stirn, Bewusstseinsstörungen, Teilnahmslosigkeit. Die wichtigste Erstmaßnahme ist die Flachlagerung mit Anheben der Beine: Verletzungen, Blutungen Grundsätzlich sollte jede Wunde zur Verminderung des Blutverlustes hoch gelagert und zur Vermeidung einer Infektion keimfrei abgedeckt werden. Bei stärkerer Blutung muss durch einen Druckverband eine Blutstillung erreicht werden. Verbrennung, Verbrühung, Verätzung 6 Einführung in die Allgemeine Chemie Arbeitssicherheit Bei Einwirkung von Hitze bzw. Säuren oder Laugen kommt es abhängig von Intensität und Dauer zu Schädigungen der verschiedenen Hautschichten. Bei Ausdehnung über 15% der Körperoberfläche besteht Schockgefahr durch Flüssigkeitsverluste, die entsprechende Maßnahmen erfordern. Die lokale Therapie besteht vorrangig in der sofortigen, intensiven Spülung (möglichst 10 Minuten lang) mit Leitungswasser (ideal 15-20 °C). Neutralisationsversuche bei Verätzungen sind unbedingt zu unterlassen. Zur Erstbehandlung der Augenverätzung durch Säuren- oder Laugenspritzer sollte schnellstmöglich das offengehaltene Auge mit viel Leitungswasser gespült werden. Keine Neutralisationsversuche! In jedem Fall sollte eine fachärztliche Untersuchung erfolgen, auch nach Abklingen der Beschwerden. Hinweise auf besondere Gefahren (R-Sätze) R1 R2 R3 R4 R5 R6 R7 R8 R9 R10 R11 R12 R14 R15 R16 R17 R18 R19 R20 R21 R22 R23 R24 R25 R26 R27 R28 R29 R30 In trockenem Zustand explosionsgefährlich Durch Schlag, Reibung, Feuer oder andere Zündquellen explosionsgefährlich Durch Schlag, Reibung, Feuer oder andere Zündquellen besonders explosionsgefährlich Bildet hochempfindliche explosionsgefährliche Metallverbindungen Beim Erwärmen explosionsfähig Mit und ohne Luft explosionsfähig Kann Brand verursachen Feuergefahr bei Berührung mit brennbaren Stoffen Explosionsgefahr bei Mischung mit brennbaren Stoffen Entzündlich Leichtentzündlich Hochentzündlich Reagiert heftig mit Wasser Reagiert mit Wasser unter Bildung hochentzündlicher Gase Explosionsgefährlich in Mischung mit brandfördernden Stoffen Selbstentzündlich an der Luft Bei Gebrauch Bildung explosionsfähiger / leicht-entzündlicher Dampf-Luftgemische möglich Kann explosionsfähige Peroxide bilden Gesundheitsschädlich beim Einatmen Gesundheitsschädlich bei Berührung mit der Haut Gesundheitsschädlich beim Verschlucken Giftig beim Einatmen Giftig bei Berührung mit der Haut Giftig beim Verschlucken Sehr giftig beim Einatmen Sehr giftig bei Berührung mit der Haut Sehr giftig beim Verschlucken Entwickelt bei Berührung mit Wasser giftige Gase Kann bei Gebrauch leicht entzündlich werden 7 Einführung in die Allgemeine Chemie R31 R32 R33 R34 R35 R36 R37 R38 R39 R40 R41 R42 R43 R44 R45 R46 R48 R49 R50 R51 R52 R53 R54 R55 R56 R57 R58 R59 R60 R61 R62 R63 R64 R65 R66 R67 R68 Arbeitssicherheit Entwickelt bei Berührung mit Säure giftige Gase Entwickelt bei Berührung mit Säure sehr giftige Gase Gefahr kumulativer Wirkungen Verursacht Verätzungen Verursacht schwere Verätzungen Reizt die Augen Reizt die Atmungsorgane Reizt die Haut Ernste Gefahr irreversiblen Schadens Verdacht auf krebserzeugende Wirkung Gefahr ernster Augenschäden Sensibilisierung durch Einatmen möglich Sensibilisierung durch Hautkontakt möglich Explosionsgefahr bei Erhitzen unter Einschluß Kann Krebs erzeugen Kann vererbbare Schäden verursachen Gefahr ernster Gesundheitsschäden bei längerer Exposition Kann Krebs erzeugen beim Einatmen Sehr giftig für Wasserorganismen Giftig für Wasserorganismen Schädlich für Wasserorganismen Kann in Gewässern längerfristig schädliche Wirkungen haben Giftig für Pflanzen Giftig für Tiere Giftig für Bodenorganismen Giftig für Bienen Kann längerfristig schädliche Wirkungen auf die Umwelt haben Gefährlich für die Ozonschicht Kann die Fortpflanzungsfähigkeit beeinträchtigen Kann das Kind im Mutterleib schädigen Kann möglicherweise die Fortpflanzungsfähigkeit beeinträchtigen Kann das Kind im Mutterleib möglicherweise schädigen Kann Säuglinge über die Muttermilch schädigen Gesundheitsschädlich: kann beim Verschlucken Lungenschäden verursachen Wiederholter Kontakt kann zu spröder oder rissiger Haut führen Dämpfe können Schläfrigkeit und Benommenheit verursachen Irreversibler Schaden möglich Kombination der R-Sätze R14/15 R15/29 R20/21 R20/22 R20/21/22 R21/22 R23/24 R23/25 R23/24/25 R24/25 Reagiert heftig mit Wasser unter Bildung hochentzündlicher Gase Reagiert mit Wasser unter Bildung giftiger und hochentzündlicher Gase Gesundheitsschädlich beim Einatmen und bei Berührung mit der Haut Gesundheitsschädlich beim Einatmen und Verschlucken Gesundheitsschädlich beim Einatmen, Verschlucken und Berührung mit der Haut Gesundheitsschädlich bei Berührung mit der Haut und beim Verschlucken Giftig beim Einatmen und bei Berührung mit der Haut Giftig beim Einatmen und Verschlucken Giftig beim Einatmen, Verschlucken und Berührung mit der Haut Giftig bei Berührung mit der Haut und beim Verschlucken 8 Einführung in die Allgemeine Chemie R26/27 R26/28 R26/27/28 R27/28 R36/37 R36/38 R36/37/38 R37/38 R39/23 R39/24 R39/25 R39/23/24 R39/23/25 R39/24/25 R39/23/24/25 R39/26 R39/27 R39/28 R39/26/27 R39/26/28 R39/27/28 R39/26/27/28 R42/43 R48/20 R48/21 R48/22 R48/20/21 R48/20/22 R48/20/21/22 R48/23 R48/24 R48/25 R48/23/24 R48/23/25 R48/24/25 R48/23/24/25 R50/53 Arbeitssicherheit Sehr giftig beim Einatmen und bei Berührung mit der Haut Sehr giftig beim Einatmen und Verschlucken Sehr giftig beim Einatmen, Verschlucken und Berührung mit der Haut Sehr giftig bei Berührung mit der Haut und beim Verschlucken Reizt die Augen und die Atmungsorgane Reizt die Augen und die Haut Reizt die Augen, Atmungsorgane und die Haut Reizt die Atmungsorgane und die Haut Giftig: ernste Gefahr irreversiblen Schadens durch Einatmen Giftig: ernste Gefahr irreversiblen Schadens bei Berührung mit der Haut Giftig: ernste Gefahr irreversiblen Schadens durch Verschlucken Giftig: ernste Gefahr irreversiblen Schadens durch Einatmen und bei Berührung mit der Haut Giftig: ernste Gefahr irreversiblen Schadens durch Einatmen und durch Verschlucken Giftig: ernste Gefahr irreversiblen Schadens bei Berührung mit der Haut und durch Verschlucken Giftig: ernste Gefahr irreversiblen Schadens durch Einatmen, Berührung mit der Haut und durch Verschlucken Sehr giftig: ernste Gefahr irreversiblen Schadens durch Einatmen Sehr giftig: ernste Gefahr irreversiblen Schadens bei Berührung mit der Haut Sehr giftig: ernste Gefahr irreversiblen Schadens durch Verschlucken Sehr giftig: ernste Gefahr irreversiblen Schadens durch Einatmen und bei Berührung mit der Haut Sehr giftig: ernste Gefahr irreversiblen Schadens durch Einatmen und durch Verschlucken Sehr giftig: ernste Gefahr irreversiblen Schadens bei Berührung mit der Haut und durch Verschlucken Sehr giftig: ernste Gefahr irreversiblen Schadens durch Einatmen, Berührung mit der Haut und durch Verschlucken Sensibilisierung durch Einatmen und Hautkontakt möglich Gesundheitsschädlich: Gefahr ernster Gesundheitsschäden bei längerer Exposition durch Einatmen Gesundheitsschädlich: Gefahr ernster Gesundheitsschäden bei längerer Exposition durch Berührung mit der Haut Gesundheitsschädlich: Gefahr ernster Gesundheitsschäden bei längerer Exposition durch Verschlucken Gesundheitsschädlich: Gefahr ernster Gesundheitsschäden bei längerer Exposition durch Einatmen und durch Berührung mit der Haut Gesundheitsschädlich: Gefahr ernster Gesundheitsschäden bei längerer Exposition durch Einatmen und durch Verschlucken Gesundheitsschädlich: Gefahr ernster Gesundheitsschäden bei längerer Exposition durch Einatmen, Berührung mit der Haut und durch Verschlucken Giftig: Gefahr ernster Gesundheitsschäden bei längerer Exposition durch Einatmen Giftig: Gefahr ernster Gesundheitsschäden bei längerer Exposition durch Berührung mit der Haut Giftig: Gefahr ernster Gesundheitsschäden bei längerer Exposition durch Verschlucken Giftig: Gefahr ernster Gesundheitsschäden bei längerer Exposition durch Einatmen und durch Berührung mit der Haut Giftig: Gefahr ernster Gesundheitsschäden bei längerer Exposition durch Einatmen und durch Verschlucken Giftig: Gefahr ernster Gesundheitsschäden bei längerer Exposition durch Berührung mit der Haut und durch Verschlucken Giftig: Gefahr ernster Gesundheitsschäden bei längerer Exposition durch Einatmen, Berührung mit der Haut und durch Verschlucken Sehr giftig für Wasserorganismen, kann in Gewässern längerfristig schädliche 9 Einführung in die Allgemeine Chemie R50/51 R52/53 R68/20 R68/21 R68/22 R68/20/21 R68/20/22 R68/21/22 R68/20/21/22 Arbeitssicherheit Wirkungen haben Giftig für Wasserorganismen, kann in Gewässern längerfristig schädliche Wirkungen haben Schädlich für Wasserorganismen, kann in Gewässern längerfristig schädliche Wirkungen haben Gesundheitsschädlich: Möglichkeit irreversiblen Schadens durch Einatmen Gesundheitsschädlich: Möglichkeit irreversiblen Schadens bei Berührung mit der Haut Gesundheitsschädlich: Möglichkeit irreversiblen Schadens durch Verschlucken Gesundheitsschädlich: Möglichkeit irreversiblen Schadens durch Einatmen und bei Berührung mit der Haut Gesundheitsschädlich: Möglichkeit irreversiblen Schadens durch Einatmen und durch Verschlucken Gesundheitsschädlich: Möglichkeit irreversiblen Schadens bei Berührung mit der Haut und durch Verschlucken Gesundheitsschädlich: Möglichkeit irreversiblen Schadens durch Einatmen, Berührung mit der Haut und durch Verschlucken Sicherheitsratschläge (S-Sätze) S1 S2 S3 S4 S5 S6 S7 S8 S9 S12 S13 S14 S15 S16 S17 S18 S20 S21 S22 S23 S24 S25 S26 S27 S28 S29 S30 S33 S35 S36 Unter Verschluss aufbewahren Darf nicht in die Hände von Kindern gelangen Kühl aufbewahren Von Wohnplätzen fernhalten Unter . . . aufbewahren (geeignete Flüssigkeit vom Hersteller anzugeben) Unter . . . aufbewahren (inertes Gas vom Hersteller anzugeben) Behälter dicht geschlossen halten Behälter trocken halten Behälter an einem gut gelüfteten Ort aufbewahren Behälter nicht gasdicht verschließen Von Nahrungsmitteln, Getränken und Futtermitteln fernhalten Von . . . fernhalten (inkompatible Substanzen sind vom Hersteller anzugeben) Vor Hitze schützen Von Zündquellen fernhalten - Nicht rauchen Von brennbaren Stoffen fernhalten Behälter mit Vorsicht öffnen und handhaben Bei der Arbeit nicht essen und trinken Bei der Arbeit nicht rauchen Staub nicht einatmen Gas/Rauch/Dampf/Aerosol nicht einatmen (geeignete Bezeichnung(en) vom Hersteller anzugeben) Berührung mit der Haut vermeiden Berührung mit den Augen vermeiden Bei Berührung mit den Augen sofort gründlich mit Wasser abspülen und Arzt konsultieren Beschmutzte, getränkte Kleidung sofort ausziehen Bei Berührung mit der Haut sofort abwaschen mit viel . . . (vom Hersteller anzugeben) Nicht in die Kanalisation gelangen lassen Niemals Wasser hinzugießen Maßnahmen gegen elektrostatische Aufladungen treffen Abfälle und Behälter müssen in gesicherter Weise beseitigt werden Bei der Arbeit geeignete Schutzkleidung tragen 10 Einführung in die Allgemeine Chemie S37 S38 S39 S40 S41 S42 S43 S45 S46 S47 S48 S49 S50 S51 S52 S53 S56 S57 S59 S60 S61 S62 S63 S64 Arbeitssicherheit Geeignete Schutzhandschuhe tragen Bei unzureichender Belüftung Atemschutzgerät anlegen Schutzbrille/Gesichtsschutz tragen Fußboden und verunreinigte Gegenstände mit . . . reinigen (Material vom Hersteller anzugeben) Explosions- und Brandgase nicht einatmen Bei Räuchern/Versprühen geeignetes Atemschutzgerät anlegen u. (geeignete Bezeichnung(en) vom Hersteller anzugeben) Zum Löschen . . . (vom Hersteller anzugeben) verwenden (wenn Wasser die Gefahr erhöht, anfügen: "Kein Wasser verwenden") Bei Unfall oder Unwohlsein sofort Arzt hinzuziehen (wenn möglich dieses Etikett vorzeigen) Bei Verschlucken sofort ärztlichen Rat einholen und Verpackung oder Etikett vorzeigen Nicht bei Temperaturen über . . . °C aufbewahren (vom Hersteller anzugeben) Feucht halten mit . . . (geeignetes Mittel vom Hersteller anzugeben) Nur im Originalbehälter auf bewahren Nicht mischen mit . . . (vom Hersteller anzugeben) Nur in gut gelüfteten Bereichen verwenden Nicht großflächig für Wohn- und Aufenthaltsräume zu verwenden Exposition vermeiden - vor Gebrauch besondere Anweisungen einholen Dieses Produkt und seinen Behälter der Problemabfallentsorgung zuführen Zur Vermeidung einer Kontamination der Umwelt geeigneten Behälter verwenden Information zur Wiederverwendung/Wiederverwertung beim Hersteller/Lieferanten erfragen Dieses Produkt und sein Behälter sind als gefährlicher Abfall zu entsorgen Freisetzung in die Umwelt vermeiden. Besondere Anweisungen einholen/Sicherheitsdatenblatt zu Rate ziehen Bei Verschlucken kein Erbrechen herbeiführen. Sofort ärztlichen Rat einholen und Verpackung oder dieses Etikett vorzeigen Bei Unfall durch Einatmen: Verunfallten an die frische Luft bringen und ruhigstellen Bei Verschlucken Mund mit Wasser ausspülen (nur wenn Verunfallter bei Bewusstsein ist) Kombination der S-Sätze S1/2 S3/7 S3/9/14 S3/9/14/49 S3/9/49 S3/14 S7/8 S7/9 S7/47 S20/21 S24/25 S27/28 S29/35 S29/56 Unter Verschluss und für Kinder unzugänglich aufbewahren Behälter dicht geschlossen halten und an einem kühlen Ort aufbewahren An einem kühlen, gut gelüfteten Ort, entfernt von . . . aufbewahren (die Stoffe, mit denen Kontakt vermieden werden muss, sind vom Hersteller anzugeben) Nur im Originalbehälter an einem kühlen, gut gelüfteten Ort, entfernt von . . . aufbewahren (die Stoffe, mit denen Kontakt vermieden werden muss, sind vom Hersteller anzugeben) Nur im Originalbehälter an einem kühlen, gut gelüfteten Ort aufbewahren An einem kühlen, von . . . entfernten Ort aufbewahren (die Stoffe, mit denen Kontakt vermieden werden muss, sind vom Hersteller anzugeben) Behälter trocken und dicht geschlossen halten Behälter dicht geschlossen an einem gut gelüfteten Ort aufbewahren Behälter dicht geschlossen und nicht bei Temperaturen über . . . °C aufbewahren (vom Hersteller anzugeben) Bei der Arbeit nicht essen, trinken oder rauchen Berührung mit den Augen und der Haut vermeiden Bei Berührung mit der Haut beschmutzte, getränkte Kleidung sofort ausziehen und Haut sofort abwaschen mit viel ...(vom Hersteller anzugeben). Nicht in die Kanalisation gelangen lassen; Abfälle und Behälter müssen in gesicherter Weise beseitigt werden Nicht in die Kanalisation gelangen lassen; dieses Produkt und seinen Behälter der Problemabfallentsorgung zuführen. 11 Einführung in die Allgemeine Chemie S36/37 S36/37/39 S36/39 S37/39 S47/49 Arbeitssicherheit Bei der Arbeit geeignete Schutzhandschuhe und Schutzkleidung tragen Bei der Arbeit geeignete Schutzkleidung, Schutzhandschuhe und Schutzbrille/Gesichtsschutz tragen Bei der Arbeit geeignete Schutzkleidung und Schutzbrille/Gesichtsschutz tragen Bei der Arbeit geeignete Schutzhandschuhe und Schutzbrille/Gesichtsschutz tragen Nur im Originalbehälter bei einer Temperatur von nicht über . . . °C (vom Hersteller anzugeben) aufbewahren Gefahrensymbole und –bezeichnungen Symbol Gefahrenbezeichnung E Explosionsgefährlich O Brandfördernd F+ Hochentzündlich F Leichtentzündlich T+ Sehr giftig Einstufung Vorsicht Stoffe und Zubereitungen, die auch ohne Luftsauerstoff exotherm reagieren und die nach festgelegten Prüfbedingungen detonieren, schnell deflagrieren oder beim Erhitzen unter teilweisem Einschluß explodieren können. Organische Peroxide, die brennbar sind, auch wenn sie nicht mit brennbaren Materialien in Berührung kommen. Sonstige Stoffe und Zubereitungen, die in der Regel selbst nicht brennbar sind, aber bei Berührung mit brennbaren Materialien, überwiegend durch Sauerstoffabgabe, die Brandgefahr und die Heftigkeit eines Brandes erheblich erhöhen. Flüssigkeiten mit einem Flammpunkt unter 0 °C und einem Siedepunkt von höchstens 35 °C. Gase und Gasgemische, die bei normalem Druck und gewöhnlicher Temperatur an der Luft entzündlich sind. Flüssigkeiten mit einem Flammpunkt unter 21 °C, die aber nicht hochentzündlich sind. Feste Stoffe und Zubereitungen, die durch kurzzeitige Erwärmung einer Zündquelle leicht entzündet werden können und danach weiterbrennen oder weiterglimmen. Einatmen, Verschlucken oder Auf-nahme über die Haut in geringer Menge können zu Gesundheitsschäden erheblichen Ausmaßes, eventuell mit Todesfolge, führen. Bei erheblichen Anhaltspunkten für schwere, Schlag, Stoß, Reibung, Funkenbildung, Feuer, Hitzeeinwirkung vermeiden. 12 Jeden Kontakt mit brennbaren Stoffen vermeiden. Entzündungsgefahr! Ausgebrochene Brände können gefördert, die Brandbekämpfung erschwert werden Von offenen Flammen, Wärmequellen fernhalten. Funken und Von offenen Flammen, Wärmequellen fernhalten. Funken und Jeglicher Kontakt mit dem menschlichen Körper ist zu vermeiden. bei Unwohlsein sofort Arzt hinzuziehen. bei als krebserzeugend, erbgutverändernd oder reproduktions-toxisch (fortpflanzungsgefährdend) eingestuften Stoffen wird auf diese Gefahren hingewiesn. Beim Umgang mit diesen Einführung in die Allgemeine Chemie T giftig Symbol Gefahrenbezeichnung Xn Gesundheitsschädlich C Ätzend Xi Reizend N Umweltgefährdend Arbeitssicherheit eventuell irreversible Schadstoffen sind besondere Vorschriften Gesundheitsschäden durch zu beachten! einmalige, wiederholte oder länger andauernde Aufnahme, insbesondere bei krebserzeugenden, erbgutverändernden und reproduktions-toxischen (fortpflanzungsgefährenden) Wirkungen. Einstufung Vorsicht Einatmen, Verschlucken oder Aufnahme durch die Haut können akute oder chronische Gesundheitsschäden verursachen. Bei Anhaltspunkten für schwere, eventuell irreversible Gesundheitsschäden durch einmalige, wiederholte oder länger andauernde Aufnahme, insbesondere bei Verdacht von krebserzeugenden, erbgutverändernden und reproduktionstoxischen (fortpflanzungsgefährdenden) Wirkungen, Gefahr aller Sensibilisierung durch Einatmen (bei Einstufung mit R42) Zerstörung des Hautgewebes in seiner gesamten Dicke bei gesunder, intakter Haut oder wenn dieses Ergebnis vorausgesagt werden kann. Kontakt mit dem menschlichen Körper ist zu vermeiden. Bei Stoffen, die im Verdacht stehen, krebserzeugend, erbgutverändernd oder reproduktions-toxisch (fortpflanzungsgefährdend) zu sein, wird auf diesen Umstand hingewiesen. Ohne ätzend zu sein, können bei kurzzeitigem, länger andauerndem oder wiederholtem Kontakt mit Haut oder Schleimhaut Entzündungen hervorgerufen werden. Gefahr der Sensibilisierung bei Hautkontakt (bei Einstufung mit R43) Bei Freisetzung in die aquatische und nichtaquatische Umwelt kann eine Schädigung des Ökosystems durch Veränderung des Naturhaushalts sofort oder später herbeigeführt werden. Manche Stoffe oder ihre Umwandlungsprodukte können gleichzeitig verschiedene Kompartimente beeinträchtigen. Berührung von Augen und vermeiden, Dämpfe nicht einatmen. 13 Durch besondere Schutzmaßnahmen Berührung mit Augen, Haut und Kleidung vermeiden. Dämpfe nicht einatmen! Bei Unfall oder Unwohlsein sofort Arzt hinzuziehen. Haut Je nach Gefährdungspotential nicht in die Kanalisation gelangen lassen. Besondere Entsorgungsvorschriften beachten! Einführung in die Allgemeine Chemie 1. Praktikumstag 1. PRAKTIKUMSTAG Präparate Theoretische Grundlagen 1.1 Chemische Grundgrößen Bei chemischen Umsetzungen reagiert jeweils eine außerordentlich große Anzahl an Atomen, Molekülen oder Ionen miteinander. Es hat sich daher als zweckmäßig erwiesen, neben der Masse noch eine andere Mengenvariable zu definieren. Hierzu wurde die Stoffmenge, Symbol n, als dimensionierte Größe eingeführt. Die internationale Einheit der Stoffmenge ist das Mol, Einheit [mol], das durch folgende Konvention festgelegt ist: 1 mol ist die Stoffmenge einer Substanz, in der dieselbe Anzahl an Teilchen enthalten ist, wie Atome in 12g des reinen Nuklids 12C (Kohlenstoff) vorliegen. Diese Anzahl ist die Avogadrosche Konstante NA mit dem Wert: Avogadro-Konstante: NA = 6,0220453⋅1023 mol-1 Ein Mol bedeutet somit eine Stoffmenge von NA Teilchen. Dabei können als Teilchen Atome, Moleküle oder Ionen betrachtet werden. Die Definition der Stoffmenge Mol erlaubt die Einführung der molaren Masse M. Als molare Masse, auch Molmasse genannt, bezeichnet man die Masse von 1 Mol einer Substanz (Atome, Moleküle, Ionen) mit der Einheit [g⋅mol-1]: Molmasse einer Substanz X: M(X) = Masse [g] m( X ) = Stoffmenge [mol] n( X ) Diese entspricht numerisch der relativen Atom- bzw. Molekülmasse des betreffenden Stoffes. Zur Berechnung der Molmasse eines Stoffes benötigt man die Atommassen der am Aufbau dieses Stoffes beteiligten Elemente. Die Atommassen der Elemente sind üblicherweise im Periodensystem der Elemente (PSE) aufgeführt (siehe Anhang I). Die Molmasse folgt additiv aus der Summe der Atommassen. Beispiele: M(Cl) = 35,453 g ⋅ mol −1 M(Cl 2 ) = M(Cl) + M(Cl) = 70,906 g ⋅ mol −1 M(BaSO 4 ) = M(Ba) + M(S) + 4 ⋅ M(O) = 233,388 g ⋅ mol −1 1.2 Konzentrationsangaben Unter der Gehaltsangabe (Konzentration) von Lösungen versteht man die Stoffmenge einer gelösten Substanz in einer bestimmten Menge an Lösungsmittel. Früher waren für Lösungen drei unterschiedliche Konzentrationsangaben üblich: Stoffmenge des gelösten Stoffes ⎡ mol ⎤ ⎢⎣ l ⎥⎦ Volumen der Lösung Stoffmenge des gelösten Stoffes ⎡ mol ⎤ Masse des Lösungsmittels ⎢⎣ kg ⎥⎦ Molarität (molare Konzentration): Molalität (molale Konzentration): 14 Einführung in die Allgemeine Chemie 1. Praktikumstag Normalität („normale“ Konzentration): Äquivalentmenge des gelösten Stoffes ⎡ val ⎤ ⎢⎣ l ⎥⎦ Volumen der Lösung Die früher gebräuchliche Konzentrationsangabe Normalität ist heutzutage fast vollständig von der Molarität in [mol/l] abgelöst worden. Oft wendet man noch eine Kurzschreibweise an. So bezeichnet man z.B. eine NaCl-Lösung mit einer Konzentration von c(NaCl) = 0,1 mol/l einfach als eine 0,1m (bzw. 0,1M) Kochsalzlösung. „Normale“ Konzentrationsangaben, auch Äquivalentkonzentrationen genannt, werden bei Konzentrationen von Säuren und Basen (2. Praktikumstag) und bei Oxidations- und Reduktionsmitteln (3. Praktikumstag) verwendet. Die Äquivalentkonzentration (cäq) lässt sich mit Hilfe des Äquivalenzfaktors z von der molaren Konzentration (cm) ableiten: ⎡ val ⎤ ⎡ mol ⎤ ⋅z c äq ⎢ ⎥ = c m ⎢ ⎣ l ⎦ ⎣ l ⎥⎦ ⎡ val ⎤ ; z in ⎢ ⎣ mol ⎥⎦ In Säure-Base-Reaktionen versteht man unter dem Äquivalent z die Anzahl der Protonen, die eine Säure abzugeben vermag bzw. eine Base aufnehmen kann. Beispiele: Salzsäure (HCl) kann ein Proton abgeben ⇒ z = 1 val/mol cäq = 1 val/mol · mol/l = 1 val/l kann zwei Protonen abgeben ⇒ z = 2 val/mol cäq = 2 val/mol · mol/l = 2 val/l Schwefelsäure (H2SO4 ) Bei Redoxreaktionen (siehe 3. Praktikumstag) versteht man unter dem Äquivalent z die Anzahl der Elektronen, die ein Oxidationsmittel während einer Reaktion aufnimmt bzw. ein Reduktionsmittel während einer Reaktion abgibt. In mathematischen Formeln der Chemie (MWG, pH-Wert, etc.) tauchen Konzentrationen häufig als variable Größen auf. Die Konzentration einer Substanz X wird dann meistens mit cX , [X] oder c(X) abgekürzt. Konzentrationsangaben einer Substanz in eckigen Klammern beziehen sich immer auf molare Konzentrationen in [mol/l]: [H + ] = Menge an gelösten H + − Ionen [mol] Volumen der Lösung [l] 1.3 Dichte Die Dichte ist eine Materialkonstante und beschreibt das Verhältnis zwischen Masse und Volumen eines Stoffes. Sie wird in g/cm3 angegeben. ρ= Masse des Stoffes m = Volumeneinheit V 1.4 Das molare Volumen Vm Das molare Volumen eines Gases ist das Volumen, das 1 mol diese Gases unter Normalbedingungen (0°C und 1013 mbar) einnimmt. Vm = Volumen des Gases bei Normalbedingungen V = Stoffmenge n [l/mol] Bei Gasen ist das molare Volumen unabhängig vom Stoff und beträgt unter Normalbedingungen 22,4 l mol-1. 15 Einführung in die Allgemeine Chemie 1. Praktikumstag 1.5 Das chemische Gleichgewicht Reaktionen, die nicht vollständig ablaufen, gelangen zu einem chemischen Gleichgewicht, bei dem die Ausgangsstoffe (Edukte) und Endstoffe (Produkte) in messbaren und konstanten Konzentrationen vorliegen. Die Dissoziation von schwachen Säuren und schwachen Basen ist eine solche Gleichgewichtsreaktion. Hierbei handelt es sich nicht um ein statisches Gleichgewicht, bei dem die Reaktion zum Stillstand kommt. Am Punkt des chemischen Gleichgewichtes sind die Geschwindigkeiten der Hinreaktion und der Rückreaktion gleich groß. Man spricht von einem dynamischen Gleichgewicht, in dem ein Stoffumsatz ständig, aber nicht messbar stattfindet. Bei der Beschreibung von chemischen Gleichgewichten spielt das Massenwirkungsgesetz MWG eine zentrale Rolle. Für eine allgemeine Reaktion: aA + bB cC + dD sind A und B die Edukte, C und D die Produkte. a, b, c und d (normalerweise ganze Zahlen) sind die stöchiometrischen Koeffizienten der entsprechenden Stoffe. Dividiert man jetzt das mathematische Produkt der Produkte durch das der Edukte, so erhält man das Massenwirkungsgesetz: MWG : K = [C ]c ⋅ [ D]d [ A]a ⋅ [ B]b Hierbei bedeuten die eckigen Klammern [ ] die Gleichgewichtskonzentrationen der jeweiligen Stoffe. Man beachte, dass die stöchiometrischen Koeffizienten zu Exponenten werden. Die Gleichgewichtskonstante "K" ist je nach Lage des Gleichgewichts eine für jede Reaktion spezifische Größe. Im chemischen Gleichgewicht ändern sich die Konzentrationen der an der Reaktion beteiligten Stoffe nicht mehr. Das Produkt der Konzentrationen der Reaktionsprodukte geteilt durch das Produkt der Konzentrationen der Edukte nimmt also einen konstanten Wert K an, den man als Gleichgewichtskonstante bezeichnet. 1.6 Das Löslichkeitsprodukt Für die Dissoziation in wässriger Lösung eines allgemeinen Elektrolyten AmBn in seine Ionen gilt nach dem Massenwirkungsgesetz: mA+ + nB- AmBn [A + ] m ⋅ [B − ] n K= [A m B n ] Diese Gleichung besagt, dass sich in einer solchen Lösung neben den Ionensorten A+ und B- noch gelöste undissoziierte Moleküle AmBn befinden. Erhöht man durch Zugabe der Ionensorten A+ und /oder B- deren Konzentrationen, so kommt es in Folge einer Gleichgewichtsverschiebung nach links zu einer Zunahme der [AmBn]-Konzentration. Wird ein bestimmter Wert für [AmBn] erreicht, den man die Löslichkeit nennt, so fällt die Verbindung AmBn als fester Stoff aus. Jetzt ist die Konzentration [AmBn] nicht mehr wie zuvor in der ungesättigten Lösung variabel, sondern gleich dem konstanten Wert der Löslichkeit. Man kann daher [AmBn] mit der Gleichgewichtskonstanten K zu einer neuen Konstanten L (L = K.[ AmBn]) zusammenfassen: L (A m B n ) = [A + ] m ⋅ [B - ] n Diese Gleichung gilt für gesättigte Lösungen mit Bodenkörper. L ( A m Bn ) bezeichnet man als das Löslichkeitsprodukt der Verbindung AmBn, weil das Produkt der Ionenkonzentrationen [A+] und [B-] diesen Wert annehmen muss, damit die Löslichkeitsgrenze der Verbindung AmBn erreicht wird und diese bei weiterer Erhöhung von [A+] oder [B-] ausfällt. 16 Einführung in die Allgemeine Chemie 1. Praktikumstag Wie man der nachfolgenden Tabelle (Tab. 1) entnehmen kann, sind die Löslichkeitsprodukte und damit die Löslichkeiten von Salzen sehr unterschiedlich. Man unterscheidet schwer lösliche Salze mit L < 1 und leicht lösliche Salze mit L > 1. Die Einheit des Löslichkeitsproduktes ist abhängig von der Anzahl der bei der Dissoziation eines Moleküles AmBn entstehenden Ionen. Für das allgemeine Beispiel beträgt sie mol (m + n ) . l (m + n ) Tab.1: Löslichkeitsprodukte L einiger Salze in Wasser bei Zimmertemperatur (Löslichkeitsprodukte sind temperaturabhängig !) Salz NaCl KClO4 BaSO4 AgCl AgI Fe(OH)3 Ag2S HgS L 37,9 mol2/l2 2,9 . 10-5 mol2/l2 1,5 . 10-9 mol2/l2 1,7 . 10-10 mol2/l2 8,5 . 10-17 mol2/l2 5,0 . 10-38 mol4/l4 5,5 . 10-51 mol3/l3 1,6 . 10-54 mol2/l2 1.6 Die molare Löslichkeit Bei der Berechnung der Löslichkeit eines Salzes AmBn in Wasser geht man davon aus, dass die Ionensorten A+ und B- in einer gesättigten Lösung ausschließlich durch Dissoziation der Verbindung AmBn entstanden sind. Dies hat zur Folge, dass die Konzentrationen [A+] und [B-] in einem bestimmten Verhältnis zueinander vorliegen. Unter der Annahme, dass alle gelösten Moleküle AmBn in Ionen dissoziiert sind, gilt dann: Löslichkeit der Verbindung A m B n : [A m B n ] = Für z.B. Fe(OH)3 Löslichkeitsprodukt: lautet das [ A + ] [ B − ] m + n L A m Bn = = n m m m ⋅n n Dissoziationsgleichgewicht und das daraus resultierende Fe3+ + 3 OH- Fe(OH)3 L Fe(OH)3 = [Fe 3+ ] ⋅ [OH − ]3 ; Einheit : mol 4 l4 Für eine gesättigte Lösung von Fe(OH)3 besteht folgender Zusammenhang zwischen den Konzentrationen der Fe3+-Ionen und der OH--Ionen: [Fe ]= 13 ⋅ [OH ] − 3+ Daraus ergibt sich für die Löslichkeit von Fe(OH)3: [Fe ]= 3+ 4 L Fe(OH )3 11 ⋅ 33 =4 L Fe(OH )3 27 17 Einführung in die Allgemeine Chemie 1. Praktikumstag Praktischer Teil Chemikalienliste Verbindung Summenformel Gefahrstoffsymbole + R- und S-Sätze Kaliumdichromat K2Cr2O7 T ;N R 49-46-21-37/38-41-4350/53; S 53-45-60-61 Ethanol C2H5OH F R 11; S 7-16 Ammoniak-Lösung NH3 C; N R 34-50; S 26-36/37/3945-61 Schwefelsäure H2SO4 C R 35; S 26-30-45 Kupfer(II)-sulfat-Pentahydrat CuSO4·5H2O Xn; N R 22-36/38-50/53; S 2260-61 Nickel(II)-chlorid-Hexahydrat NiCl2·6H2O T; N R 45-23/24/25-36/37/3842/43; S26-27-28-45-5336/37/39 Kaliumoxalat-Monohydrat K2C2O4·H2O Xn R 21/22; S 24/25 Oxalsäure-Dihydrat H2C2O4 ·2H2O Xn R 21/22; S24/25 Versuch 1: Darstellung von Tetraamminkupfer(II)sulfat-Monohydrat In einem Becherglas werden 5 g CuSO4·5H2O in 5-10 ml Wasser gelöst und mit konzentriertem Ammoniak versetzt, bis sich der Niederschlag gerade wieder vollständig gelöst hat. Die Lösung wird in einem großen Reagenzglas mit einem Ethanol/Wasser-Gemisch (1:1) vorsichtig ca. 1 cm hoch überschichtet, indem man das Gemisch langsam aus der Pipette an der Wand des Reagenzglases herunterfließen lässt. Darüber wird in gleicher Weise und Höhe reines Ethanol geschichtet. Man lässt die Lösung in dem mit einem Uhrglas bedeckten Reagenzglas für eine Woche zur Kristallisation im Abzug stehen, filtriert die entstandenen Kristalle ab und trocknet mit Ethanol. Die trockenen Kristalle sind dem Assistenten in einem Schnappdeckelglas abzugeben. Für das Protokoll: Es sind alle Reaktionsgleichungen sowie die theoretische und die im Praktikum erhaltene Ausbeute in g und Prozent anzugeben. Versuch 2: Darstellung von Kaliumtrioxalatochromat(III)-Trihydrat Zur Lösung von 3,6 g Oxalsäure-Dihydrat H2C2O4·2H2O und 1,5 g Kaliumoxalat-Monohydrat K2C2O4·H2O in 40 ml Wasser tropft man eine Lösung von 1,2 g Kaliumdichromat K2Cr2O7 in 5 ml Wasser langsam und unter Rühren mit dem Glasstab zu. Die Lösung wird bis auf etwa 5-10 ml Volumen eingedampft und für eine Woche zur Kristallisation abgedeckt in den Abzug gestellt. Dann werden die entstandenen Kristalle mit Hilfe einer Saugflasche und eines Büchnertrichters abgesaugt und ausgewogen. Die trockenen Kristalle sind dem Assistenten in einem Schnappdeckelglas abzugeben. Für das Protokoll: Es sind alle Reaktionsgleichungen sowie die theoretische und die im Praktikum erhaltene Ausbeute in g und Prozent anzugeben. 18 Einführung in die Allgemeine Chemie 1. Praktikumstag Versuch 3: Darstellung von Hexaamminnickel(II)-chlorid In einem 50 ml-Becherglas werden 6 g NiCl2·6H2O in 10 ml demineralisiertem Wasser unter Erwärmen gelöst und die Lösung, falls sie nicht ganz klar ist, filtriert. Nach dem Abkühlen gibt man tropfenweise unter ständigem Rühren ca. 15 ml konz. NH3 hinzu (ein evtl. entstehender grau-grüner Niederschlag von Ni(OH)2 muss sich auf jeden Fall wieder vollständig lösen!). Zur Vervollständigung der schon evtl. während des Zusetzens von NH3 beginnenden Ausscheidung des violetten Produkts wird die Lösung für ca. ½ Stunde in ein Eisbad gestellt. Die Kristalle werden anschließend mit Hilfe eines Büchnertrichters abgesaugt, zunächst mit konz. NH3 und danach mit Ethanol gewaschen. Die an der Luft getrockneten Kristalle sind dem Assistenten in einem Schnappdeckelglas abzugeben. Für das Protokoll: Es sind alle Reaktionsgleichungen sowie die theoretische und die im Praktikum erhaltene Ausbeute in g und Prozent anzugeben. Versuch 4: Darstellung von Chromalaun KCr(SO4)2 *12 H2O In einem 100 ml Becherglas werden 2,0 g Kaliumdichromat K2Cr2O7 mit 20 ml E-Wasser (Messzylinder) versetzt und langsam 2,5 ml konz. Schwefelsäure (Messpipette) zugegeben. (VORSICHT, die Lösung wird warm!) Nachdem das gesamte Kaliumdichromat gelöst ist, wird die Lösung etwa 5 min abkühlen gelassen. Das kalte 100 ml Becherglas wird in ein mit 100 ml kaltem Wasser gefülltes 400 ml Becherglas gestellt (Wasserbad). Die so temperierte KaliumdichromatLösung wird innerhalb von 10 min. tropfenweise unter Rühren mit 1,5 ml Ethanol (Messpipette) versetzt. (VORSICHT, die Lösung wird warm!) Das 100 ml Becherglas wird aus dem Wasserbad genommen und für eine Woche zur Kristallisation in den Abzug gestellt. Nach einer Woche werden die entstandenen Kristalle mit Hilfe einer Saugflasche und eines Büchnertrichters abgesaugt. Die an der Luft getrockneten Kristalle sind dem Assistenten in einem Schnappdeckelglas abzugeben. Für das Protokoll: Es sind alle Reaktionsgleichungen sowie die theoretische und die im Praktikum erhaltene Ausbeute in g und Prozent anzugeben. Die Aufarbeitung der Präparate ist für den 5. Praktikumstag vorgesehen. Das Protokoll ist also am 5. Praktikumstag abzugeben. 19 Einführung in die Allgemeine Chemie 2. Praktikumstag 2. PRAKTIKUMSTAG Säure-Base/Puffer Theoretische Grundlagen 2.1 Definition von Säuren und Basen Nach Brönstedt bezeichnet man Moleküle oder Ionen, die in der Lage sind, Protonen (H+) abzugeben als Protonendonatoren oder Säuren (HA). HA → H+ + A- Säuren: Moleküle oder Ionen, die in der Lage sind, Protonen anzulagern, bezeichnet man nach Brönstedt als Protonenakzeptoren oder Basen (B). B + H+ → HB+ Basen: Schreibt man diese Reaktionen als Gleichgewichtsreaktionen, so erkennt man, dass die Säure HA unter Protonenabgabe in ein Anion A- übergeht, das seinerseits in der Lage ist, ein Proton aufzunehmen und nach der Definition eine Base darstellt. Die Base B geht unter Protonenaufnahme in das Kation HB+ über, das ein Proton abgeben kann und nach der Definition eine Säure ist. Die Säure HA und ihre deprotonierte Form A- bezeichnet man als korrespondierendes oder auch konjugiertes Säure-Base-Paar. Auch die Base B und ihre protonierte Form HB+ bezeichnet man als korrespondierendes bzw. konjugiertes Säure-Base-Paar. Da bei Protonenübertragungen keine freien Protonen auftreten (dies entspräche im Fall von Wasserstoff einem „nackten“ Atomkern), kann eine Säure nur in Gegenwart einer Base ihre Protonen abgeben. Bei einer Säure-Base-Reaktion sind immer zwei konjugierte Säure-Basen-Paare beteiligt: HA A- + H+ Säure-Base-Paar HA/A- B + H+ HB+ Säure-Base-Paar HB+/B HA + B A- + HB+ Säure-Base-Reaktion Die Dissoziation einer Säure in Wasser (Protolyse) ist ebenfalls eine Säure-Base-Reaktion. Das H2OMolekül nimmt bei dieser Reaktion ein Proton auf und wirkt daher als Base: HA + H2O → A- + H3O+ Bei der Dissoziation einer Base in Wasser gibt das H2O-Molekül ein Proton ab und wirkt daher als Säure: B + H2O → HB+ + OHDie Eigenschaft des Wassers, je nach Reaktionspartner als Säure wie auch als Base wirken zu können, hat ihre Ursache darin, dass Wasser Bestandteil zweier korrespondierender Säure-BasePaare ist: H3O+/H2O und H2O/OHDiese Eigenschaft, die außer Wasser auch andere Moleküle (z.B. Aminosäuren) oder Ionen (z.B. H2PO4-) besitzen, bezeichnet man als amphoteren Charakter. Die Substanzen, die diese Eigenschaften besitzen, bezeichnet man als Ampholyte. 20 Einführung in die Allgemeine Chemie 2. Praktikumstag 2.2 Säure- und Basestärke Säuren, die während der Protolyse ihr acides Proton vollständig an Wasser abgeben, bezeichnet man als starke Säuren, ihre korrespondierenden Basen sind naturgemäß sehr schwache Basen. HA stark + H2O → A- sehr schwach + H3O+ Basen, die dem Wasser ein Proton entreißen können und dabei vollständig in die protonierte Form übergehen, bezeichnet man als starke Basen, ihre protonierte Formen sind naturgemäß sehr schwache Säuren. B stark + H2O → HB+ sehr schwach + OHSäuren bzw. Basen, bei denen die eben genannten Vorgänge nicht vollständig, sondern mehr oder weniger unvollständig ablaufen, bezeichnet man als schwache Säuren bzw. Basen. Bei schwachen Säuren bzw. Basen stellen sich die folgenden Dissoziationsgleichgewichte ein: A- schwach + H3O+ HA schwach + H2O HB+ schwach + OH- B schwach + H2O Die Begriffe Säurestärke und Basenstärke sind demnach ein Maß für die Dissoziation der Säure bzw. der Base in wäßriger Lösung. 2.3 Anwendung des MWG auf die Dissoziation von Säuren und Basen Für den Gleichgewichtszustand der Säuredissoziation lautet das Massenwirkungsgesetz: A- + H3O+ HA + H2O K= [H 3 O + ] ⋅ [A - ] [HA] ⋅ [H 2 O] Bei großer Verdünnung ist die Konzentration des Wassers im Vergleich zu den anderen auftretenden Konzentrationen ein großer Wert, der sich im Verlauf der Dissoziation nur geringfügig verändert. Als Näherung kann man demnach für große Verdünnungen die H2O-Konzentration als konstant ansehen und in die Gleichgewichtskonstante mit einbeziehen. Die neue Konstante KS bezeichnet man als Säurekonstante. Sie nimmt für jede Säure einen charakteristischen Wert an und ist ein Maß für die Säurestärke: K S = K ⋅ [H 2 O] = [H 3 O + ] ⋅ [A - ] [HA] Eine entsprechende Ableitung des Massenwirkungsgesetzes für die Dissoziation einer Base führt zur Basenkonstante KB: HB+ + OH- B + H2O K B = K ⋅ [H 2 O] = [HB + ] ⋅ [OH - ] [B] Die Gleichgewichtskonstante K aus dem Massenwirkungsgesetz ist in dem hier beschriebenen Beispiel eine dimensionslose Größe. Da bei der Herleitung der KS- bzw. KB-Werte die H2OKonzentration mit einbezogen wurde, erhalten diese Konstanten nun die Dimension einer 21 Einführung in die Allgemeine Chemie 2. Praktikumstag Konzentration (mol/l). Die Säuren- und Basenkonstanten werden in Tabellen (siehe Anhang II) als pKS- bzw. pKB-Werte zusammengefaßt. Es gelten folgende Beziehungen: pKS = -log KS und daraus: K S = 10 − pK S pKB = -log KB und daraus: K B = 10 − pK B Stark dissoziierte Säuren haben einen großen KS-Wert (KS >1) und damit einen negativen pKS-Wert. Stark dissoziierte Basen haben einen großen KB-Wert (KB > 1) und damit einen negativen pKB-Wert 2.4 Der Dissoziationsgrad α Um die Anzahl der dissoziierten Moleküle eines schwachen Elektrolyten (z.B. einer schwachen Säure oder einer schwachen Base) angeben zu können, wird der Dissoziationsgrad α (Bruchteil der dissoziierten Moleküle) definiert: α= c Konzentration (Anzahl) der dissoziierten Moleküle = diss. Konzentration (Anzahl) der vor der Dissoziation vorhandenen Moleküle c 0 Die dimensionslose Größe α kann Werte von 0 bis 1 annehmen. Der Randwert α = 0 bedeutet, dass kein einziges Molekül dissoziiert ist, der Randwert α = 1 steht für vollständige Dissoziation. Für schwache Säuren und Basen nimmt der Dissoziationsgrad Werte α ⟨⟨ 1 an. Für die Konzentrationen im Gleichgewicht gelten folgende Beziehungen: [H3O+] = [A-] = cdiss. = α co; [HA] = co - cdiss. = (1 - α)co Werden diese Beziehungen in die aus dem Massenwirkungsgesetz für die Säurekonstante KS abgeleitete Gleichung eingesetzt, so erhält man das OSTWALDsche Verdünnungsgesetz: KS = [H 3 O + ] ⋅ [A - ] . [HA] Nach Einsetzen und Umformen erhält man: α 2 ⋅ co α ⋅ KS KS KS = ⇒ 0 =α2 + − co co 1-α . Für den Dissoziationsgrad α ergibt sich schließlich als Lösung dieser quadratischen Gleichung: ⎛ K K α = − S ± ⎜⎜ S 2 ⋅ co ⎝ 2 ⋅ co 2 ⎞ K ⎟⎟ + S co ⎠ Von den zwei möglichen Lösungen ist auf Grund der Randbedingungen von α nur diejenige sinnvoll, bei der α positiv ist. Bei schwachen Elektrolyten (mit α << 1) können folgende Näherungen gemacht werden: KS =α 2 ⋅ co und daraus α= KS ; co Die Anwendung des Ostwaldschen Gesetzes empfiehlt sich im Bereich der mittelstarken (Grenze stark/schwach) Elektrolyten. 22 Einführung in die Allgemeine Chemie 2. Praktikumstag 2.5 Die Autoprotolyse des Wassers; der pH-Wert Aufgrund seines amphoteren Charakters unterliegt das Wasser einer Eigendissoziation oder Autoprotolyse nach: H3O+ + OH- H2O + H2O Dies hat zur Folge, dass in reinem Wasser geringe, aber messbare, gleich große Konzentrationen an H3O+-Ionen und OH--Ionen vorliegen. Diese Konzentrationen betragen bei 25°C: [H3O+] = [OH-] = 10-7 mol/l Mit dem MWG erhält man für das Autoprotolysegleichgewicht folgenden Ausdruck: K= [H 3 O + ] ⋅ [OH - ] [H 2 O]2 und K W = K ⋅ [H 2 O]2 = [H 3 O + ] ⋅ [OH - ] Aus dieser Ableitung ergibt sich, dass in wäßrigen Lösungen das Produkt der Konzentrationen von H3O+ und OH- immer einen konstanten Wert ergibt, der bei 25°C KW = 10-14mol2/l2 beträgt, und als Ionenprodukt des Wassers bezeichnet wird. Bei Säurezusatz steigt die Konzentration von H3O+-Ionen, so dass die Konzentration von OH--Ionen entsprechend abnehmen muss. Bei Basenzusatz verringert sich die H3O+-Ionenkonzentration, so dass die Konzentration von OH--Ionen entsprechend zunehmen muss. Der pH-Wert ist ein Maß für die H3O+-Ionenkonzentration in Lösungen. Er ist definiert als: pH = -log [H3O+] und daraus [H3O+] = 10-pH mol/l und daraus [OH-] = 10-pOH mol/l Analog dazu wird der pOH-Wert definiert als: pOH = -log [OH-] Für reines Wasser ergibt sich damit: [H3O+] = [OH-] = 10-7 mol/l; ⇒ pH = pOH = 7 (bei 25 oC) pKW = -log KW = pH + pOH = 14 Wässrige Lösungen mit einem pH-Wert von 7 nennt man neutral; den pH-Wert 7 bezeichnet man als Neutralpunkt. Lösungen, deren H3O+-Ionenkonzentration größer ist als 10-7 mol/l nennt man sauer, ihr pH-Wert ist niedriger als 7. Basische Lösungen haben eine geringere H3O+-Ionenkonzentration als reines Wasser, ihr pH-Wert ist größer als 7. Natürliche Wässer haben nie einen pH-Wert von genau 7. Je nach Region und den darin gelösten Mineralien ist ein natürlicher pH-Wert immer leicht sauer oder basisch. 2.6 Der pH-Wert von Säuren und Basen Da starke Säuren praktisch vollständig dissoziiert sind, kann die H3O+-Ionenkonzentration mit der Ausgangskonzentration der Säure [HA]0 gleichgesetzt werden: starke Säuren: pH = -log [H3O+] = -log [HA]0 Für starke Basen mit der Ausgangskonzentration [B]0 gilt dementsprechend: starke Basen: pOH = -log [OH-] = -log [B]0 und pH = 14 - pOH Bei der Berechnung der pH-Werte schwacher Säuren und schwacher Basen muss, wenn α nicht bekannt ist, auf das Massenwirkungsgesetz zurückgegriffen werden. Für eine schwache Säure gilt nach dem MWG: 23 Einführung in die Allgemeine Chemie 2. Praktikumstag KS = [A - ] ⋅ [H 3O + ] [HA] Die aus der Dissoziation der Säure hervorgegangene H3O+-Ionenkonzentration ist genauso groß wie die Konzentration ihres entstandenen Anions A-. Mit [H3O+] = [A-] ergibt sich dann: [H 3 O + ] 2 KS = und daraus [HA] 1 ⇒ pH = (pK S − log [HA] ) 2 [H 3 O + ] = K S ⋅ [HA] Für schwache, kaum dissoziierte Säuren kann man näherungsweise die unbekannte Konzentration [HA] mit der Ausgangskonzentration der Säure [HA]0 gleichsetzen und erhält dann für den pH-Wert von schwachen Säuren: schwache Säuren : pH = − log [H 3 O + ] = − log K S ⋅ [HA]0 = 1 [pK S − log [HA]0 ] 2 Für den pH-Wert von schwachen Basen mit der Ausgangskonzentration [B]0 ergibt eine entsprechende Herleitung aus dem MWG: schwache Basen : pOH = − log [OH - ] = − log K B ⋅ [B]0 = 1 ⋅ [pK B − log [B]0 ] 2 pH = 14 − pOH 2.7 Indikatoren Die gebräuchlichen Indikatoren zur pH-Wert-Bestimmung sind organische Farbstoffe, die sich ihrerseits wie schwache Säuren oder Basen verhalten. Als Indikatoren eignen sich korrespondierende Säure-Base-Paare, bei denen sich die Säure von der Base farblich unterscheidet. Wenn wir den Indikator in der Form einer Säure (HA) bezeichnen, so besteht abhängig vom pH-Wert das folgende Gleichgewicht: A- + H+ HA Methylrot z.B. hat als undissoziierte Indikatorsäure (HA) eine rote Farbe, das korrespondierende Indikatoranion (A-) dagegen ist gelb: O COOH O C N N N N N CH3 N CH3 CH3 + H+ CH3 rot Indikatorsäure gelb Indikatoranion Da es sich um ein pH-abhängiges Gleichgewicht handelt, werden bei jeder Hydroniumionenkonzentration bestimmte Anteile beider Komponenten (HA und A-) vorliegen. In 24 Einführung in die Allgemeine Chemie 2. Praktikumstag Lösung wird demnach die vom Indikator verursachte Farbe stets vom Verhältnis der Konzentrationen beider Komponenten abhängen. Theoretisch kommt somit bei allmählicher pH-Wert-Änderung ein kontinuierlicher Farbwechsel zustande. Praktisch aber wird die Wirkungsweise des Indikators davon abhängen, ab welchem pHWert sich die Farbe des Indikators für das Auge sichtbar ändert. Wir kommen damit zu zwei Grenzwerten, jenseits derer nur noch der saure bzw. der basische Farbton dominiert. Das Gebiet zwischen diesen Grenzwerten stellt damit den Umschlagbereich des Indikators dar. Er ist für jeden Indikator verschieden, jedoch für ihn spezifisch. Allgemein gilt für den Umschlagbereich eines Indikators: pH ≈ pKInd. ± 1 2.8 Salze Salze entstehen im Verlauf einer Neutralisationsreaktion aus einer Säure und einer Base nach: Säure + Base → Salz + Wasser Salze bestehen demnach aus einem Säure- und einem Basenrest. So besteht beispielsweise NaCl aus dem Säurerest Cl- der Säure HCl und dem Basenrest Na+ der Base NaOH. Diese Säure- bzw. Basenreste sind dafür verantwortlich, dass sich während der Dissoziation eines Salzes in Wasser der pH-Wert der Lösung ändern kann. Je nach dem Einfluß eines Salzes auf den pH-Wert seiner Lösung unterscheidet man saure, basische und neutrale Salze. Liegen in einem Salz das Anion (Säurerest) einer starken Säure und das Kation (Basenrest) einer starken Base vor, so spricht man von einem neutralen Salz. Die bei der Dissoziation eines neutralen Salzes entstehenden Ionen haben keinen Einfluß auf den pH-Wert. Beispiele für neutrale Salze: NaCl; KNO3; KBr Ein saures Salz enthält den Säurerest einer starken Säure und den Basenrest einer schwachen Base. NH4Cl (gebildet aus der starken Säure HCl und der schwachen Base NH3) zum Beispiel besteht aus der Säure NH4+ (Kationensäure, korrespondierende Säure oder Basenrest zur schwachen Base NH3) und der Base Cl- (korrespondierende Base oder Säurerest zur Säure HCl). Der bei der Dissoziation frei werdende Basenrest tritt nun mit H2O-Molekülen in ein Dissoziationsgleichgewicht, wodurch H3O+Ionen erzeugt werden. Der pH-Wert wird somit gesenkt: NH4Cl → NH4+ + ClNH3 + H3O+ NH4+ + H2O Zur Ermittlung des pH-Wertes von Lösungen saurer Salze verwendet man die Gleichung zur pH-WertBerechnung für schwache Säuren unter Verwendung des pKS-Wertes des schwach sauren Ions (hier NH4+). Basische Salze enthalten den Säurerest einer schwachen Säure und den Basenrest einer starken Base. Natriumacetat (CH3COONa) besteht aus dem Säurerest der schwachen Essigsäure (CH3COOH) und dem Basenrest der starken Base NaOH. Der Säurerest CH3COO-, also die korrespondierende Base (Anionenbase) zur schwachen Säure CH3COOH, ist für die Veränderung des pH-Wertes während der Dissoziation verantwortlich, da in Folge des eintretenden Dissoziationsgleichgewichtes OH--Ionen erzeugt werden, der pH-Wert steigt: CH3COONa → CH3COO- + Na+ CH3COO- + H2O CH3COOH + OH - Bei der Berechnung des pH-Wertes von Lösungen basischer Salze verwendet man die pH-Gleichung für schwache Basen unter Verwendung des pKB-Wertes des schwach basischen Ions (hier CH3COO-). 25 Einführung in die Allgemeine Chemie 2. Praktikumstag 2.9 Puffergemische Gemische von schwachen Säuren und Salzen ihrer korrespondierenden Basen (z.B. Essigsäure und Natriumacetat) sowie Gemische von schwachen Basen und Salzen ihrer korrespondierenden Säuren (z.B. Ammoniak und Ammoniumchlorid) haben die Eigenschaften, sowohl H3O+- als auch OH--Ionen, die durch irgendeine Reaktion in der Lösung entstehen oder von außen zugegeben werden, weitgehend zu binden. Dadurch bleibt der pH-Wert einer solchen Lösung annähernd konstant, was für viele Reaktionen in der analytischen Chemie und für die Funktionsfähigkeit biochemischer Systeme von großer Bedeutung ist. Man nennt solche Gemische Pufferlösungen. Beispiele für Puffergemische sind: H3CCOOH / H3CCOO"H2CO3" / HCO3H2PO4- / HPO42NH4+ / NH3 Essigsäure-Acetat-Puffer Kohlensäure-Hydrogencarbonat-Puffer Dihydrogenphosphat-Hydrogenphosphat-Puffer Ammoniumchlorid-Ammoniak-Puffer Betrachtet man ein allgemeines Puffergemisch aus der Säure HA (z.B. H3CCOOH oder NH4+) und ihrer korrespondierenden Base A- (z.B. H3CCOO- oder NH3), so sind folgende Reaktionsgleichungen für die Wirkungsweise des Puffers verantwortlich: CH3COO- + H3O+ → CH3COOH + H2O (allg.: A- + H3O+ → HA + H2O, CH3COOH + OH- → CH3COO- + H2O (allg.: HA + OH- → A- + H2O. Abfangen von H3O+-Ionen) Abfangen von OH--Ionen) Der pH-Wert von Pufferlösungen berechnet sich nach der Henderson-Hasselbalch-Gleichung: [A − ] pH = pK S + log [HA] Werden die Konzentrationen der Säure und der korrespondierenden Base gleich groß gewählt, spricht man von einem äquimolaren Puffer. Der pH-Wert eines äquimolaren Puffers beträgt pH = pKS. Je größer die Konzentrationen der Pufferkomponenten gewählt werden, umso größer ist die Kapazität des Puffers. Der pH-Wert einer Pufferlösung, welche nach Zugabe einer bestimmten Stoffmenge an H3O+-Ionen (n(H3O+)) das Gesamtvolumen Vges aufweist, berechnet sich dann nach: pH = pK S + log n(A − ) n(H 3 O + ) − Vges Vges n(HA) n(H 3 O + ) + Vges Vges Man sieht, dass sich das Gesamtvolumen „wegkürzen“ lässt und erhält: n(A − ) − n(H 3 O + ) n(HA) + n(H 3 O + ) pH = pK S + log Der pH-Wert einer Pufferlösung nach Zugabe einer bestimmten Stoffmenge an OH--Ionen (n(OH-)) berechnet sich dann analog nach: pH = pK S + log n(A − ) + n(OH − ) n(HA) − n(OH − ) 26 Einführung in die Allgemeine Chemie 2. Praktikumstag Praktischer Teil Chemikalienliste Verbindung Summenformel Gefahrstoffsymbole R- und S-Sätze Ammoniak-Lösung NH3 C; N R 34-50; S 26-36/37/3945-61 Ammoniumchlorid NH4Cl Xn R 22-36; S 22 Natriumhydroxid NaOH C R 35; S 26-37/39-45 Salzsäure HCl C R 34-37; S 26-36/37/3945 Kaliumhydrogensulfat KHSO4 C R 34-37; S 26-36/37/39/45 Natriumcarbonat Na2CO3 Xi R 36; S 22-26 Kaliumhydroxid KOH C R 22-35; S 26-36/37/3945 Natriumhydrogencarbonat NaHCO3 - - Natriumchlorid NaCl - - Essigsäure CH3COOH C R 10-35; S 23.2-2636/37/39-45 Natriumphosphat Na3PO4 Xi R 36/38 Natriumacetat NaCH3COO - - Calciumcarbonat CaCO3 - - Schwefelsäure H2SO4 C R 35; S 26-30-45 Natriumsulfid Na2S C; N R 31-34-50; S 26-45-61 Magnesiumoxid MgO - S 22 Versuch 1: pH-Wert-Bestimmung unterschiedlich konzentrierter Säuren und Basen Bestimmen Sie mit Hilfe eines elektronischen pH-Messgeräts den pH-Wert von Salzsäure, Essigsäure und Ammoniaklösung jeweils in den Konzentrationen 0,1M, 10–2M und 10–3M. Achten Sie bitte im Folgenden darauf, nach jedem Schritt sämtliche benutzten Glasgeräte und die pHElektrode gründlich mit Wasser zu spülen. Die Pipette sollte außerdem mit der zu pipettierenden Lösung gespült werden. Den pH-Wert der 0,1 M Lösungen können Sie direkt bestimmen, indem Sie eine ausreichende Menge der ausstehenden Lösung in ein Becherglas geben und das pH-Messgerät einige Sekunden hineinhalten. Die 10–2M Lösungen stellen Sie her, indem Sie mit der Vollpipette 10 ml der 0,1 M Lösung in den Messkolben geben und diesen dann mit destilliertem Wasser bis exakt zur Eichmarke (100 ml) auffüllen und anschließend schütteln. Zur Messung des pH-Werts geben Sie wieder einen Teil der Lösung in ein Becherglas. Zur Herstellung der 10–3M Lösungen verdünnen Sie ganz analog die 10–2M Lösungen um den Faktor 10. Für das Protokoll: Stellen Sie die neun gemessen pH-Werte tabellarisch mit dem berechneten pHWerte gegenüber. 27 Einführung in die Allgemeine Chemie 2. Praktikumstag Versuch 2: pH-Wert Bestimmung verschiedener Salzlösungen Lösen Sie in den zur Messung vorgesehenen Kristallisationsschalen jeweils einen halben Apothekerlöffel der aufgeführten Salze in ca. 15 ml dest. Wasser. Messen Sie erst den pH-Wert des dest. Wassers und anschließend den pH-Wert der hergestellten Lösungen mit der pH-Elektrode. Die Anzeige sollte für mindestens 10 Sekunden stabil sein. -NaCl -Na3PO4 -CH3COONa -KHSO4 -Na2CO3 -KOH -NH4Cl -NaHCO3 Spülen Sie nach jeder Messung die Elektrode gründlich mit dest. Wasser ab! Für das Protokoll: Geben Sie die vollständigen Reaktionsgleichungen, die für die pHWertänderungen der Lösungen verantwortlich sind, sowie den jeweils gemessenen pH-Wert an. Versuch 3: Säure-Base Reaktionen mit gasförmigen Endprodukten Ammoniak als Endprodukt Versetzten Sie in einem Reagenzglas eine Spatelspitze festes Ammoniumchlorid mit ein bis zwei Natriumhydroxidplätzchen und anschließend mit einigen Tropfen Wasser. Überprüfen Sie mit einem angefeuchteten pH-Indikatorpapierstreifen (über der Öffnung des Reagenzglases) und anhand des Geruchs ob Ammoniak entweicht. Kohlendioxid als Endprodukt Füllen Sie ein Reagenzglas zu einem Viertel mit verdünnter Salzsäure und geben Sie ein Marmorbröckchen hinzu. (pH-Wert; Geruch?) Chlorwasserstoff als Endprodukt Geben Sie in einem Reagenzglas zu einer Spatelspitze Natriumchlorid einige Tropfen konzentrierte Schwefelsäure. Eventuell müssen Sie das Gemisch vorsichtig über der Bunsenbrennerflamme erhitzen. (pH-Wert; Geruch?) Schwefelwasserstoff als Endprodukt Geben Sie eine Spatelspitze Natriumsulfid in ein Reagenzglas. Hierzu werden einige ml verdünnte Salzsäure gegeben. (pH-Wert; Geruch?) Essigsäure als Endprodukt Verreiben Sie in einem Mörser ein bis zwei Spatel Natriumacetat mit der gleichen Menge Kaliumhydrogensulfat. (pH-Wert; Geruch?) Für das Protokoll: Geben Sie die vollständigen Reaktionsgleichungen sowie die pH-Werte und den Geruch an. Versuch 4: Herstellung einer Pufferlösung Durch die Verwendung von festem Natriumacetat und einer 0,1 M Essigsäure, sollen 50 ml eines Puffers mit einem pH-Wert von 5 hergestellt werden. Lösen Sie dazu in einem Becherglas die entsprechende Menge an Natriumacetat in 50 ml 0,1 M Essigsäure. In dem zur Messung 28 Einführung in die Allgemeine Chemie 2. Praktikumstag vorgesehenen Becherglas werden etwa 15 ml der Pufferlösung gegeben und mit Hilfe einer pHElektrode der pH-Wert gemessen. Die Anzeige sollte für mindestens 10 Sekunden stabil sein. Die hergestellte Pufferlösung nicht verwerfen, da sie für Versuch 5 benötigt wird! Spülen Sie nach der Messung die Elektrode mit dest. Wasser gründlich ab! Für das Protokoll: Geben Sie den gemessenen und den gerechneten pH-Werte an. Versuch 5: Wirkungsweise eines Puffers Zunächst werden mit der Meßpipette 10 ml dest. Wasser in ein Becherglas gegeben. Dazu werden mit der Meßpipette 5 ml 0,1 M Salzsäure gegeben und gut durchmischt. Der pH-Wert dieser Lösung wird mit Hilfe der pH-Elektrode gemessen. Der Versuch wird unter Verwendung der 0,1M Natronlauge, anstelle der Salzsäure wiederholt. Im Anschluss werden 10 ml der in Versuch 4 hergestellten Pufferlösung in ein Becherglas gegeben und mit 5 ml 0,1 M Salzsäure versetzt und gut durchmischt. Der pH-Wert dieser Lösung wird mit Hilfe der pH-Elektrode bestimmt. Dieser Versuch ist ebenfalls unter Verwendung der 0,1 M Natronlauge zu wiederholen. Bei der Versuchsdurchführung ist darauf zu achten, dass die verwendeten Messpipetten, die Bechergläser und die pH-Elektrode immer gründlich gespült werden, bevor der nächste Versuchsteil durchgeführt wird. Für das Protokoll: Geben Sie die vier gemessenen pH-Werte an und vergleiche Sie diese mit den berechneten pH-Werten. Versuch 6: Löslichkeitsprodukt In einem 300 ml Erlenmeyerkolben wird eine Spatelspitze Magnesiumoxid in 100 ml Wasser für ca. 10 min. geschüttelt. (Das Magnesiumoxid reagiert mit dem Wasser zu Magnesiumhydroxid, welches sich solange löst bis das Sättigungsgleichgewicht erreicht ist.) Anschließend lässt man die Mischung für einige Minuten ruhen, bis sich der Feststoff vollständig am Boden abgesetzt hat. In der nun klaren Lösung wird der pH-Wert mittels pH-Elektrode bestimmt. Für das Protokoll: Geben Sie die Reaktionsgleichung an. Berechnen Sie anhand des pH-Wertes die Konzentration von Mg2+ und OH--Ionen sowie das Löslichkeitsprodukt und die molare Löslichkeit von Mg(OH)2 (unter der Annahme, dass das Magnesiumhydroxid vollständig dissoziiert vorliegt). 29 Einführung in die Allgemeine Chemie 3. Praktikumstag 3. PRAKTIKUMSTAG Redoxreaktionen Theoretische Grundlagen 3.1 Definition von Oxidation und Reduktion Nach der ursprünglichen Definition bedeutet die Oxidation eine Reaktion, bei der sich eine Substanz mit Sauerstoff verbindet. Reagieren z.B. zwei Metallatome Mg mit einem Sauerstoffmolekül O2 auf diese Weise, so beruht die Oxidbildung auf einem Übergang von Elektronen (e-) vom Metall- zum Sauerstoffatom: → 2Mg2+ + 4e→ 2O2→ 2MgO 2Mg 4e- + O2 2Mg + O2 Nach einer erweiterten Definition bedeutet Oxidation eine Abgabe von Elektronen. Die oxidierende Wirkung eines Oxidationsmittels besteht in dessen elektronenentziehender Wirkung. Das Ergebnis einer Oxidation ist eine Erhöhung der Oxidationszahl (s.u.) des oxidierten Atoms bzw. Ions. Oxidationen: Na → Na+ + eFe2+ → Fe3+ + e- Bei einer Reduktion werden gemäß dieser Definition Elektronen aufgenommen. Ein Reduktionsmittel hat die Eigenschaft, Elektronen abgeben zu können. Während einer Reduktion erfährt das reduzierte Atom bzw. Ion eine Erniedrigung der Oxidationszahl. Cl2 + 2 e- → 2 ClFe3+ + e- → Fe2+ Reduktionen: Schreibt man diese Reaktionsgleichungen als Gleichgewichtsreaktionen, dann erfolgt je nach Richtung der Reaktion eine Oxidation bzw. eine Reduktion: Fe3+ + e- Reduktion Oxidation Fe2+ Allgemein kann man schreiben: oxidierte Form + z e- reduzierte Form Die oxidierte Form und die reduzierte Form bilden zusammen ein korrespondierendes Redoxpaar. Da bei einer chemischen Reaktion keine freien Elektronen auftreten können, muß eine Oxidation, bei der Elektronen entstehen, immer mit einer Reduktion gekoppelt sein, bei der diese Elektronen aufgenommen werden. Bei Redoxreaktionen sind immer zwei Redoxpaare beteiligt: Zn → Zn2+ + 2e+ 2H + 2e → H2 Zn + 2H+ → Zn2+ + H2↑ Redoxpaar1 Redoxpaar2 Eine allgemeine Redoxgleichung lässt sich so beschreiben, dass man zur oxidierten Form des einen Redoxpaares die reduzierte Form des anderen Redoxpaares hinzu gibt: Red1 + Ox2 → Ox1 + Red2 30 Einführung in die Allgemeine Chemie 3. Praktikumstag Je stärker bei einem Redoxpaar die Tendenz der reduzierten Form ist, Elektronen abzugeben, umso schwächer ist die Tendenz der korrespondierenden oxidierten Form, Elektronen aufzunehmen. Nach dieser Tendenz sind die Redoxpaare in der sogenannte Spannungsreihe (s. u.) angeordnet. Je höher ein Redoxpaar in der Spannungsreihe steht, umso stärker ist die reduzierende Wirkung der reduzierten Form. Je tiefer ein Redoxpaar steht, umso stärker ist die oxidierende Wirkung der oxidierten Form. Also sind z.B. die Alkalimetalle (Metalle der ersten Hauptgruppe) stark reduzierend wirkende Elemente, während z.B. Fluor außerordentlich stark oxidierend wird. Anhand der Spannungsreihe (siehe Anhang III) kann man Vorhersagen über den Verlauf von Redoxreaktionen machen. Freiwillig laufen nur Redoxprozesse zwischen einer reduzierten Form mit einer in der Spannungsreihe darunter stehenden oxidierten Form ab. 3.2 Die Oxidationsstufe Der Oxidationszustand eines Atoms in einer Verbindung kann durch eine Zahl, die sogenannte Oxidationsstufe oder Oxidationszahl ausgedrückt werden. Die Änderung dieser Oxidationszahl im Zuge einer Redoxreaktion spiegelt dann die Änderung des Oxidationszustandes (Erhöhung oder Erniedrigung) wieder. Es ist daher sehr nützlich, die Oxidationszahlen der Atome der beiden an der Reaktion teilnehmenden Redoxpaare zu ermitteln. Die Bestimmung der Oxidationszahlen erfolgt nach folgenden Regeln: 1. Im elementaren Zustand haben alle Elemente die Oxidationszahl ± 0. 2. Die Summe der Oxidationszahlen aller Atome in einer neutralen Verbindung ist ± 0. 3. Die Summe der Oxidationszahlen der Atome in einem Ion entspricht der Ladung des Ions. 4. Der höchst mögliche negative Wert der Oxidationszahl ist gegeben durch die Anzahl der Valenzelektronen (Gruppennummer im PSE) minus 8. Dieser Wert entspricht der Aufnahme aller zum Abschluß der nächst höheren Oktettschale noch fehlenden Elektronen. 5. Der höchst mögliche positive Wert der Oxidationszahl ist gegeben durch die Anzahl der Valenzelektronen im elementaren Zustand. Dieser Wert entspricht der Abgabe aller Valenzelektronen, so dass die nächst niedrigere Oktettschale erreicht wird. 6. Alkalimetallionen haben immer die Oxidationszahl +1. 7. Erdalkalimetallionen haben immer die Oxidationszahl +2. 8. Fluor hat als elektronegativstes aller Elemente in seinen Verbindungen immer die Oxidationszahl -1. 9. Wasserstoff hat in chemischen Verbindungen meistens die Oxidationszahl +1, nur im Hydridion hat Wasserstoff die Oxidationszahl -1. 10. Sauerstoff hat in Verbindungen meistens die Oxidationszahl -2, in Peroxiden (z.B. Na2O2, oder BaO2) hat Sauerstoff die Oxidationszahl -1. 11. Kennt man von einer Verbindung nur die Summenformel, nicht aber die Strukturformel, erhält man für Atome der gleichen Art keine individuellen, sondern nur eine, für alle gleiche, mittlere Oxidationszahl. Diese kann, im Gegensatz zu individuellen Oxidationszahlen auch gebrochen sein. 12. Um Verwechslungen mit der Ionenladung zu vermeiden, schreibt man die Oxidationszahlen in römische Ziffern über das Elementsymbol in der Summenformel. 31 Einführung in die Allgemeine Chemie 3. Praktikumstag 3.3 Disproportionierung, Synproportionierung Es ist möglich, dass Moleküle oder Ionen ein und desselben Stoffes miteinander derart unter Elektronenübergang in Wechselwirkung treten, dass eine Atomsorte teilweise reduziert und teilweise oxidiert wird. Hierbei entstehen aus dem Molekül bzw. dem Ion eine Verbindung, die diese Atomsorte in höherer Oxidationsstufe enthält und eine andere Verbindung mit der Atomsorte in niedrigerer Oxidationsstufe. Diesen Typ einer Redoxreaktion bezeichnet man als Disproportionierung: 3 MnO42- + 4 H+ → MnO2↓ + 2 MnO4- + 2 H2O Die Umkehr einer solchen Reaktion nennt man Syn- oder Komproportionierung: 3 Mn2+ + 2 MnO4- + 2 H2O → 5 MnO2↓ + 4 H+ 32 Einführung in die Allgemeine Chemie 3. Praktikumstag Praktischer Teil Chemikalienliste Verbindung Summenformel Gefahrstoffsymbole R- und S-Sätze Chlorwasser Cl2 T; N R 23-36/37/38-51; S 7/9-45-61 Chrom(III)-Kaliumsulfat KCr(SO4)2 Xi R 36/38 Chrom(III)oxid Cr2O3 - + Diethylether C4H10O F ; Xn R 12-19-22-66-67; S 9-16-2933 Kaliumchromat K2CrO4 T; N R 49-46-36/37/38-43-50/53; S 53-45-60-61 Kaliumdichromat K2Cr2O7 T+; N R 49-46-21-25-37/38-41-4350/53; S 53-45-60-61 Kaliumiodid KI - - Kaliumnitrat KNO3 O R 8; S 16-41 Kaliumpermanganat KMnO4 O; Xn; N R 8-22-50/53; S 60-61 Kupfer(II)-sulfat-Pentahydrat CuSO4·5H2O Xn; N R 22-36/38-50/53; S 22-60-61 Mangan(II)-chlorid MnCl2 Xn R 22 Iod I2 Xn; N R 20/21-50; S 23.2-25-61 Mangan(IV)-oxid MnO2 Xn R 20/22; S 25 Mangan(II)-sulfat-Monohydrat MnSO4·H2O Xn R 48/20/22; S 22 Natriumnitrit NaNO2 O; T; N R 8-25-50; S 45-61 Natriumoxalat Na2C2O4 Xn R 21/22; S 24/25 Natriumsulfit Na2SO3 - - Natriumthiosulfat Na2S2O3 - - Salpetersäure HNO3 C R 35; S 23.2-26-36/37/39-45 Schwefelsäure H2SO4 C R 35; S 26-30-45 Schweflige Säure H2SO3 C R 20-34; S 26-36/37/39-45 Wasserstoffperoxid H2O2 C R 34; S 3-26-36/37/39-45 Versuch 1: Permanganat als Oxidationsmittel Umsetzung mit Wasserstoffperoxid: Versetzen Sie ca. 1 ml der ausstehenden 0,02 M Kaliumpermanganat-Lösung mit ca. 1 ml Wasser sowie 1 ml verd. Schwefelsäure. Geben sie zu dieser Lösung tropfenweise WasserstoffperoxidLösung (3%ig). Umsetzung mit Natriumsulfit: a) im Sauren Lösen Sie einen Mikrolöffel festes Natriumsulfit in 2 ml verd. Schwefelsäure. Versetzen Sie anschließend diese Lösung mit 5 Tropfen der ausstehenden Kaliumpermanganat-Lösung. 33 Einführung in die Allgemeine Chemie 3. Praktikumstag b) im Basischen Lösen Sie einen Mikrolöffel festes Natriumsulfit in 2 ml verd. Natronlauge. Versetzen Sie anschließend die Lösung mit 10 Tropfen der ausstehenden Kaliumpermanganat-Lösung. Danach erwärmen Sie die Lösung vorsichtig. Umsetzung mit Mangan(II)-chlorid: Geben Sie zu 2 ml 0,5 M Mangan(II)-chlorid-Lösung 10 Tropfen der Kaliumpermanganat-Lösung. Versuch 2: Soda-Salpeter-Schmelze (Oxidationsschmelze) Umsetzung mit Mangan(II)-sulfat Geben Sie zwei Spatel Natriumcarbonat und einen Spatel Kaliumnitrat auf ein Uhrglas und mischen Sie gründlich. Geben Sie nun eine Spatelspitze Mangan(II)-sulfat-Monohydrat hinzu und mischen Sie erneut gründlich mit dem Spatel. Bringen Sie das Gemenge auf eine Magnesia-Rinne und erhitzen Sie es erst vorsichtig, dann stärker bis zum Ende der Gasentwicklung. Fahren Sie damit fort, bis eine flüssige, homogene Schmelze entstanden ist (ggf. noch mehr Soda/Salpeter hinzusetzen). Der erkaltete Schmelzkuchen wird anschließend in wenig Wasser gelöst und tropfenweise mit verd. Schwefelsäure versetzt. Umsetzung mit Chrom(III)-oxid Führen Sie eine Oxidationsschmelze mit Cr2O3 durch (verfahren Sie dabei wie bei Mangan(II)-sulfat beschrieben). Der erkaltete Schmelzkuchen wird nun in einem Reagenzglas in ca. 4 ml Wasser gelöst. Zu dieser Lösung wird ca. 1 ml verd. Salpetersäure gegeben. Die Lösung wird unter fließendem Wasser kurz abgekühlt, dann 1 cm hoch mit Diethylether überschichtet und mit 10-15 Tropfen WasserstoffperoxidLösung (3%ig) versetzt. Anschließend wird die Lösung vorsichtig geschüttelt (Diethylether bzw. dämpfe sind hoch entzündlich, es dürfen sich während dieses Versuches keine offenen Flammen in der Nähe befinden). Versuch 3: Dichromat als Oxidationsmittel Umsetzung mit Natriumsulfit Lösen Sie einen Mikrolöffel festes Natriumsulfit in 2 ml verd. Schwefelsäure. Geben Sie anschließend 10 Tropfen der ausstehenden Kaliumdichromat-Lösung hinzu. Versuch 4: Wasserstoffperoxid als Oxidationsmittel Umsetzung mit Chrom(III)-Kaliumsulfat Lösen Sie einen Mikrolöffel Chrom(III)-Kaliumsulfat in ca. 1 ml Wasser und versetzen Sie die Lösung mit ca. 1 ml verd. Natronlauge. Anschließend geben Sie ca. 10-15 Tropfen Wasserstoffperoxid-Lösung (3%ig) hinzu und erwärmen schwach. 34 Einführung in die Allgemeine Chemie 3. Praktikumstag Versuch 5: Kupfer(II) als Oxidationsmittel Umsetzung mit Iodid Lösen Sie in zwei Reagenzgläsern je einen Mikrolöffel Kupfer(II)-sulfat-Pentahydrat sowie 2 Mikrolöffel Kaliumiodid in jeweils ca. 1 ml Wasser. Lösen Sie zudem 2 Mikrolöffel Natriumsulfit in einer Lösung aus ca. 1 ml Wasser und versetzen diese mit ca. 1 ml verd. Salzsäure. Geben Sie nun die Kaliumiodid-Lösung tropfenweise zu der Lösung aus Kupfer(II)-sulfat. Anschließend erwärmen Sie das Gemisch bis zum Sieden. Zu diesem Gemisch geben Sie anschließend tropfenweise die salzsaure Natriumsulfit-Lösung. Versuch 6: Mangan(IV)-oxid als Oxidationsmittel Umsetzung mit Salzsäure Versetzen Sie unter dem Abzug in einem Reagenzglas eine Spatelspitze Mangan(IV)-oxid mit ca. 2 ml konz. Salzsäure und erwärmen Sie das Gemisch vorsichtig (nicht bis zum Sieden). Versuch 7: Iod als Oxidationsmittel Umsetzung mit Thiosulfat Versetzen Sie in einem Reagenzglas 2 ml Wasser mit einer Spatelspitze Iod und einem Mikrolöffel Kaliumiodid. Geben Sie anschließend eine Thiosulfat-Lösung (½ Apothekerlöffel in 5 ml Wasser) im Überschuss hinzu. Versuch 8: Disproportionierung von Chlor in Natronlauge Geben Sie in einem Reagenzglas zu 2 ml verd. Natronlauge 2ml des ausstehenden Chlorwassers. Versetzen Sie nun die Lösung mit einigen Tropfen verd. Salpetersäure und dann mit einigen Tropfen Silbernitrat-Lösung. Versuch 9: Disproportionierung von salpetriger Säure Lösen Sie ca. ½ Apothekerlöffel festes Natriumnitrit in 2 ml Wasser und versetzen anschließend diese Lösung mit 1 ml verd. Schwefelsäure (evtl. etwas erwärmen). Für das Protokoll: Geben Sie zu allen Versuchen die jeweiligen Beobachtungen (Farben, Niederschläge, Gasentwicklung etc.) sowie die vollständigen Reaktionsgleichungen an. 35 Einführung in die Allgemeine Chemie 4. Praktikumstag 4. PRAKTIKUMSTAG Elektrochemie Theoretische Grundlagen 4.1 Das galvanische Element An einem Zinkblech, das in eine Cu2+-Lösung eintaucht, beobachtet man die Abscheidung von metallischem Kupfer. Die Reaktionsgleichung für diese Redoxreaktion lautet: 2+ Cu + Zn - Reduktion (+2e ) Oxidation (-2e-) Cu + Zn 2+ An der Metalloberfläche findet ein Elektronenaustausch zwischen den in der Lösung enthaltenen Cu2+Ionen und den Zinkatomen statt. Durch räumliche Trennung einer solchen Redoxreaktion in einem galvanischen Element ist es möglich, die Stärke des Elektronenaustausches zu messen oder sie zur Stromgewinnung zu nutzen. Ein galvanisches Element, das aus den Redoxpaaren Cu/Cu2+ und Zn/Zn2+ besteht, wird DANIELL-Element genannt. Ein metallischer Stab aus Zink taucht in eine Lösung, die Zn2+ und SO42--Ionen enthält. Dadurch wird in der 1. Halbzelle (Halbelement) das Redoxpaar Zn/Zn2+ gebildet. Mit einem Kupferstab, der in eine CuSO4-Lösung eintaucht erhält man in der 2. Halbzelle das Redoxpaar Cu/Cu2+. Die beiden Halbzellen sind durch eine poröse Wand, dem Diaphragma, oder eine Salzbrücke (ein mit Kaliumnitrat gefülltes U-Rohr) voneinander getrennt. Verbindet man nun die beiden Metallstäbe mit einem elektrischen Leiter, so fließen Elektronen vom Zinkstab zum Kupferstab. Ursache dafür ist eine Potentialdifferenz zwischen den beiden Elektroden. Die Spannung lässt sich mit einem Voltmeter messen. Die Teilreaktionen lauten: Anodenreaktion Kathodenreaktion Zn Cu2+ + 2eCu2+ + Zn → → → Zn2+ + 2eCu Cu + Zn2+ Redoxpaar 1 Redoxpaar 2 Gesamtreaktion Das größere Bestreben von Zink, Elektronen abzugeben, bestimmt die Richtung des Elektronenflusses. Zink steht in der Spannungsreihe (vgl. 3. Praktikumstag) oberhalb von Kupfer. Die Spannung eines galvanischen Elementes wird elektromotorische Kraft EMK genannt. Aufgrund der auftretenden EMK kann ein galvanisches Element elektrische Arbeit verrichten. Das Diaphragma besteht aus porösem Material und lässt nur bestimmte Ionensorten passieren. Ohne diese Maßnahme würden sich die Lösungen vermischen und die Cu2+-Ionen würden sich direkt an der Zinkelektrode abscheiden, somit wäre keine Spannung messbar. Auch mit einer undurchlässigen Wand kann man keine EMK messen. Da sich während der Reaktion in der 1. Halbzelle eine überschüssige positive Ladung aufbaut (Zn2+-Ionen entstehen) und in der 2. Halbzelle eine überschüssige negative Ladung entsteht (Cu2+-Ionen werden entzogen), ist die Neutralität der Lösungen nicht mehr gewährleistet. Es kommt zum Stillstand der Reaktion. Erst durch Wanderung von SO42--Ionen von der 2. in die 1. Halbzelle findet der notwendige Ladungsausgleich statt. Die Ionenwanderung durch das Diaphragma ist im Vergleich zur Abscheidung der Cu2+-Ionen an der Kathode ein langsamer Vorgang. Da die Abscheidung aber vom Ladungsausgleich in der Lösung abhängt, wird die Abscheidungsgeschwindigkeit von der Diffusion der SO42--Ionen durch das Diaphragma bestimmt. Dieses Diffusionsproblem führt zu Abweichungen der experimentell gemessenen Werte von den berechneten Werten. Mit Hilfe einer sogenannten Salzbrücke kann man Diffusionserscheinungen weitgehend ausschließen (Abb. 1). 36 Einführung in die Allgemeine Chemie 4. Praktikumstag Abbildung 1: Anordnung eines galvanischen Elementes unter Verwendung einer Salzbrücke Unter einer Salzbrücke versteht man ein mit Elektrolytlösung in hoher Konzentration (KNO3) gefülltes U-Rohr. Die Öffnungen dieses U-Rohres sind mit durchlässigem Material (Filterpapier) versehen. Die Halbzellen sind nun voneinander getrennt und nur über diese Salzbrücke miteinander verbunden. Während der Reaktion übernehmen nun die Ionen der Salzbrücke die Funktion des Ladungsausgleiches. K+-Ionen wandern in die 2. Halbzelle, NO3--Ionen in die 1. Halbzelle. 4.2 Berechnung von Redoxpotentialen und der EMK Die elektromotorische Kraft (EMK) ist eine messbare Potentialdifferenz (∆E) und berechnet sich aus der Differenz der Redoxpotentiale (E) der beiden Halbzellen nach: EMK = ∆E = Erechts - Elinks Hierbei muss das galvanische Element so aufgebaut sein, dass die Elektronen von der linken Halbzelle über den metallischen Leiter in die rechte Halbzelle fließen. Die Einzelpotentiale (E) lassen sich allerdings nicht absolut bestimmen, messbar sind nur Potentialdifferenzen. Da man aber nur Potentialdifferenzen misst, lässt sich das Problem mit den absoluten Redoxpotentialen durch Festlegung eines willkürlichen Nullpunktes umgehen. Dieser Nullpunkt wird durch das Redoxpaar H3O+/H2 festgelegt. Das Standardredoxpotential (bzgl. der Standardbedingungen siehe unten) eines H3O+/H2-Halbelementes, der sogenannten Standardwasserstoffelektrode (SWE), wird per Definition gleich Null gesetzt. Nun kann man jedes beliebige Redoxpaar in einer Halbzelle mit der (SWE) kombinieren und die entsprechenden Potentialdifferenzen messen. Unabhängig vom Elektronenfluß wird bei der Bestimmung der Redoxpotentiale die SWE immer als linke Halbzelle eingesetzt. Die gemessene Spannung entspricht dem jeweiligen Standardredoxpotential des entsprechenden Elementes, die Richtung des Elektronenflusses gibt das Vorzeichen an: ∆E = Erechts - Elinks = Erechts - ESWE = EHalbzelle - 0 = EHalbzelle Die EMK als Potentialdifferenz einer freiwillig ablaufenden Redoxreaktion soll nach einer Übereinkunft nur positive Werte annehmen („1. galvanische Konvention“). Beim Aufbau eines galvanischen Elementes zur Bestimmung der EMK wird darauf geachtet, dass Erechts > Elinks ist. Bei der Bestimmung der Redoxpotentiale wird, unabhängig vom freiwilligen Verlauf der Reaktion, die SWE immer links plaziert. Fließen die Elektronen nun von der SWE in die rechte Halbzelle, erhält das entsprechende Redoxpaar ein positives Redoxpotential. Fließen Elektronen von der rechten Halbzelle zur SWE, erhält das Redoxpaar ein negatives Redoxpotential. Redoxpotentiale können demnach, im Gegensatz zur EMK, sowohl positive als auch negative Vorzeichen besitzen. Für die Berechnung der Halbzellenpotentiale ergibt sich aus der NERNSTschen Gleichung für ein allgemeines Redoxpaar: oxidierte Form (Ox) + ze- E = E° − reduzierte Form (Red) [Red] = E° + RT ⋅ ln [Ox ] NERNSTsche Gleichung RT ⋅ ln [Ox ] [Red] zF zF 37 Einführung in die Allgemeine Chemie 4. Praktikumstag R : allgemeine Gaskonstante; R = 8,31441 J/(K·mol) F : Faraday-Konstante; F = 96487 C/mol T : absolute Temperatur in K z : Anzahl der bei einem Reaktionsschritt übertragenen Elektronen [Ox],[Red] : Konzentrationen der Partner des Redoxpaares E° : Standardhalbzellenpotential Häufig verwendet man auch die vereinfachte Form der Nernstschen Gleichung: E = E° + [Ox ] (T = 25°C) 0,059 V ⋅ log [Red] z Der Ausdruck 0,059 V enthält die Gaskonstante, die Faraday-Konstante sowie den Umrechnungsfaktor von ln auf lg. Weiterhin enthält der Faktor die Temperatur von T=25 °C (298,15 K), d.h. dass diese Form der Nernstschen Gleichung nur bei dieser Temperatur Gültigkeit besitzt. Unter Standardbedingungen versteht man in der Elektrochemie eine Temperatur von 25 °C, für Gaselektroden (z.B. SWE) einen Gasdruck von 1,013 bar (1 atm) und für die Lösungen eine Ionenkonzentration von 1 mol/l. Da Konzentrationen von Feststoffen nicht variabel sind, werden sie als konstante Größen in das Standardhalbzellenpotential mit einbezogen. Für Berechnungen von Halbzellenpotentialen kann man die Konzentration von Feststoffen gleich Eins setzen. Für das Cu/Cu2+-Redoxpaar gilt demnach: Cu 2+ + 2e- E = E° + Cu [ RT ⋅ ln Cu 2+ 2F ] Zur Bestimmung der EMK mit Hilfe der Nernstschen Gleichung betrachtet man ein allgemeines galvanisches Element mit folgenden Redoxpaaren: Linke Halbzelle: Rechte Halbzelle: Gesamtreaktion: RedL OxL + zeRedR OxR + ze OxR + RedL → RedR + OxL (freiwillig ablaufende Reaktion) Aus EMK = Erechts - Elinks berechnet sich die EMK nach: EMK = E° R − E° L + [Ox R ]⋅ [Red L ] = EMK° + RT ⋅ ln [Ox R ] ⋅ [Red L ] RT ⋅ ln [Red R ] ⋅ [Ox L ] [Red R ] ⋅ [Ox L ] zF zF NERNSTsche Gleichung für die EMK Für das Beispiel des Daniell-Elementes gilt für die EMK: EMK = EMK ° + RT [Cu 2+ ] ⎛ RT [ Zn 2+ ] ⎞ ⎟ ⎜ EMK ln ⋅ ln = ° ⋅ 2F 2F [ Zn 2+ ] ⎜⎝ [Cu 2+ ] ⎟⎠ Galvanische Elemente lassen sich auch durch ihr Zellsymbol vereinfacht ausdrücken. Dabei „liest“ man den Aufbau eines galvanischen Elementes „von links nach rechts“ ab. Für das Daniell-Element lautet das Zellsymbol Zn / ZnSO4(x mol/l) // CuSO4(x mol/l) / Cu Ein einfacher Schrägstrich symbolisiert eine Phasengrenze, der doppelte Schrägstrich die Trennung der beiden Halbzellen (durch ein Diaphragma oder eine Salzbrücke). 38 Einführung in die Allgemeine Chemie 4. Praktikumstag 4.3 Die EMK von Konzentrationsketten In einem galvanischen Element müssen zur Messung einer EMK nicht immer Halbzellen unterschiedlicher Redoxsysteme vorliegen. Da das Halbzellenpotential E von der Konzentration des in der Halbzelle befindlichen Elektrolyten abhängt, lässt sich auch zwischen gleichen Halbzellen mit verschiedener Konzentration eine Potentialdifferenz, also eine EMK messen. Solche galvanischen Elemente nennt man Konzentrationsketten. Je größer der Quotient der Elektrolytkonzentrationen zweier Halbzellen einer Konzentrationskette, desto größer die gemessene EMK. Am Beispiel einer Cu/[Cu2+]niedrig//[Cu2+]hoch/Cu Konzentrationskette soll das erläutert werden: Anodenreaktion Cu Kathodenreakt. Cu2+ + 2eGesamtreaktionCu2+ + Cu → → → Cu2+ + 2eCu Cu + Cu2+ Redoxpaar1: Cu/[Cu2+]niedrig Redoxpaar2: Cu/[Cu2+]hoch Der stromliefernde Prozess besteht darin, dass die Halbzelle mit der geringeren Konzentration ([Cu2+]niedrig) zur Anode wird und Elektronen liefert. Kupfer geht an der Elektrode, in Form von Kupferkationen in Lösung. Die Konzentration an Metallkationen wird also in dieser Halbzelle allmählich erhöht. Die Halbzelle mit der höheren Konzentration ([Cu2+]hoch) wird zur Kathode. An ihr scheiden sich die Metallkationen als elementares Cu ab, Elektronen werden also verbraucht. Das führt zu einer Verringerung der Metallkationenkonzentration in der Lösung. Eine reine Konzentrationskette (gleiches Redoxsystem in beiden Halbzellen) liefert keinen Strom mehr, wenn beide Konzentrationen identisch sind. Die NERNSTsche Gleichung für diese Konzentrationskette lautet: [Cu 2+ ] hoch ⋅ [Cu] [Ox] R ⋅ [Red] L RT RT EMK = E° R − E° L + ⋅ ln = E° Cu − E° Cu + ⋅ ln zF [Red] R ⋅ [Ox] L 2F [Cu] ⋅ [Cu 2+ ] niedrig Da für beide Halbzellen die Standardhalbzellenpotentiale E° gleich groß sind, und die Konzentrationen für das elementare Cu aus den oben schon erwähnten Gründen wegfallen (Konzentrationen von Feststoffen werden gleich eins gesetzt), ergibt sich folgender einfacher Ausdruck: [Cu 2+ ] hoch [Cu 2+ ] hoch RT 0,059 V EMK = ⋅ ln = ⋅ log 2F 2 [Cu 2+ ] niedrig [Cu 2+ ] niedrig 4.4 Bestimmung der Gleichgewichtskonstanten K aus der Standard-EMK Nach dem Massenwirkungsgesetz (siehe 1. Praktikumstag) ist die Gleichgewichtskonstante für eine allgemeine Redoxreaktion: K= [Ox L ] ⋅ [Red R ] [Red L ] ⋅ [Ox R ] Was bedeutet das chemische Gleichgewicht für die EMK einer Redoxreaktion? Nach Erreichen des chemischen Gleichgewichtes verlaufen Hin- und Rückreaktion gleich schnell. Dies bedeutet, dass die gemessene EMK gleich Null ist. Man sagt, das galvanische Element ist "ausgebrannt". Eingesetzt in die NERNSTsche Gleichung für die EMK, erhält man eine Beziehung zwischen der EMK und der Gleichgewichtskonstanten K: EMK Gleichgewicht = 0 = EMK° − RT ⋅ ln K zF Für die Gleichgewichtskonstante lässt sich nun folgende einfache Beziehung ableiten: für EMK = 0 ⇒ K = e 39 ⎛ zF ⎞ EMK ° ⎟ ⎜ ⎝ RT ⎠ Einführung in die Allgemeine Chemie 4. Praktikumstag Praktischer Teil Chemikalienliste Verbindung Summenformel Gefahrstoffsymbole R- und S-Sätze Ammoniumoxalat (NH4)2C2O4 Xn R 21/22; S 24/25 Eisen Fe F R 11 Kupfer Cu - - Magnesium Mg F R 11-15; S 7/8-43.3 Natriumsulfat Na2SO4 - - Silber Ag N R 50/53; S 61 Silbernitrat AgNO3 C; N R 34-50/53; S 2645-60-61 Salzsäure HCl C Salpetersäure HNO3 C R 34-37; S 2636/37/39-45 R 35; S 23-26-36-45 Zink Zn F R 10-15; S 7/8-43.3 Zinn Kupfer(II)sulfat Sn CuSO4 Xn, N Kaliumnitrat KNO3 O R 22-36/38-50/53; S 22-60-61 R 8; S16-41 Zinn(II)-chlorid SnCl2 Xn R 22-36/37/38-43; S 24-26-37 Die Apparatur besteht aus zwei kleinen Bechergläsern, zwei Elektroden, einer Salzbrücke, einer Halterung für die Elektroden sowie einem Digitalmillivoltmeter. V Herstellung der Salzbrücke Als Salzbrücke dient ein U-Rohr, das mit 2 m KNO3 so gut wie möglich gefüllt wird. Zum Verschließen der Enden der Salzbrücke nimmt man jeweils einen etwa 1,5 cm breiten Streifen Filterpapier und rollt ihn eng zu einem Röllchen zusammen. Das Röllchen wird mit der 2 m KNO3-Lösung getränkt und sollte dann stramm in ein Ende des U-Rohres passen. Vor dem Einsetzen des ersten 40 Einführung in die Allgemeine Chemie 4. Praktikumstag Filterpapierstöpsels wird das bereits gut gefüllte U-Rohr so geneigt, dass die Elektrolytlösung den Teil des Rohres, der zuerst verschlossen werden soll, vollkommen bis zum Überlaufen ausfüllt. Danach wird das U-Rohr von der anderen Seite her vollständig mit Lösung gefüllt und dort ebenfalls ein vorher mit KNO3-Lösung befeuchteter Stöpsel eingedreht. Die fertige Salzbrücke darf keine so großen Luftblasen enthalten, dass der Elektrolytstrang unterbrochen ist. Zwischen den Versuchen, wenn die Salzbrücke nicht benutzt wird, wird sie gefüllt und vor dem Austrocknen geschützt aufbewahrt. Dazu werden die Enden mit den Filterpapierverschlüssen mit destilliertem Wasser abgespült. Die Salzbrücke wird dann in das Haltebrettchen (siehe Skizze!) so eingehängt, dass ihre Enden in Bechergläser mit 2m KNO3-Lösung eintauchen. Aufbau der Elektroden Als metallischer Teil der Elektroden dienen schmale Blechstreifen, die mit einem Ende in Krokodilklemmen eingeklemmt werden. An diesen Krokodilklemmen befinden sich Metallstifte, die jeweils durch einen durchbohrten Gummistopfen geschoben werden können. Dadurch sind die Elektroden in der Höhe verstellbar. Das obere Ende des Metallstiftes muss mit Hilfe einer weiteren Krokodilklemme mit dem entsprechenden, richtigen Eingang des Messinstrumentes verbunden werden. Der Gummistopfen wird in einen Schlitz eines Haltebrettchens gesteckt. Das Haltebrettchen hat vier Schlitze, die paarweise angeordnet sind, so dass die Salzbrücke jeweils durch zwei zusammengehörige Langlöcher passt und damit zwei darunter befindliche Bechergläser miteinander verbinden kann. Versuch 1 Konzentrationsbestimmung mittels Konzentrationszelle Cu / CuSO4 // CuSO4 / Cu In zwei 50 ml-Bechergläser pipettiert man genau jeweils 30 ml der 0,1 molaren CuSO4-haltigen Lösung. Nach dem Eintauchen von Cu-Elektroden und Salzbrücke beobachtet man die Zellspannung mit dem Digitalvoltmeter. Der Wert sollte nahe bei Null liegen (warum?). Ist dies nicht der Fall, sind häufig die Cu-Elektroden korrodiert. Man reinigt sie durch kurzes Eintauchen in halbkonzentrierte Salpetersäure (Abzug!) in einem kleinen Becherglas und spült sie danach mit demineralisiertem Wasser gründlich ab. Die Anzeige am Voltmeter sollte etwa ½ Minute konstant bleiben und nicht mehr als etwa + oder - 1 mV betragen. Hierzu schaltet man das Messgerät mehrfach kurzzeitig an, liest ab und schaltet wieder aus. Das Messgerät nicht längere Zeit eingeschaltet lassen! (Warum?) Für den Versuch wird [Cu2+]+ (rechts) konstant gehalten und [Cu2+]- (links) verringert. Aus dem linken Becherglas werden nun 10 mL herauspipettiert und durch exakt (Pipette!) dieselbe Menge an 0,5 molarer Na2SO4-Lösung ersetzt, anschließend wird umgerührt. Man misst die Zellspannung erneut und liest nach Einstellung konstanter Werte ab. Dieses Verdünnungsverfahren wird mit demselben Becherglas noch weitere fünfmal fortgesetzt. Bei höheren Verdünnungen sollte man besonders darauf achten, dass das Messgerät nicht länger angeschaltet bleibt als zur Messung unbedingt notwendig, d.h. man schaltet auf den Millivoltbereich, liest ab und schaltet das Gerät wieder aus. Nach dem die sechste Verdünnung gemessen wurde, entsorgt man die CuSO4-haltigen Lösung des linken Becherglases und ersetzt sie durch die zu bestimmende CuSO4-haltigen Lösung unbekannter Konzentration. Man misst die Zellspannung erneut und liest nach Einstellung konstanter Werte ab. Zur Auswertung fertigen Sie eine Tabelle wie folgt an: 41 Einführung in die Allgemeine Chemie [Cu2+]- (links) keine Verdünnung 1.Verdünnung 2.Verdünnung 3.Verdünnung 4.Verdünnung 5.Verdünnung 6.Verdünnung Unbekannte Lösung 4. Praktikumstag - -log [Cu2+]- (links) x-Achse - - - gemessene EMK y-Achse berechnete EMK - Tragen Sie die Ergebnisse auf Millimeterpapier graphisch auf und lesen sie den Wert der unbekannten Kupferlösung durch anlegen einer Ausgleichsgerade ab. Für das Protokoll: Tabelle der Messwerte, graphische Darstellung und geben sie die Konzentration der unbekannten Kupferlösung an. Versuch 2 Bestimmung der EMK des galvanischen Elements Zn / ZnSO4 // CuSO4 / Cu Ersetzen Sie die linke Halbzelle durch eine Zn/ZnSO4–Halbzelle, indem Sie etwa 30 ml der ausstehenden 0,1 m ZnSO4-Lösung in ein 50 ml Becherglas geben. Ein schmaler Streifen Zinkblech dient als metallischer Teil der Elektrode. Das Zinkblech wird an einem Ende auf 1 bis 2 cm Länge mit konzentrierter Salzsäure gereinigt und gut mit destilliertem Wasser abgespült, bevor es in die ZnSO4Lösung getaucht wird. Sobald beim Reinigen der Lösevorgang beginnt, muss das Blech herausgenommen und abgespült werden, da das Zinkblech sonst schnell zerstört ist. An der Salzbrücke, die bei vorherigen Messungen mit beiden Seiten in CuSO4-Lösung eingetaucht war, wird an einer Seite der Filterpapierstopfen erneuert. Das Einsetzen des Verschlusses erfolgt wie vorher beschrieben. Die Seite der Salzbrücke mit dem neuen Stopfen wird auf der Seite der Zn/ZnSO4 Halbzelle verwendet. Nach dem Zusammenbau des galvanischen Elementes wird kurz gewartet (etwa 2 Minuten) und dann die Spannung gemessen. Abgelesen wird, sobald der Messwert für einige Sekunden stabil bleibt. Das Messgerät wird dann auch hier sofort wieder ausgeschaltet. Für das Protokoll: Es sind die Reaktionsgleichungen der Halbzellen, der Gesamtreaktion sowie die gemessenen und berechneten EMK-Werte anzugeben. Versuch 3 Bestimmung der EMK des galvanischen Elements Cu / CuSO4 // AgNO3 / Ag Da die Salzbrücke bei vorherigen Messungen in die ZnSO4-Lösung eingetaucht war, wird an dieser Seite der Filterpapierstopfen erneuert. Das Einsetzen des Verschlusses erfolgt wie vorher beschrieben. Die Seite der Salzbrücke mit dem neuen Stopfen wird auf der Seite der Ag/AgNO3Halbzelle verwendet. Etwa 30 ml der ausstehenden 0,1 m AgNO3/0,4 m KNO3-Lösung wird in ein 50 ml Becherglas gegeben. Ein schmaler Streifen Silberblech dient als metallischer Teil der Elektrode. Das Silberblech wird an einem Ende auf 1 bis 2 cm Länge mit konzentrierter Salpetersäure gereinigt und gut mit destilliertem Wasser abgespült, bevor es in die AgNO3-Lösung getaucht wird. Sobald beim Reinigen der Lösevorgang beginnt, muss das Blech herausgenommen und abgespült werden, da das Silberblech sonst schnell zerstört ist. Als zweite Halbzelle des galvanischen Elementes wird die Cu/CuSO4-Halbzelle aus Versuch 2 verwendet. Es ist darauf zu achten, dass die Ag/AgNO3-Halbzelle ein größeres Standartpotential besitzt und deshalb rechts steht. Nach dem Zusammenbau des galvanischen Elementes wird kurz gewartet (etwa 2 Minuten) und dann die Spannung gemessen. Abgelesen wird, sobald der Messwert für einige Sekunden stabil bleibt. Das Messgerät wird dann auch hier sofort wieder ausgeschaltet. 42 Einführung in die Allgemeine Chemie 4. Praktikumstag Für das Protokoll: Es sind die Reaktionsgleichungen der Halbzellen, der Gesamtreaktion sowie die gemessenen und berechneten EMK-Werte anzugeben. Versuch 4 Bestimmung der EMK des galvanischen Elements Zn / ZnSO4 // AgNO3 / Ag Ersetzen Sie die linke Halbzelle durch eine Zn/ZnSO4 –Halbzelle, verfahren Sie dabei wie in Versuch 2. Vergessen Sie nicht die Zn-Elektrode zu reinigen und den Filterpapierstopfen zu erneuern. Nach dem Zusammenbau des galvanischen Elementes wird kurz gewartet (etwa 2 Minuten) und dann die Spannung gemessen. Abgelesen wird, sobald der Messwert für einige Sekunden stabil bleibt. Das Messgerät wird dann auch hier sofort wieder ausgeschaltet. Für das Protokoll: Es sind die Reaktionsgleichungen der Halbzellen, der Gesamtreaktion sowie die gemessenen und berechneten EMK-Werte anzugeben. Versuch 5: Versetzen Sie in einem Reagenzglas die folgenden Metalle mit ca. 2 ml der angegebenen Säuren. Bitte alle Versuche im Abzug durchführen. a) Magnesium-Band + verd. HCl b) Zink-Granalie (klein) + halbkonz. HCl c) Zink-Granalie (klein) + konz. HNO3 / H2O (1:2) d) Cu-Blech + halbkonz. HNO3 e) Kupfer-Blech + verd. HCl f) Eisen-Pulver + verd. HCl g) Eisen-Pulver + halbkonz. HNO3 Für das Protokoll: Geben Sie zu allen Versuchen Ihre Beobachtungen sowie die jeweiligen Reaktionsgleichungen an und erklären Sie die ablaufenden Reaktionen mit Hilfe der Spannungsreihe. Versuch 6: Versetzen Sie in einem Reagenzglas die folgenden Metalle mit ca. 1 ml der angegebenen Salzlösungen. a) Zink-Granalie (klein) + AgNO3-Lsg. (10 Tropfen + 1 ml H2O) b) Zink-Granalie (klein) + CuSO4-Lsg. (2 Mikrolöffel + 1 ml H2O) c) Zink-Granalie (klein) + SnCl2-Lsg. d) Zinn-Folie + AgNO3-Lsg. (10 Tropfen + 1 ml H2O) e) Zinn-Folie + CuSO4-Lsg. (2 Mikrolöffel + 1 ml H2O) f) Kupfer-Blech + AgNO3-Lsg. (10 Tropfen + 1 ml H2O) Für das Protokoll: Geben Sie zu allen Versuchen Ihre Beobachtungen sowie die jeweiligen Reaktionsgleichungen an und erklären Sie die ablaufenden Reaktionen mit Hilfe der Spannungsreihe. 43 Einführung in die Allgemeine Chemie 5. Praktikumstag 5. PRAKTIKUMSTAG Komplexchemie Theoretische Grundlagen 5.1 Grundlagen der Komplextheorie In verschiedenen Fällen bleiben die für ein Ion charakteristischen Reaktionen ganz oder teilweise aus, wenn bestimmte andere Ionen oder Moleküle zugegen sind. Diese bilden mit dem Ion besondere chemische Verbindungen, die nicht mehr oder nur noch in geringem Maße in die Ionen oder Moleküle, aus denen sie entstanden sind, dissoziieren. Solche Verbindungen bezeichnet man als Komplexverbindungen. Neben dem Verlust des individuellen Charakters der den Komplex aufbauenden Ionen, zeigen Komplexverbindungen einige besondere Eigenschaften, die sie von den Einzelionen unterscheiden. Beispiele: 1) Komplexverbindungen besitzen in Lösung teilweise andere Farben als die einfachen Ionen, Fe2+ Ni2+ schwach grün grün [Fe(CN)6]4[Ni(NH3)6]2+ gelb blau 2) Komplexsalze unterscheiden sich in ihrer elektrischen Leitfähigkeit von den einfachen Ionen. Wenn eine wäßrige Lösung von rotem Blutlaugensalz, K3[Fe(CN)6], die Ionen K+, Fe3+ und CN- enthalten würde, so müßte die Leitfähigkeit der Lösung ungefähr gleich der Summe der Leitfähigkeiten entsprechender Mengen der Einzelsalze KCN und Fe(CN)3 sein. Dies ist nicht der Fall und man beobachtet aufgrund der verringerten Ionenzahl eine wesentlich niedrigere Leitfähigkeit. 3) Änderung des Wanderungssinns bei der Elektrolyse. In einfach gebauten Eisen(II)-salzen wandern z.B. Fe2+-Ionen zur Kathode (negativer Pol), während Fe2+ in [Fe(CN)6]4- (Anion des gelben Blutlaugensalzes K4[Fe(CN)6]) als negativ geladenes Komplexion zur Anode (positiver Pol) wandert. Komplexverbindungen können durch Komplexbildung am Anion und durch Komplexbildung am Kation aufgebaut werden. Hier sollen nur solche Komplexverbindungen behandelt werden, die durch Komplexbildung am Kation entstehen, bei denen also die Komplexbildung an Ionen eintritt, die ursprünglich als Kationen vorlagen. Während der Komplexbildung werden dabei diese Kationen oft durch Anlagerung von negativ geladenen Liganden in anionische Komplexe (d.h. negativ geladene Komplexe) umgewandelt. Zur Komplexbildung kann ein Metallkation, das als Zentralion fungiert, um sich herum Ionen mit abgeschlossener Elektronenschale (z.B. Cl-, |C≡N|-)oder Moleküle (z.B. H2O, NH3) anlagern, wodurch es zur Bildung eines stabilen Komplexes kommt. Jeder Ligand liefert hierbei zwei Elektronen an das Zentralteilchen. Die bisher vorgestellten Liganden rechnet man zu den einzähnigen Liganden, d.h. sie koordinieren nur an einer Stelle an das Kation. Im Unterschied dazu haben mehrzähnige Liganden mehr als eine Koodinationsstelle. So ist beispielsweise Ethylendiamin (H2N-CH2-CH2-NH2) ein zweizähniger Ligand. Solche Liganden bezeichnet man auch als Chelatliganden. Die Zahl der Liganden, die ein Zentralkation binden kann, hängt von mehreren Faktoren ab. Zunächst müssen die abstoßenden Kräfte zwischen gleichsinnig geladenen Liganden schwächer sein als die Anziehungskräfte zwischen Liganden und Zentralkation. Des weiteren können sich naturgemäß nur so viele Liganden um das Zentralkation herum anordnen, wie Platz vorhanden ist. Ein dritter wichtiger Faktor für die Zahl der Liganden stellt das Bestreben des Kations dar, die Elektronenkonfiguration des nächsthöheren Edelgases zu erreichen (siehe Beispiele Fe2+ und W4+). Die Anzahl der so in der Koordinationssphäre um das Kation herum anwesenden Liganden bezeichnet man als Koordinationszahl des Zentralkations. Häufig auftretende Koordinationszahlen sind 2, 4, 6 und 8. 44 Einführung in die Allgemeine Chemie 5. Praktikumstag Die Gesamtzahl der freien Elektronen, die von den Liganden zur Bindungsbildung zur Verfügung gestellt werden, beträgt bei den hier angesprochenen Koordinationszahlen also 4, 8, 12 oder 16. Dadurch erreichen viele Übergangsmetallkationen die stabile Elektronenkonfiguration des nächsten Edelgases. Im Unterschied zu den Hauptgruppenelementen der ersten drei Perioden (Edelgaskonfiguration: s2p6 = 8 Valenzelektronen) ziehen die Elemente ab der vierten Periode die (insgesamt fünf) d-Orbitale der zweitäußersten Hauptschale zur Bindungsbildung („zur Valenz“) mit heran (Edelgaskonfiguration: s2p6d10 = 18 Valenzelektronen). Da ein Ligand stets zwei Elektronen (nämlich ein Elektronenpaar) pro Bindung liefert, können Zentralatome mit einer ungeraden Anzahl an Valenzelektronen grundsätzlich nicht auf 18 Außenelektronen kommen. In einem solchen Fall "tastet" sich das Zentralatom an die Zahl 18 so nahe wie möglich heran, wobei 18 Außenelektronen nicht überschritten werden können. Solche Komplexe sind dann in der Regel etwas weniger stabil (s. "Komplexbildungskonstante"). Es gibt zwei verschiedene Zählweisen für die Elektronenkonfiguration eines Komplexes. Entweder zählt man die Gesamtanzahl der Elektronen zusammen, oder man berücksichtigt nur die Valenzelektronen. Zwei Beispiele sollen dies verdeutlichen: 1. Eisen(+II): Fe2+ + 6 CN- → [Fe(CN)6]4Sechs Cyano-Liganden stellen 12 Elektronen zur Verfügung, Fe2+ besitzt 24 Elektronen, d.h. 24e- + 12e- = 36e- ≡ [Kr] ("Krypton"). Oder: Fe2+ besitzt 6 Valenzelektronen, d.h. 6e- + 12e- = 18e-. 2. Wolfram (+IV): W4+ + 8 CN- → [W(CN)8]4Acht Cyano-Liganden stellen 16 Elektronen zur Verfügung, W4+ besitzt 70 Elektronen, d.h. 70e- + 16e- = 86e- ≡ [Rn] ("Radon”). Oder: W4+ besitzt 2 Valenzelektronen, d.h. 2e- + 16e- = 18e-. Bei der ersten Zählweise erhält man die Elektronenkonfigurationen der Edelgase Krypton und Radon. Bei der zweiten kommt man in beiden Fällen auf 18 Valenzelektronen. Diese „18-Elektronenregel“ für die Nebengruppenelemente ist das Pendant zur „Oktettregel“ der Hauptgruppenelemente. (Es gibt allerdings viele Ausnahmen.) Fe2+, Fe3+, Cr3+ treten meistens mit Koordinationszahl 6 auf, während Cu2+ und Cu+ die Koordinationszahl 4 bevorzugen. Mit der Anzahl der Liganden ist auch die Geometrie des Komplexes festgelegt, da die Liganden bestrebt sind, den gegenseitigen Abstand zu maximieren. So befinden sich die Liganden eines Zentralteilchens mit der Koordinationszahl 2 in linearer Anordnung. Die Koordinationszahl 4 führt häufig zu einer tetraedrischen Anordung der Liganden, wobei jedoch auch eine quadratisch-planare Konfiguration der das Zentralion umgebenden Ionen bzw. Moleküle möglich ist. Bei 6 Liganden weisen die Bindungen in die Ecken eines Oktaeders. L L M L M L L + z.Bsp.: [Ag(NH3)2] (linear) L - z.Bsp.: [AuCl4] (quadratisch-planar) 45 Einführung in die Allgemeine Chemie 5. Praktikumstag L L L L M L L L M L L z.Bsp.: [MnO4] (tetraedrisch) L 4z.Bsp.: [Fe(CN)6] (oktaedrisch) Die Ladung eines Komplexes entspricht der Summe der Ladungen der ihn aufbauenden einzelnen Ionen. Ebenso wie sich die Ladung des SO42--Ions aus der Ladung des Schwefels (+6) und der des Sauerstoffs (4⋅(-2)) zu -2 berechnet, bestimmt man auch die resultierenden Ladungen von Komplexverbindungen: Beispiele: Ni2+ + 4CNFe2+ + 6CNB3+ + 4F- → → → [Ni(CN)4]2[Fe(CN)6]4[BF4]- Neutrale Moleküle, wie H2O, NH3 oder CO, erbringen keinen Beitrag zur Ladung des Komplexes: Beispiel: + 4NH3 → Cu2+ [Cu(NH3)4]2+ Für Komplexe, die verschiedene Arten von Liganden enthalten, erhält man die resultierende Ladung ganz analog: Beispiele: Co3+ + 4NH3 + 2NO2Co3+ + 3NH3 + 3NO2Co3+ + 2NH3 + 4NO2- → → → [Co(NO2)2(NH3)4]+ [Co(NO2)3(NH3)3] [Co(NO2)4(NH3)2]- einfach positiv neutral einfach negativ 5.2 Nomenklatur der Komplexe In der Formel eines Komplexes steht zuerst das Symbol des Zentralatoms. Darauf folgen die anionischen und dann die neutralen Liganden, und zwar jeweils in alphabetischer Reihenfolge der Symbole. Die Formel des Komplexes wird in eckige Klammern gesetzt. Im Namen werden zuerst alle Liganden alphabetisch genannt, d.h. ohne Einteilung in anionische und neutrale und ohne Berücksichtigung ihrer Anzahl, d.h. der multiplikativen Vorsilben. Zum Schluß steht der Name des als Zentralatom vorliegenden Elements. In negativ geladenen Komplexen endet der Name des Zentralions auf –„at“. Er wird in einigen Fällen von lateinischen Namen abgeleitet: Silber → Argentat; Gold → Aurat; Kupfer → Cuprat; Eisen → Ferrat; Nickel → Nicolat. Namen anionischer Liganden besitzen stets die Endung –„o“. An Anionennamen, die auf –„id“, -„it“ oder –„at“ enden, wird ein –„o“ angehängt. Weitere Extra-Bezeichnungen sind: F-: fluoro; Cl-: chloro; Br-: bromo; I-: iodo; O2-: oxo; OH-: hydroxo; O22-: peroxo; S2-: thio; CN-: cyano; H-: hydrido. 46 Einführung in die Allgemeine Chemie 5. Praktikumstag Neutrale Liganden haben keine bestimmte Endung, werden jedoch in Klammern gesetzt. Beispiele sind aqua (für H2O), ammin (für NH3), carbonyl (CO) und nitrosyl (NO). Die Oxidationsstufe des Zentralions wird am Ende des Namens mit in Klammern gesetzten römischen Ziffern gekennzeichnet. Beispiele: [Cr(NH3)6]Cl3 [CuCl4(H2O)2]2K[Co(CN)(CO)2(NO)] Hexaamminchrom(III)-chlorid Diaquatetrachlorocuprat(II) Kalium-dicarbonylcyanonitrosylcobaltat(0) 5.3 Reaktivität von Komplexen Wie bereits zu Beginn erwähnt, unterscheiden sich Komplexe auch in ihren chemischen Reaktionen von den Komponenten, aus denen sie zusammengesetzt sind. Ag+ bildet mit Cl- schwerlösliches AgCl, wohingegen [Ag(NH3)2]+ mit Chlorid-Ionen keinen Niederschlag bildet. Auch die Komplexsalze unterliegen (ähnlich den einfachen Salzen, Säuren und Basen) der Dissoziation in wäßriger Lösung. Hiermit ist gemeint, dass z.B. bei einem anionischen Komplex wie K3[Fe(CN)6] nicht nur eine Dissoziation in 3K+ und [Fe(CN)6]3- beim Lösen auftritt, sondern dass auch das Komplexanion [Fe(CN)6]3- einer Dissoziation in Ionen unterliegt. Diese sog. zweite Dissoziation der Komplexsalze zerlegt diese in die Einzelionen. Dabei ist die Dissoziation für verschiedene Komplexsalze natürlich verschieden stark. Je stabiler der Komplex ist, desto weniger dissoziiert er in die Einzelionen. Es handelt sich hierbei um eine Gleichgewichtsreaktion, für die das MWG gilt. Die Reaktion von „rechts“ nach „links“ ist die Dissoziation. Die Reaktion von „links“ nach „rechts“ ist die Komplexbildung: Fe2+ + 6 CN- [Fe(CN)6]4- eingesetzt in das MWG: [Fe(CN) 6 ] 4= konstant = 10 37 l 6 ⋅ mol −6 = K 2+ - 6 [Fe ] ⋅ [CN ] Diese Konstante wird bei den Komplexsalzen als Komplexbildungskonstante K bezeichnet. Je größer diese Konstante ist, desto kleiner ist die Konzentration der Einzelionen in Lösung bzw. um so beständiger ist der Komplex. In diesem Beispiel ist K außerordentlich groß bzw. der Komplex sehr stabil, da dieser Komplex die "Edelgaskonfiguration" (18 Außen-e-) aufweist. Das Zentralion oder die Liganden eines Komplexes werden von einem Fällungsmittel nur dann ausgefällt, wenn die Dissoziation des Komplexes so groß ist, dass das Löslichkeitsprodukt der entstehenden schwerlöslichen Verbindung überschritten wird. Die unterschiedliche Beständigkeit der Komplexe gegenüber Fällungsmitteln kann zur Trennung von Elementen genutzt werden. So gelingt der Nachweis von Cl- neben Br- und I- mit Hilfe des [Ag(NH3)2]+-Komplexes. NH3 bindet an Ag+-Ionen so fest, dass das Löslichkeitsprodukt von AgCl nicht mehr überschritten wird. AgCl lässt sich also durch Zugabe von verd. NH3-Wasser auflösen. Dies gelingt bei AgBr nur noch unvollständig mit konz. NH3 und bei AgI gar nicht mehr, da deren Löslichkeitsprodukte kleiner sind. Die Beständigkeit des Diamminkomplexes des Silbers reicht hier nicht mehr aus, eine Fällung zu unterdrücken, so dass AgI sich durch Zugabe von NH3 nicht in Lösung bringen lässt. 47 Einführung in die Allgemeine Chemie 5. Praktikumstag Praktischer Teil Chemikalienliste Verbindung Summenformel Gefahrstoffsymbole R- und S-Sätze Blei(II)-nitrat Pb(NO3)2 T; N R 61-20/22-3350/53-62; S 53-4560-61 Cobalt(II)-nitrat-Hexahydrat Co(NO3)2 Xn R 49-22-42/43; S 24-37 Cupfer(II)-sulfat-Pentahydrat CuSO4 Xn R 22-36/38; S 22 Ethanol C2H5OH F R 11; S 7-16 Kaliumhexacyanoferrat(II) K4[Fe(CN)6] - R 52/53; S 50.1-61 Eisen(III)-chlorid FeCl3 Xn R 22-38-41; S 26-39 Kaliumhexacyanoferrat(III) K3[Fe(CN)6] - - Kaliumoxalat-Monohydrat K2C2O4·H2O Xn R21/22; S24/25 Kaliumthiocyanat KSCN Xn R 20/21/22-32; S 13 Nickel(II)-chlorid-Hexahydrat NiCl2·6H2O T; N R45-23/24/2536/37/38-42/43; S26-27-28-45-5336/37/39 Nickel(II)-sulfat NiSO4 Xn; N R 22-40-42/4350/53; S 22-36/3760-61 Oxalsäure-Dihydrat H2C2O4 ·2H2O Xn R21/22; S24/25 Silbernitrat AgNO3 C; N R 34-50/53; S 2645-60-61 Versuch 1: Ammin-Komplexe und schwerlösliche Hydroxide Versetzen Sie jeweils in einem Reagenzglas ca. 1 ml der folgenden Lösungen mit ca. 2 ml verd. Ammoniak (Überschuss!). (Beobachtung, Farben, Reaktionsgleichung) I.) CuSO4 V.) Pb(NO3)2 II.) NiSO4 VI.) FeCl3 III.) Co(NO3)2 IV.) AgNO3 Stellen Sie sich die Lösungen selbst her, falls Sie nicht ausstehen sollten! Lösen sie dazu 1-2 Mikrolöffel der entsprechenden Salze in ca. 1 ml Wasser. Die ausstehende NiSO4-Lösung muss vorher etwa 1:10 verdünnt werden. Im Falle von Ag(NO3) reichen 5 Tropfen der Lösung in 1 ml Wasser. 48 Einführung in die Allgemeine Chemie 5. Praktikumstag Versuch 2: Chloro-Komplexe und schwerlösliche Chloride Versetzen Sie jeweils in einem Reagenzglas ca. 1 ml der folgenden Lösungen tropfenweise mit ca. 2 ml konz. Salzsäure (Überschuss!). (Beobachtung, Farben, Reaktionsgleichung) I.) CuSO4 II.) Co(NO3)2 III.) AgNO3 IV.) Pb(NO3)2 Stellen Sie sich die Lösungen selbst her, falls Sie nicht ausstehen sollten! Lösen sie dazu 1-2 Mikrolöffel der entsprechenden Salze in ca. 1 ml Wasser. Im Falle von Ag(NO3) reichen 5 Tropfen der Lösung in 1 ml Wasser. Versuch 3: Bildung von Berliner Blau Zu einer FeCl3-Lösung wird tropfenweise eine K4[Fe(CN)6]-Lösung gegeben. (Beobachtung, Farben, Reaktionsgleichung) Versuch 4: Bildung von Turnbulls Blau Lösen sie etwas FeSO4 in Wasser. Geben Sie diese Lösung dann tropfenweise zu einer K3[Fe(CN)6]Lösung. (Beobachtung, Farben, Reaktionsgleichung) Versuch 5: Bildung von [Fe(SCN)3(H2O)3] Die ausstehende FeCl3-Lösung wird ca. 1:10 verdünnt. 2 ml der verdünnten FeCl3-Lösung werden dann in ein Reagenzglas gegeben und mit einigen Tropfen verd. HCl schwach angesäuert. Anschließend wird die Lösung mit Kaliumthiocyanat-Lösung versetzt. (Beobachtung, Reaktionsgleichung) Versetzen Sie nun einen Teil dieser Lösung im Überschuss mit Natriumfluorid-Lösung. (Beobachtung, Farben, Reaktionsgleichung) Versuch 6: Hydratisomerie Lösen Sie feingepulvertes KCr(SO4)2·12H2O in der Kälte in einigen ml Wasser auf (kann einige Minuten dauern, bis alles gelöst ist). Erhitzen Sie die Lösung anschließend bis zum Sieden. (Beobachtung, Farben, Reaktionsgleichung) Für das Protokoll: Geben Sie für alle Versuche die Reaktionsgleichungen und Ihre Beobachtungen (Farben, Niederschläge usw.) an. Versuch 7: Aufarbeitung der Präparate des 1. Praktikumstags 49 Einführung in die Allgemeine Chemie 6. Praktikumstag 6. PRAKTIKUMSTAG Qualitative Analyse I (Anionen) Theoretische Grundlagen 6.1 Anionenanalyse Im Gegensatz zu der quantitativen Analyse durch die das mengenmäßige Vorkommen eines Stoffes in einer Probe ermittelt wird, stellt man mittels qualitativer Analyse fest, welche Stoffe überhaupt in der Probe vorliegen. Die klassische Methode der anorganischen qualitativen Analyse ist der Trennungsgang. Er bildet gewissermaßen die Grundlage der gesamten anorganischen analytischen Chemie. Während bei den Kationen mehrere gut ausgearbeitete Trennungsgänge bekannt sind, ist man bei der Ermittlung der Anionen auf eine große Zahl von Einzelreaktionen angewiesen. Trennungsverfahren können hier nur bedingt und mit großen Störungen angewendet werden. 6.1 Sodaauszug Es ist unmöglich, die Anionen in der gleichen Untersuchungslösung wie die Kationen nachzuweisen, da ihr Nachweis recht häufig durch die Kationen gestört wird. Der Sodaauszug muss immer dann durchgeführt werden, wenn andere Metallionen als die Alkalimetallionen zugegen sind. Die an die verschiedenen Säurereste gebundenen Metallionen werden durch kochen mit Sodalösung in ihre schwerlöslichen Carbonate bzw. in die Hydroxide überführt, während die Anionen als Natriumsalze in Lösung bleiben. Carbonatbildung: BaCl2 + Na2CO3 → BaCO3↓ + 2 NaCl + Na2CO3 → MnCO3↓ + Na2SO4 MnSO4 Pb(NO3)2 + Na2CO3 → PbCO3↓ + 2 Na NO3 Hydroxidbildung: FeCl3 + 3 NaOH → Fe(OH)3↓ + 3 NaCl Al2(SO4)3 + 6 NaOH → 2 Al(OH)3↓ + 3 Na2SO4 50 Einführung in die Allgemeine Chemie 6. Praktikumstag Praktischer Teil Da Sie am 6. und 7. Praktikumstag mit sehr vielen verschiedenen Stoffen und Lösungen umgehen müssen, ist es nicht sinnvoll, wie an den vorangegangenen Praktikumstagen, alle verwendeten Chemikalien mit ihren R- und S-Sätzen aufzulisten. Durch die vorangegangenen Praktikumstage sollten Sie auch eine gewisse Übung und Sorgfalt im Umgang mit den Substanzen gewonnen haben. Dennoch müssen Sie sich über einen Ihnen unbekannten Stoff informieren. Eine Tabelle mit Gefahrstoffinformationen aller im Praktikum zugänglichen Chemikalien liegt im Labor aus. Die für die Nachweise verwendeten Proben müssen vor der Nachweisreaktion in gelöster Form als Analysenlösung oder Sodaauszug (AL) vorliegen. Mit einer trüben bzw. nicht vollständig gelösten Probe kann kein Nachweis durchgeführt werden. Als Lösungsmittel eignen sich die folgenden Lösungsmittel: Wasser (kalt), Wasser (heiß), verd. Salzsäure (kalt), verd. Salzsäure (heiß), konz. Salzsäure (kalt), konz. Salzsäure (heiß) verd. Salpetersäure (kalt), verd. Salpetersäure (heiß), konz. Salpetersäure (kalt), konz. Salpetersäure (heiß), Königswasser... Nachweis auf Chlorid (Cl-) AL wird mit verd. HNO3 angesäuert und dann mit Silbernitratlösung versetzt. Beobachtung (Farbe), Reaktionsgleichung? Jetzt wird verd. NH3-Lösung im Überschuss zugegeben. Beobachtung, Reaktionsgleichung? Nachweis auf Nitrat (NO3-) Stellen Sie sich eine verdünnte wässrige Lösung von Fe(II)sulfat her, indem sie eine Spatelspitze Fe(II)sulfat in ca. 5ml kaltem Wasser lösen. Die AL wird mit verd. H2SO4 angesäuert und danach mit der frisch zubereiteten Fe(II)sulfat-Lösung versetzt. Jetzt lässt man ein bis zwei ml konzentrierte Schwefelsäure (Vorsicht, ätzend! Konzentrierte Schwefelsäure entwickelt große Wärmemengen beim Vermischen mit Wasser und neigt dann zum Verspritzen! Schutzbrille!!) tropfenweise an der inneren Wand des schräg gehaltenen Reagenzglases herunterlaufen. Die Schwefelsäure sammelt sich wegen ihrer hohen Dichte in einer Schicht unter der wässrigen Lösung an. An der Berührungsfläche der beiden Flüssigkeitsschichten bildet sich ein violetter bis brauner Ring. Geben Sie die zwei Reaktionsgleichungen an, die für die Entstehung des braunen Ringes verantwortlich sind. Üben Sie diesen Nachweis mehrfach, bis er wirklich klappt. Der häufigste Fehler liegt im Vermischen der AL mit der konz. Schwefelsäure oder zu hohen Nitrat-Konzentrationen. Nachweis auf Phosphat (PO43-) Die ausstehende Lösung von Ammoniummolybdat, (NH4)2MoO4, wird in kleinen Portionen mit konz. HNO3 versetzt, bis ein eventuell auftretender Niederschlag sich wieder gelöst hat. Nun gibt man wenige Tropfen der phosphathaltigen AL zu und erwärmt über der Bunsenbrennerflamme. (Geduld, der Effekt tritt manchmal verzögert ein). Beobachtung, Reaktionsgleichung? Nachweis auf Sulfat (SO42-) AL wird mit verd. HCl angesäuert und mit Bariumchlorid versetzt. Beobachtung, Reaktionsgleichung? 51 Einführung in die Allgemeine Chemie 6. Praktikumstag Nachweis auf Carbonat (CO32-) Der Nachweis wird am besten an der festen Substanz, nicht an der Lösung durchgeführt. Die feste Substanz wird tropfenweise mit verd. H2SO4 versetzt. Beobachtung, Reaktionsgleichung? Nun führt man einen Glasstab, an dem ein Tropfen Bariumhydroxidlösung hängt, vorsichtig in das Reagenzglas ein, ohne die Reagenzglaswand oder die Flüssigkeitsoberfläche zu berühren. Beobachtung, Reaktionsgleichung? Nachweis auf Acetat (CH3COO-) Der Nachweis wird an der festen Substanz, nicht an der Lösung durchgeführt. Die feste Substanz wird mit der gleichen Menge festem Kaliumhydrogensulfat verrieben. Beobachtung, Reaktionsgleichung? Herstellung des Sodaauszuges In ein Becherglas werden 1-2 Mikrolöffel der entsprechenden Probe, etwa die fünffachen Menge Soda (Na2CO3), 1-2 Natriumhydroxid-Plätzchen (NaOH) und etwa 25 ml Wasser gegeben. Das Gemisch wird 5 min. gekocht und nach dem Abkühlen filtriert. Aus dem Filtrat (Sodaauszug) können die entsprechenden Anionen nachgewiesen werden. Der Sodaauszug ist stark alkalisch, was die Nachweise stören kann, da die Nachweisreaktionen im Sauren durchgeführt werden (stark Ansäuern und gegebenenfalls mit pH-Papier testen). Versuch 1: Führen Sie mit der ausstehenden Anionenprobe alle Anionennachweise durch ohne zuvor einen Sodaauszug angefertigt zu haben. Für das Protokoll: Geben Sie für alle Ionen die Nachweisreaktionen und Ihre Beobachtungen (Farben, Niederschläge usw.) an. Versuch 2: Fertigen Sie mit der ausstehenden Anionenprobe einen Sodaauszug an und führen anschließend alle Anionennachweise durch. Für das Protokoll: Geben Sie für alle Ionen die Nachweisreaktionen und Ihre Beobachtungen (Farben, Niederschläge usw.) an. Vergleiche Sie die Ergebnisse mit Versuch 1. Versuch 3: Sie erhalten von Ihrem Assistenten zwei Substanzen, die max. drei der sechs Anionen enthalten. Finden Sie die Anionen heraus. Die Ergebnisse der Analyse können max. einmal korrigiert werden. Für das Protokoll: Geben Sie die Probenbezeichnung und alle gefundenen Ionen an. 52 Einführung in die Allgemeine Chemie 7. Praktikumstag 7. PRAKTIKUMSTAG Qualitative Analyse II (Kationen) Theoretische Grundlagen 7.1 Der Trennungsgang Der klassische Kationentrennungsgang beruht in erster Linie auf dem Löslichkeitsprodukt der jeweiligen Chloride, Sulfid und Oxide. Da das Löslichkeitsprodukt stak pH-abhängig ist, kann man eine zusätzliche Trennung erreichen. Eine Analysenlösung wird mit einem Fällungsreagenz versetzt. Dieses Fällungsreagenz bildet mit einigen Ionen eine schwerlösliche Verbindung, welche nun durch Filtration abgetrennt werden kann. Die in dem Filterkuchen enthaltenen Kationen können jetzt weiter aufgearbeitet und analysiert werden. Die noch in der Lösung verbliebenen Kationen werden mit einem weiteren Fällungsmittel versetzt, um so eine weitere Gruppe schwerlöslicher Verbindungen abzutrennen. Dieser Vorgang wird mit allen bekannten Fällungsmitteln durchgeführt, bis sich nur noch leichtlösliche Kationen in der Lösung befinden. Fällungsmittel Analysenlösung Fällungsmittel lösliche Kationen ausgefällte Kationen lösliche Kationen usw. ausgefällte Kationen Je nach verwendetem Fällungsmittel und pH-Wert lassen sich die Kationen in verschiedene Gruppen ausfällen: Fällungsmittel HCl-Lösung H2S-Lösung (NH4)2S-Lösung Gruppe HCl-Gruppe H2S-Gruppe (NH4)2S- Gruppe Kationen Ag+, Pb2+ ... Cu2+,Sb3+, Bi3+, Sn2+ ... Ni2+, Co2+, Fe2+, Mn2+ ... Da ein solcher Trennungsgang aber einen großen Zeitaufwand zur Folge hat, ist er im Rahmen dieses Praktikums nicht geeignet. Wir beschränken uns daher nur auf Vorproben (Flammenfärbung) und einige Einzelnachweise. 7.2 Flammenfärbung Durch Energiezufuhr (Wärme) werden die Elektronen in Schwingung versetzt (angeregt). Sie springen dabei kurzfristig in ein höheres Energieniveau (kernfern). Wenn die Elektronen aus diesem instabilen, angeregten Zustand auf ihr altes Energieniveau zurückfallen, geben sie die zuvor aufgenommene Energie in Form von charakteristisch gefärbten Licht (hν) wieder ab. Metallion + Energie → [angeregter Zustand] → Metallion + hν 53 Einführung in die Allgemeine Chemie 7. Praktikumstag Praktischer Teil Für die Nachweise durch Flammenfärbung empfiehlt es sich, eine möglichst kleine Menge des zu untersuchenden Salzes auf ein Uhrglas zu geben. Etwas konz. HCl wird in ein zweites Uhrglas getropft, das ausgeglühte Magnesiastäbchen damit befeuchtet und wenig Substanz daran geklebt. Nachweis auf Lithium (Li+) Bringen Sie ein Magnesiastäbchen in die innere, helle Zone einer Bunsenbrennerflamme und glühen Sie es, bis keine Flammfärbung mehr sichtbar ist. Bringen Sie das Stäbchen dann in eine kleine Menge einer festen lithiumhaltigen Verbindung, danach wieder in die Flamme. Färbung der Flamme? Beurteilung von Leuchtdauer und Intensität? Nachweis auf Natrium (Na+) Verfahren Sie wie bei Li+ beschrieben unter Verwendung eines natriumhaltigen Salzes. Färbung der Flamme? Beurteilung von Leuchtdauer und Intensität? Nachweis (I) auf Kalium (K+) Verfahren Sie wie bei Li+ beschrieben unter Verwendung eines kaliumhaltigen Salzes. Färbung der Flamme? Beurteilung von Leuchtdauer und Intensität? Nachweis (II) auf Kalium (K+) AL wird mit Natriumperchlorat-Lösung oder verd. Perchlorsäure versetzt. Was beobachtet man? Geben Sie die Ionengleichung an. Nachweis auf Ammonium (NH4+) Zu einer festen ammoniumhaltigen Substanz gibt man ein Plätzchen festes NaOH und einige Tropfen Wasser und bringt ein angefeuchtetes Stück pH-Indikatorpapier (ohne Berührung!) in die unmittelbare Nähe. Beobachtung (Geruch), Reaktionsgleichung? Nachweis auf Magnesium (Mg2+) Setzen Sie der AL zwei Spatelspitzen Ammoniumchlorid und etwas konz. NH3 zu, so dass der pHWert im schwach alkalischen Bereich liegt. Jetzt gibt man Dinatriumhydrogenphosphat-Lösung zu. Beobachtung, Reaktionsgleichung? Nachweis (I) auf Calcium (Ca2+) Der Nachweis gelingt durch die Flammenfärbung, die allerdings nur beim Calciumchlorid gut sichtbar ist. Die feste Analysensubstanz wird auf einem Uhrglas mit einigen Tropfen konz. Salzsäure befeuchtet (nur befeuchten, nicht auflösen!) und dann eine kleine Menge dieser Masse mit dem Magnesiastäbchen in die Flamme gebracht. Färbung der Flamme? Beurteilung von Leuchtdauer und Intensität? Nachweis (II) auf Calcium (Ca2+) AL wird mit verdünnter Schwefelsäure versetzt. Beobachtung, Reaktionsgleichung? 54 Einführung in die Allgemeine Chemie 7. Praktikumstag Nachweis (I)auf Kupfer (Cu2+) AL wird mit konz. Ammoniak im Überschuss versetzt. Beobachtung (Farbe), Reaktionsgleichung? Anschließend wird dieselbe AL mit konz. HCl im Überschuss versetzt. Beobachtung (Farbe), Reaktionsgleichung? Nachweis (II)auf Kupfer (Cu2+) AL wird mit Kaliumiodid-Lösung versetzt. Beobachtung (Farbe), Reaktionsgleichung? Jetzt wird das Gemisch eine Minute zum Sieden erhitzt. Beobachtung? Jetzt gibt man bis zur Entfärbung SO2-Wasser zu. Was ist außer der Entfärbung noch zu beobachten? Was ist "SO2-Wasser"? Erläutern Sie durch Angabe einer Reaktionsgleichung. Geben Sie außerdem die Reaktionsgleichungen für die Fällungsreaktion und für die Entfärbungsreaktion an. Nachweis auf Eisen (Fe3+) AL wird tropfenweise mit Ammoniumthiocyanat-Lösung (nicht in großem Überschuss!) versetzt. Beobachtung, Reaktionsgleichung? Jetzt wird Natriumfluorid-Lösung im Überschuss zugegeben. Beobachtung, Reaktionsgleichung? Nachweis (I) auf Nickel (Ni2+) AL wird mit konz. Ammoniak im Überschuss versetzt. Beobachtung (Farbe), Reaktionsgleichung? Anschließend wird dieselbe AL mit konz. HCl im Überschuss versetzt Beobachtung (Farbe), Reaktionsgleichung? Nachweis (II) auf Nickel (Ni2+) AL wird mit Dimethylglyoxim-Lösung versetzt. AL muss neutral und darf nicht stark sauer sein. Beobachtung? Geben Sie die Strukturformel des Komplexes an. Nachweis auf Chrom (Cr3+) Geben Sie zwei Spatel Natriumcarbonat und einen Spatel Kaliumnitrat in ein Uhrglas und mischen Sie gründlich. Geben Sie nun eine sehr kleine Menge fester Analysensubstanz (ca. eine kleine Spatelspitze) hinzu und mischen Sie das Gemisch erneut gründlich mit dem Spatel. Bringen Sie das Gemenge auf eine Magnesia-Rinne und erhitzen Sie es erst vorsichtig, dann stärker bis zum Ende der Gasentwicklung. Fahren Sie damit fort, bis eine flüssige, homogene Schmelze entstanden ist (ggf. noch mehr Soda/Salpeter zur Analysensubstanz). Geben Sie die Reaktionsgleichung für die Oxidationsschmelze (Soda/Salpeter-Schmelze) an. Welche Farbe hat die Schmelze nach dem Erkalten? Der erkaltete Schmelzkuchen wird nun in einem Reagenzglas mit ca. 4 ml Wasser versetzt. Zu dieser Lösung werden einige Tropfen HNO3 (Salpetersäure) gegeben. Der pH-Wert der Lösung muss im Sauren liegen (Kontrolle mit pH-Papier!); die Lösung wird unter fließendem Wasser kurz abgekühlt, dann 1 cm hoch mit Diethylether überschichtet und mit einigen Tropfen H2O2 versetzt. Anschließend wird die Lösung vorsichtig geschüttelt (Diethylether ist leicht entzündlich, auch die Dämpfe, es dürfen während dieses Versuches keine offenen Flammen auf dem Labortisch sein!). Beobachtung? Reaktionsgleichung? Strukturformel des Peroxokomplexes? 55 Einführung in die Allgemeine Chemie 7. Praktikumstag Nachweis (I) auf Mangan (Mn2+) Verfahren Sie wie bei Cr3+ beschrieben: führen Sie mit der festen Substanz eine Oxidationsschmelze durch. Welche Farbe hat die Schmelze nach dem Erkalten? Geben Sie die Reaktionsgleichung für die Oxidationsschmelze an. Achten Sie auch hier darauf, nicht zuviel Substanz zu nehmen. Nachweis (II) auf Mangan (Mn2+) Der erkaltete Schmelzkuchen wird in wenig Wasser gelöst. Jetzt gibt man tropfenweise verd. Schwefelsäure zu (Beobachtung, Reaktionsgleichung). Versuch 1: Stellen Sie sich jeweils eine Analysenlösung (AL) selbst her, die das entsprechende Kation enthält und führen Sie die jeweiligen Nachweisreaktionen durch. Für das Protokoll: Geben Sie für alle Ionen die Nachweisreaktionen und Ihre Beobachtungen (Farben, Niederschläge usw.) an. Versuch 2: Sie erhalten von Ihrem Assistenten zwei Substanzen, die max. drei Anionen und max. drei Kationen enthalten. Finden Sie die Ionen heraus. Die Ergebnisse der Analyse können max. einmal korrigiert werden. Für das Protokoll: Geben Sie die Probenbezeichnung und alle gefundenen Ionen an. 56 Einführung in die Allgemeine Chemie 8. Praktikumstag 8. PRAKTIKUMSTAG Am letzten Praktikumstag findet kein Seminar statt, da der Vormittag als Nachholtermin genutzt werden kann. Am Nachmittag ist für alle Laborputz. 57 Einführung in die Allgemeine Chemie Anhang I Anhang Das Periodensystem der Elemente 58 Einführung in die Allgemeine Chemie Anhang II Säure Anhang Tabelle der pKS- und pKB-Werte ausgewählter korrespondierender Säure-Base-Paar pKS-Wert HCl ca. -6 H2SO4 ca. -3 H3O+ -1,74 HNO3 Base - pKB-Wert Cl ca. 20 starke HSO4- ca. 17 sehr Säuren H2O 15,74 schwache -1,32 NO3- 15,32 Basen H2SO3 1,81 HSO3- 12,19 HSO4- 1,92 SO42- 12,08 H3PO4 2,12 H2PO4- 11,88 HNO2 3,37 NO2- 10,63 HF 3,45 F- 10,55 HCOOH 3,75 HCOO- 10,25 CH3COOH 4,75 schwache CH3COO- 9,25 schwache H2CO3 6,37 Säuren HCO3- 7,63 Basen HSO3- 6,91 SO32- 7,09 H2S 7,04 HS- 6,96 H2PO4- 7,21 HPO42- 6,79 NH4+ 9,25 NH3 4,75 HCN 9,31 - CN 4,69 HCO3- 10,25 CO32- 3,75 HS- 11,96 sehr S2- 2,04 starke HPO42- 12,67 schwache PO43- 1,33 Basen H2O 15,74 Säuren OH- -1,74 59 Einführung in die Allgemeine Chemie Anhang III Ausschnitt der elektrochemischen Spannungsreihe oxidierte Li+ K+ Ca2+ Na+ Mg2+ Al3+ Mn2+ Zn2+ Cr3+ Fe2+ Co2+ Ni2+ Pb2+ 2H+ Cu2+ I2 Fe3+ Ag+ Hg2+ Br2 Pt2+ Au3+ MnO4- + 8H+ F2 Anhang IV Anhang + + + + + + + + + + + + + + + + + + + + + + + + + zeee2ee2e3e2e2e3e2e2e2e2e2e2e2eee2e2e2e3e5e2e- → → → → → → → → → → → → → → → → → → → → → → → → → reduzierte Li K Ca Na Mg Al Mn Zn Cr Fe Co Ni Pb H2 Cu 2IFe2+ Ag Hg 2BrPt Au Mn2+ 4H2O 2F- E0 [V] -3.05 -2.93 -2.87 -2.71 -2.36 -1.66 -1.18 -0.76 -0.74 -0.44 -0.28 -0.23 -0.13 ±0.00 +0.34 +0.54 +0.77 +0.80 +0.85 +1.09 +1.20 +1.40 +1.51 +2.87 SI-Basiseinheiten Physikalische Größe Länge l Masse m Zeit t elektrische Stromstärke I Temperatur T Stoffmenge n Name der SI-Einheit Meter Kilogramm Sekunde Ampere Kelvin Mol davon abgeleitet: Kraft = Masse x Beschleunigung Newton Druck = Kraft/Fläche Pascal Symbol m kg s A K mol N (= 1 kg ⋅ m / s2) Pa (N/m2) 60