Skript zur Vorlesung - ETH E
Werbung

Skript zur Vorlesung
Allgemeine Chemie I
Prof. R. Nesper
Inhaltsverzeichnis
1 Woraus besteht die Welt?
1
2 Was ist Chemie
2.1 Die chemische Reaktion . . . . . . . . . . . . . . . . .
2.1.1 Formel und Struktur von Verbindungen . . . . .
2.1.2 Die Chemische Gleichung . . . . . . . . . . . .
2.1.3 Arten von chemischen Reaktionen . . . . . . . .
2.1.4 Berechnung der Konzentrationen aller Spezies in
2.1.5 Konzentrationseinheiten . . . . . . . . . . . . .
4
. . . . 5
. . . . 6
. . . . 6
. . . . 9
Lösung 19
. . . . 20
3 Säuren und Basen
3.1 Die Theorien von Arrhenius, Brönsted und Lewis . . . . . . .
3.2 Protolysengleichgewicht im Wasser und pH-Wert . . . . . . . .
3.2.1 Indikatoren . . . . . . . . . . . . . . . . . . . . . . . .
3.3 Schwache Säuren und Basen . . . . . . . . . . . . . . . . . . .
3.3.1 Trends . . . . . . . . . . . . . . . . . . . . . . . . . . .
3.3.2 Aciditätsregeln nach Pauling . . . . . . . . . . . . . . .
3.4 Abhängigkeit des Säure-Base-Gleichgewichts vom pH-Wert . .
3.5 Berechnungen von pH-Werten für wässrige Lösungen von Säuren oder Basen . . . . . . . . . . . . . . . . . . . . . . . . . . .
3.5.1 Logarithmische pH-Diagramme . . . . . . . . . . . . .
3.5.2 Lösungen starker Säuren HA bzw. Basen MOH . . . .
3.5.3 Lösungen schwacher Säuren bzw. Basen . . . . . . . . .
3.5.4 Praktische Beispiele zur Berechnung des pH-Wertes . .
3.5.5 Schwache Säure und schwache Base . . . . . . . . . . .
3.5.6 Zweiprotonige Säuren . . . . . . . . . . . . . . . . . . .
3.5.7 Titrationskurven . . . . . . . . . . . . . . . . . . . . .
3.5.8 Titrationskurven und logarithmische pH-Diagramme .
i
21
22
26
27
29
35
36
37
42
44
46
49
53
56
57
59
61
INHALTSVERZEICHNIS
4 Redoxreaktionen
65
4.1 Die Oxidationszahl . . . . . . . . . . . . . . . . . . . . . . . . 66
4.2 Grundsätzliches . . . . . . . . . . . . . . . . . . . . . . . . . . 70
4.3 Ausgleichen von Redoxreaktionen . . . . . . . . . . . . . . . . 73
4.4 Galvanische Zellen . . . . . . . . . . . . . . . . . . . . . . . . 77
4.5 Die Standardwasserstoffelektrode . . . . . . . . . . . . . . . . 81
4.6 Anwendung der Nernstschen Gleichung . . . . . . . . . . . . . 82
4.7 Faradaysches Gesetz . . . . . . . . . . . . . . . . . . . . . . . 83
4.8 Einige Beispielaufgaben zu Standardreduktionspotenzialen . . 85
4.8.1 Die EMK der Kette Zn/0.1 M ZnSO4 //0.5 M CuSO4 /Cu 85
4.8.2 Berechnng von Gleichgewichtskonzentrationen . . . . . 85
+2
4.9
4.10
4.11
4.12
4.13
4.14
+4
4.8.3 Titration einer F e −Lösung mit
Konzentrationsketten . . . . . . . . . .
Elektroden zweiter Art . . . . . . . . .
Elektroden für EMK-Messungen . . . .
Potenzialdiagramme . . . . . . . . . .
Gleichgewichtslage bei Redoxprozessen
pH-E-Diagramme . . . . . . . . . . . .
Ce −Lösung
. . . . . . . .
. . . . . . . .
. . . . . . . .
. . . . . . . .
. . . . . . . .
. . . . . . . .
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
5 Komplexverbindungen
5.1 Aufbau und Eigenschaften . . . . . . . . . . . . . . . . . . .
5.2 Gleichgewichte . . . . . . . . . . . . . . . . . . . . . . . . .
5.3 Liganden . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
5.4 Nomenklatur von Komplexverbindungen . . . . . . . . . . .
5.5 Zusammensetzung und Struktur von Komplexen . . . . . . .
5.6 Isomerie von Komplexen . . . . . . . . . . . . . . . . . . . .
5.6.1 Konformationsisomerie . . . . . . . . . . . . . . . . .
5.6.2 Ionen– bzw. Ionisationsisomerie . . . . . . . . . . . .
5.6.3 Koordinationsisomerie . . . . . . . . . . . . . . . . .
5.6.4 Bindungsisomerie . . . . . . . . . . . . . . . . . . . .
5.7 Präparative Arbeiten mit robusten Komplexen . . . . . . . .
5.8 Bestimmung der Stabilitätskonstanten . . . . . . . . . . . .
5.9 Komplexometrische Titration . . . . . . . . . . . . . . . . .
5.10 Beeinflussung des Standardreduktionspotenzials durch Komplexbildung . . . . . . . . . . . . . . . . . . . . . . . . . . .
5.11 Doppelsalze . . . . . . . . . . . . . . . . . . . . . . . . . . .
.
.
.
.
.
.
.
86
88
90
91
92
94
95
.
.
.
.
.
.
.
.
.
.
.
.
.
96
96
98
100
107
108
112
112
115
115
116
116
117
121
. 123
. 125
6 Fällungsreaktionen
126
6.1 Löslichkeitsprodukt und Löslichkeit von Festkörpern . . . . . . 126
6.2 Berechnung der Löslichkeit von AgCls in N H3 -Lösungen . . . 130
ii
ABBILDUNGSVERZEICHNIS
6.3
Standardreduktionspotenziale von
von Feststoffen . . . . . . . . . .
6.4 Leitfähigkeitsmessungen . . . . .
6.4.1 Konduktometrie . . . . . .
6.5 Gravimetrie . . . . . . . . . . . .
Lösungen
. . . . . .
. . . . . .
. . . . . .
. . . . . .
in Anwesenheit
. . . . . . . . .
. . . . . . . . .
. . . . . . . . .
. . . . . . . . .
.
.
.
.
132
134
136
137
Abbildungsverzeichnis
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
Entartete Energiezustände . . . . . . . . . . . . . . . . . . . . 2
Edelgaskonfiguration . . . . . . . . . . . . . . . . . . . . . . . 10
Bindung im Ethen, C2 H4 . . . . . . . . . . . . . . . . . . . . . 11
Elektronendichte bei der Ionenbindung. . . . . . . . . . . . . . 12
Das Iodwasserstoff-Gleichgewicht . . . . . . . . . . . . . . . . 16
Dynamisches Gleichgewicht von Iodwasserstoff . . . . . . . . . 17
Acidität wässriger Lösungen . . . . . . . . . . . . . . . . . . . 27
pKs -Bereiche für verschiedene Lösungsmittel . . . . . . . . . . 37
Pufferkurve einer einprotonigen Säure mit pKS = 5 . . . . . . 38
HA0 /pH-Abhängigkeiten . . . . . . . . . . . . . . . . . . . . . 43
Logarithmisches pH-Diagramm der Benzoesäure . . . . . . . . 44
Logarithmisches pH-Diagram 0,000001 M . . . . . . . . . . . . 50
Logarithmisches pH-Diagramm 0,0001 M . . . . . . . . . . . 51
Logarithmisches pH-Diagramm einer Säure mit pKa =4.2 für
die Konzentration [HA]0 =10−4 M . . . . . . . . . . . . . . . . . 52
Logarithmisches pH-Diagramm einer Lösung von N H4+ und
CH3 COOH . . . . . . . . . . . . . . . . . . . . . . . . . . . . 56
Logarithmisches pH-Diagramm der selenigen Säure (0.1M) . . 58
Links: Titration von 0.1N Säuren mit einer 0.1N Base;
Rechts: Titration von jeweils zwei Konzentrationen einer starken und einer schwachen Säure. . . . . . . . . . . . . . . . . . 60
Titrationskurven (rechte Teile) und logarithmische pH-Diagramme
(linke Teile) der Ameisensäure (links: 0.1M =
ˆ 0.1N; rechts:
0.001M =
ˆ 0.001N) . . . . . . . . . . . . . . . . . . . . . . . . 61
Titrationskurve (rechts) und logarithmisches pH-Diagramm
(links) von Salzsäure und Essigsäure (jeweils 0.1M =
ˆ 0.1N)
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 62
Titrationskurve (rechts) und logarithmisches pH-Diagramm
(links) von 0.1M N H4 Cl bzw. von 0.1M N H3 . . . . . . . . . 62
Titrationskurve (rechts) und logarithmisches pH-Diagramm
(links) von Phosphorsäure ( 0.1M =
ˆ 0.3N) . . . . . . . . . . . 63
Oxidationszahlen von Elementen . . . . . . . . . . . . . . . . 67
iii
TABELLENVERZEICHNIS
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
38
39
40
41
42
43
Potenzialdiagramm verschieden edler Metalle . . . . . . . . . . 73
Schema einer Redoxreaktion und einer galvanischen Zelle . . . 77
Die Standardwasserstoffelektrode . . . . . . . . . . . . . . . . 80
Schematischer Aufbau einer Wasserstoffelektrode . . . . . . . 82
Konzentrationskette . . . . . . . . . . . . . . . . . . . . . . . . 89
Mehrzähnige Liganden . . . . . . . . . . . . . . . . . . . . . . 103
Makrozähnige Liganden . . . . . . . . . . . . . . . . . . . . . 104
Schema für kationische Komplexe am Beispiel von [Ag(NH3 )2 ]Cl.107
Schema für anionische Komplexe am Beispiel von Na[Ag(CN)2 ].108
Komplexe mit einzähnigen Liganden . . . . . . . . . . . . . . 111
Beispiele für Chelatkomplexe . . . . . . . . . . . . . . . . . . . 112
cis-trans Isomerie . . . . . . . . . . . . . . . . . . . . . . . . . 113
Facial- und Meridionalisomerie . . . . . . . . . . . . . . . . . . 113
Spiegelisomerie . . . . . . . . . . . . . . . . . . . . . . . . . . 114
Optische Isomerie . . . . . . . . . . . . . . . . . . . . . . . . . 114
Drehung der Polarisationsebene . . . . . . . . . . . . . . . . . 115
Beispiele für die Bindungsisomerie . . . . . . . . . . . . . . . . 116
Titrationskurve von HF . . . . . . . . . . . . . . . . . . . . . 118
Titrationskurve von Glycin und mit Cu . . . . . . . . . . . . . 119
Titrationskurve von Glycin und mit Ni . . . . . . . . . . . . . 120
Einzelgleichgewichte von Cyanidionenkomplexen . . . . . . . . 121
Tabellenverzeichnis
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
Anhydride, ihre Säuren, Basen und Wertigkeit . . . . . . . . . 23
Umschlagintervalle einiger Säure–Base–Indikatoren . . . . . . 29
Gleichgewichtskonstanten für die Protonenabspaltung . . . . . 31
Selbstprotonierung von Supersäuren . . . . . . . . . . . . . . . 34
Redoxreihe . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 72
Standardreduktionspotenziale . . . . . . . . . . . . . . . . . . 84
Komplexbildungskonstanten einiger Komplexe in Wasser . . . 99
Einige gebräuchliche Liganden . . . . . . . . . . . . . . . . . . 105
Strukturformeln einiger komplizierterer Liganden . . . . . . . 106
Beispiele für die Bezeichnung von Liganden . . . . . . . . . . . 107
Räumliche Anordnung der Liganden . . . . . . . . . . . . . . . 110
Löslichkeitsprodukte einiger schwerlöslicher Salze . . . . . . . 128
Gleichgewichtskonzentrationen in verd. N H3 (M) . . . . . . . 132
Äquivalentleitfähigkeiten (Scm2 mol−1 ) in H2 O bei 25o C . . . 135
Ionengrenzleitfähigkeiten (Scm2 mol−1 ) in H2 O bei 25o C . . . 135
Weitere Beispiele molarer Grenzleitfähigkeitswerte [Scm2 ·mol−1 ]136
iv
• Literatur
– D.W.Oxtoby, N.H. Nachtrieb, Principles of Modern Chemistry,
Saunders College Publishing, San Diego, 1996
– E. Riedel, Anorganische Chemie,
W. de Gruyter, Berlin 1994
• Weiterführende Literatur
– Hollemann-Wiberg, Lehrbuch der Anorganischen Chemie,
de Gruyter 1995
1
Woraus besteht die Welt?
Diese Frage wurde von den griechischen Naturphilosophen (Thales, Anaximander, Anaximenes, Parmenides und Heraklit) eingehend untersucht. Sie
vermuteten einen universellen Urstoff hinter allen Veränderungen in der
Natur.
Empedokles (494-434 v.Chr.) begründete die Vorstellung von den vier Urstoffen Erde, Feuer, Luft und Wasser. Ausserdem unterschied er zwischen
Stoff und Kraft. Nach heutiger naturwissenschaftlicher Sicht gibt es Grundstoffe (Physik: sechs Quarks(?), Chemie: ca.108 Elemente).
Demokrit (460-370 v.Chr.) schliesslich stellte die These von kleinsten, unsichtbaren und unteilbaren Teilchen auf, die er Atome nannte. Diese seien in
allen Stoffen in verschiedenen Kombinationen enthalten.
Durch genaue Naturbeobachtungen und klares logisches Denken haben die
griechischen Philosophen eine erstaunlich gute Vorstellung von den Stoffen
unserer Welt erlangt, die erst etwa 2300 Jahre später als grundsätzlich richtig
bestätigt werden konnte (Rutherford – Rückstreuung von α–Teilchen, 1911;
von Laue – Röntgenbeugung, 1911).
Die buddhistischen Philosophen haben vor etwa 2000 Jahren die Vorstellung
einer kleinsten Zeiteinheit (Darma), also einer Art Quantelung der Zeit, entwickelt.
Die Quantelung von Energiezuständen wurde von Planck (1901) begründet
und von Bohr (1913) zur Erklärung der verschiedenen Atome und ihrer Ei1
1 WORAUS BESTEHT DIE WELT?
genschaften benutzt.
>
Wasserelektrolyse, Flammenfärbungen
p
d
f
s
n=6
n=5
n=4
n=3
n=2
n=1
Abbildung 1: Schematische Darstellung entarteter Energiezustände der Elektronen im Wassterstoffatom (“Schalenmodell”)
Im Jahre 1805 stellte Dalton folgende Postulate auf:
1. Materie besteht aus Atomen.
2. Atome sind weder erzeugbar noch zerstörbar.
3. Alle Atome eines Elementes sind gleich, sie sind verschieden von denen
anderer Elemente.
4. Chemische Verbindungen werden gebildet zwischen ganzzahligen Mengen in definierten Zahlenverhältnissen.
Das zweite Postulat gilt im Rahmen chemischer Energieumsetzungen, nicht
aber für Kernreaktionen (-Kernphysik).
Postulat 4 wird als Regel von den konstanten Massenverhältnissen
bezeichnet. Heute weiss man, dass nicht die Massen sondern die relativen
Atomzahlen (Molzahlen) in vielen Verbindungen konstant sind. Solche Verbindungen werden als Daltonide bezeichnet (H2 O, CH4 , KIO4 , etc.).
2
Es gab aber von verschiedener Seite Zweifel daran, dass Postulat 4 für alle
chemischen Verbindungen gilt, was zu einem lebenslänglichen Streit zwischen
Dalton und Berthollet führte.
Heute weiss man, dass auch auf der Basis von Molzahlen in vielen Verbindungen keine konstanten Molverhältnisse auftreten. Solche Verbindungen wurden
als Berthollide bezeichnet.
Man spricht hierbei von Phasenbreiten, die häufiger bei Verbindungen zwischen Metallen (Legierungen) auftreten.
3
2 WAS IST CHEMIE
2
Was ist Chemie
Die Chemie befasst sich mit den Wechselwirkungen, chemisch ausgedrückt,
den Reaktionen von Atomen. Chemische Reaktionen liefern Energieumsätze,
die nicht zu Kernprozessen, also z.B. zu Elementumwandlungen, führen können.
Wesentlich für chemische Umsetzungen sind die folgenden Gesetze:
• Lavoisier, Ende des 18. Jahrhunderts:
Gesetz von der Erhaltung der Masse:
X
(Edukte) =
m
X
(P rodukte)
m
• Dalton und Berzelius:
Gesetz der konstanten und multiplen Proportionen:
Jede Verbindung definierte Verbindung (Phase) enthält die zugehörigen Elemente in immer ein und demselben Verhältnis. Konstante
Proportionen:
H2 O (Südpol) = H2 O (Zürichsee) = H2 O (Mars)
Multiple Proportionen:
ABx ,
ABy ,
ABz
x : y : z = Verhältnis ganzer Zahlen
z.B. H2 O, H2 O2 ; N2 O, N O, N2 O3 , N O2 , N2 O5 .
• Gay-Lussac, A. v. Humboldt:
Volumengesetz
Die Molvolumina verschiedener Gase sind gleich, d.h. nur durch die
Teilchenzahl und nicht durch die Masse bestimmt.
Volumina miteinander reagierender Gase verhalten sich zueinander wie
einfache ganze Zahlen.
4
2.1 Die chemische Reaktion
• Avogadro, Loschmidt:
Gleiche Volumina enthalten gleiche Teilchenzahlen
NA (= NL ) = 6.022 · 1023 Teilchen · mol−1
Alle Elemente mit Ausnahme von Wasserstoff und Helium weisen mehrere
Elektronenschalen auf.
Jede dieser Hauptschalen kann nur bestimmte Zahlen von Elektronen aufnehmen.
Solche Hauptschalen sind noch einmal in Unterschalen energetisch aufgegliedert, die wiederum nur ganz bestimmte Elektronenzahlen zulassen.
Die Unterschalen heissen, unabhängig von der Hauptschale, in der sie sich
befinden, s-, p-, d- und f-Schalen bzw. -Orbitale.
Jedes Element hat eine definierte Zahl von Kernladungen (Z) und dieselbe
Zahl von Elektronen. Damit sind seine isolierten Atome neutral (ungeladen).
Obwohl die Elektronen die Kernladung neutralisieren, können sie diese in der
Regel nicht vollständig abschirmen (Ausnahme: Edelgase).
Deshalb haben mit wenigen Ausnahmen nahezu alle Elemente das Bestreben
weitere Elektronen aufzunehmen - sogar die Alkalimetalle!
Elemente mit komplett gefüllten Hauptschalen wie die Edelgase sind chemisch äusserst schwierig (Xe- bzw. Kr-Verbindungen) oder gar nicht oxidativ, d.h. unter Elektronenentzug, anzugreifen. Sie haben auch kein Bestreben
zusätzliche Elektronen aufzunehmen (Reduktion).
Im Normalfall reagieren Elemente untereinander, indem sie Elektronen austauschen, und bilden damit chemische Verbindungen.
2.1
Die chemische Reaktion
Chemische Verbindungen werden in Form von chemischen Formeln dargestellt.
Chemische Reaktionen, also chemische Stoffumsetzungen, werden als Gleichungen zwischen chemischen Verbindungen dargestellt.
5
2 WAS IST CHEMIE
2.1.1
Formel und Struktur von Verbindungen
Die Formel gibt die Summe der in einer Verbindung enthaltenen chemischen
Elemente an.
Dabei wird nach steigender Elektronegativität sortiert.
Es gibt Fälle, in denen eine Formel für eine bestimmte Verbindung angegeben wird, welche wenig mit der tatsächlichen Struktur zu tun hat. Als
Beispiel sei hier Borax genannt, dessen Formel Na2 B4 O7 · 10H2 O oder besser
Na2 B4 O7 (H2 O)10 nichts über die Zusammensetzung des in dieser festen Verbindung vorliegenden Tetraboratanions [B4 O6 (OH)2 ]2− aussagt.
Die Formel für Borax sollte also besser N a2 [B4 O6 (OH)2 ](H2 O)9 lauten.
Die Formel AsO2 F6 lässt vermuten, dass zehnwertiges Arsen vorliegt, was
unmöglich ist.
Eine gute Beschreibung für diese Verbindung, in der das Dioxygenylkation
O2+ vorliegt, ist [O2 ]+ [AsF6 ]− .
Die Mennige, P b3 O4 , enthält kein Blei in der Oxidationsstufe 38 , sondern wird
besser als [P bO]2 [P bO2 ] beschrieben.
Wichtige chemische Gruppierungen von Atomen (Moleküle, Komplexe, Cluster bzw. spezielle Teilstrukturen) können separat geklammert werden.
2.1.2
Die Chemische Gleichung
Mit der chemischen (Reaktions-)Gleichung werden Ausgangsstoffe (Edukte)
und Endstoffe (Produkte) quantitativ miteinander in Beziehung gesetzt:
Edukt A + Edukt B −→ Produkt C + Produkt D
Die Reaktion von Schwefelwasserstoff (H2 S ) mit Schwefeldioxid (SO2 ) z.B.
liefert Schwefel (S8 , Kronenschwefel) und Wasser ( H2 O):
3
2H2 S + SO2 S8 + 2H2 O
8
16H2 S + 8SO2 3S8 + 16H2 O
6
2.1 Die chemische Reaktion
>
Der Claus-Prozess
Die Molzahlen (Stöchiometriezahlen) der beteiligten (Elemente und) Verbindungen müssen so gewählt werden, dass jede Atomsorte gleichhäufig auf
der linken und auf der rechten Seite der Gleichung auftritt.
Das gilt auch für Ladungen, sodass deren Summen auf der linken und und
der rechten Seite gleich sind.
4K + + Cr2 O72− + H2 O 4K + + 2CrO42− + 2H + .
Die meisten Reaktionen können in Halb- oder Teilgleichungen aufgespalten
werden, wie
Cr2 O72− + H2 O 2CrO42− + 2H + ,
die einen oder mehrere wesentliche Aspekte der Gesamtreaktion beschreiben.
>
Das Chromat – Dichromat-Gleichgewicht
Die Teilreaktion Cu◦ + Ag + −→ Cu2+ + Ag ◦ der Silberbaum- Reaktion muss
vollständig lauten:
Cu◦ + 2Ag + −→ Cu2+ + 2Ag ◦
(1)
oder
Cu◦ + 2AgN O3 −→ Cu(N O3 )2 + 2Ag ◦ .
>
Silber- und Bleibaum
Man spaltet z.B. in Teilreaktionen auf, um den Erhalt von Atomen und
Ladungen leichter überprüfen zu können.
7
2 WAS IST CHEMIE
16 S 2− + 8 S 4+ 32 H + + 16 O2− 3 S8
16 H2 O
16 H2 S + 8 SO2 3 S8 + 16 H2 O
Ausserdem können quasi unabhängig zu betrachtende Prozesse, wie z.B.
Elektrodenreaktionen separat formuliert werden.
Die Teilreaktionen können addiert werden.
Treten keine Ladungen auf, so spricht man von Stoffgleichungen, sonst
von Ionengleichungen. In letzteren werden nur die reagierenden Spezies
aufgeführt.
In derselben Weise können die im nächsten Kapitel angeführten Reaktionen
in Ionengleichungen umgeschrieben werden:
N H3 (aq) + H + (aq) −→ N H4+ (aq)
N i2+ (aq) + 6N H3 (aq) −→ [N i(N H3 )6 ]2+
aq
N i2+ (aq) + EDT A4− (aq) −→ [N iEDT A]2−
aq
5F e2+ (aq) + M nO4− (aq) + 8H + (aq) −→
5F e3+ (aq) + M n2+ (aq) + 4H2 O
HgCl2 + Hg(l) −→ Hg2 Cl2 (s)
Cu2+ (aq) + S 2− (aq) −→ CuS(s) ↓
Ag + (aq) + Cl− (aq) −→ AgCl(s) ↓
Das Ausfallen einer festen Phase wird gewöhnlich durch Einführung von (s)
für solidus gekennzeichnet.
Dem Chemiker stehen somit bei der Diskussion von Reaktionen mehrere
Schreibweisen für ein und dieselbe Reaktionsgleichung zur Verfügung.
8
2.1 Die chemische Reaktion
Die Neutralisation von Salzsäure mit Natronlauge in wässriger Lösung z.B.
kann man wie folgt formulieren:
H + + OH − H2 O.
Andere Möglichkeiten sind:
H3 O+ + OH − 2H2 O
H + (aq) + OH − (aq) H2 O
Welche Notation man wählt, wird davon abhängen, welchen Teilaspekt der
Reaktion man näher herausheben möchte.
Durch die Schreibweise H3 O+ wird betont, dass das Wasserstoffion in Wasser hydratisiert vorliegt. Dabei sollte aber nicht vergessen werden, dass alle
Teilchen in wässriger Lösung hydratisiert vorliegen, womit die dritte Formulierung die eigentlich sinnvollste ist.
In allen drei Gleichungen wurden die Natrium- und die Chloridionen weggelassen, weil diese durch die Reaktion nicht betroffen sind.
2.1.3
Arten von chemischen Reaktionen
Man unterscheidet zwei Grenzfälle:
1. Atom A zieht weniger stark Elektronen an als B, dann findet ein Elektronenübertrag von A nach B statt.
2. Atom A ist von derselben Sorte wie Atom B, dann teilen sich die zwei
Atome einige ihrer Elektronen.
Man kann dies wie in den Abbildungen 2 veranschaulichen.
Beispiele:
9
2 WAS IST CHEMIE
Heliumkonfiguration
H : H
Heliumkonfiguration
|Cl : Cl |
|N ::: N|
H: O : H
Argonkonfiguration
Neonkonfiguration
Neonkonfiguration
Abbildung 2: Durch die gemeinsame Nutzung von Elektronen erreichen alle Atome
eines Moleküls eine Edelgaskonfiguration
Dabei wird klar, dass es zwischen den Grenzfällen eines kompletten Übertrags
von Valenzelektronen zwischen den äusseren Schalen der Atome A und B,
nämlich dem ideal ionischen Fall,
A + B Am+ B m−
z.B. bei
1
N a + Cl2 N a+ Cl−
2
(m = 1)
eine grosse Zahl von intermediären Fällen geben kann, bei denen ein unvollständiger Ladungsübertrag δ stattfindet:
A + B Aδ+ B δ−
10
(δ ≤ m)
2.1 Die chemische Reaktion
Abbildung 3: Bindung im Ethen, C2 H4 .
a) Lewisformel.
b) Valenzelektronenkonfiguration des angeregten C-Atoms. Drei Valenzelektronen
bilden sp2 -Hybridorbitale.
c) Jedes C-Atom bildet mit seinen drei sp2 -Hybridorbitalen drei σ-Bindungen.
d) Die p-Orbitale, die senkrecht zur Molekülebene stehen, bilden eine π-Bindung.
Die wahren Ladungen, man spricht von effektiven Ladungen, in NaCl sind
etwa bei δ=0.75. Also liegen N a0.75+ und Cl0.75− –Ionen vor.
Ein positiv geladenes N aδ+ -Ion kann also genauso stark Elektronen anziehen
wie ein negativ geladenes Clδ− –Ion, nämlich wenn δ = 0.75 ist.
11
2 WAS IST CHEMIE
Ionenradius Cl−
Ionenradius Na+
Elektronendichte
a)
Cl−
Na+
Abbildung 4: (a) Schematischer Verlauf der Elektronendichte bei der Ionenbindung. Die Na+ - und Cl− -Ionen im NaCl-Gitter berühren sich, die Elektronenhüllen durchdringen sich nicht. Die Elektronendichtesinkt daher an der
Berührungsstelle der Ionen auf annähernd null.
(b) Röntgenographisch bestimmte Elektronendichten in einem NaCl-Kristall.
Die Linien verbinden Stellen gleicher Elektronendichte (die Zahlen bedeuten
Elektronen/10−30 m3 ). Sie nimmt mit der Entfernung vom Atomkern rasch ab. Auf
der Verbindungslinie zwischen Na+ - und Cl− -Ionen nimmt sie auf nahezu null ab.
Integriert man die Elektronendichte in den dadurch abgegrenzten kugelförmigen
Ionenvolumina, erhält man für Na+ 10,05, für Cl− 17,70 Elektronen. dies beweist
den Aufbau des Gitters aus Ionen. Die fehlenden 0,25 Elektronen befinden sich in
Zwischenräumen ausserhalb der Kugeln.
Verbindungen, bei denen der Ladungsübertrag relativ gross ist, werden nach
dem Konzept der formalen Ladungen behandelt.
Man nennt sie Ionenverbindungen.
Es gibt keine Verbindung mit vollständigem effektiven Ladungsübertrag. Der
vollständige Ladungsübertrag ist ein formales Konzept (formale Ladungen),
das sich aber als überaus erfolgreich erwiesen hat.
12
2.1 Die chemische Reaktion
Dieser Erfolg ist nicht zufällig, sondern er kann heute auf quantenmechanischer Basis erklärt werden.
Verbindungen, bei denen der effektive Ladungsübertrag relativ klein ist,
werden als kovalente Verbindungen bezeichnet, auch wenn der effektive Ladungsübertrag nicht gleich null ist. Man spricht im letzteren Fall von polarisierten kovalenten Bindungen.
Obwohl es also keine wirkliche Grenze zwischen kovalenten und ionischen Verbindungen gibt, hat sich die Einteilung als sehr wirksames Klassifikationsund Arbeitskonzept bewährt.
Um die Vielfalt der möglichen chemischen Reaktionen überblicken zu können,
teilt man diese in Gruppen ein. Man unterscheidet dabei zwischen folgenden
Reaktionstypen:
• Säure–Base–Reaktionen
HCl + N aOH H2 O + N aCl
HCl + N H3 N H4 Cl
>
Darstellung von Ammoniumchlorid
• Komplexbildungsreaktionen
N iCl2 + 6N H3 [N i(N H3 )6 ]Cl2
N iCl2 + N a4 EDT A N a2 [N iEDT A] + 2N aCl
13
2 WAS IST CHEMIE
>
Nickelkomplexe
• Redoxreaktionen
5F eSO4 + KM nO4 + 4H2 SO4 M nSO4 + 52 F e2 (SO4 )3 + 4H2 O + 12 K2 SO4
HgCl2 + Hg(l) Hg2 Cl2
>
Redoxreaktionen von Kaliumpermanganat
• Fällungsreaktionen
CuCl2 + H2 S CuS(s) + 2HCl
AgN O3 + N aCl AgCl(s) + N aN O3
>
Sulfid und Silberniederschläge
Wenn die Reaktion der zwei Ausgangsstoffe (Edukte) A und B unter sehr
grossem Energiegewinn ∆G◦ stattfindet, z.B.
14
2.1 Die chemische Reaktion
1
H2 + O2 −→ H2 O,
2
dann kann sie unter denselben Bedingungen nicht umgekehrt werden, was
man durch die Richtung des Reaktionspfeiles angibt.
Reaktionen, die spontan bei gegebenem Druck und gegebener Temperatur
in die gewünschte Richtung ablaufen können, zeigen eine negative Reaktionsenergie ∆G◦ < 0 und werden als exergonisch bezeichnet.
Solche, für die das Umgekehrte gilt, werden als endergonisch bezeichnet
(∆G◦ > 0).
Obwohl bei 600◦ C eine Boltzmannverteilung von heisseren und kälteren H2 O–
Molekülen vorliegt, ist die Chance, dass eines davon so heiss wird, dass es
wieder dissoziiert
1
H2 O −→ H2 + O2
2
äusserst gering.
Bei 2000◦ C hingegen treten beide Reaktionsarten mit recht grosser Häufigkeit bzw. Wahrscheinlichkeit auf - es entsteht ein dynamisches Gleichgewicht
zwischen den Teilreaktionen, was durch einen Doppelpfeil angegeben wird:
1
H2 + O2 H2 O
2
Allgemein bezeichnet man diese Situation als chemisches Gleichgewicht
A + B AB
oder wenn man mit A und B keine Elemente sondern Moleküle aus mehreren
Atomen bezeichnet:
Edukte (Verbindungen) Produkte (Verbindungen)
A+B C +D
15
2 WAS IST CHEMIE
Die Lage des Gleichgewichtes hängt also von der Temperatur, aber auch vom
Druck ab.
Theoretisch ist jede chemische Reaktion (Hinreaktion) umkehrbar (Rückreaktion).
Man bezeichnet dies als Prinzip der mikroskopischen Reversibilität.
Sinnvollerweise wird dies jedoch nur dann berücksichtigt, wenn beide Teilreaktionen mit genügend grosser Häufigkeit auftreten.
Das dynamische Gleichgewicht von zwei chemischen Reaktionen führt zu keinem Nettostoffumsatz, und es wird deshalb keine Reaktionsenergie gebildet.
Pro Zeiteinheit
gebildete
HI-Moleküle
Hinreaktion (Bildungsreaktion)
H2 + I2 −→ 2 HI
Pro Zeiteinheit
zerfallene
HI - Moleküle
Gleichgewicht
H2 + I2 2 HI
Rückreaktion (Zerfallsreaktion)
H2 + I2 ←− 2 HI
Zeit
Abbildung 5: Bei der Reaktion von H2 mit I2 zu HI werden nicht nur HI-Moleküle
gebildet, sondern gleichzeitig zerfallen auch gebildete HI-Moleküle wieder. Vor erreichen des Gleichgewichtszustandes bilden sich pro Zeitintervall aber mehr HIMoleküle als zerfallen, die Bildungsreaktion ist schneller als die Zerfallsreaktion. Im
Gleichgewichtszustand ist die Anzahl sich bildender und zerfallender HI-Moleküle
gleich gross geworden.
16
2.1 Die chemische Reaktion
Bildung von HI
Gleichgewicht
Zerfall von HI
H2 + I2 −→ 2 HI
H2 + I2 2 HI
H2 + I2 ←− 2 HI
490◦ C
1 Mol H2
1 Mol I2
0,228 Mol I2
0,228 Mol H2
1,544 Mol HI
490◦ C
2 Mol HI
2
2
HI
HI
HI
Mol 1
1 Mol
H2 , I2
0
Zeit
H2 · I2
H2 · I2
Zeit
Zeit
0
Abbildung 6: Gleichgewichtskonzentration im dynamischen Gleichgewicht der Bildung und des Zerfalls von Iodwasserstoff.
Für alle chemischen Gleichgewichte gilt ∆G = 0.
>
Das Iod – Wasserstoff-Gleichgewicht
Werden bei einer ungestörten Reaktion die Edukte scheinbar komplett verbraucht, so ist kein nennenswertes Gleichgewicht vorhanden.
Die Konzentrationen von Edukten ([A], [B]) und Produkten ([C], [D]) können
also dafür benutzt werden, den Grad des chemischen Gleichgewichtes zu definieren:
[C] · [D]
=K
[A] · [B]
Diese Gleichung wird als Massenwirkungsgesetz bezeichnet und wurde
erstmals von dem norwegischen Mathematiker C. M. Guldberg und dem norwegischen Chemiker P. Waage im Jahre 1867 aufgestellt.
Man sieht leicht ein, dass die Lage des chemischen Gleichgewichtes und damit die Grösse von K von der Temperatur abhängt (s. Gl. 2 auf Seite 18 ).
Die Gleichgewichtskonstante K hat für gegebenen Druck und gegebene Temperatur für jede Reaktion, allgemein
17
2 WAS IST CHEMIE
aA + bB + cC + . . . lL + mM + . . .
einen charakteristischen Wert
[L]l · [M ]m · . . .
Πi [P rodukt]ei
= Kc =
[A]a · [B]b · [C]c . . .
Πj [Edukt]ej
Für jede Reaktion besteht also ein Konzentrationsverhältnis, das bei unveränderten Zustandsvariablen Druck und Temperatur unabhängig ist von
Einzelkonzentrationen.
Der Index c steht für Konzentration.
Werden Drucke (p) in das Massenwirkungsgesetz als Konzentrationsangabe
eingesetzt, so heisst die Konstante Kp .
Zwischen der freien Reaktionsenthalpie und der Massenwirkungskonstanten
besteht ein einfacher Zusammenhang:
∆G◦ = −RT ln K
(2)
Ausserdem hängen Druck und Konzentration bei Gasreaktionen wie folgt
zusammen:
c=
p
RT
und damit
Kp = Kc · (RT )(l+m+... )−(a+b+... )
Da die K-Werte sich über viele Grössenordnungen erstrecken können, verwendet man häufig die sogenannten pK-Werte, die dem negativen Logarithmus zur Basis 10 von K entsprechen.
pK = − lg K
Insgesamt hängt also jede chemische Reaktion ab von:
• den beteiligten Stoffen,
18
2.1 Die chemische Reaktion
• den Konzentrationen der beteiligten Stoffe,
• der Temperatur und
• dem Druck.
Ausserdem wirkt das Prinzip des kleinsten Zwanges nach Le Chatelier
und Braun:
• Temperaturerhöhung fördert endotherme Reaktion
• Temperaturerniedrigung fördert exotherme Reaktion
• Druckerhöhung bewirkt Volumenabnahme
• Druckerniedrigung bewirkt Volumenzunahme
>
2.1.4
Das Gleichgewicht NO2 - N2 O4
Berechnung der Konzentrationen aller Spezies in Lösung
Angenommen eine Lösung von F e2+ (aq) wird mit einer bekannten Menge
einer KM nO4 –Lösung bei gegebenen pH-Wert versetzt.
Es können nun Fragen wie die folgenden gestellt werden:
• Ist die angegebene Reaktion spontan (d. h. verläuft sie freiwillig in die
gewünschte Richtung)?
• Verläuft die Reaktion quantitativ?
• Kann sie z.B. als Grundlage für die quantitative Bestimmung von F e2+
verwendet werden?
• Wie gross sind die Gleichgewichtskonzentrationen von
M nO4− , M n2+ , F e2+ und F e3+ ?
Einfachshalber wird die Reaktionsgeschwindigkeit nicht berücksichtigt und
angenommen, dass sich das System in chemischem Gleichgewicht befindet.
Zur Lösung dieses Problems benötigen wir die Kenntnis der Gleichgewichtskonstanten folgender Reaktion:
19
2 WAS IST CHEMIE
M nO4− (aq) + 8H + (aq) + 5F e2+ (aq) M n2+ (aq) + 5F e3+ (aq) + 4H2 O
K=
[F e3+ ]5 [M n2+ ]
[M nO4− ][H + ]8 [F e2+ ]5
Die Gleichgewichtskonstante lässt sich aus den Standardreduktionspotenzialen berechnen. Standardreduktionspotenziale sind tabellierte Werte,
mit deren Hilfe entschieden werden kann, ob und unter welchen Bedingungen
eine Redoxreaktion abläuft.
Ähnliche Fragestellungen findet man bei Säure–Base–, Komplexbildungs–
und Fällungsreaktionen. Die benötigten Gleichgewichtskonstanten für diese
Reaktionen sind oft bekannt. Andernfalls können die oben erwähnten Standardreduktionspotenziale entsprechenden Tabellen entnommen werden. Das
heisst, eine quantitative Berechnung ist fast immer möglich.
2.1.5
Konzentrationseinheiten
Bei der Angabe der Konzentrationen können verschiedene Einheiten verwendet werden, welche bezogen auf wässrige Systeme nachfolgend eingeführt
werden:
• Massenprozente (Gramm Substanz pro 100 g Lösung)
• Molarität (Mol Substanz in 1 Liter Lösung)
• Molalität (Mol Substanz in 1 kg Lösungsmittel)
• Molenbruch (Der Quotient der Stoffmenge in mol einer Komponente
und der Summe der Stoffmengen aller Komponenten eines Gemisches)
Löslichkeitsangaben werden oft auf 100 g Wasser bezogen. Dies ist ein Beispiel dafür, dass die Verwendung bestimmter Einheiten nicht selten von ihrer
speziellen Anwendung abhängt.
20
3
Säuren und Basen
Schon sehr früh versuchte man, Ursache und Wirkung von Säuren und Basen
zu erforschen.
A. L. Lavoisier (1743 - 1794) hielt noch den Sauerstoff (Oxygenium =
Säurebildner) für die Ursache der sauren Wirkung eines Stoffes, da beim
Auflösen vieler Nichtmetalloxide (vgl. Tabelle 1 Säureanhydride) in Wasser
saure Lösungen (Säuren) entstehen.
Später wiesen dann H. Davy (1779 - 1829) und vor allem J. Liebig (1803 1873) dem durch Metalle ersetzbaren Wasserstoff die säurebildende Rolle zu.
Unser heutiges Verständnis der Säurewirkung in wässrigen Lösungen geht
auf S. Arrhenius (1859 - 1927) zurück, der die sauren Eigenschaften einer
Verbindung nicht auf das Wasserstoffatom, sondern auf das Wasserstoffion
(Proton, H+ ) zurückführte.
Im folgenden seien einige Eigenschaften von Säuren und Basen zusammengefasst:
Säuren:
– saurer Geschmack
– färben manche blauen Pflanzenfarbstoffe rot (Indikator)
– lösen Marmor
– enthalten Sauerstoff (Lavoisier)
– enthalten Wasserstoff, der durch Metalle ersetzt werden kann (Liebig)
Basen:
– schmecken unangenehm scharf und seifig
– laugenartiges Gefühl
– enthalten OH–Gruppen
– OH ist durch Säurereste ersetzbar
Säuren und Basen neutralisieren sich gegenseitig, wenn auch nicht notwendigerweise komplett.
21
3 SÄUREN UND BASEN
3.1
Die Theorien von Arrhenius, Brönsted und Lewis
Arrhenius (1883):
• Säuren:
Wasserstoffverbindungen, die in wässriger Lösung H + –Ionen abgeben
(z.B. HX (X = Cl, Br, I), H2 SO4 , HN O3 , H3 P O4 , HAc aber auch
N H4 Cl ).
Kleine, hochgeladene, elektronegative (Nichtmetall-)Kationen bilden
mit Sauerstoff i.d.R. Säureanhydride oder saure Oxide
y
E + O2 EOy
2
bzw.
S + O2 SO2 ,
die sich mit Wasser zu Säuren umsetzen.
(Formulieren Sie einige solcher Umsetzungen).
• Basen:
Hydroxylverbindungen, die in wässriger Lösung OH − –Ionen bilden
(z.B. M OH (M = Li, N a, K, Rb, Cs), M 0 (OH)2
(M 0 = Ca, Sr, Ba ))
Grosse, niedriggeladene, elektropositive Kationen bilden mit Sauerstoff
i.d.R. Basenanhydride oder basische Oxide
y
M + O 2 M Oy
2
bzw.
1
2N a + O2 N a2 O,
2
22
3.1 Die Theorien von Arrhenius, Brönsted und Lewis
Tabelle 1: Anhydride, ihre Säuren, Basen und Wertigkeit
Anhydrid
Säure
Wertigkeit
N2 O 5
HN O3
1
P2 O 5
H3 P O 4
3
SO2
H2 SO3
2
CO2
H2 CO3
2
I2 O7 =
ˆ I2 O5 + O2 H5 IO6 =
ˆ HIO4 (H2 O)2
1
N a2 O
CaO
Al2 O3
Base
N aOH
Ca(OH)2
Al(OH)3
1
2
3
die sich mit Wasser zu Basen umsetzen.
(Formulieren Sie einige solcher Umsetzungen).
• Neutralisation:
Bildung von Wasser und Säure–Base–Paaren (= Salze)
H + + OH − H2 O
∆H 0
N aOH + HCl N aCl + H2 O
∆H 0
(3)
(4)
Arrheniussäuren und -basen dissoziieren in H2 O mehr oder weniger stark:
M OH M + + OH −
HXOy H + + XOy
Die Stärke von Säuren und Basen (Säurestärke, Basenstärke) wird durch
die Dissoziationskonstanten bestimmt.
Die Neutralisationswärme geht im wesentlichen auf die Bildung von undissoziiertem H2 O zurück (s. Gleichung 3 und 4) .
Die Arrheniusdefinition ist auf Wasser als Lösungsmittel beschränkt.
23
3 SÄUREN UND BASEN
Brönsted (1923):
• Protonen werden von Säuren abgegeben und von Basen aufgenommen.
HA H + + A−
Säure H + +
konjugierte Base
H + + B HB +
H + + Base konjugierte Säure
Zwischen Säuren und Basen entsteht eine Konkurrenz um das Proton,
das sogenannte Protolysengleichgewicht:
HA + B HB + + A−
N H3 + H2 O N H4+ + OH −
>
Ammoniak-Springbrunnen
• Ampholyte (amphotere Stoffe) können je nach Reaktionspartner oder
nach Lösungsmittel als Säuren oder Basen wirken:
H2 O, N H3 , Al(OH)3 , . . .
>
Protolyse eines Aluminiumsalzes
Die Brönsted–Definition ist nicht mehr auf Wasser als Lösungsmittel beschränkt. Sie gilt für alle protischen, d.h. H + -liefernden Lösungsmittel.
Lewis (1923):
24
3.1 Die Theorien von Arrhenius, Brönsted und Lewis
• Säuren sind Elektronenpaarakzeptoren
>
Bestimmung der Akzeptorfähigkeit (Lewis-Säure-Charakter)
von Lösungsmitteln
• Basen sind Elektronenpaardonatoren
>
Bestimmung der Donorfähigkeit (Lewis-Base-Charakter) von
Lösungsmitteln
• Säure-Base-Reaktion: Bildung einer Bindung zwischen einer Säure und
einer Base über ein Elektronenpaar.
BF3 + N H3 −→ BF3 N H3
>
Lewissäureverhalten der Borsäure gegenüber Mannit
SnCl4 + Cl− −→ SnCl5−
SnCl5− + Cl− −→ SnCl62−
Cu2+ + N H3 −→ CuN H3 2+
(Machen Sie sich klar welche Spezies Säuren und welche Basen sind).
Die Theorie von Lewis (1875 - 1946) hat den Säure-Base-Begriff nochmals
erweitert und vom Proton bzw. vom Hydroxidion völlig unabhängig gemacht.
25
3 SÄUREN UND BASEN
3.2
Protolysengleichgewicht im Wasser und pH-Wert
Die Messung der elektrischen Leitfähigkeit von reinem Wasser zeigt, dass
dieses in geringem Masse Ionen enthält. Diese Ionen entstehen aus der sogenannten Eigendissoziation des Wassers (Autoprotolyse).
Die Konzentrationen der beiden entstehenden Teilchen H + (aq) und OH − (aq)
betragen jeweils 1.0 · 10−7 mol · l−1 bei 25◦ C . Im Protolysengleichgewicht
kann Wasser als Ampholyt formuliert werden
H2 O + H2 O H3 O+ + OH − (aq)
=⇒
S1 + B1 B2 + S2
oder einfacher als
H2 O H + (aq) + OH − (aq).
Danach ist das sogenannte Ionenprodukt des Wassers
[H + ] · [OH − ] = Kw = 1.0 · 10−14 M 2
(25o C)
Die eckigen Klammern [ ] bezeichnen Konzentrationsangaben.
In einer sauren Lösung ist [H + ]>[OH − ], in einer alkalischen dagegen [OH − ]>[H + ].
Bei [H + ] = [OH − ] spricht man von einer neutralen Lösung.
Es ist üblich zur Charakterisierung einer wässrigen Lösung den pH-Wert
anzugeben
pH = − log[H + ] und pH + pOH = 14,
zu dessen Berechnung näherungsweise die Konzentration anstelle der Aktivität (Wirkkonzentration) der Wasserstoffionen eingesetzt wird.
Der pH-Wert einer Lösung kann mit Hilfe einer galvanischen Zelle und einem
pH-Meter gemessen werden.
Sein Wert liegt in wässrigen Lösungen in einem Bereich zwischen pH = 0
([H + ] = 1 M; stark saure Lösung), pH = 7 (neutral) und pH = 14 ([H + ] =
10−14 M und [OH − ] =
ˆ 1 M; stark alkalische bzw. basische Lösung).
26
3.2 Protolysengleichgewicht im Wasser und pH-Wert
Saurer Bereich
cH3 O+ > cOH −
pH < 7
pH
0
1
2
3
4
Basischer Bereich
cOH − > cH3 O+
pH > 7
Neutralität
cH3 O+ = cOH −
pH = 7
5
6
7
8
9
10
11
12 13
14
cH3 O+
1
10−1 10−2 10−3 10−4 10−5 10−6 10−7 10−8 10−9 10−10 10−11 10−1210−13 10−14
cOH −
10−14 10−13 10−12 10−11 10−10 10−9 10−8 10−7 10−6 10−5 10−4 10−3 10−2 10−1 1
Zunehmende Acidität
Zunehmende Basizität
Abbildung 7: Acidität wässriger Lösungen.
Für wässrige Lösungen gilt das Ionenprodukt des Wassers. Es beträgt bei 25◦ C :
cH3 O+ · cOH − = 10−14 mol2 l−2 .
Anmerkung:
Der pH-Wert einer 1 · 10−4 M HCl ist 4, der einer 1 · 10−10 M
HCl jedoch nicht 10 sondern etwa 7.
3.2.1
Indikatoren
Der pH–Wert kann elektrochemisch oder über Indikatoren bestimmt werden. Indikatoren sind Farbstoffsäuren oder Farbstoffbasen, die stark gefärbte
Lösungen haben und deren Überführung zur konjugierten Base oder Säure
von einer deutlichen Farbänderung begleitet wird. (s. Tabelle 2 für die Säuren: HMO, HMR und HBTB).
>
Farbreaktionen des Phenolphthaleins
Indikatoren können daher sowohl zur Abschätzung als auch zur genauen Messung des pH-Wertes einer Lösung verwendet werden, wobei im zweiten Fall
nicht mehr das Auge, sondern ein Spektralphotometer oder ein Kolorimeter
zur Farbbestimmung eingesetzt wird.
Indikatoren werden oft zur Anzeige von pH-Änderungen bei Säure-BaseTitrationen eingesetzt. Dabei sollte die beigefügte Menge Indikator möglichst
klein sein, sodass die Titration durch ihn nicht verfälscht wird.
Eine entsprechende Kontrolle ist immer empfehlenswert.
27
3 SÄUREN UND BASEN
Für eine Farbstoffsäure H(Ind) gilt:
H(Ind) + H2 O (Ind)− + H3 O+
KHInd =
[H + ][Ind− ]
[HInd]
Wenn HInd und Ind− unterschiedlich gefärbt sind, lässt sich zeigen, dass
mit dem Auge ein Farbumschlag im pH-Intervall
pH = pK(HInd) ± 1
wahrgenommen werden kann.
28
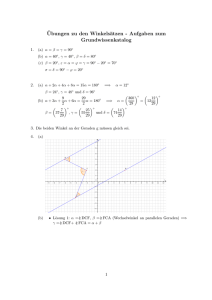
3.3 Schwache Säuren und Basen
0
1
2
3
4
rot
1,2-2,8
rot
1,3-3,2
rot
6
7
8
9
10
violett
0,1-3,2
gelb
5
12
13
14
pH
Methylorange
gelb
Thymolblau
gelb
2,94,0
Tropäolin 00
gelb
Dimethylgelb
gelb
3,0-4,6
violett
Bromphenolblau
rot
3,13,3
orange
Methylorange
gelb
4,0-5,6
rot
Bromkresolgrün
blau
4,4-6,2
farblos
gelb
5,0-7,0
gelb
6,27,6
p-Nitrophenol
blau
6,88,0
gelb
Kresolrot
Mehtylrot
gelb
rot
Neutralrot
Thymolblau
Bromthymolblau
gelb
7,2-8,8
rot
8,0-9,6
gelb
farblos
Phenolphthalein
blau
8,0-10.0
farblos
Thymolphthalein
Tropäolin 0
rot
9,410,5
gelb
Alizaringelb
blau
10,0-12,0
gelb
Lackmus
rot
11,0-13,0
farblos
Sym. Trinitrobenzoesäure
0
11
orangebraun
12,013,5
orange
4,5-8,3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
pH
Tabelle 2: Umschlagintervalle einiger Säure–Base–Indikatoren bei Raumtemperatur
3.3
Schwache Säuren und Basen
Arrhenius hat gezeigt, dass bei schwachen Säuren und Basen Dissoziationskonstanten definiert werden können nach:
29
3 SÄUREN UND BASEN
HA(aq) H + (aq) + A− (aq)
als
KS =
[H + ][A− ]
[HA]
und nach
B(aq) + H2 O BH + (aq) + OH − (aq)
als
KB =
[BH + ][OH − ]
.
[B]
Ausserdem gilt
pKB (B) = pKw − pKS (HB + )
KS und KB werden als Aciditäts– und Basizitätskonstante bezeichnet.
Schwache Säuren werden durch KS -Werte charakterisiert, die wesentlich kleiner als 10−1 sind. Entsprechendes gilt für schwache Basen.
Starke Säuren und Basen haben KS - bzw. KB -Werte grösser als 100. Ihre
Bestimmung ist in diesem Falle schwierig, da die Konzentrationen von H +
bzw. OH − nahezu identisch mit der eingesetzten Säure– oder Basekonzentration sind.
Anstelle der KS - bzw. KB -Werte werden oft ihre negativen Dezimallogarithmen verwendet, die sogenannten pKS - bzw. pKB -Werte. Eine Liste häufig
gebrauchter pKS -Werte ist in der Tabelle 3 zu finden.
30
3.3 Schwache Säuren und Basen
Tabelle 3: Gleichgewichtskonstanten für die Protonenabspaltung einiger
Säuren in wässriger Lösung.
pKs −Werte einiger Säure-Base-Paare bei 25◦ C (pKs = - lg Ks )
Säure
Base
pKs
−
HClO4
ClO4
-10
−
HCl
Cl
-7
−
- 3,9
H2 SO4
HSO4
+
H3 O
H2 O
- 1,74
−
HNO3
NO3
- 1,37
−
2−
HSO4
SO4
+ 1,96
−
H2 SO3
HSO3
+ 1,90
−
H3 PO4
H2 PO4
+ 2,16
3+
2+
[Fe(H2 O)6 ]
[Fe(OH)(H2 0)5 ]
+ 2,46
−
HF
F
+ 3,18
−
CH3 COOH
CH3 COO
+ 4,75
Stärke der
3+
2+
[Al(OH)(H2 O)5 ]
+ 4,97
Säure nimmt [Al(H2 O)6 ]
y
zu
CO2 + H2 O
HCO−
+
6,35
3
x
[Fe(H2 O)6 ]2+ [Fe(H2 O)5 OH]+
+ 6,74 Stärke der
−
H2 S
HS
+ 6,99 Base nimmt
HSO−
SO2−
+ 7,20 zu
3
3
H2 PO−
HPO2−
+ 7,21
4
4
2+
+
[Zn(H2 O)6 ]
[Zn(H2 O)5 OH]
+ 8,96
−
HCN
CN
+ 9,21
+
NH3
+ 9,25
NH4
−
2−
CO3
+10,33
HCO3
−
H2 O2
HO3
+11,65
2−
3−
HPO4
PO4
+12,32
−
2−
HS
S
+12,89
−
H2 O
OH
+15,74
−
2−
OH
O
+29
31
3 SÄUREN UND BASEN
In der Tabelle 3 werden auch zwei- und dreiprotonige Säuren
aufgeführt. Deren pKS -Werte wurden durch Extrapolation der
pKS -Werte bei gegebenen Konzentrationen der Komponenten
und unter Berücksichtigung der
P entsprechenden Ionenstärken
I, für I −→ 0 erhalten ( I = 12 ci zi2 , wobei ci die molare Konzentration und zi die Ladung der Komponente i in der Lösung
darstellt).
Dieses Vorgehen ist notwendig um den Einfluss der interionischen
Wechselwirkungen auf die Konstanten zu eliminieren, die proportional zur Ionenstärke sind.
Es ist bei potentiometrischen Messungen üblich alle Lösungen
mit dem gleichen Inertsalz der gleichen molaren Konzentration
zu versehen, um durch die Aktivitätskoeffizienten wie auch die
Diffussionspotenziale an den Phasengrenzen der verwendeten Messzellen konstant halten zu können.
Zwischen der Aktivität a und der Konzentration c eines Ions gilt, wie schon
erwähnt, folgende Beziehung
a = fc · c
wobei der Aktivitätskoeffizient fc mit der Ionenstärke variiert nach
√
zi2 I
√
lg fc = −0.5
1+ I
für Ionenstärken < 0.1.
Die Konstanten KS und KB lassen sich mit verschiedenen Methoden bestimmen:
• pH-Messungen
• Leitfähigkeitsmessungen
• kolligative Eigenschaften (Gefrierpunktserniedrigung,...)
• spektrophotometrisch
32
3.3 Schwache Säuren und Basen
Eine Bestimmung der Dissoziationskonstanten KS der Säure HA lässt sich
leicht durch Messung des pH-Wertes einer wässrigen Lösung bekannter Konzentration c durchführen.
Durch Einstellung des Gleichgewichts werden die für die verschiedenen Spezies angegebenen Konzentrationen erreicht.
HA
H + + A−
Anfang: c
0
0
+
+
Gleichgewicht: c − [H ]
[H ]
[A− ] = [H + ]
Die Berechnung von KS erfolgt dann leicht durch Einsetzen:
KS =
[H + ][A− ]
[H + ]2
[H + ]2
=
=
[HA]
[HA] − [H + ]
c − [H + ]
(5)
Aus dem gemessenen pH-Wert erhält man die Wasserstoffionenkonzentration
[H + ], die zusammen mit c, der Menge der zugegebenen Säure, die Berechnung von KS erlaubt.
Diese Methode kann zu wesentlich genaueren Werten führen, wenn man die
Ausgangslösung mit starker Base titriert und damit die Säure neutralisiert.
Man erhält dann eine sogenannte Titrationskurve, deren Auswertung den
Wert für KS ergibt.
Man kann in etwa folgende Einteilung der Säuren treffen:
• Starke Säuren: pKS ≤ 0
• Mittelstarke Säuren: 0 ≤ pKS ≤ 4
• Schwache Säuren: 4 ≤ pKS ≤ 9
• Sehr schwache Säuren: pKS ≥ 9
Verdünnte Lösungen haben Konzentrationen von cs /cb ≤ 1M.
Damit ersteckt sich der pH-Bereich auf 0 ≤ pH ≤ 14.
Vollständige Protonierung von H2 O
Reines Wasser —- 55.55M
pH zwischen -1 und -2
33
3 SÄUREN UND BASEN
Tabelle 4: Selbstprotonierung von Supersäuren
Säure
Formel
x saurer
Dischwefelsäure
H2 S2 O7
1015
Fluoroschwefelsäure HSO3 F
1015
Magische Säure
(HSO3 F )3 (SbF5 ) 1021.5
Starke Säuren und Supersäuren protonieren sich selbst
Konz. H2 SO4 ist ca 1012 mal saurer als 1M H2 SO4 Alle Säuren, die noch
stärker sind heissen Supersäuren
Superlewissäuren erniedrigen die Konzentration der konjugierten Base.
Supersäuren können extrem schwache Basen protonieren:
HCOOH + HA+ HCOOH2+
HCHO + HA+ HCHOH +
D2 + HA+ DH + DS +
Spaltung von D2
HN O3 + H2 SO4 H2 N O3+ + HSO4−
>
Nitriersäure
Darstellung und Verbrennung von Schiessbaumwolle
(CH3 )3 CH + HS + −→ (CH3 )3 C + + H2 + S
Hydridabspaltung
Ausserhalb des (normalen) pH-Bereiches (0-12) können die Spezies H3 O+
und OH − nicht mehr vollständig von H2 O hydratisiert sein.
Zusätzlich können sie auch direkt von der Säure bzw. Base geliefert werden.
Damit sind die normalen pH-Messungen gestört.
34
3.3 Schwache Säuren und Basen
3.3.1
Trends
Bei Arrheniussäuren und –basen hängt der jeweilige Charakter von der gegenseitigen Stärke der Bindungen
M n+ − − −O2− − − −H +
ab.
• Je kleiner das Kation M n+ desto stärker die M—O–Bindung (Polarisation von O2− ).
• Je höher geladen das Kation desto stärker die M—O–Bindung (CoulombWechselwirkung).
• Je elektronegativer das Kation desto stärker die M—O–Bindung (kovalenter Anteil).
• Je stärker die M—O–Bindung desto höher der Säurecharakter.
Säurestärke in einer Gruppe:
Be(OH)2 > M g(OH)2 > Ca(OH)2 > Sr(OH)2 > Ba(OH)2
Säurestärke in einer Periode:
N a(OH) < M g(OH)2 < Al(OH)3 < Si(OH)4
< OP (OH)3 =
ˆ (H3 P O4 ) < O2 S(OH)2 =
ˆ (H2 SO4 )
< O3 Cl(OH) =
ˆ (HClO4 )
35
3 SÄUREN UND BASEN
3.3.2
Aciditätsregeln nach Pauling
Für Säuren der Form On E(OH)m hat L.Pauling folgende Regeln angegeben:
1. Für eine stufenweise Dissoziation solcher Säuren gilt mit
Kl =
[On E(OH)m ]
+
[H ]l [On+l E(OH)m−l ]
K2
K1
'
' 105
K2
K3
bzw.
pKS ' 8 − 5m.
2. Damit erhält man folgende Klassifizierung:
n
0
1
2
3
pK1 Art der Säure
' 7 sehr schwach
' 2 schwach
' -3 stark
' -8 sehr stark
Ladung von E
E m+
E (m+2)+
E (m+4)+
E (m+6)+
In anderen Lösungsmitteln als Wasser treten andere pKS - und pKB -Werte
auf.
pKs -Werte einiger Säuren in Wassser und flüssigem Ammoniak als
Lösungsmittel
Säure
pKs in Wasser pKs in flüssigem Ammoniak
+
NH4
9,3
-1,62
H2 N–CN
10,4
0
PH3
27
16
36
3.4 Abhängigkeit des Säure-Base-Gleichgewichts vom pH-Wert
>
Neutralisation in flüssigem Ammoniak
Der Bereich der Säurestarken, der in einem Lösungsmittel untersucht werden
kann ist umso grösser, je geringer die Autoprotolyse des Lösungsmittels ist.
(vgl. Zunahme der Säurestärke von HCl in Alkoholen).
NH3
H2 O
HCOOH
CH3 COOH
H2 SO4
(C2 H5 )2 O
-20 -15 -10
-5
0
+5 +10 +15 +20 +25 +30
pKs
Abbildung 8: pKs -Bereiche für verschiedenen Lösungsmittel, innerhalb derer
eine Differenzierung nach Säurestärken möglich ist.
3.4
Abhängigkeit des Säure-Base-Gleichgewichts vom
pH-Wert
Aus der Definition von KS (s. Gl. 5) erhält man durch Logarithmieren
pKS = pH − lg
[A− ]
[HA]
(Henderson-Hasselbalch-Gleichung)
(6)
Diese Gleichung kann zur Berechnung der sogenannten Pufferkurve im
Neutralisationsgrad–pH–Diagramm verwendet werden.
Der Neutralisationsgrad ist wie folgt definiert:
g=
[A− ]
[A− ] + [HA]
37
3 SÄUREN UND BASEN
Wie der Name Neutralisationsgrad schon sagt, stellt dieser den Anteil der
Säure dar, der neutralisiert wurde. Das bedeutet, dass sein Wert nur zwischen
0 und 1 liegen kann und dass ausserdem
g
[A− ]
=
[HA]
1−g
gilt.
Eine Änderung des pKS führt wegen Gleichung 6 zu einer entsprechenden
Verschiebung der Pufferkurve, deren Form aber erhalten bleibt.
Aus der graphischen Darstellung der Pufferkurve kann man für beliebige pHWerte entnehmen, welcher Neutralisationsgrad erreicht wurde.
Abbildung 9: Pufferkurve einer einprotonigen Säure mit pKS = 5
Die Abbildung 9 zeigt die Pufferkurve einer Essigsäure-Acetat-Pufferlösung.
Die beste Pufferwirkung hat eine 1:1 Mischung (pH =4,75). H3 O+ -Ionen
werden von CH3 COO− -Ionen, OH − -Ionen von CH3 COOH gepuffert:
Pufferung von OH−
−−−−−−−−−−−−→ CH COO− + H O+
CH3 COOH + H2 O ←
3
3
−−−−−−−−−−−−
−
+
Pufferung von H3 O
Solange dabei das Verhältnis CH3 COOH/CH3 COO− im Bereich 0,1 bis 10
bleibt, ändert sich der pH-Wert nur wenig.
38
3.4 Abhängigkeit des Säure-Base-Gleichgewichts vom pH-Wert
Aus dieser Abbildung können also die Konzentrationen der vorhandenen
Säure und ihrer konjugierten Base ermittelt werden. Sie eignet sich hervorragend zur anschaulichen Darstellung der Überführung einer Säure in die
konjugierte Base.
Man erkennt, dass bei einem Neutralisationsgrad von 0.5 der pH-Wert nur
minimal mit der Basenzugabe steigt.
Dieser Bereich ist also der günstigste zur Verwendung des konjugierten SäureBase-Paares als Puffer.
>
Das Puffersystem Essigsäure - Natriumacetat
Eine Pufferlösung verhält sich so, dass ihr pH-Wert sich,
auch bei Zugabe erheblicher Mengen starker Säuren oder Basen, nur unwesentlich ändert. Dies gilt besonders im Bereich
pH = pKS ± 0.5.
Als Beispiel betrachten wir eine Essigsäure-Natriumacetat–Pufferlösung
( pH = pKS = 4.75) mit [HOAc]◦ = 0.5 M und [N aOAc]◦ = 0.5
M. In 100 ml einer solchen Lösung werden 0,05 mol HCl gegeben.
Wie gross ist die resultierende pH-Änderung?
HCl, als starke Säure, wird vollständig dissoziieren.
Die dadurch entstehenden Protonen werden quantitativ mit dem
aus Natriumacetat entstandenen Acetatanion reagieren und es
entsteht Essigsäure.
Daher wird also die Essigsäurekonzentration um diesen Betrag
erhöht, die Acetationenkonzentration jedoch um denselben Betrag verringert.
Die neuen Gleichgewichtskonzentrationen der relevanten Komponenten in Lösung sind also:
39
3 SÄUREN UND BASEN
[HOAc] = 0.5 + 0.05 = 0.55M
[OAc− ] = 0.5 − 0.05 = 0.45M
Der pH-Wert der Lösung kann dann mit Hilfe der Gleichung 6
berechnet werden:
[OAc− ]
0.45
pH = pKS +
= 4.75 + log
= 4.66
HOAc]
0.55
Die berechnete pH-Änderung beträgt also 0.09.
Ohne Puffer wäre die Lösung am Anfang neutral und nach der
Reaktion hätte sie mit [H + ] = 0.05 M einen pH-Wert von 1.30,
was einer Änderung um 5.7 pH-Einheiten entspräche.
Bei Pufferlösungen ist aber nicht nur der pH-Wert, sondern auch
die Konzentration der Komponenten wichtig. Dies wird deutlich,
wenn wir für die oben betrachtete Reaktion eine verdünntere Pufferlösung verwenden.
Bei einer 5mal verdünnteren Lösung seien folgende Anfangskonzentrationen gegeben:
[HOAc]◦ = 0.1M und [OAc− ]◦ = 0.1M
Die neuen Gleichgewichtskonzentrationen und der pH-Wert sind
dann
[HOAc] = 0.15M und [OAc− ] = 0.05M
sowie
pH = 4.75 − 0.48 = 4.27,
d.h. die pH-Änderung wäre also in diesem Fall ca. 5mal grösser.
40
3.4 Abhängigkeit des Säure-Base-Gleichgewichts vom pH-Wert
Der Stoffwechsel von Organismen beruht auf Säure-Base-Reaktionen und viele dieser Reaktionen reagieren sehr empfindlich auf pH-Änderungen.
So sind z. B. Enzyme der meisten Lebewesen nur in einem eng begrenzten
pH-Bereich katalytisch wirksam.
Hydrogencarbonat- und Phosphatpuffer sind Puffersysteme, die in Organismen häufig anzutreffen sind. Sie zeigen eine grosse Pufferwirkung, die auch
nötig ist, wenn man z.B. nur den weiten pH-Bereich der eingenommen Nahrungsmittel betrachtet.
>
Das Puffersystem Essigsäure - Natriumacetat,
Hydrogencarbonat - Carbonat Gleichgewicht
41
3 SÄUREN UND BASEN
3.5
Berechnungen von pH-Werten für wässrige Lösungen von Säuren oder Basen
Der pH-Wert ist das Bindeglied zur Ermittlung aller Gleichgewichtskonzentrationen in wässriger Lösung. Man geht so vor, dass man so viele Gleichgewichtsbedingungen formuliert, wie Unbekannte (Konzentrationen) ermittelt
werden müssen. Wir betrachten folgende Konzentrationen:
[HA] Konzentration an nicht dissoziierter Säure
[H+ ] Wasserstoffionenkonzentration
[A− ] Konzentration der Säureanionen
[OH− ] Hydroxidionenkonzentration.
Die folgenden vier Grundbedingungen können nun immer aufgestellt werden:
1. Massenwirkungsgesetz
KA =
[H + ][A− ]
[HA]
2. Massenerhaltung
[HA]0 = [HA] + [A− ]
3. Elektroneutralität
[H + ] = [OH − ] + [A− ]
4. Ionenprodukt des Wassers
KW = [OH − ][H + ]
Durch Kombination dieser Gleichungen erhält man:
KW
[H + ]([H + ] − [H
+] )
[H + ][A− ]
[H + ]([H + ] − [OH − ])
KA =
=
=
KW
[HA]0 − [A− ]
[HA]0 − ([H + ] − [OH − ])
[HA]0 − ([H + ] − [H
+] )
und damit die Gleichung 3. Grades in [H + ]
42
3.5 Berechnungen von pH-Werten für wässrige Lösungen von Säuren oder
Basen
[H + ]3 + KA · [H + ]2 − (KW + KA · [HA]0 )[H + ] − KW KA = 0,
(7)
die mit x = 10lg x als
[HA]0 = 10pKA −2pH + 10−pH + 10pKA −pKW = 10pH−pKW
formuliert werden kann.
Jede Säure bzw. Base hat einen eigenen pKA - bzw. pKB -Wert; deren Werte
können über den gesamten pH-Bereich streuen.
Stellt man entsprechende [HA0 ] / pH -Abhängigkeiten dar, so ergibt sich die
Abbildung 10.
Abbildung 10: [HA0 ]/pH-Abhängigkeiten für verschiedene pKA - Werte.
[B0 ]/pH-Abhängigkeit für verschiedene pKB -Werte.
43
3 SÄUREN UND BASEN
Was kann man über kleine bzw. grosse Konzentrationen [HA0 ] aussagen?
Abbildung 10 kann direkt zum Abschätzen von pH-Werten benutzt werden.
3.5.1
Logarithmische pH-Diagramme
In logarithmischen pH-Diagrammen wird der pH-Wert gegen den Logarithmus der Konzentration (lg[ ] ) einer eingesetzten Substanz (Säure, Base, Salz)
aufgetragen.
In Abbildung 11 ist das für eine 0.01M-Lösung von Benzoesäure (pKA = 4.19)
dargestellt.
Abbildung 11: Logarithmisches pH-Diagramm der Benzoesäure für die Konzentration [HA]0 = 0, 01M
Daraus können zunächst viele prinzipielle Details entnommen werden
(Je nach Situation können Vereinfachungen angebracht werden, bei denen
Teilbedingungen vernachlässigt werden können):
• Bei niedrigen pH-Werten liegt die Säure praktisch undissoziiert vor.
44
3.5 Berechnungen von pH-Werten für wässrige Lösungen von Säuren oder
Basen
• Bei P1 ist immer noch [HA] ' [HA]0 = [H + ]. Das entspricht einer
Mischung einer starken und einer schwachen Säure.
• Die Benzoesäure als schwache Säure erreicht bei dieser Konzentration
nur den Wert pH1 (P2). Es gilt:
[A− ] = [H + ] > [HA] ' [HA]0 [OH − ]
Genauso wie mit reiner Benzoesäure kann dieser pH-Wert aber auch
mittels einer äquimolaren Mischung von K-Benzoat und HCl eingestellt
werden, da die HCl die A− -Anionen komplett protoniert unter Bildung
von HA und gelöstem KCl.
• Bei P3 knicken die [HA] und [A− ]-Geraden ab; das zeigt, dass hier
starke Abhängigkeiten auftreten. Mit pH = pKA gilt auch:
[HA] = [A− ] > [H + ] [OH − ]
Diesen Punkt ( pKA / lg[HA]0 − 0.3010 ) erreicht man immer dann,
wenn man
äquimolare Mengen von einer schwachen Säure und ihrem Salz mit einer
starken Base vorlegt (Pufferlösung).
• P4 bezeichnet KW in reinem Wasser.
• P5 wird eingestellt durch eine Lösung eines Salzes der schwachen Säure
(mit einer starken Base), z.B. K-Benzoat.
Folgende Reaktionen sind zu berücksichtigen
A− + H2 O OH − + HA
und
2H2 O OH − + H +
woraus
[OH − ] = [HA] + [H + ]
folgt.
Ausserdem ist aber im alkalische Bereich
[HA] [H + ]
45
und damit
3 SÄUREN UND BASEN
[OH − ] ' [HA].
Natürlich kann dies auch erreicht werden, indem das Salz in situ gebildet wird; z.B. aus äquimolaren Mengen von HA und einer starken Base
wie KOH.
• Bei P6 liegt analg zu P1 eine Mischung einer starken Base (z.B. KOH)
mit einer schwachen Base vor.
Dabei ist dann die schwache Base vollständig deprotoniert, und der
pH-Wert wird ausschliesslich durch die Konzentration der starken Base
bestimmt.
3.5.2
Lösungen starker Säuren HA bzw. Basen MOH
Bei starken Säuren lässt sich der pH-Wert direkt berechnen mit
pH = − lg[HA]0 ;
(8)
pH = 14 + lg[M OH]0 .
(9)
bei starken Basen gilt
(Der Index 0 steht wieder für die zugegebene Menge Verbindung bzw. für
Zeitpunkt t=0).
Die Gleichungen 8 und 9 gelten aber nur für Konzentrationen von
[HA]0
bzw.
[M OH]0 > 10−5 M.
Unterschreitet die Konzentration der zugegebenen Säure bzw. Base diese
Grenze so muss die Autoprotolyse des Wassers berücksichtigt werden.
Beispiel:
starke Säure:
[HA]0 = 1 · 10−7 M
46
3.5 Berechnungen von pH-Werten für wässrige Lösungen von Säuren oder
Basen
HA −→
H + + A−
10−7 + 10−7
schwache Säure:
H2 O −→ H + + OH −
x +
x
Wir wollen die beiden Teilsysteme, Wasser und Säure, getrennt betrachten.
Wir wissen, dass die starke Säure vollständig dissoziiert. Dabei entstehen
Protonen und Anionen.
Bei der Dissoziation des Wassers entstehen ebenso viele OH − - wie H + -Ionen.
Die Konzentrationen hängen von KW und [HA]0 ab.
Damit können die folgenden Zusammenhänge abgeleitet werden:
[H + ] = [HA]0 + x
(10)
[OH − ] = x
(11)
Mit Hilfe der Ionenproduktgleichung des Wassers,
[H + ] · [OH − ] = 10−14 ,
die in wässrigen Systemen für 0 ≤ pH ≤ 12 immer gilt, und mit Gl. 10 folgt
([HA]0 + x) · [OH − ] = 10−14 ,
Ersatz von x mit Gl. 11 ergibt
([HA]0 + [OH − ]) · [OH − ] = 10−14 ,
und mit [HA]0 = 10−7 erhält man
(10−7 + [OH − ]) · [OH − ] = 10−14
47
3 SÄUREN UND BASEN
sowie
[OH − ]2 + 10−7 · [OH − ] − 10−14 = 0,
Dann ist
[OH − ] = −0.5 · 10−7 +
r
10−14
+ 10−14 = 6.18 · 10−8 M,
4
pOH = 7.209 sowie pH = 14 - pOH = 14 - 7.209 = 6.791 und
[H + ] = 1.618 · 10−7
Von der letzteren Konzentration stammen 1 · 10−7 aus [HA] und 0.618·10−7
aus H2 O.
Zeigen Sie in Abbildung 10, wie sich der pH-Wert ändert in Abhängigkeit
von der Konzentration einer starken Säure zwischen 1 M und 10−14 M .
Die pH-Wertberechnung für die Mischung einer starken (HA2 ) und einer
schwachen Säure (HA1 ) kann auch auf einfache Weise gleich als Funktion der
Protonenkonzentration geschrieben werden. Dabei ist der Korrekturfaktor
vor der Wurzel nun positiv, weil [H + ] um diesen Betrag grösser ist (um den
[OH − ] kleiner ist):
r
[HA
]
[HA2 ]20
2 0
[H + ] =
+
+ KHA1 · [HA1 ]0
2
4
Die Differenz zwischen [H + ] und [OH − ] ist also [HA2 ]0 , die Ausgangskonzentration der starken Säure.
48
3.5 Berechnungen von pH-Werten für wässrige Lösungen von Säuren oder
Basen
3.5.3
Lösungen schwacher Säuren bzw. Basen
Wir haben bereits besprochen, wie aus der pH-Messung einer Lösung einer
schwachen Säure HA die Dissoziationskonstante dieser Säure erhalten werden kann.
Ist die Dissoziationskonstante KA einer solchen Säure bekannt, so kann man
aus Gl. 5 den pH-Wert für eine Lösung der Gesamtkonzentration c bestimmen.
Die stöchiometrischen Gleichungen lauten wie folgt:
c = [HA]0 = [HA] + [A− ]
In dieser Bilanz liegt die zugegebene Säure in Form eines dissoziierten Anions
(A− ) und eines nicht dissoziierten Anteils HA in Lösung vor.
c = [H + ]t = [HA] + [H + ] − [OH − ]
(12)
Diese Gleichung beschreibt die Protonenbilanz des Systems.
Alle zugegebenen Protonen [H + ]t können entweder als H + oder als HA
vorliegen.
Die aus der Dissoziation des Wassers entstehenden Protonen müssen noch
abgezogen werden. Ihre Konzentration ist mit [OH − ] identisch.
Des weiteren gelten die bekannten Beziehungen
[H + ] · [OH − ] = 10−14 und
KA =
[H + ][A− ]
.
[HA]
49
3 SÄUREN UND BASEN
Abbildung 12: Logarithmisches pH-Diagramm einer Säure mit pKA = 6.8 für
die Konzentration [HA]0 = 10−6.5 M
Insgesamt müssen wir hier ein System von vier Gleichungen mit vier Unbekannten ([H + ], [HA], KA und [OH − ]) berücksichtigen. Dies führt zu einer
Gleichung dritten Grades in [H + ].
[H + ]3 + KA [H + ]2 − (KW + KA · [HA]0 )[H + ] − KW · KA = 0
(13)
– vgl. Gl. 7 .
In den meisten Fällen ist eine der Konzentrationen [H + ] oder [OH − ] gegenüber der anderen vernachlässigbar klein
und kann aus der zweiten stöchiometrischen Gleichung (12) eliminiert werden.
Das gilt für die in Abbildung 13 dargestellte Situation.
50
3.5 Berechnungen von pH-Werten für wässrige Lösungen von Säuren oder
Basen
Abbildung 13: Logarithmisches pH-Diagramm einer Säure mit pKA = 6.8 für
die Konzentration [HA]0 = 10−4 M
Damit gilt [A− ] [OH − ]
[H + ]2 = KA [HA]
und
[H + ] = [A− ]. Hieraus folgt
[H + ]2 = KA ([HA]0 − [H + ]
bzw.
und
[H + ]2 + KA · [H + ] − KA · [HA]0 = 0
sowie schliesslich
[H + ] =
r
KA · [HA]0 +
KA2
KA
−
4
2
(14)
Diese Gleichung liefert in weiten Konzentrationsbereichen genaue Ergebnisse.
Liegt eine Situation wie in Abbildung 11 vor, so kann auch noch die Abnahme
der Konzentration der undissoziierten Säure ([HA] = [HA]0 ) vernachlässigt
werden, und es gilt näherungsweise
51
3 SÄUREN UND BASEN
[H + ] =
p
KA · [HA]0
(15)
oder
pH =
pKA − log[HA]0
.
2
(16)
Abbildung 14: Logarithmisches pH-Diagramm einer Säure mit pKa =4.2 für
die Konzentration [HA]0 =10−4 M .
Die Gleichungen 15 (16), 14 und 13 gelten also für zunehmende Verdünnung.
Wird die Lösung aus der schwachen Säure HA und dem Salz N aA hergestellt,
so müssen die stöchiometrischen Gleichungen wie folgt geändert werden:
[HA]◦ + [N aA]0 = [HA] + [A− ]
52
3.5 Berechnungen von pH-Werten für wässrige Lösungen von Säuren oder
Basen
Die Bilanz des Anions verändert sich hier, weil nun nicht nur die Säure,
sondern auch das eingesetzte Salz Anionen liefern. Wenn dieses das Salz
mit einer starken Base (z.B. N aOH/N a+ wie im vorliegenden Fall) ist, so
dissoziert es vollständig. Die möglichen Spezies, nämlich dissoziiert oder nicht
dissoziiert, bleiben natürlich gleich (nicht aber deren Konzentrationen)
[H + ]t = [HA]0 = [HA] + [H + ] − [OH − ]
(Da N a+ nicht mit dem Wasser reagiert, beeinflusst es diese Beziehungen
nicht und taucht deshalb nicht auf). In der Protonenbilanz ändert sich gegenüber dem ersten Fall nichts, da nach wie vor Protonen nur aus der Säure
und der Eigendissoziation des Wassers entstehen können. Allerdings geht nun
die geänderte [A− ]-Konzentration in das Massenwirkungsgesetz (KA ) ein. Es
resultiert die Henderson-Hasselbalch-Gleichung 6.
3.5.4
0.01M
Praktische Beispiele zur Berechnung des pH-Wertes
CH3 COOH
Aufstellen der Gleichungen
(1)
[OAc− ]t = 0.01 = [HOAc] + [OAc− ]
Acetat kann entweder als Essigsäure HOAc oder als Acetatanion OAc− vorliegen. Die Summe beider Komponenten ergibt die Gesamtmenge:
(2)
[H + ]t = 0.01 = [HOAc] + [H + ] − [OH − ].
[OH − ] aus der Dissoziation des Wassers ist vernachlässigbar, weil bei einer
Säurekonzentration von 0.01 M im allgemeinen [H + ]>>[OH − ] ist. Natürlich
hängt das vom pKA -Wert der Säure und deren Konzentration ab (wieso?).
Aus (1) und (2) folgt [H + ] = [OAc− ].
Dies ist vernünftig, da ja die Eigendissoziation des Wassers keine Rolle spielen soll und damit alle Protonen und alle Acetatanionen aus der Essigsäure
entstehen.
Nun können wir die oben gewonnenen Beziehungen in die Gleichung für die
Dissoziationskonstante einsetzen :
(3)
KA =
[H + ][OAc− ]
[HOAc]
=
[H + ]2
0.01−[H + ]
= 10−4.75
Nach Auflösung von (3) erhält man:
53
3 SÄUREN UND BASEN
[H + ]2 + 10−4.75 · [H + ] − 10−6.75 = 0 und
(4)
(5)
[H + ] = 21 [10−4.75 +
= 4.13 · 10−4 M
√
10−9.5 + 4 · 10−6.75 ]
pH = 3.38; [OAc− ] = 4.13 · 10−4 M;
[HOAc] = 9.587 · 10−3 M
Kontrolle der Annahme [H + ]>>[OH − ]:
[OH − ] = 10−10.62 M <<[H + ]!
2.
0.01M CH3 COOH und 0.01M CH3 COONa
(1)
[OAc− ]t = 0.02 = [HOAc] + [OAc− ]
Im Gegensatz zu Beispiel 1 wird hier ein Teil des Anions als Salz zugegeben.
[H + ]t = [HOAc]o = 0.01 = [HOAc] + [H + ] − [OH − ]
(2)
Die Gesamtkonzentration der Protonen bleibt unverändert, da ja auch die
Säuremenge konstant bleibt. Wie wir vorher gesehen haben, beträgt der
pH-Wert der reinen Säurelösung etwa 3.4. Da durch die Zugabe des Salzes der pH-Wert sich sicher erhöhen wird (versuchen Sie dies anhand des
Ausdrucks für die Dissoziationskonstante zu verifizieren!), können wir annehmen, dass die Säurekonzentration durch die Dissoziation nur in geringem
und deshalb vernachlässigbarem Rahmen verändert wird. Es gilt daher:
[H + ]<<[HOAc]
[HOAc] ' [OAc− ].
und damit
Mit dem Ausdruck für die Dissoziationskonstante
KA =
[H + ]·[A− ]
HA]
= 10−4.75
ergibt sich dann [H + ] = 10−4.75 M = 1.78 · 10−5 M << 0.01 M
Kontrolle: [OH − ] = 10−9.25 M <<[H + ]
3.
0.1M NH3
54
3.5 Berechnungen von pH-Werten für wässrige Lösungen von Säuren oder
Basen
N H3 kann in wässriger Lösung wie folgt reagieren:
N H3 + H2 O −→ N H4 + + OH −
Wir können also folgende Bilanzgleichungen aufstellen:
(1)
[N H3 ]t = 0.1 = [N H3 ] + [N H4 + ]
(2)
[H + ]t = 0 = [N H4 + ] + [H + ] − [OH − ].
Es wurde also keine Säure zugegeben. Für diesen Fall wird die Basizitätskonstante benutzt:
(3)
Kb =
[N H4 + ]·[OH − ]
[N H3 ]
= 10−14+9.245 = 10−4.755
Die Beziehung pKb = pKW − pKA gilt für jedes System.
Durch Einsetzen in Gleichung (3) werden folgende Ausdrücke erhalten:
10−4.755 =
[OH − ]2
0.1−[OH − ]
und
[OH − ]2 + 10−4.755 [OH − ] − 10−5.755 = 0
[OH − ] = 21 [−10−4.755 +
Damit ist pOH = 2.88;
−→ ([H + ]<<[OH − ])
[N H4+ ] = [OH − ];
√
sowie
10−9.510 + 4 · 10−5.755 ] = 1.317 · 10−3 M.
pH = 14 - 2.88 = 11.12;
[N H3 ] = 9.868 · 10−2 M
Zusammenfassend gilt für diesen Fall
1
pH = 7 + (pKA + log[B])
2
55
3 SÄUREN UND BASEN
3.5.5
Schwache Säure und schwache Base
In Abbildung 15 sind die Konzentrationsverhältnisse für Lösungen von N H3
und CH3 COOH (HAc) angegeben. Es treten prinzipiell die drei Reaktionen
auf:
HAc + H2 O Ac− + H3 O+
N H3 + H2 O N H4+ + OH −
HAc + N H3 Ac− + N H4+
(17)
Zunächst sieht man, dass bei einer Säure-Base-Titration
eines Gemisches zweier schwacher Säuren, zuerst die stärkere und dann die
schwächere deprotoniert wird.
Abbildung 15: Logarithmisches pH-Diagramm einer Lösung von N H4+ und
CH3 COOH
Im Punkt P (pH=7) gilt [N H4+ ] = [Ac− ], was man auch durch Auflösen von
Ammoniumacetat (N H4 Ac) erreichen kann.
56
3.5 Berechnungen von pH-Werten für wässrige Lösungen von Säuren oder
Basen
(Warum ist die Lage von P bei pH=7 rein zufällig?)
Generell gilt für P
1
pH = (pKA1 + pK[A2 )
2
(18)
und für alle anderen pH-Werte mit
KA1 =
KA2
[H + ][Ac− ]
[HAc]
[H + ][N H4 ]
=
[N H4+ ]
schliesslich
[H + ] = KA1 · KA2
[HAc][N H4+ ]
.
[Ac− ][N H3 ]
(19)
In Abbildung 15 ist klar zu erkennen, dass [H + ] und [OH − ] zwischen P1
und P2 vernachlässigt werden können. Damit wird der Bruch in Gl. 19 gleich
eins, weil nur noch Reaktion 17 gilt. Es resultiert dann Gl. 18. Ersetzt man
noch pKA2 durch pKB2 , so wird Gl. 18 zu
1
pH = 7 + (pKA1 − pKB2 )
2
Damit kann man leicht sehen, dass
1. die Lösung sauer reagiert, wenn Säure 1 stärker ist als Base 2
2. die Lösung basisch reagiert, wenn Base 2 stärker ist als Säure 1.
3.5.6
Zweiprotonige Säuren
Im Falle der zweiprotonigen Säure H2 SeO3 gibt es drei wichtige Gleichgewichtsreaktionen
HSeO3− + H2 O SeO32− + H3 O+ ,
(20)
HSeO3− + H2 O H2 SeO3 + OH −
(21)
57
3 SÄUREN UND BASEN
und
HSeO3− + HSeO3− H2 SeO3 + SeO32− .
(22)
Abbildung 16: Logarithmisches pH-Diagramm der selenigen Säure (0.1M)
Wir analysieren Abbildung 16:
1. Im Bereich pKA1 = 2.6<pH<pKA2 = 7.2 liegt überwiegend der Ampholyt HSeO3− vor und nur Gl. 22 ist von Bedeutung, da in diesem
Bereich einerseits [OH − ]<<[H2 SeO3 ] andererseits [H + ]<<[SeO32− ]
ist.
Dann sollte im gesamten Bereich [H2 SeO3 ] ' [SeO32− ] sein. Damit
wird der explizite Ausdruck
KA1 KA2 =
[HSeO3− ][H + ] [SeO32− ][H + ]
·
[H2 SeO3 ]
[HSeO3− ]
zu
[H + ]2 = KA1 KA2
oder
1
pH = (pKA1 + pKA2 )
2
58
(23)
3.5 Berechnungen von pH-Werten für wässrige Lösungen von Säuren oder
Basen
Die letzten beiden Gleichungen gelten auch für Lösungen eines entsprechenden Salzes, z.B. Natriumhydrogenselenit N aHSeO3 .
2. Handelt es sich um Salze von starken Säuren, so sind die Gln. 20 und
21 nicht mehr von untergeordneter Bedeutung und die Näherung 23
stimmt nicht mehr.
Aber auch dann gibt 23 noch den Punkt an,
an dem die Konzentration des Ampholyten (z.B. HSO4− ) maximal ist.
Hier ist das Ausmass der Säurereaktion des Ampholyten HA− (Gl. 20)
gleich dem der Basenreaktion (Gl.21), und man spricht vom isoelektrischen Punkt.
3. Liegen die pKA -Werte mindestens 4 pH-Einheiten auseinander, so kann
man die steilen Äste für H2 A und A2− ganz vernachlässigen. Damit
liegt praktisch eine Mischung zweier schwacher Säuren vor (vgl. Gl. 18).
3.5.7
Titrationskurven
Titrieren heisst, die unbekannte Menge eines gelösten Stoffes dadurch zu
ermitteln, dass man ihn durch Zugabe einer geeigneten Reagenzlösung mit
genau bekanntem Gehalt (Wirkungsgrad, Titer) quantitativ von einem chemisch definierten Anfangszustand in einen ebenso gut bestimmten Endzustand überführt. Man misst dabei die verbrauchte Menge Reagenzlösung.
59
3 SÄUREN UND BASEN
Abbildung 17: Links: Titration von 0.1N Säuren mit einer 0.1N Base;
Rechts: Titration von jeweils zwei Konzentrationen einer starken und einer
schwachen Säure.
Gesucht wird der Äquivalenzpunkt, bei dem gerade die zugegebene Menge
des Titers der der Säure entspricht; an diesem Punkt ist der Titrationsgrad
eins.
τ=
[Base]
,
[Base]0
wobei [Base]0 der Erwartungswert für den Titer darstellt. Für eine Base ist
der Titer natürlich eine starke Säure.
Die folgenden Angaben für Titrationen gelten für Raumtemperatur, da sich
das Verhalten chemischer Stoffe mit der Temperatur verändern kann:
• der Wert des Äquivalenzpunktes kann auch aus den logarithmischen
Diagrammen entnommen werden (vgl. P5 in Abbildung 11,
• starke Säure / starke Base — Äquivalenzpunkt fällt mit dem Neutralpunkt zusammen,
60
3.5 Berechnungen von pH-Werten für wässrige Lösungen von Säuren oder
Basen
• schwache Säure / starke Base — Äquivalenzpunkt liegt im alkalischen
Bereich,
• starke Säure / schwache Base — Äquivalenzpunkt liegt im sauren Bereich,
• schwache Säure / schwache Base — Äquivalenzpunkt liegt am oder
nahe des Neutralpunktes, ist aber nur schwer festzustellen,
• die pH-Wertberechnung für schwache Säuren wird nach
[A− ]
pH = pKA + lg [HA]
durchgeführt,
• die Kurven der schwachen Säuren zeigen bei τ = 0.5 einen Wendepunkt,
und hier liegt die grösste Pufferwirkung vor.
3.5.8
Titrationskurven und logarithmische pH-Diagramme
Die folgenden drei Abbildungen zeigen Zusammenhänge zwischen Titrationskurven und logarithmischen pH-Diagrammen an:
Abbildung 18: Titrationskurven (rechte Teile) und logarithmische pHDiagramme (linke Teile) der Ameisensäure (links: 0.1M =
ˆ 0.1N; rechts:
0.001M =
ˆ 0.001N)
61
3 SÄUREN UND BASEN
Abbildung 19: Titrationskurve (rechts) und logarithmisches pH-Diagramm
(links) von Salzsäure und Essigsäure (jeweils 0.1M =
ˆ 0.1N)
Abbildung 20: Titrationskurve (rechts) und logarithmisches pH-Diagramm
(links) von 0.1M N H4 Cl bzw. von 0.1M N H3
62
3.5 Berechnungen von pH-Werten für wässrige Lösungen von Säuren oder
Basen
Abbildung 21: Titrationskurve (rechts) und logarithmisches pH-Diagramm
(links) von Phosphorsäure ( 0.1M =
ˆ 0.3N)
Die Konzentration einer starken Base, die in Wasser zu einer schwachen Säure
HA zugegeben wird, lässt sich wie folgt ausdrücken:
[OH]t = [A− ] + [OH − ] − [H + ]
und der Neutralisationsgrad τ damit auch als
a=
[A− ]t
[OH − ] − [H + ]
[OH − ] − [H + ]
[OH − ]t
=
+
=g+
[HA]t
[HA]t
[HA]t
[HA]t
Wenn [OH − ] − [H + ] vernachlässigbar klein ist, dann ist die Titrationskurve
(τ , pH) mit der Pufferkurve (g, pH) identisch.
Bei tiefen oder hohen pH-Werten ist dagegen [H + ] gegenüber [OH − ]t nicht
mehr vernachlässigbar. Die zwei Kurven fallen nicht mehr zusammen. Wir
betrachten den Fall, bei dem die Grössen τ bzw. g verschieden sind, wie z.B.
bei pKA (HA) = 3. Bei einer totalen Konzentration [HA]o = 1 · 10−2 M
berechnet man die folgende Wertetabelle pH vs.([OH − ] − [H + ])/[HA]o :
pH
5
4
3
2
1
0
[OH − ]−[H + ]
[HA]0
−10−3
−10−2
−10−1
-1
-10
-100
63
3 SÄUREN UND BASEN
Es zeigt sich, dass es bei den vorliegenden Bedingungen durch eine starke
Säurezugabe praktisch unmöglich ist, eine Lösung der undissozierten Säure
HA zu erhalten. Und zwar deshalb, weil die Zugabe der starken Säure keine
weitere Protonierung von A− ermöglicht, sondern nur zur Herabsetzung des
pH-Wertes der Lösung beiträgt.
64
4
Redoxreaktionen
Der Begriff Redoxreaktion geht auf Lavoisier zurück, der für Vorgänge,
bei denen sich eine andere Substanz mit Sauerstoff verbindet, den Ausdruck
Oxidation einführte, wie z.B. bei
2N i + O2 −→ 2N iO
2M g + O2 −→ 2M gO
3F e + SO2 −→ F e3 O4
und
S + O2 −→ SO2
Die Bezeichnung Reduktion wurde entsprechend für den Entzug von Sauerstoff verwendet (vgl. Gewichtsreduktion):
CuO + H2 −→ Cu + H2 O
>
Pyrophore Eigenschaften des Raney-Nickels,
Oxidation von Eisen,
Reduktion von Kupfer(II)-oxid
F e2 O3 + 3C −→ 1F e + 3CO
(24)
Die Reaktion 24 beschreibt den wesentlichen Vorgang beim Hochofenprozess
zur Darstellung von Roheisen.
Viele Oxide lassen sich mit elementarem Aluminium reduzieren
(−→aluminothermische Reaktionen, Thermitversuch) unter Bildung von Aluminiumoxid:
3SiO2 + 4Al −→ 3Si + 2Al2 O3
65
4 REDOXREAKTIONEN
>
Die Aluminothermische Darstellung von Silicium
bzw.
F e2 O3 + 2Al −→ 2F e + Al2 O3
Reduktion und Oxidation gehen immer miteinander einher. Deshalb nennt
man solche Reaktionen Redoxreaktionen. Heute versteht man unter diesem Begriff ganz allgemein Reaktionen, bei denen Elektronen zwischen den
Komponenten übertragen werden.
4.1
Die Oxidationszahl
Der Formalismus der Oxidationszahlen ist besonders bei der Beschreibung
von Redoxvorgängen wichtig. Die Oxidationszahl gibt an, wieviele Elektronen ein neutrales Atom innerhalb einer Verbindung aufgenommen (+e− )
bzw. abgegeben (−e− ) hat. Die Oxidationszahl lässt sich leicht mit Hilfe
folgender Regeln herleiten:
• Jedes Atom im elementaren Zustand hat die Oxidationszahl Null. Dies
gilt auch für die Elemente, die als Moleküle oder Polymere (z.B. Graphit, Silicium, etc.) vorliegen.
• Bei Ionenverbindungen ist die Oxidationszahl eines Elementes identisch
mit seiner Ionenladung.
66
4.1 Die Oxidationszahl
8
7
6
Ordnungszahlen
5
4
3
2
1
0
−1
−2
−3
−4
H
He
1.Periode
Li
Be
B
C
N
O
F
Ne
Ne
Mg
Al
Si
P
S
Cl
Ar
3.Periode
2. Periode
Abbildung 22: Wichtige Oxidationszahlen der Elemente der ersten drei Perioden
• Die Summe der Oxidationszahlen aller Atome einer mehratomigen Verbindung ist gleich Null.
Die Summe der Oxidationszahlen aller Atome eines mehratomigen Ions
ist gleich der Gesamtladung dieses Ions.
• Bei kovalent (mit Lewis-Bindestrichen) formulierten Verbindungen wird
die Verbindung formal in Ionen aufgeteilt.
Dabei wird angenommen, dass die an jeder Bindung beteiligten Elektronen vom elektronegativeren Atom vollständig übernommen werden.
67
I
4 REDOXREAKTIONEN
J
K
L
M
N
O
P
Q
R
S
T
U
V
W
X
Y
Z
[
\
]
^
_
`
a
b
c
d
e
f
g
h
i
j
k
l
m
n
¬
o
z
{
|
}
~
­
.
v
w
x
y
³
3
¶
5
·
6
7
¸
²
µ
4
u
t
0
2
´
s
¯
±
1
r
/
q
®
°
p
¹
º
8
»
9
:
!
%
¼
½
¾
¿
;
"
#
À
<
Á
=
>
$
&
(
Â
,
?
@
A
B
'
-
*
Ã
Ä
Å
Æ
Ç
+
C
D
¡
¢
£
¤
¥
¦
§
¨
©
ª
E
F
G
H
«
)
• Die positive Oxidationszahl eines Elementes kann nicht grösser sein als
die Gruppennummer dieses Elementes
(Das gilt für die alte und die neue Gruppeneinteilung).
• Die maximale negative Oxidationszahl eines Elementes ist nach der
alten Gruppeneinteilung: Gruppennummer - 8;
nach der neuen Gruppeneinteilung : Gruppennummer - 18.
• Die höchsten bisher beobachteten Oxidationstufen sind +8 in OsO4
und -5 in Verbindungen mit E13 (E13=Elemente der Gruppe 13 nach
der neuen Einteilung; B, Ga). Die grösste Spanne von Oxidationszahlen ist bisher mit ∆OZ=10 bei schwereren Übergangsmetallen wie Os
68
4.1 Die Oxidationszahl
(Os2− bis Os8+ ) gefunden worden. Bei den Maximalwerten kommt das
Konzept an seine Belastungsgrenze.
• Die meisten Elemente treten in mehreren Oxidationsstufen auf.
>
Oxidationsstufen
In der chemischen Formel wird die Oxidationszahl über dem zugehörigen
Elementsymbol als arabische oder als römische Zahl geschrieben. Früher wurden auch oft römische Zahlen in () hinter das Elementsymbol geschrieben.
Das Vorzeichen steht vor der Zahl, im Gegensatz zu dem der Ladungszahl.
Einige Oxidationszahlen ausgewählter Elemente in Verbindungen:
III
−I
III
III
III
F ; Alkalimetalle(I); Erdalkalimetalle(II); Al, Sc, Y , La
II
O (mit Ausnahmen).
Früher war es üblich römische Zahlen zu benutzen; heute wählt man überwiegend arabische, weil man auch die 0 und gebrochene Zahlen zur Verfügung
hat.
Einige weitere Beispiele:
+1 −1
+1 −1
N aCl : N aCl
HCl : H Cl
+1 −2
+2 −1
Cl2 O : Cl2 O
OF2 : O F 2
+1 +7 −2
+1−2 +1
HOCl : H O Cl
HClO4 : H ClO4
+1 +6 −2
+1 −1
H2 SO4 : H 2 S O4
+ 83
N aH : N aH
−2
F e3 O4 : F e3 O4
Oxidationszahlen (OZ) sind zur systematischen Klassifizierung von Verbindungen nützlich, dienen zur Interpretation bestimmter Eigenschaften von
Verbindungen (z.B. magnetischer Eigenschaften) und sind hilfreich beim Formulieren von Redoxgleichungen.
Das Ausgleichen der Halbreaktion (27) lässt sich problemlos durchführen,
wenn die OZ angegeben werden.
+7
+2
M n−→M n
69
4 REDOXREAKTIONEN
Die Differenz der OZ von oxidierter und reduzierter Form ergibt die benötigte
Anzahl Elektronen.
+7
+2
M n + 5e− −→M n
4.2
Grundsätzliches
Man kann bei Redoxreaktionen immer Teilreaktionen formulieren, die jeden
der Einzelvorgänge separat beschreiben:
1. Bei der Oxidation werden von der betrachteten Komponente Elektronen abgegeben, und die Oxidationszahl erhöht sich.
0
+z
−
A−→ A +z · e
0
(25)
+2
F e−→F e +2e−
0
+1
N a−→N a +e−
2. Bei der Reduktion werden von der betrachteten Komponente Elektronen aufgenommen, und die Oxidationszahl erniedrigt sich.
−z
0
−
B +z · e −→ B
−1
0
Cl2 +2e− −→ 2 Cl
+3
+2
F e +e− −→F e
70
(26)
4.2 Grundsätzliches
>
Redoxreaktionen mit Phosphor
Oxidierte und reduzierte Form einer Komponente bilden ein Redoxpaar
0
+1
+2
+3
−1
0
(z.B. N a / N a+ , F e / F e, 2 Cl− / Cl2 ).
An jeder Redoxreaktion sind immer zwei Redoxpaare beteiligt.
Redoxpaar 1
Redoxpaar 2
Red1 Ox1 + e−
Red2 Ox2 + e−
Redoxreaktion:
Red1 + Ox2 Ox1 + Red2
>
Silber- und Bleibaum
Je stärker bei einem Redoxpaar die Tendenz der reduzierten Form ist, Elektronen abzugeben, um so schwächer ist die Tendenz der oxidierten Form,
Elektronen aufzunehmen. Man kann die Redoxpaare nach dieser Tendenz in
einer Redoxreihe oder Spannungsreihe anordnen. Je höher in der Redoxreihe ein Redoxpaar steht, um so stärker ist die reduzierende Wirkung der
reduzierten Form. Weit oben stehende Spezies werden als Reduktionsmittel bezeichnet, weit unten stehende als Oxidationsmittel. Metalle, die ein
positives Normalpotenzial haben heissen edel, die anderen unedel. Jede reduzierte Form einer Spezies kann auf eine unter ihr stehende oxidierte Form
einer anderen Spezies Elektronen übertragen. Nur solche Redoxreaktionen
laufen freiwillig ab.
71
4 REDOXREAKTIONEN
Tabelle 5: Redoxreihe
x
Zunehmende
Tendenz der
Elektronenabgabe;
zunehmende
reduzierende
Wirkung
reduzierte Form
Na
Zn
Fe
H2 + 2 H2 O
2 I−
Cu
Fe2+
2 Br−
2 Cl−
oxidierte Form + e−
Na+
+1 e−
Zn2+
+2 e−
Fe2+
+2 e−
2 H3 O+
+2 e−
I2
+2 e−
Cu2+
+2 e−
Fe3+
+1 e−
Br2
+2 e−
Cl2
+2 e−
Zunehmende
Tendenz der
Elektronenaufnahme;
zunehmende
oxidierende
Wirkung
y
Nicht möglich ist z.B. das Auflösen von Kupfer in wässrigen Lösungen (nichtoxidierender) Säuren
Cu + 2H3 O+ 6−→ Cu2+ + H2 + 2H2 O
>
Reaktion von Säuren mit Metallen
Beispiele für in ws̈sriger Lösung ablaufende Redoxreaktionen:
Zn + Cu2+ −→ Zn2+ + Cu
F e + Cu2+ −→ F e2+ + Cu
2N a + 2H3 O+ −→ 2N a+ + H2 + 2H2 O
2I − + Br2 −→ I2 + 2Br−
2Br− + Cl2 −→ Br2 + 2Cl−
72
4.3 Ausgleichen von Redoxreaktionen
E(V)
-3
E◦N a
6
-2
unedle Metalle
E◦Al
6
6
E◦Zn
-1
6
E◦H = 0
?
?
?
E◦W asser
6
E◦Cu E◦Ag
?
6
?
6
?
+1
?
edle Metalle
Abbildung 23: Potenzialdiagramm verschieden edler Metalle
>
4.3
Oxidationsreaktionen,
Der Silber- und Bleibaum
Ausgleichen von Redoxreaktionen
Bei der Formulierung von Redoxgleichungen stellt sich oft das Problem der
Vervollständigung der Gleichung. Dabei wird verlangt, dass die freiwerdenden
Elektronen vollständig verbraucht werden. Da es keine feststehenden Regeln
für die zahlenmässige Vervollständigung dieser Gleichungen gibt, erfolgt diese
meist empirisch. Grundsätzlich ist es aber empfehlenswert sich zunächst die
Frage zu stellen, ob überhaupt eine Redoxreaktion vorliegt.
Die Reaktion
2+
Cu2+
aq + Zn(s) −→ Znaq + Cu(s)
besteht aus den zwei Halbreaktionen
−
Cu2+
aq + 2e −→ Cu(s)
Reduktion
−
Zn(s) −→ Zn2+
aq + 2e
Oxidation
73
4 REDOXREAKTIONEN
Hier ist das Ausgleichen der Reaktion trivial, es gibt aber Fälle, bei denen
etwas mehr Vorsicht angebracht ist. Wie kann man z.B. die Oxidation von
F e2+ zu F e3+ mit KM nO4 in saurer Lösung formulieren, wenn man weiss,
dass M n2+ entsteht?
Man beginnt, die Halbgleichungen zu formulieren, indem man die darin vorkommenden Komponenten auflistet. Die Reduktion lautet dann
+7
K M n O4 + H + + e− −→ M n2+ + . . . ,
(27)
und die Oxidation wird, wie folgt, formuliert:
F e2+ −→ F e3+ + e− .
Die erste Halbreaktion kann durch folgende Überlegungen vervollständigt
werden:
• Aus O-Atomen kann mit H + H2 O gebildet werden. (Auf der linken
Seite der Halbgleichung können, sofern die Reaktion in saurer Lösung
stattfindet, soviele H + −Ionen, wie benötigt, eingesetzt werden).
• Ausgleichen der Ladungen, indem 5e− zur Kompensation der fünf überschüssigen positiven Ladungen auf der linken Seite eingesetzt werden.
+7
K M n O4 + 8H + + 5e− −→ M n2+ + 4H2 O + K +
Ladungen :
3+
−→
3+
• Durch Kombination der beiden Halbreaktionen verschwinden die Elektronen aus der resultierenden Gleichung.
KM nO4 + 8H + + 5e− −→ M n2+ + 4H2 O + K +
5F e2+ −→ 5F e3+ + 5e−
• Addition der beiden Halbgleichungen ergibt die vollständige Redoxgleichung:
7+
K M n O4 + 8H + + 5F e2+ −→ 5F e3+ + M n2+ + 4H2 O + K +
74
4.3 Ausgleichen von Redoxreaktionen
>
Redoxreaktionen von Kaliumpermanganat
Ein anderes Beispiel ist das Auflösen von Kupfer in einer oxidierenden Säure:
Cu −→ Cu2+ + 2e−
Redoxsystem 1
Redoxsystem 2
Redoxgleichung
>
4H3 O+ + N O3− + 3e− −→ N O + 6H2 O
x3
x2
3Cu + 8H3 O+ + 2N O3− −→ 3Cu2+ + 2N O + 12H2 O
Darstellung von NO
Man kann also folgendes Schema zur Vervollständigung von Redoxgleichungen angeben:
• Stellen Sie aus den Ausgangsstoffen und Reaktionsprodukten eine Gleichung auf, in der die Elemente, die ihre Oxidationsstufe wechseln, enthalten sind.
• Bestimmen Sie die Halbreaktion, in welcher die Oxidation bzw. die
Reduktion auftritt.
• Vervollständigen Sie die Halbreaktion so, dass die Zahl der einzelnen
Elemente auf beiden Seiten gleich wird. Die Sauerstoffbilanz ist dabei
als erstes auszugleichen (Nötigenfalls H2 O, H + oder OH − hinzufügen,
niemals jedoch O2 oder H2 (!), sofern dies keine Reaktanden sind).
In saurem Milieu können begreiflicherweise nur H + und H2 O, in alkalischem Milieu nur H2 O und OH − als Reaktanden eingesetzt werden!
• Nachdem die Erhaltung der Atome gewährleistet ist, wird durch Einführung
von Elektronen für die Ladungserhaltung gesorgt.
• Multiplizieren Sie die Halbreaktionen mit entsprechenden Zahlenfaktoren derart, dass die Gesamtzahl der vom Reduktionsmittel abgegebenen Elektronen derjenigen vom Oxidationsmittel aufgenommenen entspricht.
75
4 REDOXREAKTIONEN
• Addieren Sie beide Halbreaktionen.
• Prüfen Sie die Richtigkeit der Endgleichung durch Abzählen der Atome
jedes Elements auf beiden Seiten der Gleichung, und kontrollieren Sie
die Ladungserhaltung.
>
Reaktionsverhalten von Metallen
Ein Redoxprozess kann durch Mischen der nötigen Edukte auftreten.
Die Reaktion liefert dann eine bestimmte Wärmemenge, die von der gewählten Zusammensetzung und der Enthalpie der Reaktion abhängt.
Dieser Prozess kann auch in galvanischen Zellen durchgeführt werden.
>
Redoxreaktionen
76
4.4 Galvanische Zellen
4.4
Galvanische Zellen
Die Abscheidung von Silber aus Silbernitratlösung an metallischem Kupfer
ist bereits in Gleichung 1 formuliert worden. Eine weitere, lange bekannte
Redoxreaktion ist die Abscheidung von Kupfer aus einer Kupfersalzlösung
auf metallischem Zink.
Abbildung 24: Schematische Darstellung einer Redoxreaktion (links). Schematische Darstellung einer galvanischen Zelle (rechts, sogenanntes Daniell-Element).
>
Das Daniell Element
In der Versuchsanordnung in Abbildung 24 rechts ist der Reaktionsraum in
zwei Halbzellen, Halbelemente bzw. Halbräume aufgeteilt. Diese Anordnung
wird als Kette, Zelle, galvanische Zelle, Galvanisches Element oder Volta–
Element bezeichnet. Entscheidend ist, dass die beiden Halbelemente so getrennt werden, dass die reagierenden Komponenten nicht direkt in Lösung
miteinander zur Reaktion kommen (innerer Kurzschluss). Das wird durch
eine halbdurchlässige Membran oder eine semipermeable Membran (Diaphragma) bzw. durch eine Salzbrücke (Stromschlüssel) gewährleistet. Dabei
muss aber eine Ionenwanderung möglich bleiben, da sonst kein Stoffumsatz
und kein Ladungstransport möglich ist.
Bei der Oxidation werden die freiwerdenden Elektronen an die Anode abgegeben und über einen elektrischen Leiter, der an ein Messgerät oder einen
77
4 REDOXREAKTIONEN
Verbraucher angeschossen ist, zur Kathode überführt, wo sie für den Reduktionprozess verbraucht werden. Der Fluss der Elektronen wird durch die
Wanderung von Anionen kompensiert, sodass die Elektroneutralität gewährleistet ist.
In diesem Fall liefert die chemische Reaktion also direkt elektrische Energie, deren Menge von der Zahl der überführten Elektronen und von
der freien Enthalpie der Reaktion, ∆G, abhängt. Durch letztere wird
auch die Spannung zwischen den beiden Elektroden bestimmt. Diese wird
auch als Elektromotorische Kraft EMK bezeichnet. Auf Grund der EMK
kann das galvanische Element Arbeit leisten und zwar entsprechend ∆G der
zugrundliegenden chemischen Reaktion.
Redoxpaar 1 (Halbelement1)
Redoxpaar 1 (Halbelement1)
2+
−
Zn −→ Zn + 2e
Cu2+ + 2e− −→ Cu
Gesamtreaktion
Zn + Cu2+ −→ Zn2+ + Cu
Redoxpotenzial 1
◦
+ 0,059
lg cZn2+
EZn = EZn
2
Redoxpotenzial 2
◦
ECu = ECu
+ 0,059
lg cCu2+
2
Gesamtpotenzial
◦
◦
∆E = ECu − EZn = ECu
− EZn
+
0,059
2
c
2+
lg cCu2+
Zn
Die in Abbildung 24 dargestellte Reaktion verläuft spontan. Diese Aussage kann entweder bei Kenntnis von ∆G oder der bekannten Potenziale der
beiden Elektroden machen. Es gilt nämlich
∆G◦ = −nF E ◦ = −96487 nE ◦
(28)
∆G◦ = −RT lnK = −5.707 lgK
(29)
und
mit der Faradaykonstante F=96487 Asmol−1 und der Gaskonstanten R=8.314
JK −1 mol−1 . K ist die Gleichgewichtskonstante und n die Zahl der bei der
Reaktion beteiligten Elektronen in mol.
Die Potenziale erhält man durch Anwendung der Nernstschen Gleichung, die
für eine Halbzelle wie folgt zu formulieren ist
E1 = E1◦ −
RT [Red1 ]
ln
nF [Ox1 ]
78
(30)
4.4 Galvanische Zellen
und für die Reaktionsgleichung
Red1 −→ Ox1 + n1 e−
gilt.
Beim Vertauschen von [Ox] und [Red] ändert sich das Vorzeichen vor dem
konzentrationsabhängigen zweiten Glied.
E1◦ heisst Normal- oder Standardpotenzial der Halbzelle 1 für den Fall, dass
die Aktivitäten von Red1 und Ox1 eins betragen. Diese Werte sind für viele Halbreaktionen tabelliert, so dass nach Gleichung 30 viele Halbzellenpotenziale für beliebige Aktivitäten der Reaktionspartner berechnet werden
können. Eine ähnliche Gleichung gilt für die zweite Halbzelle:
E2 = E2◦ −
RT [Red2 ]
ln
nF
[Ox2 ]
Für eine spontane Reaktion sind E1 und E2 so zu kombinieren, dass die Differenz der beiden Werte positiv ist. Im speziellen Fall E1 = E2 ist die Differenz
der beiden Werte Null, und das System befindet sich im Gleichgewicht. Nur
eine Kombination der Halbreaktionen ergibt eine spontane Reaktion.
Bei Anwendung der Nernstschen Gleichung werden nur die Komponenten,
die als Ionen in Lösung oder als Gase auftreten, berücksichtigt. Für feste
Stoffe und Wasser ist die Aktivität eins.
Der Umsatz von Permanganat mit Eisen(II)–Salzen wurde bereits besprochen:
+7
M n O4− + 8H + + 5e− −→ M n2+ + 4H2 O
[M n2+ ]
RT
ln
E=E −
5F [M nO4− ][H + ]8
◦
Galvanische Zellen bestehen immer aus zwei Halbzellen.
Als Beispiel sei noch einmal das Daniellelement angeführt:
Hier bestimmt das grössere Bestreben von Kupfer, Elektronen aufzunehmen,
die Richtung des Elektronenflusses.
79
4 REDOXREAKTIONEN
Abbildung 25: Bestimmung von Standardpotenzialen mit einer Standardwasserstoffelektrode als Bezugselektrode
>
Potenzialmessungen mit der Normalwasserstoffelektrode
Die Bestimmung von Standardpotenzialen: Als Bezugselektrode dient eine Standardwasserstoffelektrode. Die Standardwasserstoffelektrode hat das Potenzial null, da ihr Standardpotenzial willkürlich mit null festgesetzt wird. Die gesamte EMK
der Anordnung a) ist also gleich dem Elektrodenpotenzial der
Zn-Elektrode:
◦
∆E = EZn = EZn
+ 0,059
lg aZn2+ . Beträgt die Aktivität von Zn2+
2
eins (aZn2+ = 1, ) so ist die EMK gleich dem Standardpotenzial
von Cu. Standardpotenziale sind Relativwerte bezogen auf die
Standardwasserstoffelektrode.
Das Standardreduktionspotenzial E ◦ einer Halbzelle wird durch Messung der
80
4.5 Die Standardwasserstoffelektrode
Spannung zwischen dieser Halbzelle und einer Standardelektrode Standardwasserstoffelektrode unter Standardbedingungen (25◦ C , 1 bar H2 und
Aktivitäten aller Reaktanden gleich eins) erhalten. Das Standardreduktionspotenzial der Standardwasserstoffelektrode wird definitionsgemäss gleich Null
gesetzt.
Das Vorzeichen von E ◦ ist nur dann positiv, wenn die Halbzelle bei obiger
Reaktion als Kathode wirkt (vgl. Tab. 6). Die E ◦ -Werte von Halbreaktionen sind wichtige Grössen, weil sie die Berechnung der freien Enthalpie ∆G
(kJ/mol) und der Gleichgewichtskonstanten K mit Hilfe der Gleichungen 28
und 29 erlauben.
Gleichung 28 ergibt bei einem spontanen Prozess (E ◦ >0) einen negativen
Wert für ∆G, wie es die Thermodynamik verlangt. Aus den Gleichungen 28
und 29 folgt:
E◦ =
RT
0.0592
lnK =
lgK
nF
n
(31)
Damit kann aus dem E ◦ −Wert die zur Reaktion gehörende Gleichgewichtskonstante K berechnet werden. Diese ist besonders wichtig, weil sie es erlaubt, die jeweiligen Gleichgewichtskonzentrationen für einen Redoxprozess
zu berechnen und zu entscheiden, ob z.B. eine volumetrische Titration für
eine quantitative Bestimmung herangezogen werden kann.
>
4.5
Das Daniell Element
Die Standardwasserstoffelektrode
Die Standard– oder Normalwasserstoffelektrode ist eine Halbzelle. Sie besteht aus einer Elektrode, die mit fein verteiltem Platin beschichtet ist und
die bei 25◦ C von Wasserstoffgas unter einem konstantem Druck von 1 bar
umspült wird. Diese Elektrode ist in eine wässrige Lösung einer Säure (pH
= 0 bzw. [H + ] = 1 mol · l−1 oder besser aH + = 1) eingetaucht.
Die zugehörigen Gleichungen lauten
1
H + + e− H2 (g)
2
und
1/2
RT aH +
0.0592 pH2
E=E +
ln 1/2 = E ◦ −
lg
.
F
1
aH +
pH
◦
2
81
4 REDOXREAKTIONEN
Abbildung 26: Schematischer Aufbau einer Wasserstoffelektrode
Redoxsystem
H2 + 2H2 O 2H3 O+ + 2e−
a2
+
◦
Redoxpotenzial
EH = EH
+ 0.059
lg HpH3 O
2
2
Das Standardpotenzial einer Wasserstoffelektrode wird
willkürlich null gesetzt. Für die Standardwasserstoffelektrode
ist daher EH = 0 .
>
4.6
Die Normalwasserstoffelektrode
Anwendung der Nernstschen Gleichung
In den folgenden Beispielen wird gezeigt, wie man mit Hilfe der Nernstschen
Gleichung das Potenzial E einer Halbzelle für beliebige Konzentrationen der
beteiligten Reaktanden berechnet.
a) E ◦0 einer Elektrode unter Standardbedingungen, aber bei einem von 0
verschiedenen pH-Wert :
Das Standardreduktionspotenzial einer H2 -Elektrode bei pH = 7.
a
1/2
E = E ◦ − 0.0592 lg [HH+2 ]
1/2
= −0.0592 · pH − 0.0592 lg aH2
1/2
= −0.414 − 0.0592 lg aH2
= −0.414V
82
4.7 Faradaysches Gesetz
mit aH2 = 1.
Unter Standardbedingungen und pH = 7 ist das Auflösen von Ni unter
H2 −Entwicklung nicht mehr möglich (E ◦ (N i2+ /N i) = -0.25 V!).
b) E bei gegebener Konzentration bzw. Aktivität:
Das Potenzial einer H2 −Elektrode bei pH = 2 und aH2 = 0.1 beträgt:
E = 0 − 0.0592 lg
4.7
0.11/2
= −0.89V
10−2
Faradaysches Gesetz
Das Faradaysche Gesetz beschreibt den quantitativen Zusammenhang zwischen elektrischer Ladung und der an einer Elektrode abgeschiedenen Stoffmenge. Man erhält die durch die Strommenge Q abgeschiedene Masse m des
Stoffes mit der Molmasse M und der Ladung n nach:
m=
MQ
nF
F ist die sogenannte Faradaykonstante, ihr Wert beträgt 96485 Cmol−1 .
83
4 REDOXREAKTIONEN
Tabelle 6: Standardreduktionspotenziale, gültig bei 25◦ C und 1 bar, in saurer
Lösung.
reduzierte Form Li
K
Ba
Ca
Na
Mg
Al
Mn
Zn
Cr
S2−
Fe
Cd
Co
Sn
Pb
Fe
H2 + 2 H2 O
Sn2+
Cu+
SO3 + 6 H2 O
Cu
Cu
2 I−
H2 O2 + 2 H2 O
Fe2+
Ag
Hg
NO + 6 H2 O
2 Br−
6 H2 O
2 Cr3+ + 21 H2 O
2 Cl−
2+
Pb + 6 H2 O
Au
Mn2+ + 12 H2 O
3 H2 O + O2
2 F−
e−
oxidierte Form
Li+
K+
B2+
Ca2+
Na+
Mg2+
Al3+
Mn2+
Zn2+
Cr3+
S
Fe2+
Cd2+
Co2+
Sn2+
Pb2+
Fe3+
H3 O+
Sn4+
Cu2+
+
SO2−
4 + 4 H3 O
2+
Cu
Cu+
I2
O2 + 2 H3 O+
Fe3+
Ag+
Hg2+
+
NO−
3 + 4 H3 O
Br2
O2 + 4 H3 O+
+
Cr2 O2−
7 + 14 H3 O
Cl2
PbO2 + 4 H3 O+
Au3+
MnO−
4 + 8 H2 O
O3 + 2 H3 O+
F2
84
+1
+1
+2
+2
+1
+2
+3
+2
+2
+3
+2
+2
+2
+2
+2
+2
+3
+2
+2
+1
+2
+2
+1
+2
+2
+1
+1
+2
+3
+2
+4
+6
+2
+2
+3
+5
+2
+2
e−
e−
e−
e−
e−
e−
e−
e−
e−
e−
e−
e−
e−
e−
e−
e−
e−
e−
e−
e−
e−
e−
e−
e−
e−
e−
e−
e−
e−
e−
e−
e−
e−
e−
e−
e−
e−
e−
Standardpotenzial
E ◦ in V
-3,04
-2,92
-2,90
-2,87
-2,71
-2,35
-1,68
-1,19
-0,76
-0,74
-0,48
-0,41
-0,40
-0,28
-0,14
-0,13
-0,036
0
+0,15
+0,15
+0,17
+0,34
+0,52
+0,54
+0,68
+0,77
+0,80
+0,85
+0,56
+1,07
+1,23
+1,33
+1,36
+1,46
+1,50
+1,51
+2,07
+2,87
4.8 Einige Beispielaufgaben zu Standardreduktionspotenzialen
4.8
4.8.1
Einige Beispielaufgaben zu Standardreduktionspotenzialen
Die EMK der Kette Zn/0.1 M ZnSO4 //0.5 M CuSO4 /Cu
Es gilt zunächst E ◦ (Zn2+ /Zn) = -0.763 V und E ◦ (Cu2 + /Cu) = 0.340
V. Für die Anode erhalten wir mit Gl. 30
EA = −0.763 −
1
0.0592
RT
· ln
=
−0.763
−
· lg 10 = −0.793V
nF
[Zn2+ ]
2
und für die Kathode
0.0592
· lg 0.5−1 = 0.331V.
2
Die Zellspannung (stromlos gemessen) ist dann
EK = +0.340 −
EM K = EK − EA = 1.124V.
4.8.2
Berechnng von Gleichgewichtskonzentrationen
Es sollen Gleichgewichtskonzentrationen berechnet werden, die man erhält,
wenn man eine 0.1 M CuSO4 −Lösung mit Zn−Pulver versetzt.
Cu2+ + Zn Zn2+ + Cu
K=
[Zn2+ ]
[Cu2+ ]
Die EMK dieser Kette unter Standardbedingungen beträgt:
E ◦ = 0.340 + 0.763 = 1.103V
Die Gleichgewichtskonstante K kann dann nach Gl. 31 berechnet werden:
1.103·2
K = 10 0.0592 = 1037.26
Die Konzentration von Zn2+ beträgt 0.1 M (es wird angenommen, dass nahezu das gesamte Cu2+ durch Zn umgesetzt wird). Die verbleibende Konzentration von Cu2+ lässt sich dann mit dieser Annahme wie folgt berechnen:
[Zn2+ ]
[Zn2+ ]
= 37.26 = 10−38.26 M
K
10
Dieses Ergebnis rechtfertigt auch die Annahme, dass die Zn2+ −Konzentration
am Ende etwa gleich 0.1 M sei.
[Cu2+ ] =
85
4 REDOXREAKTIONEN
+2
4.8.3
+4
Titration einer F e −Lösung mit Ce −Lösung
+2
+4
100 ml 0.01 M F e −Lösung sollen mit 0.100 M Ce −Lösung titriert werden.
Die Titration soll in 1 M H2 SO4 erfolgen.
+3
+2
+4
E ◦ (F e / F e) = 0.77V
+3
E ◦ (Ce / Ce) = 1.44V
+3
Die Messkette enthält eine Platinelektrode zur Messung des Potenzials E(F e
+2
/ F e). Mit Gl. 30 erhält man
+3
+2
E = E ◦ (F e / F e) − 0.24 − 0.0592 lg
[F e2+ ]
.
[F e3+ ]
Als Referenzelektrode wird eine Kalomelelektrode mit E ◦ = +0.24 V verwendet.
Die Potenziale E sollen berechnet werden:
+2
a) nach Oxidation der Hälfte der F e −Lösung,
+2
+4
b) nach Zugabe der zu F e äquivalenten Menge Ce,
+4
+4
+3
c) für einen Überschuss an Ce, so dass gilt: [Ce] = [Ce].
Wir gehen nach folgendem Schema vor:
Zuerst wird die Gleichgewichtskonstante der Reaktion ermittelt:
+2
+4
+3
+3
F e + Ce
F e + Ce
K = 10
1.44−0.77
0.0592
= 1011.3
Daraus folgt, dass die Reaktion praktisch vollständig abläuft.
Wir können nun die Gleichgewichtskonzentrationen berechnen.
+4
(a) In diesem Fall sind 5 ml 0.1 M Ce −Lösung notwendig.
Berücksichtigt man die zugehörige Volumenänderung, so wird die Aus+2
gangskonzentration von F e:
86
4.8 Einige Beispielaufgaben zu Standardreduktionspotenzialen
+2
[F e]o =
0.01 · 100
= 0.00952M
100 + 5
+4
und die eingesetzte Ce −Konzentration
+2
[F e]o
= 0.00476M.
[Ce]o =
2
+4
Da die Reaktion, wie schon erwähnt, praktisch vollständig verläuft,
folgt:
+3
+3
+2
1 +2
[F e] = [Ce] = [F e] = [F e]o
2
und E = 0.53V.
+4
Die tatsächliche Ce −Konzentration ergibt sich aus:
+3 +3
+4
[Ce]
=
[F e][Ce]
+2
[F e]·K
+3
= [Ce] · 10−11.3
= 2.38 · 10−14 M
+4
(b) Für diese Aufgabe sind 10 ml 0.1 M Ce −Lösung notwendig. Die ur+2
sprüngliche Konzentration an F e ergibt sich damit zu:
+2
[F e]o =
0.01 · 100
= 0.00909M.
100 + 10
+2
+4
+3
Da laut Aufgabenstellung das gesamte F e durch Ce zu F e oxidiert
werden soll, folgt
+3
+3
+2
[F e] = [Ce] = [F e]o .
+4
+2
Mit [Ce] = [F e] gilt weiter
87
4 REDOXREAKTIONEN
+4
+2
+2 √
[Ce] = [F e] = [F e]o 10−11.3 = 2.03 · 10−8 M.
Mit Hilfe des Massenwirkungsgesetzes (K) ergibt sich
+2
[F e]
= 2.24 · 10−6
+3
[F e]
und
E = 0.53 − 0.0592 · lg 2.24 · 10−6 = 0.864V
+4
(c) In diesem Fall werden 20 ml 0.1 M Ce −Lösung benötigt. Man erhält
weiter:
+4
[Ce]o
0.1 · 20
[Ce] =
=
= 8.33 · 10−3 M
2
(100 + 20)2
+3
Mit Hilfe der Massenwirkungskonstante K ergibt sich wieder
+2
[F e]
+3
+3
+2
= 10−11.3 , [F e] = 8.33 · 10−3 , [F e] = 4.17 · 10−14 .
[F e]
und E = 0.53 − 0.0592 · lg 10−11.3 = 1.19V.
4.9
Konzentrationsketten
Nach Gleichung 30 hängt das Elektrodenpotenzial von der Ionenkonzentration in einer elektrochemischen Zelle ab.
Das heisst, dass man mit ein und demselben Elektrodentyp aber mittels
Konzentrationsunterschieden in den Halbzellen ein galvanisches Element aufbauen kann.
88
4.9 Konzentrationsketten
In der folgenden Abbildung ist eine Silberkonzentrationskette als Beispiel
angegeben. Auch die EMK dieser Kette ist gleich der Differenz der Potenziale
der beiden Halbelemente:
∆E = EAg (1) − EAg (2) = 0, 059 lg
Reaktion im Halbelement 1
Ag + + e− −→ Ag
cAg+ (1)
cAg+ (2)
Reaktion im Halbelement 2
Ag −→ Ag + + e−
Redoxpotenzial 1
Redoxpotenzial 2
◦
◦
EAg (1) = EAg + 0, 059 lg cAg+ (1) EAg (1) = EAg
+ 0, 059 lg cAg+ (1)
Abbildung 27: Konzentrationskette: Ag-Elektroden tauchen in Lösungen mit unterschiedlicher Ag + -Konzentration. Lösungen verschiedener Konzentration haben
das Bestreben, ihre Konzentrationen auszugleichen. Im Halbelement 2 gehen daher
Ag + -Ionen in Lösung, im Halbelement 1 werden Ag + -Ionen abgeschieden, Elektronen fliessen vom Halbelement 2 zum Halbelement 1.
Mit Konzentrationsketten lassen sich sehr kleine Ionenkonzentrationen messen und Löslichkeitsprodukte bestimmen.
Beispiel: Löslichkeitsprodukt von AgI
89
4 REDOXREAKTIONEN
Versetzt man eine AgN O3 -Lösung mit I − -Ionen, fällt AgI aus. Es gilt das
Löslichkeitsprodukt
cAg · cI = LAgI
Verwendet man eine I − -LÖsung der Lonzentration 10− 1mol/l, so kann durch
Messung der Ag + -Konzentration das Löslichkeitsprodukt bestimmt werden.
Man erhält die Ag + -Konzentration durch Messung der EMK einer Konzentrationskette, die aus einem Halbelement Ag|AgI|Ag + und dem Referenzelement besteht
∆E = 0, 059 lg cAg + (R) − 0, 059 lg cAg+
lg cAg+ =
∆E
+ lg cAg+ (R)
0, 059
Beträgt die Ag + -Konzentration der Referenzelektrode cAg+ = (R) = 10−1 mol/l
und ∆E = 0, 832V, ist CAg+ = 8 · 101 6 mol/l und lAgI = 8 · 10−17 mol2 /l2 .
4.10
Elektroden zweiter Art
Setzt man einem Ag + /Ag−Halbelement Anionen zu, die mit Ag + −Ionen
ein schwerlösliches Salz billden, so wird die Ag + −Ionenkonzentration durch
das Löslichkeitsprodukt des Salzes bestimmt. Das Potenzial einer solchen
Elektrode erhält man also mit
E = E ◦ + 0.059 lg[Ag + ]
und
[Ag + ][Cl− ] = L.
zu
◦
E = EAg
+ 0.0592 lg
L
.
[Cl− ]
Elektroden zweiter Art eignen sich sehr gut als Vergleichselektroden.
• Sie lassen sich leicht herstellen.
• Ihr Potenzial ist gut reproduzierbar.
90
4.11 Elektroden für EMK-Messungen
>
Potenzialmessungen an Elektroden
Eine in der Praxis häufig gebrauchte Vergleichselektrode ist die Kalomelelektrode, die aus einem Pt-Draht, Quecksilber, Quecksilberchlorid, und
einer gesättigten Kaliumchloridlösung besteht:
P t/Hg/Hg2 Cl2 /KCl(ges.) E ◦ = +0.24V
Der Pt-Draht dient nur als Zuleitung.
4.11
Elektroden für EMK-Messungen
Bei jeder Halbreaktion wird immer ein System zur Übertragung der Ladungen bzw. zur Abscheidung oder Auflösung eines Reaktanden benötigt. Diese
Funktionen werden durch geeignete Elektroden realisiert.
Durch Anwendung sehr kleiner Strommengen treten i.d.R. vernachlässigbar
kleine Änderungen der Konzentrationen der Ionen in Lösung auf. Das heisst
zugleich, dass die gemessene EMK zeitlich praktisch unverändert bleibt. Bei
vielen Messungen sind Phasengrenzen zwischen zwei Lösungen unvermeidlich
(pH-Messung, Anwendungen von Referenzelektroden, etc.).Diese verursachen
sogenannte Diffusionspotenziale, die eine genaue EMK-Messung erschweren.
Alle Teile einer Messkette können die Messergebnisse beeinflussen, weil auch
sie mitgemessen werden.
Die folgende Überlegungen müssen bei der Auswahl von Elektroden angestellt
werden:
• Wenn bei der Halbreaktion ein Metall und seine Ionen auftreten, dann
wirkt das Metall als Elektrode (z.B. Cu, Zn, Ag, etc.)
• Platinschwarz oder Platinschwamm kann sehr grosse Mengen an H2
aufnehmen und abgeben. Es kann daher als Basismaterial für eine Wasserstoffelektrode verwendet werden.
• Elektroden für Anionen erhält man, indem man ein Metall, mit einem
schwerlöslichen Salz des betreffenden Anions beschichtet.
So erlauben die Elektrodensysteme Ag/AgX, Hg/Hg2 X2 die Messung
von X − −Anionen (X = Cl− , Br− , I − ).
91
4 REDOXREAKTIONEN
• Bei Halbreaktionen zwischen löslichen Reaktanden mit verschiedenen
Oxidationszahlen können inerte Metallelektroden verwandt werden, zum
Beispiel Pt oder Au für die Redoxpaare
+3
+2
+2
+7
+2
F e / F e, Hg /Hg22+ , CrO24− /Cr+3 und M n O4− / M n
• Das Potenzial zwischen zwei Lösungen gegebener Wasserstoffionenkonzentration, getrennt durch eine geeignete Membran (z.B. ionendurchlässiges Spezialglas), kann mittels Glaselektroden gemessen werden.
Man verlangt dabei, dass eine Elektrode ein Verhalten aufweisst, das die
Nernstsche Gleichung der entsprechenden Halbzelle erfüllt. Zusätzlich ist
für die Praxis ein rasches Einstellen der entsprechenden Gleichgewichte erforderlich. Diese Bedingungen sind nicht immer erfüllt.
4.12
Potenzialdiagramme
Für Elemente, die in mehreren Oxidationsstufen stabil auftreten, können
in einem Diagramm alle E ◦ −Werte angegeben werden. Anhand dieser sogenannten Potenzialdiagramme können Disproportionierungen und andere
Redoxprozesse diskutiert werden.
0,158 V
Cu
2+
0,522 V
- Cu+
-
1)
Cu
(saure Ls.)
2)
0,340 V
Aus obigem Diagramm ist auch ersichtlich, dass das Standardpotenzial keine
Zustandsgrösse ist, wohl aber die freie Enthalpie ∆G◦ (E1◦ +E2◦ 6= E3◦ ; ∆G1 +
∆G2 = ∆G3 ) :
0.158 + 0.522 = 0.680 = 2 · 0.340.
Für die Disproportionierung gilt:
2Cu+ −→ Cu2+ + Cu
und E ◦ = 0.522 - 0.158 = 0.364 < 0! Danach ist klar, dass diese Reaktion
spontan abläuft.
92
4.12 Potenzialdiagramme
Eine Disproportionierung von Teilchen tritt dann auf, wenn
das Redoxpotenzial für die Reduktion zum nächstniedrigeren
Oxidationszustand positiver ist als das Redoxpotenzial für die
Oxidation zum nächsthöheren Oxidationszustand.
Die Disproportionierung von F e2+ , hingegen, ist nicht spontan:
0,770 V
Fe3+
-0,440 V
- Fe2+
-
1)
Fe
(saure Ls.)
2)
-0,037 V
Als Beispiel für ein komplizierteres Potenzialdiagramm wird das von Chlor
in saurer Lösung wiedergegeben:
+1,47
ClO−
4
-1,19
-
ClO−
3
+1,21
+1,65
-
HClO2
+1,63
-
HOCl
+1,358
-
Cl2
-
Cl−
+1,49
+1,43
Diese Daten erlauben die Berechnung der E ◦ −Werte beliebiger Redoxpaare
zwischen den beteiligten Spezies. Im Falle der Dissoziation von schwachen
Säuren (HClO und HClO2 ) ist die Kenntnis der zugehörigen Dissoziationskonstanten unerlässlich.
Das entsprechende Potenzialdiagramm in alkalischer Lösung erhält man,
wenn man als Reaktanden die in diesem Medium stabilen Teilchen einsetzt.
Als Beispiel sei hier die Berechnung von E ◦ (ClO4− /ClO3− ) aufgeführt: Die
Gleichung der Halbzelle in sauerem Milieu lautet:
2H + + ClO4− + 2e− −→ ClO3− + H2 O
E ◦ = 1.19V
und die zugehörige Nernstsche Gleichung ist:
E = 1.19 −
[ClO− ]
0.0592
lg + 3 − .
2
[H ][ClO4 ]
93
(32)
4 REDOXREAKTIONEN
Die Anionen ClO3− und ClO4− sind auch im alkalischen Milieu stabil, und
die zugehörige Gleichung für E ◦ erhält man durch Substitution von [H + ] mit
Hilfe des Ionenproduktes des Wassers Kw /[OH − ] = 10−14 /[OH − ]:
E = 1.19 −
= 1.19 −
= 0.36 −
[ClO3− ][OH − ]2
10−28 [ClO4− ]
[ClO3− ][OH − ]2
0.0592
0.0592
·
28
−
lg
2
2
[ClO4− ]
−
− ]2
[ClO
][OH
0.0592
3
lg
2
[ClO4− ]
0.0592
2
lg
Die letzte Gleichung entspricht dem Gleichgewicht
H2 O + ClO4− + 2e− −→ ClO3− + 2OH − mit E ◦ = 0.36V.
Natürlich kann die Berechnung von E ◦ für beliebige pH-Werte durchgeführt
werden. Für pH = 5 erhält man mit Gl. 32
[ClO− ]
E = 1.19 −
0.0592
2
3
lg (10−5 )2 [ClO
−
]
= 1.19 −
0.0592
2
· 10 −
4
0.0592
2
[ClO− ]
lg [ClO3− ] .
4
Das heisst, E ◦ =0.894 V für diese Halbkette bei pH=5.
4.13
Gleichgewichtslage bei Redoxprozessen
Bei einem Redoxprozess liegt Gleichgewicht vor, wenn die Potenziale der
beiden Redoxpaare gleich gross sind.
E1◦ +
RT
[Ox1 ]
RT
[Ox2 ]
ln
= E2◦ +
ln
zF
[Red1 ]
zF
[Red2 ]
E2◦ − E1◦ =
RT [Ox1 ][Red2 ]
RT
ln
=
ln K
zF
[Red1 ][Ox2 ]
zF
Für 25o C erhält man
(E2◦ − E1◦ )
z
= lg K.
0.0592
Je grösser die Differenz der Standardpotenziale, um so weiter
auf einer Seite liegt das Gleichgewicht.
94
4.14 pH-E-Diagramme
4.14
pH-E-Diagramme
Für jede Halbkette kann man E ◦ −Werte in Abhängigkeit vom pH-Wert berechnen und erhält durch Auftragen von E ◦ gegen pH pH-E-Diagramme.
Mit Hilfe solcher Darstellungen können ermittelt werden:
1. Die Richtungen von Redoxreaktionen beim beliebigen pH-Werten. Man
vergleicht hierzu resultierenden E-Werte der zwei Halbketten.
2. Die stabilste Komponente eines galvanischen Elementes bei gegebenen
Bedingungen (pH,E ◦ ).
Dabei soll beachtet werden, dass das Diagramm einer Halbkettenreaktion die
pH / E-Wertepaare angibt, bei denen die Konzentrationen von Red und Ox
1 M betragen:
Ox + ne− −→ Red
E = E◦ −
0, 059 Red
lg
n
Ox
Je positiver der E-Wert, desto stabiler ist die oxidierte Form, und je negativer
der E-Wert, desto stabiler ist die reduzierte Form der Verbindung.
Bemerkung:
Aussagen über den Verlauf einer Reaktion mittels Standardreduktionspotenzialen gelten für Systeme, die im Gleichgewicht stehen. Sehr oft lässt sich das
aus kinetischen Gründen nicht realisieren!
Anwendungsbeispiele:
>
Elektrolyse,
Brennstoffzelle,
Das Kupfer – Eisen-Element,
Oxidation von Zink
95
5 KOMPLEXVERBINDUNGEN
5
Komplexverbindungen
5.1
Aufbau und Eigenschaften
Komplexverbindungen werden oft auch als Koordinationsverbindungen
bezeichnet.
Ein Komplex besteht aus einem Koordinationszentrum und
der Ligandenhülle. Zum Zentrum können ein oder mehrere
Zentralatome oder Zentralionen gehören. Die Liganden sind
Ionen oder Moleküle bzw. Molekülionen.
Koordinationszentrum
Al3+
Cr3+
Fe3+
Ni
Ag+
Ligand Komplex
F−
NH3
H2 O
CO
CN−
[AlF−]3−
[Cr(NH3 )6 ]3+
[Fe(H2 O)6 ]3+
Ni(CO)4
[Ag(CN)2 ]−
KZ
6
6
6
4
2
Die Zahl der an das Zentrum gebundenen Liganden heisst Koordinationszahl (Abkürzung: KZ bzw. CN). Komplexionen werden in [ ] gesetzt. Die
Gesamtladung ist die Summe aller Einzelladungen im Komplex. Komplexe
können oft an ihren typischen Eigenschaften erkannt werden:
• Komplexionen zeigen häufig charakteristische Farben.
2−
Cu2+
aq + SO4
schwachblau
F e2+
aq
schwachgelb
+4N H3 −→ [Cu(N H3 )4 ]2+ + SO42−
tiefblau
+6CN − −→
[F e(CN )6 ]4−
gelb
• Lösungen von Komplexen haben charakteristische elektrolytische
Eigenschaften. Die gemessene Leitfähigkeit kann nicht nach der folgenden Gleichung
K4 [F e(CN )6 ] −→ 4K + + F e2+ + 6CN −
96
5.1 Aufbau und Eigenschaften
sondern nur nach
K4 [F e(CN )6 ] −→ 4K + + [F e(CN )6 ]4−
erklärt werden (vgl. auch Kap. 5.11 Doppelsalze).
• Die für die freien Ionen typischen Ionenreaktionen werden häufig
nicht beobachtet, weil viele Komplexe in wässriger Lösung in nur geringem Masse dissoziieren. Solche Komplexe sind also recht stabil bzw.
robust, und ihre Zentralionen sind maskiert:
Ag + + Cl− −→ AgClf est
LAgCl = 10−10
[Ag(N H3 )2 ]+ + Cl− ←− AgClf est,weiss + 2N H3
>
(33)
Fällung und Auflösung von Silberniederschlägen
aber
[Ag(N H3 )2 ]+ + I − −→ AgIf est,gelblich + 2N H3
LAgI = 10−16
F e2+ + S 2− −→ F eSf est,schwarz
[F e(CN )6 ]4− + S 2− ←− F eSf est,schwarz + 6CN −
(34)
In den Gln. 33 und 34 sind die Silber- bzw. die Eisenionen maskiert.
Der Komplex [F e(CN )6 ]4− reagiert aber in typischer Weise mit F e3+ −Ionen
zu Berliner Blau bzw. Turnbulls Blau.
[F e(CN )6 ]4− + F e3+ ←− F e4 [F e(CN )6 ]3,f est
tiefblau
Bei Ligandenaustauschreaktionen bildet sich immer der stabilere Komplex.
Beispiele:
[Cu(H2 O)4 ]2+ +4N H3
−→
[Cu(N H3 )4 ]2+ +4H2 O
hellblau
tiefblau
[Ag(N H3 )2 ]+
+2CN −
−→
97
[Ag(CN )2 ]−
+2N H3
5 KOMPLEXVERBINDUNGEN
>
5.2
Darstelung von “Berliner Blau”,
Komplexreaktionen
Gleichgewichte
In wässriger Lösung sind Metallionen von einer gewissen Zahl von Wassermolekülen in der ersten Koordinationssphäre umgeben. Darum wird für diese
z+
Ionen oft die Bezeichnung Maq
verwendet. Ist die Anzahl der koordinierten
H2 O-Moleküle bekannt, dann kann dies in der Formel explizit angegeben
werden. Beim Aluminiumaquaion sind sechs H2 O-Liganden vorhanden, so
dass [Al(H2 O)6 ]3+ geschrieben werden kann. Das Zentralion Al3+ hat also
die Koordinationszahl KZ=6 bzw CN=6.
Schon Alfred Werner (1866 - 1919) konnte zeigen, das die Koordinationszahl
sechs häufig von einer oktaedrischen Anordnung der Ligandatome begleitet wird. In Wasser können sogenannte Ligandaustauschreaktionen auftreten. Dabei werden koordinierte H2 O-Moleküle gegen andere Liganden ausgetauscht. Dieser Prozess tritt in der Regel schrittweise auf, wie es in der
folgenden Reihe von Gleichungen dargestellt ist von
[Al(H2 O)6 ]3+ + F − [Al(H2 O)5 F ]2+ + H2 O
über
[Al(H2 O)7−n Fn−1 ](4−n) + F − [Al(H2 O)6−n Fn ](3−n) + H2 O
n = 2, 3, 4, 5
zu
[Al(H2 O)F5 ]2− + F − [AlF6 ]3− + H2 O.
>
Maskierung eines Aluminiumsalzes mittels Fluorid
Bei F − -Zugabe werden also sukzessive sechs verschiedene Fluorokomplexe
gebildet. Es handelt sich dabei um Gleichgewichte mit den zugehörigen Stabilitätskonstanten Kn :
Kn =
[Al(H2 O)6−n Fn ]
[Al(H2 O)7−n Fn−1 ][F − ]
98
n = 1, 2, . . . , 6
5.2 Gleichgewichte
Tabelle 7: Komplexbildungskonstanten einiger Komplexe in Wasser
Komplex
lg β
Komplex
lg β
+
2+
[Ag(NH3 )2 ]
7
[Cu(NH3 )4 ]
13
3−
3−
[Ag(S2 O3 )2 ]
13
[Fe(CN)6 ]
44
−
4−
[Ag(CN)2 ]
21
[Fe(CN)6 ]
35
−
2−
[Au(CN)2 ]
37
[Ni(CN)4 ]
29
2+
2+
[Co(NH3 )6 ]
5
[Zn(NH3 )4 ]
10
3+
−
[Co(NH3 )6 ]
35
[Cu(CN)4 ]
27
(In der Literatur sind z.T. sehr unterschiedliche Werte angegeben.)
und den Brutto-Komplexbildungskonstanten βn :
n
Y
[Al(H2 O)6−n Fn ]
βn =
=
K
·
K
·
.
.
.
·
K
=
Ki
1
2
n
[Al(H2 O)6 ][F − ]n
i=1
(35)
In Gleichung 35 wurden die Ladungen weggelassen. Die Bruttokonstanten βn
können experimentell ermittelt werden.
Je grösser die Komplexbildungskonstanten sind, um so
beständiger ist ein Komplex.
Das Einstellen der Gleichgewichte kann bei labilen Komplexen sehr rasch
(t < 1s), bei robusten, inerten Komplexen sehr langsam (t > 1s, Minuten,
Tage, u.m.) erfolgen. Labile Komplexe eignen sich besser für Gleichgewichtsstudien, robuste hingegen für präparative Arbeiten. Für die Katalyse mit
Übergangsmetallionen werden labile Komplexgleichgewichte benötigt.
Auch für Komplexe können quantitative stöchiometrische Beziehungen aufgestellt werden. Die Beziehungen für Aluminiumkomplexe, die durch Mischen
einer Al(ClO4 )3 mit einer HF −Lösung (teilweise durch starke Base neutralisiert) erhalten werden, sind wie folgt zu formulieren:
3+
[Al ]t =
6
X
3−n
[{Al(H2 O)6−n Fn }
3+
] = [{Al(H2 O)6 } ] · (1 +
n=0
6
X
βn [F − ]n )
n=1
(36)
−
−
[F ]t = [F ] + [HF ] +
6
X
n=1
99
n · [{Al(H2 O)6−n Fn }3−n ]
5 KOMPLEXVERBINDUNGEN
[OH − ]t = [F − ] +
6
X
n · [{Al(H2 O)6−n Fn }3−n ] + [OH − ] − [H + ]
n=1
(Wegen der Koinzidenz von Konzentrations- und Komplexbezeichnungen werden hier die Komplexe in { } angegeben). Die zwei letzten Gleichungen lassen
sich unter Berücksichtigung von Gl. 36 und von Kw umformen zu:
[F − ]t = [F − ] · (1 + Ks−1 [H + ]) + [{Al(H2 O)6 }3+ ] · (1 +
6
X
nβn [F − ]n ) (37)
n=1
−
−
3+
[OH ]t = [F ] + [{Al(H2 O)6 } ] · (1 +
6
X
nβn [F − ]n ) + Kw [H + ]−1 − [H + ].
n=1
(38)
Man erhält also ein System von drei Gleichungen 36, 37 und 38 mit den drei
Unbekannten [{Al(H2 O)6 }3+ ], [F − ] und [H + ].
Für bekannte Konzentrationen von [Al3+ ]t , [F − ]t und [OH − ]t kann man die
Gleichgewichtskonzentrationen aller Spezies ermitteln, sofern die Konstanten
βn (n = 1,2,...,6), Ks und Kw bekannt sind:
Ks =
5.3
[H + ][F − ]
.
[HF ]
Liganden
In Wasser können Liganden für die Metallkomplexbildung eingesetzt werden,
die in der Lage sind, die am Metallatom koordinierten H2 O−Moleküle zu ersetzen.
Man kennt sehr viele solcher Liganden, wie z.B. die einfach koordinierenden,
einzähnigen
F − , Cl− , Br− , I − , OH − , CO32− , N H3 , S 2− , u.a.
100
5.3 Liganden
.
!
"
#
$
%
&
'
(
)
*
+
,
0
1
2
/
3
4
>
5
6
7
8
Eisenkomplexe
die zweizähnigen
Ethylendiamin, Oxalatanion, Glycinat, Mercaptoacetat, Acetylacetonat, Iminodiacetat und 2,2’Dipyridyl
F
G
<
>
?
@
C
D
E
A
(
)
*
%
&
'
=
!
"
#
$
B
H
+
,
-
.
/
0
1
2
3
4
5
6
7
8
9
:
;
J
x
M
N
O
P
Q
R
S
q
o
s
]
^
_
`
a
b
c
d
e
f
g
h
i
j
k
l
m
101
p
t
z
\
L
Y
r
[
K
y
n
X
Z
I
{
u
|
}
~
v
w
T
U
V
W
5 KOMPLEXVERBINDUNGEN
>
Ni-Komplexe
sowie die mehrzähnigen
Diethylendiamin (dreizähn.), Nitriloacetat (vierzähn.), Bis-(2,2’Dipyridyl)
(vierzähn.), Anion der Ethylendiamintriessigsäure (fünfzähn.) und Ethylendiamintetraacetat (EDTA4− , sechszähn.).
>
Komplexierung
102
5.3 Liganden
!
"
#
$
%
O
P
Q
R
S
T
U
=
V
W
>
?
X
Y
Z
@
[
A
\
]
^
_
`
B
C
<
D
E
F
G
H
I
J
K
L
M
N
&
õ
æ
ç
'
ö
(
)
÷
ø
*
+
ù
,
ú
-
.
û
ü
/
ý
0
þ
1
2
3
ÿ
4
5
6
7
8
9
:
;
a
å
é
Û
Ü
Ý
Þ
ß
à
á
ê
ð
"
#
$
%
&
'
(
ñ
g
h
i
¡
j
¢
í
î
ô
m
¤
n
o
¥
p
¦
q
§
r
s
t
¨
u
©
v
ª
«
w
¬
x
­
y
z
®
{
|
¯
~
±
Æ
Ç
²
È
É
³
´
Ê
Ë
µ
Ì
¶
Í
·
Î
Ï
¸
Ð
¹
Ñ
º
Ò
»
Ó
¼
Ô
½
¾
Õ
°
)
l
ó
k
£
}
ì
!
f
ë
ò
e
â
*
d
ï
ä
c
è
ã
b
¿
Ö
À
×
Á
Â
Ø
Ã
Ù
Ä
Å
Ú
Abbildung 28: Mehrzähnige Liganden
Die Pfeile deuten die freien Elektronenpaare an, die die Koordinationsstellen
besetzen. Weitere Beispiele sind sogenannte makrozyklische Liganden,
von denen hier nur
18-Krone-6, Cryptand C222 sowie C221 (jeweils sechszähn.) genannt seien,
die in Wasser stabile Komplexe mit einigen Alkali- und Erdalkalimetallenionen bilden.
103
5 KOMPLEXVERBINDUNGEN
'
!
"
(
+
,
-
.
)
*
#
/
F
0
G
1
2
H
I
3
J
4
K
5
L
6
M
7
8
N
9
O
P
:
;
Q
<
R
S
=
T
>
U
?
@
V
A
W
B
X
C
Y
D
Z
[
$
%
&
E
\
]
^
_
`
a
b
c
Abbildung 29: Makrozähnige Liganden
Ferner sind in lebenden Organismen Metallkomplexe mit sehr komplizierten
Strukturen vorhanden, die als (Enzyme) wirken. Als Beispiel sei hier die
Carboxypeptidase aufgeführt, ein Zinkkomplex der Summenformel
C1561 H2352 O465 N465 S5 Zn (M = 34472amu)
bestehend aus 307 Aminosäuren. Der Zn-Gehalt beträgt 0,19 %. Das Zn2+ −Ion
ist mit zwei N-Atomen aus Histidin (69 und 196), einem O-Atom aus Glutaminsäure
72 und einem O-Atom eines H2 O-Moleküls koordiniert.
104
5.3 Liganden
Tabelle 8: Zusammensetzung, Name und Kurzbezeichnung einiger gebräuchlicher Liganden
1
2
3
4
5
6
H
I
J
K
L
M
N
O
P
Q
R
S
7
8
9
T
F
V
:
U
;
W
<
=
X
!
>
Y
Z
?
"
#
[
@
\
A
$
%
]
B
^
C
_
&
D
'
(
)
*
+
,
-
.
/
0
E
`
a
b
c
d
e
G
g
h
i
j
k
l
s
f
m
n
o
p
t
¢
£
¤
¥
¦
Î
Ï
Ð
Ñ
Ò
Ó
Ô
Õ
Ö
ç
è
é
ê
ë
ì
í
î
ï
ð
ñ
x
y
z
{
|
}
~
©
ª
«
¬
¯
Ø
ò
ó
ô
õ
ö
°
±
²
³
´
µ
¶
·
¸
¹
º
»
¼
½
¾
¿
À
Á
Â
Ã
Ä
Å
Æ
Ç
÷
ø
ù
ú
Ù
û
Ú
)
*
+
,
-
.
/
0
1
2
3
4
5
6
7
8
9
:
ü
Û
ý
Ü
þ
Ý
Þ
ÿ
ß
à
á
â
ã
ä
å
æ
;
"
#
$
%
&
'
È
É
K
<
=
>
?
(
L
G
D
A
_
t
v
a
I
M
N
O
P
Q
R
S
T
U
V
W
X
Y
Z
F
u
`
H
E
B
b
w
c
x
d
y
e
z
f
{
g
|
h
}
i
~
j
k
l
Ë
C
J
Ê
­
×
!
¨
Í
¡
Ì
w
§
®
v
r
u
q
m
n
o
p
q
r
s
105
¡
¢
£
¤
¥
¦
§
¨
©
ª
[
\
]
^
@
5 KOMPLEXVERBINDUNGEN
Tabelle 9: Strukturformeln einiger komplizierterer Liganden
%
&
'
(
)
!
"
#
$
*
-
.
/
0
1
2
+
,
a ,a
3
@
4
106
A
5
B
C
6
D
7
E
8
9
:
;
<
=
>
?
5.4 Nomenklatur von Komplexverbindungen
5.4
Nomenklatur von Komplexverbindungen
Für einen Komplex wird zuerst der Name der Liganden und dann der des
Zentralatoms angegeben. Anionische Liganden werden durch Anhängen eines
o an den Stamm des Ionennamens gekennzeichnet:
Tabelle 10: Beispiele für die
F−
fluoro
−
Cl
chloro
−
OH
hydroxo
−
CN
cyano
Bezeichnung von Liganden
H2 O aqua
NH3 ammin
CO carbonyl
Die Anzahl der Liganden wird mit vorangestellten griechischen Zahlen mono,
di, tri, tetra, penta, hexa bezeichnet. Die Oxidationszahl des Zentralatoms
wird am Ende des Namens mit in Klammern gesetzten römischen Ziffern
gekennzeichnet.
Di
ammin
Anzahl der Ligand
Liganden
silber
ZentralTeilchen
kationischer Komplex
(I)
Oxidationszahl
chlorid
Anion
Anion
Abbildung 30: Schema für kationische Komplexe am Beispiel von
[Ag(NH3 )2 ]Cl.
Weitere Beispiele
[Cu(NH3 )4 ]2+ Tetraamminkupfer(II)
[Ni(CO)4 ]
Tetracarbonylnickel(0)
[Cr(H2 O)6 ]Cl3 Hexaaquachrom(III)-chlorid
(Die Zahl de Cl-Atome braucht nicht bezeichnet zu weren, sie ergibt sich
aus der Ladung des Komplexes.)
In negativ geladenen Komplexen endet der Name des Zentralatoms auf -at.
Erwird in einigen Fällen vom lateinischen Namen abgeleitet.
107
5 KOMPLEXVERBINDUNGEN
Natrium
di
cyano
argent
at
Kation
Anzahl der
Liganden
Ligand
Zentralteilchen
at
(I)
Oxidationszahl
anionischer Komplex
Kation
Abbildung 31: Schema für anionische Komplexe am Beispiel von
Na[Ag(CN)2 ].
[CoCl4 ]2−
Tetrachlorocobaltat(II)
−
Weitere Beispiele: [Al(OH)4 ]
Tetrahydroxoaluminat(III)
K4 [Fe(CN)6 ] Kalium-hexacyanoferrat(II)
(Die Zahl der K-Atome wird nicht bezeichnet. Sie ergibt sich aus der
Ladung – 4 des Komplexes).
Bei verschiedenen Liganden ist die Reihenfolge alphabetisch.
Beispiel:
[Cr(H2 O)4 Cl2 ]+
5.5
Tetraaquadichlorochrom(III)
Zusammensetzung und Struktur von Komplexen
Verbindungen wie CoCl3 (N H3 )6 , CoCl3 (N H3 )5 oder P tCl4 (N H3 )3 , die schon
vor 100 Jahren bekannt waren, konnten nach der damals geltenden Valenzlehre nicht verstanden werden und wurden darum Verbindungen höherer
Ordnung genannt. Es war z.B. schon bekannt, dass es in Lösungen von
Chlorokomplexen nicht immer möglich war, alle enthaltenen Cl− −Ionen mit
AgN O3 −Lösung zu bestimmen. So werden bei CoCl3 (N H3 )6 drei, bei CoCl3 (N H3 )5
nur zwei und bei P tCl4 (N H3 )2 kein Chloridion bestimmt. Diese Befunde
konnten von A. Werner durch Einführung von Koordinationszuordnungen
erklärt werden.
108
5.5 Zusammensetzung und Struktur von Komplexen
5
6
7
@
A
r
3
4
;
<
s
t
u
v
w
x
y
z
{
|
}
~
=
B
C
D
E
F
G
H
I
J
K
L
8
9
O
M
:
P
?
W
X
>
!
"
#
$
%
&
N
Q
T
U
V
Y
Z
[
\
]
^
_
`
a
b
c
'
(
R
S
f
d
*
+
,
-
.
/
0
¡
¢
g
e
j
k
l
m
n
o
p
q
)
1
2
h
i
£
¤
¥
¦
In den drei angegebenen Beispielen ist die Koordinationszahl immer sechs.
III
IV
Bei robusten Komplexen (Co −, P t −) werden Liganden der ersten Koordinationssphäre nur sehr langsam ersetzt, und darum können bei der Titration
mit Ag + nicht alle Cl− quantitativ erfasst werden.
Die Untersuchungen von Werner haben gezeigt, dass besonders bei Verwendung von einzähnigen Liganden eine grosse Vielfalt von Komplexen gefunden werden kann. Dabei tritt die Koordinationszahl sechs sehr häufig, aber
nicht aussschliesslich auf. Für viele Ionen gibt es bei wechselnden Liganden
Komplexe mit unterschiedlicher Koordinationszahl. Für N i2+ sind oktaedrische, tetraedrische und quadratisch-planare Komplexe bekannt. Einige Ionen
bevorzugen eine ganz bestimmte Koordinationszahl und Koordinationsgeometrie.
109
5 KOMPLEXVERBINDUNGEN
Tabelle 11: Räumliche Anordnung der Liganden
5
6
7
8
9
:
;
<
=
>
?
@
A
B
C
D
E
F
G
H
I
J
K
L
M
N
O
P
Q
R
S
T
U
V
W
X
Y
Z
[
\
]
^
_
`
a
b
c
d
e
f
g
h
i
j
k
l
m
n
o
p
q
r
s
t
u
v
w
x
y
z
{
|
}
~
¡
¢
£
¤
¥
¦
§
¨
©
ª
«
¬
­
®
¯
°
±
²
³
´
µ
¶
·
¸
¹
º
»
¼
½
¾
¿
À
Á
Â
Ã
Ä
Å
Æ
Ç
È
É
Ê
Ë
Ì
Í
Î
Ï
Ð
Ñ
Ò
Ó
Ô
Õ
Ö
×
Ø
Ù
Ú
Û
Ü
Ý
Þ
ß
à
á
â
ã
ä
å
æ
ç
è
é
!
"
#
$
%
&
'
(
ê
ë
ì
í
î
ï
ð
ñ
ò
ó
ô
õ
ö
÷
ø
ù
ú
û
ü
)
ý
þ
#
$
H
I
ÿ
%
&
'
(
)
*
+
,
-
.
/
0
1
2
3
4
5
6
7
8
9
:
;
<
=
>
?
@
A
B
C
D
E
!
F
"
G
o
*
>
+
,
-
.
/
0
1
2
3
p
J
q
K
r
L
s
M
t
u
N
v
O
P
Q
R
S
T
U
V
W
X
Y
Z
[
\
]
^
_
`
a
b
c
d
e
f
g
h
i
j
k
l
m
n
w
4
Kupfer-Cadmium-Trennung
Die Koordinationszahl drei tritt sehr selten auf, Beispiele sind aber bekannt:
[HgI3 ]−
trigonal planar
[SnCl3 ]−
trigonal pyramidal
[P t(P (C6 H5 )3 )3 ]−
trigonal planar
110
5.5 Zusammensetzung und Struktur von Komplexen
9
:
n
o
p
j
;
A
B
l
=
)
*
+
,
-
.
/
0
1
2
3
4
!
5
?
6
C
"
#
7
$
%
&
'
(
J
K
L
M
N
O
P
D
Q
E
R
F
G
S
T
H
U
V
b
c
d
e
f
g
h
I
W
t
X
Y
Z
[
\
]
^
_
`
i
Ù
$
ë
ì
í
î
ï
ð
ñ
ä
ò
å
æ
ó
Ü
z
{
|
}
~
Ì
Í
Î
Ï
¤
¥
¦
ç
ô
è
õ
!
&
ö
÷
)
ø
é
ù
ú
û
ü
ý
þ
ÿ
§
¨
*
+
,
-
'
.
¡
¢
©
ª
«
"
(
/
0
1
2
3
4
¬
­
®
¯
°
±
²
³
´
µ
¶
·
6
O
y
â
5
x
%
w
Þ
Û
á
ê
v
Ú
ã
u
£
Ý
Ø
s
à
#
×
r
m
@
8
a
ß
>
q
k
<
7
P
8
Q
9
R
:
S
T
;
U
<
=
>
?
@
A
B
V
C
D
E
F
G
H
I
J
K
L
M
N
¸
¹
Ð
º
»
Ñ
¼
Ò
Ó
½
¾
Ô
Õ
¿
À
Á
Â
Ã
Ä
Å
Æ
Ç
È
É
Ê
Ë
Ö
Abbildung 32: Beispiele für Komplexe mit einzähnigen Liganden und verschiedener Koordinationszahl
111
5 KOMPLEXVERBINDUNGEN
$
&
(
)
%
'
!
"
#
*
+
,
-
.
/
0
1
2
3
4
5
Abbildung 33: Beispiele für Chelatkomplexe
5.6
Isomerie von Komplexen
Treten zwei chemische Spezies mit unterschiedlicher räumlicher Struktur aber
mit derselben Summenformel und Ladung auf, so spricht man von Isomerie.
Die Isomerie ist in den Komplexverbindungen ziemlich weit verbreitet, u.a.
deshalb weil gewisse Liganden nicht nur in der ersten Koordinationssphäre
auftreten können.
5.6.1
Konformationsisomerie
+4
Im Falle der Komplexe von P t mit N H3 und Cl− sowie K + als Gegenion
kennt man z. B. die ganze Reihe:
[P t(N H3 )6 ]Cl4 , [P t(N H3 )5 Cl]Cl3 , [P t(N H3 )4 Cl2 ]Cl2 , [P t(N H3 )3 Cl3 ]Cl,
[P t(N H3 )2 Cl4 ], K[P t(N H3 )Cl5 ] und K2 [P tCl6 ].
Dabei sind für den an der dritten und an der fünften Stelle stehenden Komplex je zwei Formen (Isomere, cis und trans - s. Abb. 34),
112
5.6 Isomerie von Komplexen
&
"
#
%
$
'
(
)
!
*
+
,
-
.
/
0
1
2
3
4
5
Abbildung 34: cis-trans Isomerie
sowie für den an der vierten Stelle stehenden Komplex ebenfalls zwei Isomere
(facial und meridional - s. Abb. 35) möglich.
Beispiel [Rh(H2 O)3 Cl3 ]
$
%
&
'
)
*
+
,
(
#
"
-
.
/
!
0
1
Abbildung 35: Facial- und Meridionalisomerie
Verhalten sich zwei Isomere wie Bild und Spiegelbild so spricht man von
Spiegelbild– bzw. optischer Isomerie (Abb. 36).
113
5 KOMPLEXVERBINDUNGEN
!
"
#
$
%
&
'
(
Abbildung 36: Spiegelisomerie
Optische Isomere oder auch Enatiomere zeigen identische physikalische Eigenschaften mit Ausnahme einer Drehung von linear polarisiertem Licht.
!
"
#
Abbildung 37: Optische Isomerie
Sie drehen die Schwingungsebene des polarisierten Lichtes um den selben
Betrag aber in umgekehrter Richtung (optische Aktivität).
Wird die Polarisationsebene des Lichts im Uhrzeigersinn gedreht, so bezeichnet man das Enatiomer als rechtsdrehend und kennzeichnet es durch das
Symbol (+) vor der Formelbezeichnung, z.B. (+) − [Co(en)3 ]3+ . Bei Drehung gegen den Uhrzeigersinn heisst das Enatiomer linksdrehend und wird
entsprechend gekennzeichnet, z.B. als (−) − [Co(en)3 ]3+ .
Ein Enantiomerengemisch von 1:1 nennt man Racemat bzw. racemisches
Gemisch.
Die drei hier vorliegenden Isomerieformen fasst man unter dem Begriff Stereoisomerien zusammen.
114
5.6 Isomerie von Komplexen
Abbildung 38: Drehung der Polarisationsebene einer gelösten Substanz in
einem neutralem Medium
Die Polarisationsebene wird im chiralen Medium zum verdrehten Band. Das
Ausmass der Drehung ist proportional der Konzentration c der Lösung und
der Schichtdicke l. Ausmass und Vorzeichen hängen ferner ab von der Art des
Lösungsmittels, der Temperatur T und der Wellenlänge λ des verwendeten
Lichts. Eine Substanz wird durch einen spezifischen Drehwert α charakterisiert:
[α]Tλ =
5.6.2
αλT gemessen
l[dm] · c[g/ml]
Ionen– bzw. Ionisationsisomerie
Verschiedene Ionen können als Liganden im Komplex oder als Gegenionen
gebunden sein.
[P t(N H3 )4 Cl2 ]Br2 und [P t(N H3 )4 Br2 ]Cl2
oder
[Co(N H3 )5 Cl]SO4 und [Co(N H3 )5 SO4 ]Cl.
Die Hydrat– bzw. Hydratationsisomerie ist eine spezielle Form:
[Cr(H2 O)6 ]Cl3 und [Cr(H2 O)5 Cl]Cl2 (H2 O)
und
[Cr(H2 O)4 Cl2 ]Cl(H2 O)2 .
5.6.3
Koordinationsisomerie
Diese Variation kann auftreten, wenn Anionen und Kationen in Form von
Komplexen vorliegen:
115
5 KOMPLEXVERBINDUNGEN
[P t(N H3 )4 ][P tCl6 ] und [P t(N H3 )4 Cl2 ][P tCl4 ]
oder
[Cu(N H3 )4 ][P tCl4 ] und [P t(N H3 )4 ][CuCl4 ].
5.6.4
Bindungsisomerie
Sie tritt dann auf, wenn mehrkernige Liganden durch verschiedene Atome an das Zentrum gebunden sind. Bekannt hierfür sind die CN − − und
N O2− −Anionen:
Me − C ≡ N|
Cyano-Komplex
OL
Me − N H HH
O
H
Nitro-Komplex
M e − N ≡ C|
Isocyano-Komplex
Me − O − N = O
Nitrito-Komplex
Abbildung 39: Beispiele für die Bindungsisomerie
[Co(N H3 )5 N O2 ]Cl2 und [Co(N H3 )5 ON O]Cl2
5.7
Präparative Arbeiten mit robusten Komplexen
III
II
Bei der Herstellung von Co −Komplexen wird oft der Umweg über Co
−Verbindungen gewählt. Man profitiert dabei von der Labilität der letzteren, wodurch Ligandenaustauschreaktionen praktisch momentan verlaufen.
III
Den gewünschten Co −Komplex erhält man anschliessend durch Oxidation
II
des Co −Komplexes. Durch ähnliche Verfahren war es A. Werner in mehr
als zwanzig Jahren Arbeit möglich gewesen, eine sehr grosse Zahl von KomIII III
IV
plexen von Co, Cr und P t zu synthetisieren. Damit konnte er seine Theorie
bestätigen. Besonders hervorzuheben ist die Trennung der optischen Antipoden (Enatiomeren) von [Co(en)2 N H3 Br]Cl2 .
>
Cobalt(II)-Komplex
116
5.8 Bestimmung der Stabilitätskonstanten
5.8
Bestimmung der Stabilitätskonstanten
Eine wichtige Methode zur Bestimmung der Stabilitätskonstanten besteht
darin, für Lösungen bekannter Zusammensetzung (z.B. [Al3+ ]t , [F − ]t oder
[OH − ]t ) den pH-Wert zu messen (vgl. hierzu Gln. 36, 37 und 38).
Das ermöglicht die Berechnung von [H + ], die mit Hilfe einer Kombination
der Gln. 37 und 38 die Gleichgewichtskonzentration [F − ] liefert. Diese ergibt
+ ][F − ]
mit [H + ] und Ks die Konzentration [HF] ( Ks = [H[HF
).
]
Somit kann man für beliebige
P6 Gesamtkonzentrationen die am Aluminium
gebundene Menge Fluorid
n=1 n · [AlFn ] und den Komplexbildungsgrad
P6
[AlFn ]
n̄ =
n=1 n [Al3+ ]t erhalten. Für die Ermittlung der Bruttostabilitätskonstanten βn wird Gl. 39 verwendet, die zu Systemen linearer Gleichungen in
den gesuchten βn führt.
6
X
(n̄ − n) · βn [F − ]n + n̄ = 0.
(39)
n=1
Für eine genaue Ermittlung aller βn werden ([F − ], n̄)-Wertepaare im ganzen
n̄−Bereich 0 ≤ n̄ ≤ 6 benötigt. Die sich im Wasser abspielenden Gleichgewichte sind gekoppelt. Deshalb erlaubt die Messung nur einer Konzentration die Berechnung der Konzentrationen aller vorhandenen Spezies. Somit
ist die Ermittlung von Stabilitätskonstanten verschiedenster Metallkomplexe möglich, wenn man die erforderlichen Titrationskurven aufgenommen hat.
In der folgenden Abbildung sind die Titrationskurven von 100 ml
1. einer reinen Fluorwasserstoffsäurelösung (6 · 10−2 M) und
3+
(1 · 10−2 M) mit starker Base (1 M N aOH)
2. in Anwesenheit von Alaq
angegeben.
117
5 KOMPLEXVERBINDUNGEN
Abbildung 40: Titrationskurve von HF allein ([F]t = 6·10−2 M) und mit Al3+
([Al]t :[F]t = 1:6)
Wie man leicht erkennt, ist die Lösung in Anwesenheit von Metallionen infolge Komplexbildung deutlich saurer.
Ähnliche Titrationskurven für 100 ml protoniertes Glycin H2 L+ (5·10−3 ), allein und in Anwesenheit von Cu2+ bzw. N i2+ , bei verschiedenen Metall/LigandMolverhältnissen mit 0.1 M KOH sind in den nächsten zwei Abbildungen
zu finden.
118
5.8 Bestimmung der Stabilitätskonstanten
Abbildung 41: Titrationskurve von Glycin allein ([L]t = 5·10−3 M) und mit
verschiedenen Mengen Cu ([Cu]t :[L]t = 1:1; 1:2; 1:3)
Sie zeigen eindeutig Im ersten Fall ist ganz eindeutig die Bildung von zwei
Komplexen, nämlich CuL+ und CuL2 festzustellen.
Im zweiten Fall treten drei Komplexe auf, nämlich N iL+ , N iL2 und N iL3− .
119
5 KOMPLEXVERBINDUNGEN
Abbildung 42: Titrationskurve von Glycin allein ([L]t = 5·10−3 M) und mit
verschiedenen Mengen Ni2+ ([Ni]t :[L]t = 1:1; 1:2; 1:3)
Man erkennt dies daran, dass beim entsprechenden [M ]t /[L]t −Verhältnis eine pH-Erniedrigung des Puffergebietes HL/L− als Folge der Komplexbildung
auftritt. Die Möglichkeit, aus den erhaltenen Titrationskurven mit sehr kleinem Aufwand eine sinnvolle Angabe der gebildeten Komplexe zu erhalten,
ist eine grosse Hilfe bei der Ermittlung der Komplexbildungskonstanten.
Für Cd2+ −Ionen in Cyanid-haltiger Lösung findet man sogar vier Einzelgleichgewichte:
Cd2+ + CN −
[Cd(CN )]+ + CN −
[Cd(CN )2 ] + CN −
[Cd(CN )3 ]− + CN −
[Cd(CN )]+
[Cd(CN )2 ]
[Cd(CN )3 ]−
[Cd(CN )4 ]2−
120
K1
K2
K3
K4
= 105.5
= 105.2
= 104.6
= 103.5 β4 = 1018.8
5.9 Komplexometrische Titration
1,0
0
12
0,5
Stoffmengenanteil
0
4
3
lg cCN −
Abbildung 43: Auftragung der Gleichgewichtskonzentration von Cd2+ und
der Komplexe [Cd(CN)]+ , [Cd(CN)2 ], [Cd(CN)3 ]− und [Cd(CN)4 ]2− in
abhängigkeit von der CN− Konzentration. Die Ziffern an den Kurven geben
die Anzahl der Liganden an (0 bedeutet Cd2+ , 4 bedeutet [Cd(CN)4 ]2− ). Mit
steigender CN− -Konzentration wird zunächst der Komplex [Cd(CN)]+ gebildet, dann [Cd(CN)2 ] usw. Die Konzentrationen der Komplexe [Cd(CN)]+ ,
[Cd(CN)2 ] und [Cd(CN)3 ]− durchlaufen ein Maximum. auf ihre Kosten bildet
sich [Cd(CN)4 ]2− ), der schliesslich der allein vorhandene Komplex ist.
Die hier angegeben, sehr einfache Beschreibung der Bildung von einkernigen
Komplexen M Ln (n = 1, ..., n) ist oft deutlich erschwert, wenn Teilchen
Mq Hp Ln mit q > 1 und p ≥ 1 auftreten (die elektrische Ladung ist nicht
angegeben).
Dann gilt z.B. die Gleichung 39 nicht mehr.
Neben der pH-Methode, existieren noch weitere Verfahren, mit denen auch
andere Grössen experimentell erfasst werden können wie [M z+ ], [M L], [L], ...
(die elektrischen Ladungen der Teilchen werden oft weggelassen; L steht als
Abkürzung für Ligand). Über die Anwendung von EMK-Messungen wurde
im letzten Kapitel berichtet.
5.9
Komplexometrische Titration
Einzähnige Liganden bilden mit wenigen Ausnahmen schwache, labile Komplexe mit kleinen Komplexbildungskonstanten. Dagegen bilden mehrzähnige
Liganden (Chelatliganden) stabilere Komplexe. Diesen Befund nennt man
Chelateffekt, welcher sich auf entropische Gründe zurückführen lässt.
N i2+ + 6N H3 [N i(N H3 )6 ]2+
N i2+ + 3en [N i(en)3 ]2+
121
β ' 109
β ' 1018
5 KOMPLEXVERBINDUNGEN
>
Ni(II)-Komplexbildungsgleichgewichte
Da Metallionen sehr oft die Koordinationszahl sechs aufweisen, ist EDTA mit
sechs Ligandatomen, die fünf Chelat-Fünfringe bilden, ein günstiger Komplexbildner. Die mit EDTA erhaltenen Stabilitätskonstanten zeigen, dass
bereits mit Erdalkalimetallionen die Werte zwischen 108 und 1011 liegen,
während zweiwertige Übergangsmetallionen, wie auch dreiwertige Lanthanide, Werte von mehr als 1014 erreichen. In den meisten Fällen zeigt es sich, dass
EDTA eine günstige Verbindung für die volumetrische Bestimmung von
Metallionen ist. Bei dieser Methode wird ein Metallion mit einer EDTALösung titriert, wobei sich folgendes Gleichgewicht einstellt:
M z+ + H2 EDT A2− M EDT A(4−z)− + 2H +
Ein Puffersystem sorgt für die Aufnahme der freigesetzten H + −Ionen. Bei
einer genügend grossen Stabilitätskonstanten ist dann zu erwarten, dass am
Endpunkt eine grosse Änderung der M z+− Konzentration stattfindet. Diese
wird mit einem angezeigt, dessen Farbe sich ändert (Farbumschlag). Der Metallindikator Hi F I bildet mit M z+ −Ionen einen M F (z−i)+ −Komplex, dessen
Farbe sich wesentlich von der des protonierten Indikators Hi F I bei gleichem
pH-Wert unterscheidet. Der Komplex M F (z−i)+ ist unter den verwendeten
Bedingungen weniger stabil als M EDT A(4−z)− , womit am Endpunkt die folgende Reaktion eintritt:
H2 EDT A2− + M F I (z−i)+ −→ M EDT A(4−z)− + Hi F I
Beispiele sind:
M z+ − F I
Zn2+ − ErioT
Hi F I
rot
Ca2+ − M urexid
rot
Arbeitspunkt M F I (z−i)
pH = 10
blau
pH = 12
violett
Da Metallindikatoren auch pH-Indikatoren sind, müssen die pH-Bedingungen
strikt eingehalten werden. Die verwendeten Puffersysteme enthalten oft Liganden (z.B. N H3 ), die durch teilweise Komplexbildung die Hydrolyse von
Metallionen und damit die Bildung von schwerlöslichen Hydroxiden verhindern. EDT A4− ist eine Base, die bei pH ' 10.2 ein Proton, bei pH ' 6.2 das
zweite, bei pH ' 2.6 das dritte und bei pH ' 2 das vierte Proton aufnimmt:
H4 EDT A H3 EDT A− + H +
122
pK = 2.0
5.10 Beeinflussung des Standardreduktionspotenzials durch
Komplexbildung
H3 EDT A− H2 EDT A2− + H +
pK = 2.67
H2 EDT A− HEDT A3− + H +
pK = 6.16
HEDT A− EDT A4− + H +
pK = 10.26
Damit nimmt die Konzentration an EDT A4− durch Verringerung des pHWertes stark ab: [EDT A]t = [EDT A4− ] + [HEDT A3− ] + [H2 EDT A2− ]
+[H3 EDT A3− ] + [H4 EDT A]
[EDT A]t = [EDT A4− ](1 + [H + ]1010.26 + [H + ]2 1016.42
+[H + ]3 1019,09 + [H + ]4 1021.09
[EDT A]t = αH · [EDT A4− ]
pH
11
10
9
lg αH
0.07 0.45 1.3
8
7
6
5
4
2.3 3.3 4.7 6.5 8.4
3
10.6
Bei pH = 4 ist die Konzentration von EDT A4− durch Protonierung 8.4
Grössenordnungen kleiner als bei pH = 11. Bei einem pH-Wert von vier findet
also bei Ca2+ (lgK1 = 10.7) schon eine teilweise Dissoziation des Komplexes
statt, während bei Zn2+ (lgK1 = 16.4) eine komplexometrische Titration
immer noch zu korrekten Ergebnissen führt, sofern ein geeigneter Indikator
verwendet wird. Zn2+ titriert man oft bei pH = 5 komplexometrisch, wobei
Xylenolorange als Indikator verwendet wird.
5.10
Beeinflussung des Standardreduktionspotenzials
durch Komplexbildung
Die Standardreduktionspotenziale werden durch die Anwesenheit von Komplexbildnern in der Messlösung stark verändert. Das Potenzial einer Metallelektrode
M z+ + 2e− −→ Ms
E = E◦ −
1
RT
ln
2F
[M z+ ]
123
5 KOMPLEXVERBINDUNGEN
wird negativer durch die Abnahme der Konzentration von [M z+ ] durch die
Komplexbildung.
>
Das Daniell Element,
Redoxsystem Co(III) / Co(II)
Beispiel:
AlF63− + 3e− −→ Als + 6F −
E◦ = −2.07V
(E◦Al3+ = −1.66V)
[Zn(N H3 )4 ]2+ + 2e− −→ Zns + 4N H3
E◦ = −1.04V
(E◦Zn2+ = −0.763V)
[Zn(CN )4 ]2− + 2e− −→ Zns + 4CN −
E◦ = −1.26V
(E◦Zn2+ = −0.763V)
aq
aq
aq
Die E ◦ −Werte zur Berechnung der Bruttokomplexbildungskonstanten benutzt werden:
E◦ =
3·0.41
β6 (AlF6 3− ) = 10 0.0592 = 1020.8
0.0592
lgK
n
9.36
β4 (Zn(N H3 )2+
4 ) = 10
16.8
β4 (Zn(CN )2−
4 ) = 10
Im Falle von Redoxpaaren zwischen Ionen verschiedener Oxidationsstufen
können gegenüber dem Fall der Aquaionen E ◦ -Werte erwartet werden, die
positiver oder negativer sind.
Das hängt davon ab, ob die reduzierte oder die oxidierte Form stärkere Komplexe bildet.
Ox + ze− −→ Red
E = E◦ −
RT [Red]
ln
2F
[Ox]
Beispiele:
F e(phen)33+ + e− −→ F e(phen)2+
3
E◦ = 1.10V
F e(EDT A)− + e− −→ F e(EDT A)2− E◦ = 0.12V
124
5.11 Doppelsalze
5.11
Doppelsalze
Doppelsalze wie KAl(SO4 )2 (H2 O)12 oder KM gCl3 (H2 O)6 müssen aufgrund
ihrer Eigenschaften von den Komplexen unterschieden werden.
Solche Salze dissoziieren nämlich in wässriger Lösung in die einfachen Einzelionen, und es entsteht kein beständiger Sulfato– bzw. Chlorokomplex.
125
6 FÄLLUNGSREAKTIONEN
6
Fällungsreaktionen
Die Zustandsform von Stoffen (Aggregatzustand, Reaktivität, usw.) wird
durch die Gibbsche Freie Energie bestimmt, wenn sich Gleichgewichte einstellen können (keine kinetische Hinderung).
Feste Stoffe lösen sich auf, wenn die in ihnen enthaltenen Teilchen (Ionen,
Moleküle) in Lösung einen energetisch niedrigeren Zustand erreichen können.
Das kann z.B. durch Bindungskräfte zwischen den Stoffteilchen und den
Lösungsmittelteilchen oder durch (entropische) Verteilungseffekte, i.d.R. durch
beides, bewirkt werden.
Umgekehrt fällt ein Feststoff aus einer Lösung aus, wenn der feste Zustand
denjenigen der niedrigsten Gesamtenergie liefert.
In der Realität treten zwischen den idealen Grenzfällen, fest und komplett
gelöst, immer Zwischenzustände auf.
6.1
Löslichkeitsprodukt und Löslichkeit von Festkörpern
Das Gleichgewicht zwischen einem Feststoff und seinen Ionen in Lösung kann
durch das Löslichkeitsprodukt KL bzw. LAB charakterisiert werden.
Ist eine schwerlösliche Verbindung auch in Lösung vorhanden, so wird dies
durch Angabe der entsprechenden Konstanten berücksichtigt.
Für AgCl findet man folgendes Gleichgewicht:
−
−
+
+
]
mit dem Löslichkeitsprodukt: KL = [Agaq
][Claq
AgCls Agaq
+ Claq
+
−
und entsprechend für ein komplizierteres Salz: A2 B3,s 2Aaq + 3Baq ; mit
2
− 3
dem Löslichkeitsprodukt: KL = [A+
aq ] [Baq ]
Man unterscheidet drei verschiedene Fälle von Lösungsgleichgewichten:
1. Gesättigte Lösung
in einer solchen Lösung
von AgCl in H2 O ist bei 25o C
√
[Ag + ] = [Cl− ] = KL = 10−5 mol · l−1 .
2. Übersättigte Lösung
+
−
KL < [Agaq
][Claq
];
in diesem Fall wird festes AgCl ausfallen bis die Lösung gesättigt ist.
3. Ungesättigte Lösung
+
−
KL > [Agaq
][Claq
];
126
6.1 Löslichkeitsprodukt und Löslichkeit von Festkörpern
das Salz ist vollständig gelöst, und weiteres festes Salz (AgCl) kann
sich auflösen.
Oft kann die Konstante KL experimentell (z. B. durch EMK-Messungen)
ermittelt werden. Manchmal ist KL mit gewissen Kationen besonders klein,
so dass diese aus einer Lösung in Form von schwerlöslichen Verbindungen
abgetrennt werden können.
Calciumphosphat in den Knochen oder Calciumcarbonat in der Schale einer
Muschel sind Beispiele von Fällungen, die für Lebewesen von grosser Bedeutung sind.
Die Metallionen (Cu2+ , Cd2+ , Hg 2+ , P b2+ , Bi3+ , As3+ , Sb3+ , Sn2+ ) können
mit H2 S leicht als Sulfide aus einer Lösung gefällt werden.
Zn2+ , N i2+ , Co2+ werden mit N H4 HS bzw. N H4 Sx als feste Sulfide und
F e3+ , Al3+ , Cr3+ , M n2+ mit N H3 als feste Hydroxide in der qualitativen
Analyse abgetrennt.
Schwerlösliche Metallsulfide,
Kristallisation von Natriumacetat aus einer übersättigten
Lösung
In photographischen Prozessen werden die Silberhalogenide, die durch das
Licht nicht verändert wurden (unbelichtete Filmbereiche), mit Natriumthiosulfat (Fixiersalz) entfernt. S2 O23− bildet dabei lösliche Silberkomplexe.
>
In Tabelle 12 ist eine Liste von KL -Werten angegeben. Beim Vergleich der
Löslichkeiten (in M) dieser Verbindungen können die angegebenen Werte
nur dann direkt verwendet werden, wenn die betrachteten Verbindungen die
gleiche Zahl von Ionen in Lösung bilden. Dagegen lässt sich zeigen, dass z.
B. Ag3 P O4 eine grössere Löslichkeit in mol · l−1 aufweisst (1.60 · 10−5 M) als
AgCl (1.33 · 10−5 M), obwohl KL für die erste Verbindung wesentlich kleiner
ist als für die zweite (KL = 1.8 · 10−18 bzw. 1.79 · 10−10 ).
Die Löslichkeit von schwerlöslichen Verbindungen kann auf unterschiedliche
Art und Weise verändert werden:
1. Durch Zugabe eines Inertsalzes, das nicht direkt am betrachteten Gleichgewicht teilnimmt.
KL = aAg+ · aCl− = [Ag + ][Cl− ] · fAg+ fCl−
127
6 FÄLLUNGSREAKTIONEN
Tabelle 12: Löslichkeitsprodukte einiger schwerlöslicher Salze in H2 O bei
25o C
Halogenide
MgF2
CaF2
BaF2
PbF2
PbCl2
PbI2
CuCl
CuBr
CuI
AgCl
AgBr
AgI
AgCN
Hg2 Cl2
Hg2 I2
Sulfide
6·10−9
2·10−10
2·10−6
4·10−8
2·10−5
1·10−8
1·10−6
4·10−8
5·10−12
2·10−10
5·10−13
8·10−17
2·10−14
2·10−13
1·10−23
Chromate
BaCrO4
PbCrO4
Ag2 CrO4
8·10−11
2·10−14
4·10−12
Sulfate
1·10−26
3·10−28
7·10−16
1·10−21
4·10−19
8·10−45
5·10−51
1·10−24
1·10−28
2·10−54
SnS
PbS
MnS
NiS
FeS
CuS
Ag2 S
ZnS
CdS
HgS
Carbonate
Li2 CO3
Mg2 CO3
Ca2 CO3
Sr2 CO3
Ba2 CO3
Pb2 CO3
Zn2 CO3
Ag2 CO3
128
2·10−3
3·10−5
5·10−9
2·10−9
2·10−9
3·10−14
6·10−11
6·10−12
CaSO4
SrSO4
BaSO4
PbSO4
2·10−5
8·10−7
1·10−9
2·10−8
Hydroxide
Be(OH)2
Mg(OH)2
Ca(OH)2
Ba(OH)2
Al(OH)3
Pb(OH)2
Mn(OH)2
Cr(OH)3
Ni(OH)2
Fe(OH)2
Fe(OH)3
Cu(OH)2
Zn(OH)2
Cd(OH)2
3·10−19
1·10−12
4·10−6
4·10−3
2·10−33
4·10−15
7·10−13
7·10−31
3·10−17
2·10−15
5·10−38
2·10−19
2·10−17
2·10−14
6.1 Löslichkeitsprodukt und Löslichkeit von Festkörpern
Durch Änderung der Aktivitätskoeffizienten variiert der Wert von KLc .
Gewöhnlich werden bei Zugabe von Inertsalzen die Aktivitätskoeffizienten kleiner als eins, wobei diese Veränderung von der Ionenstärke
und vom verwendeten Salz abhängt.
2. Durch Zugabe eines Reaktanden, z.B. eines komplett löslichen Salzes
mit mindestens einem identischen Ionentyp. Damit wird die Löslichkeit
des schlecht löslichen Salzes deutlich weiter verkleinert.
Beispiel: Zugabe von NaCl zum System AgCls /AgClgelöst
[Cl− ] = 10−2
und
[Ag + ] =
10−9.75 −7.75
10
M
[Cl− ]
So kann man die Konzentration einer Komponente in Lösung stark verringern und gleichzeitig eine quantitative Bestimmung des Feststoffes
durchführen.
Andere typische Beispiele sind:
• Fällung der Metallhydroxide
• Fallung der Metallsulfide, wobei neben einer Zugabe von H2 S die
Konzentration von S 2− auch durch pH-Änderung variiert werden
kann.
Schwerlösliche Sulfide werden besonders von d9 − und d10 −Kationen
gebildet.
Auch bei anderen schwachen Säuren (H3 P O4 , H2 CO3 , HSO4− , HCrO4− )
ist die Bildung von schwerlöslichen Salzen pH abhängig.
3. Durch Zugabe von Komplexbildnern kann die Löslichkeit stark erhöht
werden.
>
Al(OH)3 + OH−
schwerlösl.
−→
[Al(OH)4 ]−
löslich
AgCl + Cl−
schwerlösl.
−→
[AgCl2 ]−
besser löslich
Fällungsreaktionen
129
6 FÄLLUNGSREAKTIONEN
6.2
Berechnung der Löslichkeit von AgCls in N H3 -Lösungen
In Anwesenheit von N H3 nimmt die Löslichkeit von AgCls deutlich zu.
>
Fällung und Auflösung von Silberniederschlägen
AgCls + 2N H3 [Ag(N H3 )2 ]+ + Cl−
(40)
Dabei werden zwei Komplexe, [AgN H3 ]+ und [Ag(N H3 )2 ]+ gebildet.
Aus dem Vergleich der zwei Konstanten,
K1 =
K2 =
[Ag(N H3 )+ ]
= 103.37
[Ag + ][N H3 ]
[Ag(N H3 )2+ ]
= 103.85
[Ag(N H3 )+ ][N H3 ]
kann man entnehmen, dass für [N H3 ] = 0.1 M die Konzentration des 1:2Komplexes 700mal grösser ist als diejenige des 1:1-Komplexes und dass letztere wiederum 234mal grösser ist als diejenige des Silberions [Ag + ].
Unter diesen Umständen kann man für die Berechnung der Löslichkeit von
AgCls die Konstante des Gleichgewichts 40 verwenden:
[Ag(N H3 )2 ]+ [Cl− ]
= 107.22 · 10−9.75 = 10−2.53
K3 =
2
[N H3 ]
Für [N H3 ] = 0.1 M ergibt sich dann,
[Ag(N H3 )2+ ] = [Cl− ] = 10−4,53/2 M = 10−2.265 M = 5.43 · 10−3 M ,
d. h. eine im Vergleich zu einer gesättigten AgCl−Lösung (1.33 · 10−5 M)
400mal grössere Löslichkeit.
Da N H3 immer teilweise hydrolysiert wird, können wir noch die N H4 + Konzentration berücksichtigen:
KB =
[N H4+ ][OH − ]
= 10−4.755
[N H3 ]
130
6.2 Berechnung der Löslichkeit von AgCls in N H3 -Lösungen
Einsetzen von [N H3 ] = 0.1 M ergibt:
[N H4+ ] = [OH − ] = 10−5.755/2 = 10−2.878 = 1.32 · 10−3 M
pH = 14 − pOH = 14 − 2.88 = 11.12
Es folgt weiter
[N H3 ]t = [N H3 ] + [N H4+ ] + 2 · [Ag(N H3 )+
2]
= 0.1 + 0.00132 + 0.01086 = 0.11218 M
Für niedrige N H3 −Konzentrationen müssen auch die Beiträge der anderen
Gleichgewichte betrachtet werden:
AgCls + N H3 Ag(N H3 )+ + Cl−
AgCls Ag + + Cl− ,
wobei die folgende Komplexbildungskonstanten benützt werden:
K4 =
[Ag(N H3 )+ ][Cl− ]
= 103.37 · 10−9.75 = 10−6.38
2
[N H3 ]
K5 = [Ag + ][Cl− ] = 10−9.75
Da in allen Gleichgewichten die Konzentration des Chloridions erscheint, gilt
auch:
−
[Ag + ] + [Ag(N H3 )+ ] + [Ag(N H3 )+
2 ] = [Cl ],
oder anders ausgedrückt: Für jedes freiwerdende Cl− −Ion muss auch ein
Ag + −Ion in irgendeiner Form in Lösung gehen.
Die Summe der Konzentrationen aller möglichen Teilchen, die Ag + enthalten
können, muss also gleich der Cl− −Konzentration sein.
Es folgt dann mit Hilfe von K1 und K2 ,
[Ag + ](1 + 103.37 [N H3 ] + 107,22 [N H3 ]2 ) = [Cl− ]
131
6 FÄLLUNGSREAKTIONEN
Tabelle 13: Gleichgewichtskonzentrationen in verd. N H3 (M)
NH3 -Konzentration
0,01 M
0,001 M 0,0001 M 0,00001 M
+
−7
[Ag ]
2,90·10
2,71·10−6 1,13·10−5 1,32·10−5
[Ag(NH3 )+ ] 6,49·10−6 6,06·10−6 2,53·10−6 2,96·10−7
[Ag(NH3 )+
6,06·10−4 5,66·10−5 1,81·10−6 2,19·10−8
2]
[Cl− ]
6,13·10−4 6,55·10−5 1,57·10−5 1,35·10−5
woraus sich durch Ersetzen von [Ag + ] mit 10−9.75 /[Cl− ] die Cl− −Konzentration
berechnen lässt:
[Cl− ] =
p
10−9.75 (1 + 103.37 [N H3 ] + 10.7.22 [N H3 ]2 )
Anschliessend werden mit den vorausgegangenen Gleichungen
[Ag + ], [Ag(N H3 )+ ]
und
[Ag(N H3 )+
2]
erhalten.
In dieser Rechnung wurde der pH-Wert der Lösung nicht berücksichtigt. Seine
Angabe würde es erlauben, mit der Dissoziationskonstanten Ks von N H4+ ,
die N H4+ −Konzentration zu ermitteln.
Man kann aber auch umgekehrt für eine bekannte Gesamtkonzentration [N H3 ]t
mit Hilfe des pH-Werts die [N H3 ] berechnen.
Eigentlich liegen hier Pufferlösungen vor, die eine genauere Festsetzung der
gewünschten Konzentrationen erlauben.
6.3
Standardreduktionspotenziale von Lösungen in Anwesenheit von Feststoffen
Für die Halbzellenreaktion
AgCls + e− Ags + Cl−
erhält man ein Standardreduktionspotenzial E ◦ = 0.222 V. Dies lässt sich
kombinieren mit dem Wert für E ◦ = 0.799 V von
Ag + + e− Ags .
132
6.3 Standardreduktionspotenziale von Lösungen in Anwesenheit von
Feststoffen
Damit erhält man für
AgCls ←− Ag + + Cl−
die Konstante KL = 10−0.577/0,0592 = 10−9.75 . Diese Zahl stimmt mit dem
Wert in Tabelle 12 nicht überein, weil in dieser der Unterschied zwischen
Aktivität und Konzentration noch nicht berücksichtigt ist. Extrapoliert man
auf unendliche Verdünnung, so erhält man genau diesen Wert. Entsprechende
Werte sind auch für andere Systeme bekannt.
Also können Löslichkeitsprodukte durch Messungen an galvanischen
Zellen bestimmt werden.
>
Potenzialmessungen zwischen Silberelektroden
Andere Beispiele:
(a)
CuIs + e− ←− Cus + I −
Cu+ + e− ←− Cus
E ◦ = −0.185V
E ◦ = +0.522V
CuIs ←− Cu+ + I − E ◦ = −0.707V
KL = 10−0.707/0.0592 = 10−11.94
(b)
Hg2 Cl2,s + 2e− ←− 2Hgf l + 2Cl−
Hg22+ + 2e− ←− 2Hgf l
E ◦ = 0.268V
E ◦ = 0.798V
Hg2 Cl2,s ←− Hg22+ + 2Cl− E ◦ = −0.530V
KL = 10−0.530/0.0296 = 10−17.90
133
6 FÄLLUNGSREAKTIONEN
6.4
Leitfähigkeitsmessungen
Für Elektrolytlösungen gilt das Ohmsche Gesetz
U =R·I
und für den elektrischen Widerstand einer Lösung, gemessen zwischen zwei
Elektrodenflächen mit dem Abstand d
d
R=ρ .
A
ρ ist der spezifische Widerstand [Ωcm] und sein reziproker Wert die spezifische Leitfähigkeit κ [Ω−1 cm−1 ] = [Scm−1 ].
Üblicherweise ist es sinnvoll, die Leitfähigkeiten von Elektrolyten zu vergleichen, wenn die Lösungen gleiche Stoffmengenkonzentrationen bezogen auf
Ionenäquivalente haben.
Man definiert als Äquivalentleitfähigkeit Λ die Leitfähigkeit einer Lösung
bezogen auf die Äquivalentkonzentration
1
c( z∗
X) als
Λ=
κ
1
c( z∗
X)
[cm2 Ω−1 mol−1 ]
Die molare Grenzleitfähigkeit Λ∞ bzw. Λ0 erhält man durch Extrapolation:
Λ∞ = lim Λc
c→0
Die molaren Grenzleitfähigkeiten Λ∞ zeigen, dass die Ionen unabhängig voneinander wandern (Gesetz von Kohlrausch, 1879) und für einen Elektrolyten
Aa Bb aufgeteilt werden können:
−
Λ∞ = a · λ+
∞ + b · λ∞
−
Dabei bedeuten λ+
∞ und λ∞ die Ionengrenzleitfähigkeiten der Kationen und
der Anionen.
Die Tabelle 14 zeigt sehr schön, dass die Äquivalentleitfähigkeiten stark von
den Ionenkonzentrationen abhängen.
Leitfähigkeitsmessungen werden u.a. dazu verwandt, die Zusammensetzungen von Komplexsalzen zu bestimmen.
Auch die Endpunkte von Fällungstitrationen können mit ihrer Hilfe erkannt
werden.
Für die Deutung der Daten in Tabelle 15 müssen folgende Überlegungen
−
berücksichtigt werden, wobei λ+
∞ und λ∞ als Mass für die Geschwindigkeiten
der Ionen im äusseren elektrischen Feld verstanden werden:
134
6.4 Leitfähigkeitsmessungen
Tabelle 14: Äquivalentleitfähigkeiten (Scm2 mol−1 ) in H2 O bei 25o C
Äquivalenzleitfähigkeit in mol/l
0,0001 0,0010 0,0100
0,1000
Äquivalenzleitfähigkeit in cm2 /(Ω mol)
NaCl
BaCl2
CuSO4
126,5
140,0
133,0
123,7
134,3
115,2
118,5
123,9
83,3
106,7 =
ˆ 0,84 Λ∞
105,2 =
ˆ 0,75 Λ∞
50,5 =
ˆ 0,38 Λ∞
Tabelle 15: Ionengrenzleitfähigkeiten (Scm2 mol−1 ) in H2 O bei 25o C
H3 O+
LI+
Na+
K+
NH+
4
349,8
38,7
50,1
73,5
73,4
Mg2+
Ba2+
Fe3+
OH−
Cl−
135
53,1
63,6
68,0
198,0
76,3
Br−
I−
NO−
3
SO2−
4
CO2−
3
78,4
76,8
71,4
79,8
70,0
6 FÄLLUNGSREAKTIONEN
Tabelle 16: Weitere Beispiele molarer Grenzleitfähigkeitswerte [Scm2 · mol−1 ]
N aCl
CsI
126.5
154.0
M gSO4
M gCl2
266
258.8
LaCl3
428.2
1. Zur Beurteilung der Daten sollen die solvatisierten Ionen betrachtet
werden.
2. Die hohe Ionenleitfähigkeit von H2 O kommt dadurch zustande, dass
nur Platzwechselvorgänge der Protonen über die Wasserstoffbrücken
des Wassers stattfinden (Grothus–Mechanismus) und keine echte Wanderung von H3 O+ und OH − .
3. Innerhalb einer Ladungsklasse sind die Unterschiede klein.
4. Die Grenzleitfähigkeit hängt vorwiegend von der Ladung ab.
Man erkennt deutlich, wie sich Ladung und Zahl der Ionen pro Formeleinheit
auf die Leitfähigkeit auswirken.
Mit Hilfe von Leitfähigkeitsmessungen kann man darum die Gesamtzahl der
Ionen pro Formeleinheit bestimmen, eine Methode, die in der präparativen
Komplexchemie oft zur Charakterisierung der erhaltenen Komplexsalze benutzt wird.
Ferner wurde diese Methode ausgiebig zur Bestimmung der Dissoziationskonstanten von schwachen Säuren und Basen verwendet (W. Ostwald, 1889).
Weitere Anwendungen sind die Messungen von Gefrierpunktserniedrigung,
Siedepunktserhöhung und osmotischem Druck.
6.4.1
Konduktometrie
Wenn eine wässrige, chloridhaltige Lösung mit einer AgN O3 −Lösung titriert,
wird findet eine sukzessive Abscheidung von AgCls statt. Dabei wird ein in
Lösung befindliches Cl− −Ion durch durch ein Nitrat-Ion ersetzt.
Das bewirkt eine nur sehr kleine Abnahme der Leitfähigkeit (siehe Tab. 15).
Die graphische Darstellung von ml AgN O3 −Ls. gegen die Leitfähigkeit ergibt
eine Gerade.
Diese setzt sich bis zur vollständigen Fällung von AgCls , d.h. bis zum Endpunkt der Chloridausscheidung, fort.
136
6.5 Gravimetrie
Anschliessend trägt die zugegebene Menge AgN O3 , die ja vollständig in
Lösung geht, zur stetigen Erhöhung der Leitfähigkeit bei. Da diese Zunahme direkt proportional zur zugegebenen Menge Titrierlösung ist, bilden die
Leitfähigkeitwerte in diesem Bereich eine neue, steilere Gerade.
Der Schnittpunkt der beiden Geraden ergibt die Menge AgN O3 Lösung, die zur Titration des Cl− -Ions nötig war.
6.5
Gravimetrie
Eine weitere Anwendung von Fällungsreaktionen ist die Gravimetrie. Es handelt sich hierbei um eine quantitative Analysenmethode zur Bestimmung der
in einer Lösung vorhandenen Kationen und Anionen.
Man nutzt dabei die Schwerlöslichkeit gewisser Verbindungen aus. Die betreffende Fällungsreaktion muss selektiv für die zu bestimmenden Ionen sein
und unter den gewählten Bedingungen quantitativ ablaufen.
Das gefällte Produkt soll möglichst leicht filtrierbar sein und eine grosse Molmasse besitzen.
Man kennt verhältnismässig viele Verbindungen, die schwerlöslich sind, aber
trotzdem nicht für gravimetrische Bestimmungen verwendet werden können,
weil die Trennung des kristallinen Niederschlags oder die Überführung zu
einem leicht wägbaren Produkt mit konstanter Zusammensetzung nicht gelingt.
Aus diesem Grund werden z.B. die meist schwerlöslichen Sulfide und Hydroxide sehr selten in der Gravimetrie verwendet.
Das Nickel-Ion wird z.B. mit Dimethylglyoxim bestimmt.
Die Gravimetrie erlaubt Bestimmungen mit einer wesentlich
höheren Genauigkeit als die Volumetrie (Titration). Sie wird
daher oft zur Kontrolle der anderer Methoden verwandt, auch
wenn sie relativ zeitraubend ist.
137
Index
Äquivalenzpunkt, 61
Arrhenius, S., 23, 24
Brönsted, 24, 26
Davy, H., 23
Faraday, 86
Gay-Lussac, 7
Grothus, 138
Guldberg, C. M., 20
Humbold, A. von, 7
Kohlrausch, 136
Lavoisier, A. L., 7, 23, 66
Le Chatelier und Braun, 21
Lewis, 24, 27
Liebig, J., 23
Nernst, 86
Ostwald, W., 138
Waage, P., 20
Werner, A., 100, 110
Borax, 9
Brönsted
-Base, 26
-Säure, 26
Chelatligand, 124
chemische Reaktionen, Arten, 12
chemisches Gleichgewicht, 17
chirales Medium, 117
Daltonide, 5
Daniell Element, 78
Diaphragma, 78
Disproportionierung, 95
Doppelsalz, 127
EDTA, 124
Edukt, 9
effektive Ladung, 13
Elektrode
für EMK Messungen, 93
Elektroden
-reaktion, 11
Auswahl, 93
Elektroden zweiter Art, 92
Elektronenübertrag, 12
Elektronenschalen, 8
Elektroneutralität, 44
EMK, 79, 87, 129
Messung, 93
enantiomer, 116
endergonisch, 17
endotherme Reaktion, 21
Enzym, 106
Essigsäure, 55
exergonisch, 17
exotherme Reaktion, 21
Aktivität
optische, 116
Aktivitätskoeffizient, 131
ampholyte, 26
Analyse
konduktometrische, 138
Autoprotolyse, 28
Base, 23
Basenanhydride, 24
Benzoesäure, 46
Berliner Blau, 99
Berthollide, 6
Bestimmung
volumetrische, 124
Bindung
kovalente, 15
polarisierte, 15
Bindungsisomerie, 118
Fällungsreaktion, 128
138
INDEX
Faradaykonstante, 79
Faradaysches Gesetz, 86
Festkörper
Löslichkeitsprodukt, 128
freie Enthalpie, 82
-bildungskonstante, 101, 126
Isomerie, 115
Nomenklatur, 109
Struktur, 110
Zusammensetzung, 110
Komplexbildner, 131
Komplexe
Präparation, 120
komplexometrische Titration, 124
Komplexverbindung, 98
Konduktometrie, 138
Konformationsisometrie, 115
konstante Proportionen, Gesetz, 7
Konzentrationseinheiten, 22
Konzentrationsketten, 91
Konzept der formalen Ladungen, 15
Koordination
-sisomerie, 118
-szahl, 98
-szentrum, 98
Koordinationsverbindung, siehe Komplexverbindung
Koordinationsverbindungen, 98
Koordinationszahl, 98
Koordinationszentrum, 98
kovalente Bindung, 15
Kp, 20
Kronenschwefel, 9
galvanische Zelle, 78
Gefrierpunktserniedrigung, 138
Gemisch
racemisches, 117
gesättigte Lösung, 128
Gesetz der konstanten und multiplen Proportionen, 7
Gibbsche Freie Energie, 128
Gleichgewicht, 100
Gleichgewichtskonstante, 20, 82
Gleichgewichtskonzentration, 87
Gravimetrie, 139
Halbzelle, 78
Hauptschalen, 8
Hinreaktion, 18
Hydratationsisomerie, 118
Hydratisierung, 12
Indikatoren, 29
Inertsalz, 129
Ionengleichungen, 11
Ionenprodukt des Wassers, 28, 44
Ionenverbindungen, 15
Ionenwanderung, 78
isoelektrischer Punkt, 61
Isomerie
Bindungs-, 118
Hydrat-, 118
Hydratations-, 118
Ionen-, 118
optische, 116
Löslichkeit
Berechnung, 132
Löslichkeitsprodukt, 128
Lösung
übersättigte, 128
gesättigte, 128
ungesättigte, 128
Ladung, formale, 15
Ladungsübertrag, 13
Leitfähigkeit, 136
Messung, 136
Lewis
Kalomelelektrode, 88, 93
Kernladung, 8
Komplex
139
INDEX
-Base, 27
-Säure, 27
Licht, 117
polarisiertes, 116
Ligand, 98, 100, 102
-austauschreaktion, 100
Chelat-, 124
einzähniger, 102
makrozyklischer, 105
mehrzähniger, 104
zweizähniger, 103
-Messung, 51
-Wert, 28, 44
Berechnung, 50, 55
Diagramm, 46
Phasenbreite, 6
photografischer Prozess, 129
pK-Wert, 21, 45
polarisierte kovalente Bindung, 15
polarisiertes Licht, 116
Potenzialdiagramme, 94
Prinzip des kleinsten Zwanges, 21
Produkt, 9
Proportionen
konstante, 7
multiple, 7
protische Lösungsmittel, 26
Protolyse
Gleichgewicht, 28
Puffer, 121, 124, 134
Pufferkurve, 39
Maskierung, 99
Massenerhaltung, 44
Gesetz, 7
Massenprozente, 22
Massenwirkungsgesetz, 20, 44, 90
Medium
chirales, 117
Metallindikator, 124
Metallion
volumetrische Bestimmung, 124
Metallkomplex
-bildung, 102
mikroskopische Reversibilität, 18
Molenbruch, 22
Multiple Proportionen, 7
Rückreaktion, 18
Racemat, 117
Reaktion
Fällung, 16, 128
Gas, 20
Komplexbildung, 16
Redox, 16
Säure-Base, 15
Teil-, 10
Reaktionsenergie, 17
Reaktionsenthalpie, 20
Reaktionsgeschwindigkeit, 22
Reaktionsgleichung, 9
Redox
-reaktion, 16, 66
ausgleichen, 71, 74
-reihe, 73
Gleichgewichtslage, 96
Reduktion, 66
Reduktionsmittel, 73
Nernstsche Gleichung, 79, 86, 87
Neutralisation, 11
Nomenklatur
Komplexverbindungen, 109
Normalpotenzial, 80
Orbital, 8
osmotischer Druck, 138
Oxidation, 66, 78
Oxidationsmittel, 73
Oxidationszahl, 67
pH
-E-Diagramm, 97
140
INDEX
Reversibilität
mikroskopische, 18
Valenzelektronen, 13
Volta-Element, 78
Volumengesetz, 7
Säure, 23
einprotonige, 40
mehrprotonige, 32
schwache, 58
zweiprotonige, 59
Säureanhydride, 24
Schwefel, 9
Schwefeldioxid, 9
Schwefelwasserstoff, 9
semipermeable Membran, 78
solidus, 11
Spannungsreihe, 73
Stöchiometriezahlen, 10
Stabilitätskonstante, 100
Bestimmung, 120
Brutto-, 120
Standardpotenzial, 80
Bestimmung, 82
Standardreduktionspotenzial, 22
Beeinflussung, 126
Beispielaufgaben, 87
Lösung mit Festkörper, 134
Standardwasserstoffelektrode, 82, 85
Stereoisomerie, 117
Stoffgleichungen, 11
Xylenolorange, 125
Teilreaktion, 10
Titration, 88
komplexometrische, 124
Titrationskurve, 36
Stabilitätskonstante, 120
Titrieren, 61
Turnbulls Blau, 99
Umschlagsintervalle, 31
ungesättigte Lösung, 128
Unterschalen, 8
Urstoff, 4
141