7a. Chemische Gleichungen aufstellen
Werbung
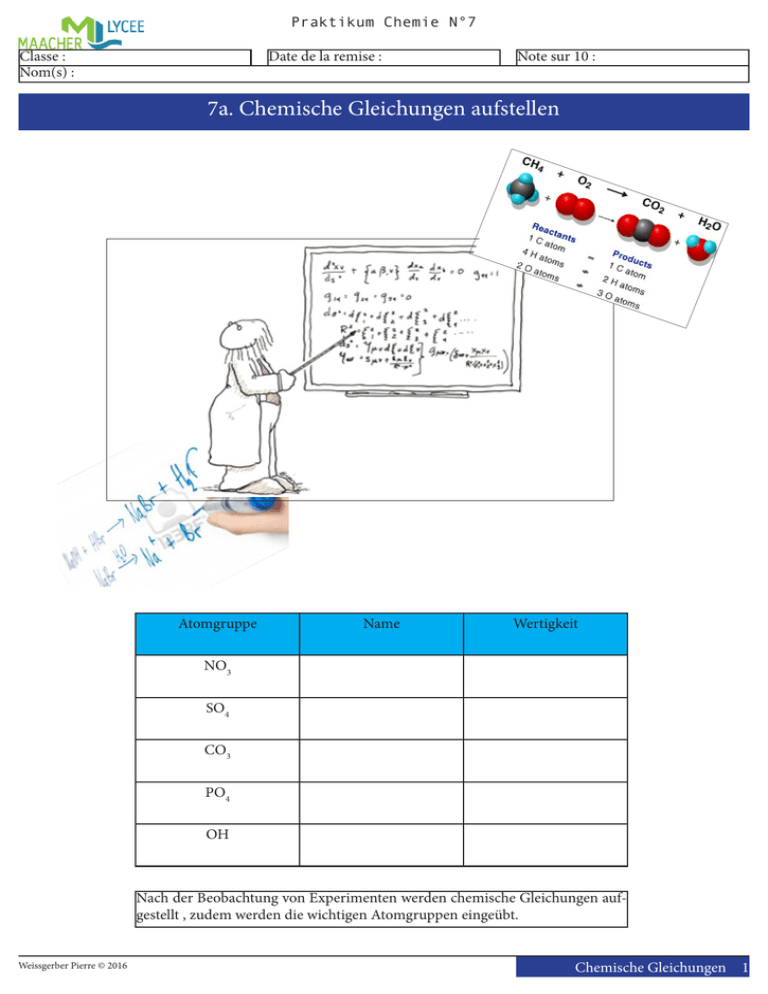
Praktikum Chemie N°7 Classe : Nom(s) : Date de la remise : Note sur 10 : 7a. Chemische Gleichungen aufstellen Atomgruppe Name Wertigkeit NO3 SO4 CO3 PO4 OH Nach der Beobachtung von Experimenten werden chemische Gleichungen aufgestellt , zudem werden die wichtigen Atomgruppen eingeübt. Weissgerber Pierre © 2016 Chemische Gleichungen 1 Während dieses Praktikums werdet ihr eine Reihe von Versuchen durchführen und werdet jeweils eure Beobachtungen festhalten und die ausgeglichene chemische Gleichung des jeweiligen Versuches aufstellen. Versuch 1 : Verbrennen von Alkohol a) Materialien : • • • Ethanol Bunsenbrenner Feuerzeug oder Streichhölzer b) Handlung : • • • Verbrennung von organischen Stoffen Bei der Verbrennung von organischen Stoffen enstehen, bei ausreichender Sauerstoffzufuhr, normalerweise diese zwei Produkte : ______________ und _______________________ . Unter dem Abzug arbeiten ! Einige mL Alkohol unter dem Abzug verteilen. Mit dem Feuerzeug in Brand setzen. c) Informationen : Ethanol, veraltet Äthanol, umgangssprachlich oft gleichgesetzt mit Alkohol, ist ein aliphatischer, einwertiger Alkohol mit der Summenformel C2H6O. Die reine Substanz ist eine bei Raumtemperatur farblose, leicht entzündliche Flüssigkeit mit einem brennenden Geschmack und einem charakteristischen, würzigen (süßlichen) Geruch. Die als Lebergift eingestufte Droge wird bei der Herstellung von Genussmitteln und alkoholischen Getränken wie Wein, Bier und Spirituosen aus kohlehydrathaltigem Material durch eine von Hefen ausgelöste Gärung in relativ großen Mengen produziert. d) Beobachtungen : e) Resultate : Stelle nun die Wortgleichung und die ausgeglichene Reaktionsgleichung auf : Weissgerber Pierre © 2016 Chemische Gleichungen 2 Versuch 2 : Verbrennen von Magensium a) Materialien : • • • 3 cm Magnesiumband Porzelanschale und Tiegelzange Bunsenbrenner , Feuerzeug oder Streichhölzer b) Handlung : • • • • Verbrennung von Metallen Bei der Verbrennung von Metallen entsteht, bei ausreichender Sauerstoffzufuhr, das korrespondierende Metalloxid. (Kreuzformel beachten) Unter dem Abzug arbeiten ! Mg-Band mit Tiegelzange fassen. Mit der rauschenden Flamme anzünden. Über der Schale abbrennen lassen und das Pulver auffangen. c) Informationen : Magnesium ist ein chemisches Element mit dem Elementsymbol Mg und der Ordnungszahl 12. Im Periodensystem der Elemente steht es in der zweiten Hauptgruppe bzw. der 2. IUPAC-Gruppe und gehört damit zu den Erdalkalimetallen. Magnesium ist eines der zehn häufigsten Elemente der Erdkruste. Es kommt in zahlreichen Mineralen sowie im Blattgrün der Pflanzen vor. d) Beobachtungen : e) Resultate : Stelle nun die Wortgleichung und die ausgeglichene Reaktionsgleichung auf : Weissgerber Pierre © 2016 Chemische Gleichungen 3 Versuch 3 : Salzsäure und Kalk a) Materialien : • • Wichtige Säuren Salzsäure und Kalk (Calciumcarbonat) Erlenmeyer (klein) b) Handlung : • • Etwas (1-2 Spatelspitzen) Kalk in den Erlenmeyer geben. Maximal 5 mL Salzsäure hinzugeben. c) Informationen : Calciumcarbonat ist eine der am weitesten verbreiteten Verbindungen auf der Erde, vor allem in Form von Sedimentgesteinen. Es tritt vor allem in der Form des Minerals Calcit (Kalkspat, Doppelspat) auf, das zu den häufigsten Mineralen der Erdkruste gehört. Es ist nicht nur in den massiven Kalkgesteinen das vorherrschende Kristall, in Verbindung mit Quarz, Baryt und Fluorit bildet es auch das Muttergestein sehr vieler Erzgänge. d) Beobachtungen : e) Resultate : Stelle nun die Wortgleichung und die ausgeglichene Reaktionsgleichung auf : (Bei dieser Reaktion entsteht Kohlendioxid, Wasser, und Calciumchlorid ) Weissgerber Pierre © 2016 Chemische Gleichungen 4 Versuch 4 : Magensium und Salzsäure a) Materialien : • • • 2 cm Magnesiumband und Salzsäure 2 Reagenzgläser Feuerzeug oder Streichhölzer Säure und unedele Metalle Bei der Reaktion von Säuren und unedelen Metallen entstehen Wasserstoffgas und das entsprechende Salz. b) Handlung : • • • Das Mg in das RG geben und einige Tropfen Salzsäure hinzufügen. Mit einem zweiten RG das entstehende Gas auffangen. Knallgasprobe durchführen ! c) Informationen : Mit dem Begriff Knallgasprobe bezeichnet man in der Chemie einen Nachweis von Wasserstoff. Dieser ist jedoch unspezifisch, da auch z. B. Methan mit Sauerstoff Knallgas bildet, und dient nur im Chemieunterricht als Pseudonachweis. Die eigentliche Verwendung (siehe unten) ist das Überprüfen des Luftgehaltes einer Wasserstoff produzierenden Apparatur. Für den Nachweis wird üblicherweise das zu überprüfende Gas in einem Reagenzglas mit der Öffnung nach unten (damit Wasserstoff wegen der geringeren Dichte als Luft nicht entweichen kann) an eine Zündquelle (Bunsenbrenner, Feuerzeug) gehalten. d) Beobachtungen : e) Resultate : Stelle nun die Wortgleichung und die ausgeglichene Reaktionsgleichung auf : Weissgerber Pierre © 2016 Chemische Gleichungen 5 Versuch 5 : Zink und Phosphorsäure a) Materialien : • • Zinkgranulat und Phosphorsäure 1 Reagenzglas mit RG-Halter b) Handlung : • Säure und undele Metalle Bei der Reaktion von Säuren und unedelen Metallen entstehen Wasserstoffgas und das entsprechende Salz. Das Metall in das RG geben und einige Tropfen Säure hinzufügen. c) Informationen : Phosphorsäuren dienen als Ausgangsstoff zur Herstellung phosphathaltiger Dünger (in den USA >90 % der Produktion), von Waschmitteln, Rostentfernern bzw. von Rostumwandler sowie zur Passivierung von Eisen und Zink zum Schutz vor Korrosion. In der Zahnmedizin findet Zinkphosphatzement Verwendung. Zink ist ein chemisches Element mit dem Elementsymbol Zn und der Ordnungszahl 30. Zink wird zu den Übergangsmetallen gezählt. Es ist ein bläulich-weißes sprödes Metall und wird unter anderem zum Verzinken von Eisen und Stahlteilen sowie für Regenrinnen verwendet. Zink ist für alle Lebewesen essentiell und ist Bestandteil wichtiger Enzyme. d) Beobachtungen : e) Resultate : Stelle nun die Wortgleichung und die ausgeglichene Reaktionsgleichung auf : Weissgerber Pierre © 2016 Chemische Gleichungen 6 Versuch 6 : Kupfer und Salpetersäure a) Materialien : • • Kupfergranulat oder Münze und Salpetersäure 1 Reagenzglas mit RG-Halter b) Handlung : • Das Metall in das RG geben und einige Tropfen Säure hinzufügen. Salpetersäure und Kupfer Es ensteht Kupfer(II)nitrat, Stickstoffmonoxid und Wasser. Das Stickstoffmonoxid reagiert mit dem Luftsauerstoff und ergibt das braune giftige Stickstoffdioxid. c) Informationen : Salpetersäure ist farblos und hat einen scharf stechenden Geruch. Sie wird unter anderem zur Herstellung von Düngemitteln, Farbstoffen und Sprengstoffen verwendet. Kupfer (lat. Cuprum) ist ein chemisches Element mit dem Elementsymbol Cu und der Ordnungszahl 29. Es ist ein Übergangsmetall, im Periodensystem steht es in der 4. Periode und der 1. Nebengruppe. Kupfer ist als relativ weiches Metall gut formbar und zäh. Als hervorragender Wärme- und Stromleiter findet es vielseitige Verwendung. Darüber hinaus zählt es auch zur Gruppe der Münzmetalle. d) Beobachtungen : e) Resultate : Stelle nun die Wortgleichung und die ausgeglichene Reaktionsgleichung auf : Weissgerber Pierre © 2016 Chemische Gleichungen 7 Versuch 7 : Silbernitrat mit Natriumchlorid a) Materialien : • • Silbernitrat und Natriumchlorid 2 Erlenmeyer (klein) b) Handlung : • • • Einige Körner Silbernitrat in Erlenmeyer 1 lösen. Einige Körner Natriumchlorid in Erlenmeyer 2 lösen. Die Lösung aus EM1 in EM2 gebem c) Informationen : Silbernitrat ist Ausgangsstoff zur Darstellung anderer Silbersalze, besonders der Silberhalogenide, die in der Fotografie verwendet werden. Es dient zur galvanischen Versilberung, zur Herstellung von Silberspiegeln und als Haarfärbemittel. Silberchlorid ist eine weiße, mikrokristalline, lichtempfindliche Substanz mit dem Schmelzpunkt von 455 °C und einem Siedepunkt von 1550 °C. In Wasser wie in Salpetersäure ist Silberchlorid praktisch unlöslich. Salze in Lösung Schreibt man Lösungsgleichungen von Salzen im Wasser, wird H2O nicht als Edukt angegeben sondern über den Reaktionspfeil angeschrieben. Desweiteren werden gelöste Ionen mit (aq) angegeben. Fällungsreaktion Fällungsreaktionen nennt man chemische Reaktionen, bei denen die Reaktanten im Lösungsmittel gelöst vorliegen und mindestens ein Produkt in diesem Lösungsmittel un- oder schwerlöslich ist. d) Beobachtungen : e) Resultate : Stelle nun die Lösungsgleichungen der beiden Salze und die Wortgleichung und die ausgeglichene Reaktionsgleichung der Fällungsreaktion auf : Weissgerber Pierre © 2016 Chemische Gleichungen 8 Versuch 8 : Kupfersulfat erhitzen a) Materialien : • • Kupfersulfatgranulat (blau) 1 Reagenzglas mit RG-Zange b) Handlung : Hydratierte Salze Hydrate (altgr. ὕδωρ hydōr ‚Wasser‘) sind in der Chemie allgemein Substanzen, die Wasser enthalten. Für die Kennzeichnung von Hydraten in Summenformeln wird dieses nicht direkt in die Formel mit eingefügt, c) Informationen : sondern als · n H2O ans Ende der In der Natur kommt Kupfersulfat als Verwitterungsprodukt sulfidischer KupSummenformel gesetzt fererze als krustenförmige, körnige oder faserige Aggregate vor. Die wasserfreie Form (CuSO4) tritt in der Natur nicht auf, sondern ausschließlich das Kupfersulfat-Pentahydrat (CuSO4 · 5 H2O) als seltenes Mineral Chalkanthit. • Kupfersulfat im RG erhitzen. Kupfersulfat wird für eine Vielzahl von Prozessen und Reaktionen verwendet, so zum Verkupfern, zur Herstellung von kupferhaltigen Farben, zur Kupferstichätzung, in Silvester-Raketen (erzeugt einen bläulich-grünen Farbton) und weiteren Anwendungen. d) Beobachtungen : e) Resultate : Stelle nun die Wortgleichung und die ausgeglichene Reaktionsgleichung auf : Weissgerber Pierre © 2016 Chemische Gleichungen 9 Folgende Aufgaben sind am Ende des praktischen Teils zu lösen und sind fester und obligatorischer Bestandteil dieses Praktikums. Aufgabe 1 : Stelle die Wortgleichungen und die ausgeglichenen Gleichungen für folgende Reaktionen auf. a) Bleinitrat reagiert mit Kaliumiodid. b) Elektrolyse von Wasser. Salze in Lösung Acetate, Nitrate und Perchlorate sind im allgemeinen leicht löslich. Hydroxide, Carbonate und Sulfide sind im allgemeinen schwer löslich. Die Halogenide von Silber und Blei sind schwer löslich. c) Verbrennung von Methan. d) Photosynthese. c) Rosten von Eisen (mit beidem Wertigkeiten angeben). d) Synthese von Stickstoffiodid. d) Aluminium reagiert mit schwefliger Säure. Weissgerber Pierre © 2016 Chemische Gleichungen 10