Methoden - BIOspektrum
Werbung

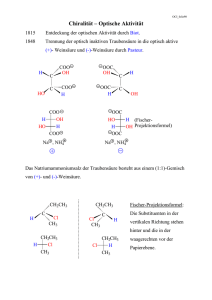
Methoden 518 Ultraschnelle Methode zur Bestimmung von Stoffwechselstörungen bei Neugeborenen C. D. Langhans, D. Kohlmüller, P. Feyh Universitätsklinikum Heidelberg, Kinderklinik, Stoffwechselzentrum Einleitung Im Verlauf des Intermediärstoffwechsels von Aminosäuren, Fettsäuren und Kohlenhydraten treten eine Vielzahl saurer Zwischen- und Endprodukte auf, die auf Grund ihrer Wasserlöslichkeit über den Harn ausgeschieden werden und in dieser Matrix einer chemischen Analyse zugänglich sind [1]. Der Begriff „Organische Säuren“, der in diesem Zusammenhang Verwendung findet, wird dabei als Sammelbegriff für eine breite Klasse von Verbindungen gebraucht, die sowohl Mono- und Dicarbonsäuren als auch Keto- und Hydroxysäuren beinhaltet. Auch einige stickstoffhaltige Verbindungen wie 5-Oxoprolin (Pyroglutamat) und Aminosäure-Konjugate wie Hippursäure (Benzoylglycin) fallen darunter. Störungen im Intermediärstoffwechsel, die zu einem Anstau von Carbonsäuren und ihrer vermehrten Ausscheidung im Urin führen, werden als Organoazidopathien bezeichnet. Ursache vieler Organoazidopathien ist ein defektes Enzym oder dessen Cofaktor. Als Folge dieser Funktionsstörung reichert sich ein Substrat vor dem Enzymblock an. Aus dieser unphysiologischen Konzentrationserhöhung können Sekundärmetabolite auf alternativen Stoffwechselwegen entstehen. Das Fehlen wichtiger Primärmetabolite sowie die toxische Wirkung einiger Sekundärmetabolite manifestiert sich in einer Reihe klinischer Symptome. Darunter sind Wachstumsstörungen, mentale Retardierung bis hin zum Tod in den ersten Lebensmonaten im Falle angeborener Stoffwechselerkrankungen [2]. BIOspektrum · Sonderheft 2/02 · 8. Jahrgang Als erste einer langen Liste wurde 1966 die Isovalerianazidurie beim Menschen beschrieben. Auslöser war der auffällige Geruch einer UrinProbe [3]. Einige dieser Organoazidopathien resultieren aus Störungen des intramitochondrialen Abbaus verzweigtkettiger Aminosäuren. Im Fall der Propionazidurie liegt ein Defekt der biotin-abhängigen Propionyl-CoA-Carboxylase im Metabolismus der Aminosäuren Isoleucin, Methionin, Threonin und Valin vor. Bei der Methylmalonazidurie führt ein Defekt der adenosylcobalamin-abhängigen Methylmalonyl-CoA-Mutase zu einer massiven Ausscheidung von Methylmalonsäure und Methylcitronensäure. Ebenso dokumentieren sich auch Harnstoff-Zyklus Defekte, Fettsäure-Oxidationsstörungen (MCAD, SCAD) sowie Störungen im Pyrimdin- und im GABA-Stoffwechsel (SSADH-Mangel) in einer vermehrten Ausscheidung bestimmter Metabolite, die als spezifische Marker für die jeweilige Erkrankung dienen [4]. Um ein Bild der aktuellen Stoffwechsellage zu bekommen, wird ein chromatographisches Profil der organischen Säuren im Urin erstellt [5]. Dazu werden die sauren Komponenten aus der Urin-Matrix extrahiert [6]. Es stehen verschiedene Methoden wie Ionenaustausch- oder Adsorptionschromatographie zur Verfügung, doch für den Routine-Betrieb hat sich die Flüssig-Flüssig-Verteilung unter sauren Bedingungen mit Ethylacetat oder Diethylether als sehr effektiv erwiesen. Vorhandene Oxosäuren und andere Carbonyl-Verbindungen werden vor der Extraktion zu Oxim-Derivaten umgesetzt [7]. Diese haben den Vorteil, dass sie die in einem Keto-EnolGleichgewicht vorliegenden Oxosäuren in ein definiertes Derivat überführen und somit die Analytik erleichtern. Nach der Extraktion muss die polare Säure-Fraktion weiter derivatisiert werden, um für die Gaschromatographie leichter verdampfbar zu werden. Weit verbreitet sind TrimethylsilylDerivate (TMS-Derivate), die ohne großen Aufwand gebildet werden können. Allerdings entstehen bei einigen Verbindungen wie den Acylglycinen neben den Mono- auch Di-TMS-Produkte, was bei der quantitativen Auswertung Probleme bereiten kann. In diesem Fall sind Methylester besser geeignet [6]. Für die weitere Analyse der derivatisierten Extrakte ist die Kopplung der Gaschromatographie mit der Massenspektrometrie die Methode der Wahl. Mit Hilfe der modernen Kapillarsäulen-Technik wird bereits eine weitgehende Tren- Abb. 1: Totalionenstromchromatogramm der Organischen Säure-Fraktion des Urins eines Patienten mit Propionazidurie BIOspektrum · Sonderausgabe · 8. Jahrgang Methoden nung des komplexen Urin-Extraktes erreicht. Eine Identifizierung der einzelnen Bestandteile allein auf der Basis der Retentionszeiten ist allerdings nicht empfehlenswert, da einige Komponenten wie z.B. 2- und 3-Hydroxyglutarsäure coeluiert werden. Erst der Einsatz der Massenspektrometrie als effizienter Detektor erlaubt eine sichere Peakzuordnung, auch von Verbindungen, deren gaschromatographische Trennung schwierig ist. Bei den üblicherweise verwendeten 30 m Fused-Silica Kapillarsäulen mit 0.25 – 0.32 mm Innendurchmesser und einer Filmbe- + + NH 3 Valin NH 3 Isoleucin - COO - COO O O 2-Oxo-Isovalerat 2-Oxo-3-Methyl-Valerat - COO - COO O O SCoA Isobutyryl-CoA 2-Methyl-butyryl-CoA SCoA O O Methacrylyl-CoA OH 2-Methyl-3-OH-Butyryl-CoA SCoA OH SCoA O 3-OH-Isobutyryl-CoA 3-OH-Isobutyrat Tiglyl-CoA SCoA O 2-Methyl-3-Oxo-Butyryl-CoA - O Methylmalonyl-semialdehyd O OH O SCoA O O SCoA O - O O Propionyl-CoA Propionylglycin SCoA Propionyl-CoACarboxylase 3-OH-Propionsäure O - Methylmalonyl-CoA Methylcitrat OOC SCoA Propionsäure Succinyl-CoA O - OOC SCoA Citrat-Zyklus 4-Aminobutyrat (GABA) - OOC NH 3 - OOC CHO + Transaminase Succinat-Semialdehyd SuccinatsemialdehydDehydrogenase 4-Hydroxybutyrat Succinat - OOC - OOC OH - COO Abb. 2: Schema des Stoffwechselweges der verzweigtkettigen Aminosäuren Valin und Isoleucin sowie des Neurotransmitters 4-Aminobuttersäure (GABA) BIOspektrum · Sonderausgabe · 8. Jahrgang BIOspektrum · Sonderheft 2/02 · 8. Jahrgang Methoden 520 deutung ist in diesem Fall die chromatographische Abtrennung der 4-Hydroxybuttersäure vom benachbart eluierenden Harnstoff-diTMS. Dies unterstreicht die Effizienz der analytischen Methode. Literatur [1] M. Spiteller, G. Spiteller. J. Chromatography 164 (1979) 253 – 317. [2] J. Zschocke, G.F. Hoffmann. “Vademecum Metabolicum – Diagnose und Therapie erblicher Stoffwechselkrankheiten“, Milupa – Schattauer, Stuttgart, 2. Auflg. 1999. [3] K. Tanaka, M.A. Budd, M.L. Efron, K.J. Isselbacher. Proc. Natl. Acad. Sci. USA 56 (1966) 236. [4] S. I. Goodman, S.P. Markey. „Diagnosis of organic acidemias by gas chromatography- mass spectrometry“, Alan Liss, New York, 1981. Abb. 3: Totalionenstromchromatogramm der Organischen Säure-Fraktion des Urins eines Patienten mit SSADH-Mangel legung von 0.25 – 1.5 µm sind Analysenzeiten von 50 – 60 Minuten für die Aufnahme eines Säureprofils üblich [8]. Durch die Entwicklung der Fast-GC-Methodik [9], d. h. kurzen Dünnfilm-Trennsäulen mit kleinen Innendurchmessern (< 0.1 mm) ist eine deutliche Verkürzung der Analysenzeiten auf 4 Minuten ohne Einbuße an chromatographischer Auflösung möglich. In Verbindung mit den schnellen Scan-Raten der Timeof-flight (ToF) Massenspektrometrie wird die GC-ToF-Kopplung zu einem effizienten Analysensystem, das im Routine-Betrieb im Bereich der Organischen-Säure-Analytik eine schnelle und sichere DiagnosenStellung erlaubt. Experimenteller Teil Probenvorbereitung Das einem Kreatinin-Gehalt von 1µmol entsprechende Urin-Volumen wird mit D4-4-Nitrophenol und 2-Oxocapronsäure als Innere Standards versetzt und mit 0.5n H2SO4 angesäuert. Zur Oximierung wird Pentafluorbenzylhydroxylamin (PFBHA) zugesetzt und eine Stunde bei Raumtemperatur oximiert und die Reaktionsmischung mit Ethylacetat extrahiert. Der über Na2SO4 getrocknete Extrakt wird nach Verdampfen des Lösungsmittels mit N-Methyl-NTrimethylsilyl-Heptafluorbutyramid (MSHFBA) silyliert. GCMS-Bedingungen Alle Trennungen werden auf einer unpolaren 5% Phenyl Dimethylpolysiloxan-Phase (BPX5MS, SGE) mit 7,5 m × 0,1 mm und 0,1 µm Filmdicke durchgeführt. Die Ofentemperatur wird von 50 °C mit 55°/min auf 280 °C erhöht (TRACE GC 2000, ThermoFinnigan). Die Injektortemperatur beträgt 290 °C. Als Trägergas wird Helium verwendet. Die Datenaufnahme mit dem To F - M a s s e n s p e k t r o m e t e r (TEMPUS, ThermoFinnigan) erfolgt mit 20 scans pro Sekunde. Diskussion In Abb. 1 ist das chromatographische Profil der Organischen Säuren im Urin eines Patienten mit einer Propionacidurie dargestellt. Charakteristisch für dieses Krankheitsbild ist die vermehr- te Ausscheidung von Methylcitronensäure, 3-Hydroxy-Propionsäure, 3-Hydroxy-Valeriansäure, Propionylglycin und Tiglylglycin. Eine schematische Darstellung des Stoffwechsels von Valin und Isoleucin ist in Abb. 2 gezeigt. Die inhibitorische Wirkung des akkumulierten Propionyl-CoA auf das Glycin-Cleavage-Enzym führt zu einer Anreicherung von Glycin und erklärt das Auftreten von Propionylglycin und Tiglylglycin im Harn des Patienten. Im Chromatogramm treten diese beiden pathologischen Metabolite als Mono- und Di-TMS-Derivate auf. In Abb. 3 ist das charakteristische Chromatogramm eines SSADH-Mangels (4-Hydroxybutyracidurie) dargestellt. Ein Mangel an dem Enzym Succinatsemialdehyd-Dehydrogenase führt dazu, dass der Neurotransmitter γ-Aminobuttersäure (GABA) zu 4-Hydroxybuttersäure verstoffwechselt wird anstatt zu Bernsteinsäure (s. Abb. 2). Als weitere Metabolite können 3,4Dihydroxybuttersäure, 4,5Dihydroxycapronsäure sowie dessen Lakton vorkommen. Für die Diagnosenstellung von Be- [5] H. Böhles, G. Hoffmann, D. Kohlmüller, E. Mayatepek, A. Sewell, L. Wagner. „Befunde des metabolischen Labors – Darstellung typischer Laborbefunde bei der Diagnostik angeborener Stoffwechselerkrankungen“ SHS Gesellschaft für klinische Ernährung mbH, Heilbronn 1999. [6] L. Sweetman, „Organic acid analysis” in: F.A. Hommes (ed.). „Techniques in Diagnostic Human Biochemical Genetics: A Laboratory Manual” p. 143 – 176, Wiley-Liss, New York 1991. [7] G. F. Hoffmann, S. Aramaki, E. Blum-Hoffmann, W.L. Nyhan, L. Sweetman. Clin. Chem. 35 (1989) 587 – 595. [8] W. Meier-Augenstein, G.F. Hoffmann, B. Holmes, J.L. Jones, W.L. Nyhan, L. Sweetman. J. Chromato- graphy 615 (1993) 127-135. [9] R. Sacks, H. Smith, M. Nowak. Anal. Chem. 70 (1998) 29A – 37A. Korrespondenzadressen: Dr. C. D. Langhans Dr. D. Kohlmüller P. Feyh Universitätsklinikum Heidelberg Kinderklinik, Stoffwechselzentrum Im Neuenheimer Feld 150 D-69120 Heidelberg Thermo Finnigan GmbH Dr. H. Kandewitz Boschring 12 D-63329 Egelsbach BIOspektrum · Sonderausgabe · 8. Jahrgang