Übungsbogen 4
Werbung

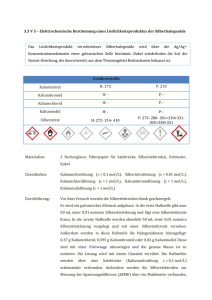
Prof. Dr. C. Janiak Analytische Chemie I Übungsbogen 4 zum Praktikum/zur Vorlesung Analytische Chemie I 1. Aufgabe Eine rotbraune, in Wasser schwerlösliche Verbindung zeigt folgende Reaktionen: i) Sie löst sich in NH3-Lösung unter Bildung einer gelben Lösung. ii) Sie löst sich in HNO3-Lösung unter Bildung einer orangen Lösung. iii) Bei Zugabe von Salzsäure zur Lösung in ii) fällt ein weißer Niederschlag aus. iv) Der weiße Niederschlag aus iii) löst sich unter den Bedingungen von i) wieder auf. v) Bei Zugabe von Natriumsulfit zu ii) färbt sich die Lösung grün. a) Um was für eine Substanz handelt es sich? b) Formulieren Sie qualitativ die ablaufenden Reaktionsgleichungen. 2. Aufgabe Wie kann man folgende Stoffe in Lösung bringen: (Geben Sie die benötigten Reagenzien an!) a) TiO2 c) HgS e) PbSO4 b) SnO2 d) BaSO4 f) As2S5 3. Aufgabe Würde man in neutraler Lösung noch eine Fällung von Mangansulfid (MnS) aus einer Lösung der Konzentration 10–4 mol/l erwarten? L (MnS) = 10–15 mol2/l2 K1 (H2S) = 10–7 mol/l K2 (H2S) = 10–13 mol/l [H2S] = 10–1 mol/l 4. Aufgabe Erklären Sie die folgenden Beobachtungen: a) Arsensulfid kann aus einer sauren, aber nicht aus einer alkalischen Lösung gefällt werden. b) Zinksulfid löst sich in verdünnter Salzsäure, Nickelsulfid jedoch nicht, trotz eines fast gleichen Löslichkeitsprodukts. c) Nach Abtrennung der Salzsäuregruppe findet sich Blei auch als Teil des Sulfidniederschlages in der nachfolgenden H2S-Gruppe. 5. Aufgabe a) Nennen Sie aus dem Bereich der qualitativen Analyse 4 Beispiele für gemischt valente Verbindungen, d.h. Verbindungen, in denen ein Element in verschiedenen Oxidationsstufen auftritt. 6. Aufgabe Die Leerfelder im folgenden Text sind auszufüllen! Ihre Vollanalyse kann die folgenden Anionen enthalten: Cl–, SO42–, PO43–, NO3–, F–, SiO32–, CO32–, S2– sowie fünf der folgenden Metalle in ionogener Form: Fe, Co, Cu, Li, Cd, Mn, Ni, Cr, Ba, Al, Sb, Pb, As, Sn, Ca, Ag. Zeigen Sie an, welchen Folgerungen Sie aus den nachstehend beschriebenen Beobachtungen ziehen können, d.h. geben Sie an, welche Elemente vorliegen oder nicht vorliegen können! 1 Prof. Dr. C. Janiak Analytische Chemie I Am Anfang Ihrer Vollanalyse führten Sie zunächst einige Vorproben durch: Sie beobachteten eine rote Flammenfärbung, die Sie spektroskopisch untersuchten. Sie sahen eine dünne rote und orange Linie links von der gelben Na-D-Linie. Grüne Linien konnten Sie nicht beobachten. ⇒ _________ Die Phosphorsalzperle war blau gefärbt, eine grüne Perle war nicht zu erhalten, ebenso keine gelbe Oxidationsschmelze. ⇒ _____________ Beim Ansäuern der Oxidationsschmelze mit Eisessig trat keine Violettfärbung auf. ⇒ ______ Eine Leuchtprobe nach Zugabe von Zink und etwas HCl zur festen Analysensubstanz war ebenfalls negativ, und bei der Marsh'schen Proben wurde kein Metallspiegel abgeschieden. ⇒ ______________ Bei den Anionen wurden zunächst durch Zugabe von konzentrierter H2SO4 zur Analysensubstanz in einem Bleitiegel und Abdecken mit einer Glasplatte eine Probe durchgeführt, die negativ verlief. ⇒ _________________ Das Verreiben der Probe mit CaF2 und Versetzen mit H2SO4 in einem Bleitiegel, der mit einem durchbohrten Deckel abgedeckt ist, auf dem schwarzes Filterpapier liegt, brachte nach dem Erwärmen nur ein negatives Ergebnis. ⇒ ______________ Bei Zugabe von HCl zur Ursubstanz setzte Gasentwicklung ein, Barytwasser in einem Gärröhrchen wurde getrübt. ⇒ _____________ In einer letzten Anionenprobe versetzten Sie die feste Analysensubstanz mit konz. H2SO4. Die entstehenden Gase wurden über konz. NH3 geleitet, es bildete sich jedoch kein weißer Rauch. In die Gase gehaltenes Bleiacetatpapier wurde nicht geschwärzt. Es waren allerdings schwache braune Dämpfe zu bemerken. ⇒ _____________ Damit waren die Vorproben beendet, und man versuchte die Substanz zu lösen, was schließlich vollständig in verd. HNO3 gelang. Mit der Zugabe von verd. HCl begann der Kationentrennungsgang. Es fiel ein weißer Niederschlag aus, der sich in der Hitze nicht wieder löste, sondern erst beim Versetzen mit NH3. ⇒ ____________ Im Zentrifugat des HCl-Niederschlages wurde nun mit Thioacetamid _____ entwickelt. Bei größerer Verdünnung fiel ein gelblicher Niederschlag aus, bei dem es sich nur um _________ handeln konnte, was durch Glühen im Tiegel und sodann im Glühröhrchen mit Na2C2O4 durch Abscheiden eines Metallspiegels noch bestätigt wurde. Das Zentrifugat der H2S-Gruppe wurde mit SCN– bzw. mit Kaliumhexacyanoferrat(II) auf X überprüft. Es fiel ein roter bzw. blauer Niederschlag aus. ⇒ X = _________ Bei Zugabe von Ammoniummolybdat zum Zentrifugat entstand kein gelber Niederschlag. ⇒ _____________ Nun wurde mit Urotropin in Gegenwart von NH4Cl gefällt, der Niederschlag abzentrifugiert, in HCl wieder aufgelöst und X als Chlorokomplex ausgeethert. Aus der wäßrigen HCl-Lösung fiel beim Kochen mit NH4Cl kein Niederschlag. Ein Test mit Morin in essigsaurer Lösung war ebenfalls negativ. ⇒ _______ Das Nichtauftreten einer Blaufärbung beim Ausschütteln der mit H2SO4 und H2O2 versetzten Lösung mit Ether bestätigte das negative Ergebnis der Vorprobe hinsichtlich: __________. Das Filtrat der Urotropinfällung wurde ammoniakalisch gemacht und mit (NH4)2S ein schwarzer Niederschlag gefällt. Dieser schwarze Niederschlag konnte nach der Vorprobe erwartungsgemäß identifiziert werden: Nach Lösen in CH3COOH/H2O2, Versetzen mit KSCN und Ausschütteln mit Amylalkohol/Ether war die organische Phase blau gefärbt. ⇒ _____ Bei Zusatz von Dimethylglyoxim erfolgte keine Bildung eines roten Niederschlags. ⇒ _____ Als letztes wurde noch der Sodaauszug untersucht. Mit Hilfe der Ringprobe wurde _______ nachgewiesen. Bei Zusatz von Ag+ fiel erwartungsgemäß nach der Vorprobe kein Niederschlag aus, aber beim Hinzufügen von Ba2+. ⇒ _________ 2 Prof. Dr. C. Janiak Analytische Chemie I 7. Aufgabe Vervollständigen Sie durch Einfügen der Produkte oder Edukte die Gleichungen folgender im Trennungsgang wichtiger Reaktionen: (Anmerkung: Die Gleichungen brauchen nicht stöchiometrisch richtig gestellt zu werden) a) Cu2+ + 2 CN– → -- CN–-Überschuss → -- H2S → b) → CrO5 c) Br- + Cl2 → -- Cl2-Überschuss → 2+ d) Cu + NH3 (Überschuss) → e) → Hg + Hg(NH2)Cl f) Fe(SCN)3 + F– (Überschuss) → g) MnSO4 → CO2 -- → MnO4– + MnO2 8. Aufgabe Bei der Trennung der Erdalkali-Kationen nach dem Chromatverfahren nutzt man die unterschiedlichen Löslichkeitsprodukte der Erdalkalichromate aus. Beantworten Sie mit Hilfe einer Rechnung die Frage, ob bei Anwesenheit von jeweils 0.01 mol/l Ba2+ und Sr2+ in einer gepufferten essigsauren Lösung bei pH = 3 eine Trennung gewährleistet sein wird. Die Anfangskonzentration an Dichromat sei 0.1 mol/l. KL(BaCrO4) = 10–10 mol2/l2 KL(SrCrO4) = 10–4.4 mol2/l2 Cr2O72– + 3 H2O ←→ 2 CrO42– + 2 H3O+ K = 10–13 mol3/l3 9. Aufgabe Durch welche Vorprobe können Sie Arsen und Antimon erkennen und unterscheiden? Beschreiben Sie die Durchführung, formulieren und begründen Sie die Reaktionsgleichungen. 10. Aufgabe Wie können Sie aus einer Lösung, die jeweils 10–2 mol/l Cd2+ und Fe2+ enthält, Cadmium quantitativ als Sulfid ausfällen, ohne dass Eisensulfid merklich mitgefällt wird? (Rechnung, Begründung, abschließende Aussage) KL(CdS) = 10–26 mol2/l2 KL(FeS) = 10–20 mol2/l2 –21 3 3 Ionenprodukt von H2S: 10 mol /l 11. Aufgabe Was sind Urotropin und Thioacetamid (Strukturformel)? Wo werden diese Stoffe eingesetzt, und wie kommt ihre Wirkung zustande (Reaktionsgleichung)? Was sind ihre Vorteile? 12. Aufgabe Löst sich Calciumcarbonat bei Zusatz des Liganden EDTA4– auf? Der Ca-EDTA-Komplex mit der Formel [Ca(EDTA)]2– hat (unter geeigneten Bedingungen) eine Stabilitätskonstante β = 1010 L/mol bzw. eine Dissoziationskonstante KD = 10–10 mol/L (Hinweis: Die Formel von EDTA ist hierbei irrelevant.) Das Löslichkeitsprodukt von Calciumcarbonat beträgt 10–8 mol2/L2. 13. Aufgabe Bei welchen Metallionen kann Hexacyanoferrat(II) als sinnvolles Nachweisreagenz eingesetzt werden. Wie sieht der Nachweis aus (Farbe, Formel)? 14. Aufgabe (a) Nennen Sie mindestens 4 Nachweise, bei denen Thiocyanat (Rhodanid) eine Rolle spielt. Thiocyanat kann dabei auch als Komplex gebunden sein. Wie sieht der Nachweis aus (Farbe, Formel)? 3 Prof. Dr. C. Janiak Analytische Chemie I (b) Nennen Sie vier Nachweise, bei denen zweiwertiges Zinn als Reagenz eingesetzt wird. 15. Aufgabe (a) Nennen Sie mindestens 6 Beispiele für Kationen-Nachweise mit organischen Reagenzien, die Sie kennengelernt haben. Es genügt die Angabe des Kations und des Namens des organischen Reagenz. Die Formel muss nicht angegeben werden. (b) Nennen Sie zwei Merkmale die für organische Nachweisreagenzien typisch sind. 16. Aufgabe Auch bei an sich spezifischen nasschemischen Nachweisen können (vorher) Verfahrensfehler gemacht worden sein. Welche Fehler können in den folgenden Fällen vorgelegen haben (Begründung)? (a) Ihre Analyse enthält u.a. Mn! Sie wollen Mn als violettes Permanganat nachweisen durch Oxidation mit Peroxodisulfat in saurer Lösung. Es wird aber keine Violettfärbung erhalten. (b) Ihre Analyse enthält Cu, Cd, As und Sn! Aus Ihrer Analysenlösung fällen Sie zunächst mit TAA die Sulfide. Die Niederschläge werden von der Lösung abgetrennt und mit LiOH/KNO3-Lösung (oder NH4-polysulfid) behandelt, um die Sulfide der As-Sn- von denen der Cu-Gruppe zu trennen. Mit der dadurch erhaltenen Lösung fallen allerdings alle Nachweise auf Arsen negativ aus. 17. Aufgabe Welches Sulfid hat die geringere Löslichkeit: Fe2S3 mit KL = 10–85 mol5/L5 oder CuS mit KL = 10–40 mol2/L2? (Begründung!) 18. Aufgabe Vervollständigen Sie die folgende Tabelle! maßanalytische 1 Beispiel Methode dazu geeigneter Urtiter (zur Herstellung dazu chemischer Indikator oder Einstellung der Maßlösung) Redoxtitration Neutralisationstitration Fällungstitration chelatometrische Titration 19. Aufgabe (a) Nennen Sie die Bestandteile der Reinhardt-Zimmermann-Lösung, die bei der permanganometrischen Titration von Eisen(II) im salzsauren Medium verwendet wird! (b) Nennen Sie die Wirkung(en) oder Funktion(en), die die Bestandteile der ReinhardtZimmermann-Lösung ausüben! (c) Formulieren Sie die Konkurrenzreaktion, die Permanganat in salzsaurer Lösung ohne Zusatz des oben genannten Hilfsstoffs eingeht, in einer Redoxgleichung! (d) Der Fe2+-Gehalt kann ebenfalls durch eine dichromatometrische Titration bestimmt werden. Formulieren Sie die grundlegende Redoxgleichung für diese Bestimmung. (e) Vergleichen Sie entscheidende Vor- und Nachteile der Dichromatometrie und der Permanganometrie. (f) Wie gehen Sie vor, wenn Sie nicht sicher sind, ob sich ein Teil der zu titrierenden Lösung nicht bereits vor der Bestimmung in Eisen(III) umgewandelt hat? 4 Prof. Dr. C. Janiak Analytische Chemie I 20. Aufgabe Eine Iodid-Probenlösung wird in eine Iodlösung überführt und dann mit einer Thiosulfatmaßlösung titriert. (a) Formulieren Sie die Gleichung für die eigentliche Titrationsreaktion. (b) Wie erfolgt die Endpunktsbestimmung? (c) Was ist bei einer Thiosulfatmaßlösung zu beachten? (d) Bei der Überführung von I– in I2 wird zunächst das Iodid mit Brom zum Iodat oxidiert. Wie geht es danach weiter? (e) Warum gelingt die Oxidation von Iodid zu Iodat mit Brom, obwohl die Normalpotentiale lauten: E0(Br2/2Br–) = 1.065 V und E0(IO3–/I–) = 1.083 V? 21. Aufgabe a) Nennen Sie drei Beispiele von Elementen, deren Konzentration Sie mit einer komplexometrischen Titration bestimmen können. b) Erläutern Sie die Bedeutung des pH-Wertes bei einer komplexometrischen Titration mit EDTA. Warum ist ein zu niedriger pH-Wert problematisch? c) Skizzieren Sie die Strichformel von EDTA d) Erläutern Sie das Prinzip der Äquivalenzpunktanzeige bei einer komplexometrischen Titration mit Hilfe eines Indikators. 5