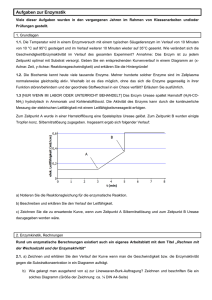
Aus dem Institut für Pharmakologie, Toxikologie und Pharmazie der
Werbung

Aus dem Institut für Pharmakologie, Toxikologie und Pharmazie der Tierärztlichen Hochschule Hannover ______________________________________________________ Untersuchung zur Beeinflussung der Funktion dendritischer Zellen durch Schwermetalle INAUGURAL-DISSERTATION zur Erlangung des Grades einer Doktorin der Veterinärmedizin (Dr. med. vet.) durch die Tierärztliche Hochschule Hannover Vorgelegt von Karoline Hünermann aus Haselünne Hannover 2006 Wissenschaftliche Betreuung: Univ.-Prof. Dr. M. Kietzmann 1. Gutachter: Prof. Dr. M. Kietzmann 2. Gutachter: Prof. Dr. M. Hewicker-Trautwein Tag der mündlichen Prüfung: 22.11.2006 Meiner lieben Familie Inhaltsverzeichnis Inhaltsverzeichnis 1 Einleitung……………………………………………………………………………..…..1 2 Literaturübersicht……………………………………………………………………..…2 2.1 Dendritische Zellen………………………………………………………………….2 2.1.1. Hämatopoese und Reifung der DC………………………………………...5 2.1.2. Steuerung der DC-Funktion…………………………………………………7 2.1.3. Antigenaufnahme, -prozessierung und –präsentation durch DC………..9 2.2 Schwermetalle……………………………………………………………………...11 2.2.1. Definition …………………………………………………………………….12 2.2.2. Vorkommen………………………………………………………………….12 2.2.3. Toxikologie…………………………………………………………………..13 2.3 Blei……………………………..……………………………………………………15 2.3.1. Vorkommen………………………………………………………………….15 2.3.2. Toxikokinetik.………………………………………………………………..15 2.3.3. Toxikologie……………………………………………..……………………16 2.4 Mangan………………………..……………………………………………………17 2.4.1. Vorkommen………………………………………………………………….17 2.4.2.Toxikokinetik…………………………………………………………………18 2.4.3. Toxikologie…………………………………………………………………..18 2.5 Schwermetalle und ihr Einfluss auf Immunreaktionen….……………………..20 2.5.1. Allergische Kontaktdermatitis………………………………………………20 2.5.2. TDI-Kontaktallergiemodell………………………………………………….22 2.5.3. DNCB-Kontaktallergiemodell………………………………………………23 2.5.4. Th1-/Th2-Antwort……………………………………………………………24 2.5.5. In-vitro-Untersuchungen zur Beeinflussung der DC-Maturation und Immunreaktionen durch Schwermetalle…………………………….26 2.5.5.1. MAPKinase-Signalwege und die Wirkungen von Schwermetallen..29 2.5.5.2. Einfluss der Schwermetalle auf die CCR7-Expression……………..30 2.5.6. In-vivo-Untersuchungen zu immunmodulatorischen Effekten durch Schwermetalle………………………………………………………………31 Inhaltsverzeichnis 3 Material und Methoden………………………………………………………………...34 3.1 Geräte und Reagenzien………………………………………………………......34 3.1.1. Geräte für Zellkulturversuche………………………………………………34 3.1.2. Reagenzien für Zellkulturversuche……………………………………......35 3.1.3. Schwermetalle……………………………………………………………….35 3.1.4. Geräte für ELISA…………………………………………………………….36 3.1.5. Geräte für FACS-Analyse…………………………………………………..36 3.1.6. Reagenzien für FACS-Analyse……………………………………...........36 3.1.7. Geräte für Westernblot………………………………………………..........37 3.1.8. Reagenzien für Westernblot……………………………………………….37 3.2 Hergestellte Puffer und Lösungen………………………………………………..38 3.3 Versuchstiere…………………………………………………………………….....40 3.4 Versuchsübersicht………………………………………………………………….41 3.4.1. In-vitro-Untersuchungen……………………………………………………42 3.4.1.1. Generierung von DC…………………………………………………….42 3.4.1.2. Gewinnung von T-Zellen………………………………………………..43 3.4.1.3. Versuchsaufbau…………………………………………………..43 3.4.1.4. Zytokinbestimmung……………………………………………………...45 3.4.1.5. Migrationsassay………………………………………………………….45 3.4.1.6. FACS-Analyse……………………………………………………….......46 3.4.1.7. Untersuchung der MAPKinase pp38 mit Hilfe des Westernblots…..48 3.4.1.8. T-Zellen: MLR, Vitalität und Proliferation…………………………......48 3.4.2. In-vivo-Untersuchungen…………………………………………………….50 3.4.2.1. TDI-Kontaktallergiemodell………………………………………………50 3.4.2.2. DNCB-Kontaktallergiemodell…………………………………………..50 3.4.2.3. Bleibestimmung im Vollblut………………………………………….....51 3.4.2.4. Untersuchung der allergischen Entzündungsreaktion anhand der Lnn. auriculares und der Ohrdickenmessung………………………...51 3.4.2.5. Untersuchung von Lymphknotenzellen aus den Lnn. auriculares….52 Inhaltsverzeichnis 3.4.2.6. Migrationsassay………………………………………………………….53 3.4.2.7. Bestimmung von IL-4 aus dem Ohrhomogenat……………………..53 3.4.2.8. Proteinbestimmung…………………………………………………......53 3.5 Statistische Auswertung……………………………………………………….55 4 Ergebnisse……………………………………………………………………………….56 4.1 In-vitro-Untersuchungen………………………………………………….……56 4.1.1. Einfluss der Schwermetalle auf die Vitalität der DC und T-Zellen, sowie auf die Proliferation der T-Zellen………………………….……56 4.1.2. Einfluss von Blei und Mangan auf die TNF-α-Produktion………......58 4.1.3. Beeinflussung der DC durch Schwermetalle im Migrationsassay….60 4.1.4. Untersuchung der Expression von Oberflächenmolekülen in der FACS- Analyse…………………………………………………………..62 4.1.5. Einfluss von Blei auf die MAPKinase p38…………………………….67 4.1.6. Wirkung der Schwermetalle auf die T-Zellproliferation in der MLR..68 4.2 In-vivo-Untersuchungen……………………………………………………….72 4.2.1. Bleiwerte im Vollblut…………………………………………………….72 4.2.2. Einfluss von Blei auf die entzündliche Ohrschwellung……………...73 4.2.3. Einfluss von Blei auf die lokalen Lymphknoten (Lnn. auriculares)..74 4.2.4. Ergebnisse der Migrationsassays…………………………………….80 4.2.5. Einfluss von Blei auf die Lymphknotenzellen………………………..81 4.2.6. Einfluss von Blei auf die IL4-Produktion im Kontaktallergiemodell..83 5 Diskussion……………………………………………………………………………….84 5.1 Einfluss der Schwermetalle auf die DC- und T-Zellfunktionen …………..84 5.1.1. Einfluss der Schwermetalle auf die Vitalität sowie auf die p38Aktivierung ………………………………………………………………..84 5.1.2. Einfluss von Blei und Mangan auf die TNF-α-Produktion durch DC..85 5.1.3. Einfluss von Blei und Mangan auf die CCR7-Expression……………86 Inhaltsverzeichnis 5.1.4. Beeinflussung der DC-Migration durch Schwermetalle ……………..87 5.1.5. Einfluss von Blei und Mangan auf die CD80/86-Expression………...88 5.1.6. Wirkung von Blei und Mangan auf die T-Zellproliferation……………90 5.2 Einfluss von Blei im Allergiegeschehen……………………………………..93 5.2.1. Einfluss von Blei auf die entzündliche Ohrschwellung…………….....93 5.2.2. Einfluss von Blei auf die lokalen Lymphknoten (Lnn. auriculares)….94 5.2.3. Einfluss von Blei im Migrationsassay…………………………………..95 5.2.4. Einfluss von Blei auf Lymphknotenzellen in der Zellkultur…………..96 5.2.5. Einfluss von Blei auf die IL4-Produktion im Kontaktallergiemodell…96 6 Zusammenfassung……………….…………………………………………………….98 7 Summary………………………………………………………..………………………100 8 Literaturverzeichnis…………………………………………………………………..102 9 Anhang………………………………………………………………………………….115 Abkürzungsverzeichnis Abkürzungsverzeichnis Abb. Abbildung APC Antigenpräsentierende Zellen BC Boyden Chamber CCL Chemokine Ligand CCR Chemokine Receptor CD Cluster of Differentiation DC Dendritic Cell(s), dendritische Zelle(n) DNCB 2,4-Dinitrochlorobenzol ELISA Enzyme-Linked-Immunosorbent-Assay g Gramm GM-CSF Granulocyte-Macrophage Colony-Stimulating Factor IFN Interferon Ig Immunglobulin IL Interleukin i.p. intraperitoneal LPS Lipopolysaccharide mA Milliampere MCP-1 Monocyte Chemoattractant Protein-1 mg Milligramm MHC Major-Histocompatibility -Complex MIP-3β Macrophage-Inflammatory-Protein-3 β ml Milliliter Abkürzungsverzeichnis MLR Mixed Leukocyte Reaction Mn Mangan MW Molekulargewicht OD Optische Dichte PGE2 Prostaglandin E2 PHA Phytohämagglutinin RANTES Regulation and Activated Normal T-cell Expressed and Secreted SDS Sodiumlaurylsulfat Tab. Tabelle TARC Thymus and Activation-Regulated Chemokine TDI Toluendiisocyanat Th T-Helferzelle TLR Toll-like receptor TNF-α Tumor-Nekrose-Faktor α u.a. unter anderem Pb Blei V Volt µmol Mikromol µl Mikroliter Einleitung 1 Einleitung Das Immunsystem ist ein komplexes, den gesamten Organismus durchziehendes Netzwerk mit der Aufgabe, Informationen über die Präsenz körpereigener, harmloser und pathogener Bestandteile zu sammeln, zu bewerten und darauf zu reagieren. Die Antwort besteht entweder in der Ausbildung einer Toleranz oder einer Immunität. Wichtige Komponenten dieses Systems sind immunkompetente Zellen, zu denen auch die dendritischen Zellen (DC) gehören. Sie sind leukozytären Ursprungs und stellen eine bedeutende Gruppe antigenpräsentierender Zellen dar (APC), die in der Lage sind, Antigene aufzunehmen und mit diesen in den regionalen Lymphknoten zu wandern, um dort durch Stimulation von T-Zellen eine Immunantwort zu initiieren. Ziel der vorliegenden Arbeit ist es, Erkenntnisse über die Beeinflussung der Zellfunktionen von murinen DC durch Schwermetalle zu gewinnen. Als Substanzen kommen Blei, Mangan und in den Vorversuchen Zink, Kupfer und Cadmium zum Einsatz. In der Literatur gibt es lediglich Angaben zu dem Metall Nickel und seine Wirkung als Allergen bei der Kontaktdermatitis, sowie zu der Immunmodulation von Splenozyten, B-Zellen und Makrophagen durch Schwermetalle allgemein. In vitro wird der Einfluss der Schwermetalle auf die unterschiedlichen Phasen der DC-Maturation untersucht. Im Mittelpunkt stehen zum einen das Auswanderverhalten stimulierter DC in einem Migrationsassay, sowie die Expression diverser Oberflächenmoleküle nach Schwermetallkontakt untersucht in der Durchflußzytometrie. Die T-Zellstimulation durch DC in der Mixed Leukocyte Reaction (MLR) ist ein weiterer Schwerpunkt dieser Arbeit. In zwei Kontaktallergiemodellen mit den Haptenen Toluen-2,4-diisocyanat (TDI) und 2,4-Dinitrochlorobenzol (DNCB) wird in vivo der immunmodulatorische Effekt von Bleiacetat getestet. Den Balb/c-Mäusen wird diese Substanz in zwei unterschiedlichen Konzentrationen (230 und 2300 ppm) ad libitum über das Trinkwasser angeboten. Die Studien beziehen sich auf das Migrationsverhalten und die T-Zellstimulation der DC untersucht anhand der Ohrschwellung, der Anzahl ausgewanderter Zellen im regionalen Lymphknoten und deren Charakterisierung. 1 Literaturübersicht 2 Literaturübersicht 2.1 Dendritische Zellen Die dendritischen Zellen (DC) sind antigenpräsentierende Zellen und spielen eine wichtige Rolle in der Überwachung und Steuerung der Immunabwehr. Sie werden häufig als die „Wächter des Immunsystems“ bezeichnet, da sie auf der einen Seite das Immunsystem alarmieren und andererseits dessen Reaktionen kontrollieren. Somit spiegeln sie die Verbindung zwischen dem angeborenen und dem erworbenen Immunsystem wider (CAUX et al. 2000). Erstmals wurden die DC als solche von STEINMAN et al. (1973) beschrieben, die durch die eigenartige Zellmorphologie dieser Zellen auf sie aufmerksam wurden. Die DC erhielten ihren Namen aufgrund ihrer baumartig verzweigten Zytoplasmaausläufer (dendron, griech.: der Baum). Abbildung 1 zeigt unterschiedliche Entwicklungsstadien der DC. Abb.1 Unterschiedliche Reifestadien der aus dem Knochenmark einer Maus gewonnenen DC im Phasenkontrastmikroskop 2 Literaturübersicht In den frühen 90er Jahren begannen u.a. INABA et al. (1992) erstmals mit der Kultivierung von DC aus dem murinen Knochenmark. Hierbei konnte man drei unterschiedliche myeloide Zellarten gewinnen, die sich in Morphologie, Wachstumseigenschaften und Oberflächenstrukturen voneinander unterscheiden: Neutrophile Granulozyten, Makrophagen und DC. Die Differenzierung dieser heterogenen Zellgruppe gelang zu dieser Zeit anhand ihrer charakteristischen Zellmorphologie und mit Hilfe monoklonaler Antikörper. INABA et al. (1992) schafften es, größere Mengen unreifer DC zu generieren, indem sie granulocyte-macrophage colony stimulating factor (GM-CSF, ein Schlüsselzytokin für die DC-Reifung) hinzusetzten und die in großen Mengen vorkommenden, nicht adhärenten Granulozyten durch Waschvorgänge entfernten. Übrig blieben proliferierende Cluster bestehend aus DC, die sich locker mit darunterliegendem Stroma der Zellkultur verbanden. Es gelang, eine Zellpopulation von ca. 5x106 Zellen/Maus nach acht bis zehn Tagen mit einer Reinheit von 70% zu kultivieren. Diese Methode zur Generierung von DC wurde einige Jahre später von LUTZ et al. (1999) modifiziert, indem die Dosis von GM-CSF reduziert, die Kultivierungsdauer um zwei Tage verlängert und eine geringere Zelldichte ausgesät wurde. Damit erreichte man eine Reinheit von 65-75% bei einer Zelldichte von 1-3x108 DC/Maus nach 10-12 Tagen Kultivierung (siehe auch in dem Kapitel Versuchsübersicht, Generierung von DC). Mittlerweile konnte man die gewonnenen Zellen mit der FACS-Analyse (siehe Material und Methoden) weiter differenzieren und sie anhand bestimmter Oberflächenmoleküle in immatur und maturiert unterteilen (siehe Tab.1). Tab.1 Einteilung der DC nach den Cluster of Differentiation (CD) (JANEWAY und TRAVERS 1997) CD31/34 MHCII CD11b CD11c CD14 CD25 CD40 CD68 CD80/86 Stammzelle + - - - - - - - - Unreife DC - - + -/+ + - - + - Reife DC - + - + - + + - + (+ = CD exprimiert, - = CD nicht exprimiert) 3 Literaturübersicht Die CD-Moleküle (cluster of differentiation) sind zelltypische oder funktionell exprimierte Oberflächenmoleküle, die jeder einzelnen Zelle des Körpers eine Zugehörigkeit oder eine bestimmte Funktion zuweisen. Bei der DC spielen sie eine wichtige Rolle zur Unterscheidung ihrer Entwicklungsstadien. Das Oberflächenmolekül CD11c ist zum Beispiel ein Oberflächenmolekül, das nur auf reifen DC zu finden ist. Es ist ein Integrin, also ein Zelloberflächenprotein, das in der Lage ist, die Adhäsion zwischen Zellen bei der Immunantwort oder im inflammatorischen Geschehen zu ermöglichen. Weitere wichtige CDs, die im Laufe der DC-Entwicklung eine Rolle spielen, sind die costimulatorischen Moleküle CD80 und CD86, die bei der Interaktion der DC mit naiven T-Zellen für deren Aktivierung sorgen. In diesem Zusammenhang sei auch CD40 genannt, ein Oberflächenmolekül der DC, das ebenfalls bei der T-Zellaktivierung wichtige Funktionen hat und seinen Liganden CD40L auf den T-Zellen bindet (JANEWAY und TRAVERS 1997). Im Folgenden sollen die Entwicklung und unterschiedliche Funktionen der DC dargestellt werden. 4 Literaturübersicht 2.1.1. Hämatopoese und Reifung der DC Die DC entwickeln sich aus Vorläuferzellen, die wiederum von sich immer wieder erneuernden CD34+-Stammzellen aus dem Knochenmark abstammen. DC entwickeln sich sowohl aus der lymphoiden, als auch aus der myeloiden Linie und werden den Leukozyten zugeordnet (siehe Abb.2) (CAUX et al. 2000). Natürliche T-Helferzellen Killerzellen Lymphoide Entwicklungslinie T-Zellen Stammzelle DC Lymphoide Stammzellen KnochenmarkStromazellen CD34 + Makrophagen Neutrophile Granulozyten Eosinophile Granulozyten Myeloide Entwicklungslinie Mastzellen Myeloide Basophile Stammzellen Granulozyten Thrombozyten Erythrozyten Abb.2 Schematische Darstellung der DC-Entwicklung (nach NAIRN 2004) Die in dieser Arbeit nach LUTZ et al. (1999) generierten DC stellen eine von insgesamt vier DC-Subtypen dar (epitheliale, interstitielle, Monozyten-abgeleitete und 5 Literaturübersicht plasmazytoide DC). Die DC unterscheiden sich sowohl morphologisch als auch funktionell voneinander. Allen gemeinsam sind die Phasen der Maturation, die sie während ihrer Funktion als antigenpräsentierende Zellen durchlaufen. Um sich den funktionellen Änderungen während der Reifung anpassen zu können, kommt es im Laufe der Reifung zur Veränderung des Phänotyps. Im ersten Schritt werden proinflammatorische und/oder antivirale Zytokine von Vorläufer-DC im Knochenmark und in der Blutbahn ausgeschüttet. Die zweite Phase ist geprägt von unreifen DC in der Peripherie mit einer geringen Anzahl costimulatorischer Oberflächenmoleküle und einer Heraufregulation endozytotischer Rezeptoren zur Antigenaufnahme. Phase drei spiegelt reife DC wider, die durch inflammatorische Signale (wie z.B. TNF-α, IL-1β) oder LPS während einer Infektion oder Entzündung aktiviert werden, endozytotische Rezeptoren herunterzuregulieren und costimulatorische Oberflächenmoleküle sowie MHCII zu exprimieren. Im Anschluß werden in Phase vier naive T-Zellen stimuliert und folglich eine Immunantwort induziert (CAUX et al. 2000). Nicht alle DC durchlaufen diese Phasen gleichermaßen. Man kann immature und semi-maturierte von maturierten DC unterscheiden. Die immaturen DC kommen im Gewebe vor und verharren solange in einem Steady-state-Zustand, bis sie durch Zytokine oder andere Warnsignale (z.B. TNF-α, LPS) aktiviert werden (McCOLL 2002). Es kommt daraufhin zur Reifung der DC (=maturierte DC) und durch die Stimulation naiver T-Zellen im regionalen Lymphknoten zur Immunreaktion des Organismus gegen das Fremdantigen, also die Bildung von T-Effektor- und Gedächtnis-Zellen. Die semi-maturierten DC, also DC, die nicht vollständig gereift sind, unterscheiden sich von reifen DC durch die fehlende Ausschüttung proinflammatorischer Zytokine. Ihre Funktion besteht darin, Selbstantigen oder apoptotisches Zellmaterial zu den regionalen Lymphknoten zu transportieren und über dort ansässige T-Zellen eine Toleranz zu vermitteln (LUTZ und SCHULER 2002; STEINMAN 2003a). 6 Literaturübersicht 2.1.2. Steuerung der DC-Funktion Sämtliche Aktionen der DC können als eine Reaktion auf Chemokine gesehen werden. Chemokine sind Proteine von einer Größe von 6-14 kDa, die von Zellen sezerniert werden, um das Verhalten meist phagozytischer Zellen oder Lymphozyten hinsichtlich ihrer Wanderung und Aktivierung zu beeinflussen (JANEWAY und TRAVERS 1997). Durch das Zusammenspiel der chemotaktischen Substanzen einerseits und der Expression spezifischer Rezeptoren auf Leukozytenoberflächen andererseits kommt es zur Migration der Entzündungszellen entlang eines chemotaktischen Gradienten auf einer somit festgelegten Route. In Tabelle 2 ist eine Übersicht über einige wichtige Chemokinrezeptoren sowie ihrer Liganden gegeben. Die für diese Arbeit relevanten Substanzen sind hervorgehoben. Tab.2 Nomenklatur einiger Chemokine mit Hervorhebung der für diese Arbeit relevanten Substanzen (McCOLL 2002) Rezeptor Ligand systematischer Name Mensch CCR 2 CCL 2 MCP-1, MCAF JE CCR 5 CCL 3 MIP-1α MIP-1α CCR 5 CCL 4 MIP-1 β MIP-1 β CCR 5 CCL 5 RANTES RANTES CCR 7 CCL 19, CCL 21 MIP-3β, ELC MIP- 3β, ELC Die Chemokine lassen sich funktionell Maus in inflammatorische und homöostatische unterteilen: inflammatorische Chemokine, wie z.B. CCL2/MCP-1, CCL3/MIP-1α, CCL4/MIP-1β und CCL5/RANTES, werden zur Rekrutierung immaturer DC und T-Zellen von DC in deren frühen Reifungsphase sezerniert. Dieses geschieht im peripheren Gewebe nach Kontakt mit Pathogenen, um einen möglichst hohen Influx von Entzündungszellen zu erreichen. Homöostatische Chemokine (CCL19/MIP-3β, CCL22/MDC) werden vorrangig von reifen DC in den T- und B-Zell-Zonen sekundärer lymphoider Organe, wie z.B. Lymphknoten oder 7 Literaturübersicht Milz, gebildet. Sie sorgen für den Nachschub von DC aus der Peripherie und das Anlocken naiver T-Zellen, die wiederum mit dem Chemokinrezeptor 7 (CCR7) ausgestattet sind. Zuletzt gibt es auch solche Chemokine, die beiden Gruppen zugeordnet werden können und sowohl im peripheren Gewebe als auch in Lymphorganen anzutreffen sind (CCL17/TARC, CCL20/MIP-3α) (LEBRE et al. 2005). DC gelten somit als große „Chemokinquellen“, wobei es vom Reifestadium der DC abhängt, welche Chemokine sie in der Lage sind zu sezernieren. In der frühen Reifungsphase werden inflammatorische, in der späteren Reifephase homöostatische Chemokine ausgeschüttet (siehe Abb.3). CCR7 Ag maturierte DC (mDC) CCL2 /3/5 drainierendes Lymphgefäß CCR1/2/5/6 Blutgefäß Immature DC (iDC) CCL19/ MIP-3β naive TZellen Immunantwort MHCII mDC CD40 CD80/86 (Immunität, Toleranz) sekundäres Lymphorgan (Lymphknoten/Milz etc.) Chemokine Chemokinrezeptoren Oberflächenmoleküle Abb.3 Schematische Darstellung des Zusammenhanges zwischen Chemokinen und der DC-Reifung, in Anlehnung an LEBRE et al. (2005) und McCOLL (2002) 8 Literaturübersicht 2.1.3. Antigenaufnahme, -prozessierung und –präsentation durch DC Das Immunsystem ist ständig damit beschäftigt, Fremd- oder Selbstantigene im Organismus zu kontrollieren und zu erkennen. Im Bezug auf die DC gibt es vorwiegend zwei bisher bekannte Mechanismen, wie sie Antigene aufnehmen und den T-Zellen präsentieren können. Die erste und auch zugleich schnellere Art ist die Aufnahme von Antigenen durch residente DC im Lymphknoten (innerhalb weniger Minuten). Dieser enthält ein dreidimensionales Netzwerk bestehend aus Retikulumzellen, deren Stabilität durch Retikulumfasern gewährleistet wird. In diesem Netzwerk befinden sich neben Lymphozyten, Plasmazellen und Makrophagen immature DC, die mit der Basalmembran dieses „Conduit-Systems“ verbunden sind. Die Funktion des Netzwerkes ist die Verbindung afferenter Lymphgefäße mit den Venolen des Lymphknotens, damit kleine lösliche Substanzen (<70 kDa) direkt vom subcapsulären Sinus in die kleinen Venolen gelangen, ohne die B-/T-Zell-Zone zu durchlaufen. Dieses System ermöglicht es, dass z.B. Chemokine bei inflammatorischen Prozessen auf dem schnellsten Weg Leukozyten alarmieren können. Ein anderer Vorteil ist die direkte Aufnahme von löslichen Antigenen durch die residenten, immaturen DC, die darauf eine Reifung durchmachen und folglich in der Lage sind, Antigen über MHCII den T-Zellen zu präsentieren (SIXT et al. 2005). Der zweite Mechanismus, der zwischen acht und zwölf Stunden in Anspruch nimmt, stellt die Aufnahme von Pathogenen durch DC z.B. in einem Entzündungsgeschehen dar. Immature DC besitzen durch ihre große Anzahl antigenbindender Rezeptoren (z.B. CD40, TLR, Fcγ-, Fcε- und Langerinrezeptoren) eine hohe Phagozytosekapazität (WALLET et al. 2005). Antigen wird von DC durch Endozytose aufgenommen und an MHCII gebunden. Einmal aktiviert, werden costimulatorische Moleküle (CD 40/54/80/86), sowie diverse Chemokinrezeptoren (CCR5/7) exprimiert, um es den nun reifenden DC zu ermöglichen, aus dem Entzündungsgebiet in den drainierenden Lymphknoten auszuwandern und die Antigene den T-Zellen zu präsentieren. Während dieses Prozesses wandern die DC ausgehend vom lymphatischen Gewebe entlang eines chemotaktischen Gradienten (MIP-3β, CCL19/21) (STEINMAN et al. 2003b). Im Lymphknoten kommt es zur 9 Literaturübersicht Interaktion zwischen DC und T-Zellen durch Oberflächenmoleküle, wie z.B. CD40 und dem Liganden CD40L, sowie durch CD80 und CD86 und dem Ligand CD28 auf den T-Zellen. Nachdem diese Rezeptoren gebunden haben, wird eine intrazelluläre Kaskade ausgelöst, unter anderem werden MAPKinasen wie p38 aktiviert. In Folge dessen kommt es zur Ausschüttung proinflammatorischer Zytokine (IL-6, IFN-γ) und zur Aktivierung weiterer T-Zellen. Da immature DC in der Peripherie nicht ausschließlich Pathogene oder Fremd-Antigene phagozytieren, sondern auch körpereigene Substanzen, wie z.B. apoptotische Zellen, ist es wichtig, dass es nicht immer zu einer Immunreaktion über eine T-Zellaktivierung kommt. Da die DC in der Lage sind, Immunantworten zu steuern, kommt es z.B. nach Aufnahme von apoptotischen Zellen zu einer reduzierten Produktion von IL-12 und zu vermehrter IL-10-Ausschüttung, womit die Aktivierung der T-Zellen inhibiert und folglich eine Toleranz erreicht wird (WALLET et al. 2005). Tab.3 Übersicht der DC und ihrer typischen Charakteristika zu bestimmten Entwicklungsstadien DCEntwicklungs- Stammzelle Stadium OberflächenMoleküle CD34+ Vorläuferzelle (myeloid/lymphoid) CCR2 Immature DC Maturierte DC CCR1/2/5/6, CCR7 MHCII, CD40, TLR, MHCII, CD40/80/86 Fcγ-, Fcε- und CCL19/21, Langerinrezeptoren Langerinrezeptoren↓ IL-8, CCL3/4/5 CCL17/18/19/22 Zytokin-/ Chemokinaus- --- --- CCL2 schüttung Vorkommen Knochenmark Knochenmark, Gewebe, Blut Lymphknoten Aufnahme, Ausbildung von --- Expression über Toleranz/Immunität Reaktion auf Antigene ---- sek. lymphat.Organe MHCII Interaktion Zellen T- Präsentation, --- --- nicht möglich Stimulation T-Zellen + Toleranzinduktion 10 Literaturübersicht 2.2 Schwermetalle Die meisten bekannten Elemente auf der Welt zählen zu den Schwermetallen. Insgesamt haben davon 30 toxikologische Bedeutung (RÖMPP 1996). In Abbildung 4 sind die für diese Arbeit relevanten Schwermetalle und ihre Stellung im Periodensystem dargestellt. Hauptgruppen Ia-VIIIa Ia IIIa IVa Va VIa VIIa VIIIa He 1 H IIa Li Be Na Mg IIIb IVb Vb VIb VIIb VIIIb VIIIbVIIIb Nebengruppen C N O F Ne 2 IIb Al Si P S Cl Ar 3 As Se Br Kr 4 Sb Te Xe 5 B Ib Mn Fe Co Ni Cu Zr Nb Mo Tc* Ru Rh Pd Ag Hf Ta W Re* Os Ir Pt Au Rf* Db* Sg* Bh* Hn* Mt* Uun* Uuu* Uub* Uut* Uuq* 115* Uuh* 117* Uuo* 7 Lantanoide La Ce Pr Nd Pm* Sm Gd Tb Dy Ho Lu 6 2 Ac* Th* Pa* U* Np* Pu* Am* Cm* Bk* Cf* Es* Fm* Md* No* Lr* 7 K Ca Sc Ti Rb Sr Y Cs Ba 1 Fr* Ra* 2 1 Actinoide V Cr Eu Ga Ge Zn Cd In Hg Tl Sn Pb Bi Er I Po* At* Rn* 6 Tm Yb Abb.4 Stellung der Schwermetalle Blei (Pb), Kupfer (Cu), Zink (Zn), Mangan (Mn) und Cadmium (Cd) im Periodensystem der Elemente In der vorliegenden Arbeit wurden fünf Schwermetalle (Blei, Mangan, Kupfer, Zink und Cadmium) in den Konzentrationen 1, 10 und 100 µmol/l (bei Cadmium 0,1 anstatt 100 µmol/l) verwendet. Nachdem in Vorversuchen ersichtlich wurde, dass sie die dendritischen Zellfunktionen in ähnlicher Art und Weise beeinflussen, wurden die Hauptversuche repräsentativ mit Blei und Mangan in den Konzentrationen 1,10 und 100 µmol/l durchgeführt. Mangan ist als Vertreter einer Substanz ausgewählt 11 Literaturübersicht worden, die in geringer Dosis essentiell ist; Blei hingegen als ein Metall, das gerade im chronischen Geschehen toxische Auswirkungen hat. 2.2.1. Definition Zu den Schwermetallen zählen alle natürlichen metallischen Elemente einer Dichte > 5 g/cm³. Die Gruppe der Schwermetalle umfasst viele Elemente, u.a. Quecksilber, Blei, Kadmium, Kupfer, Arsen, Nickel, Zink, Kobalt und Mangan. Abzugrenzen von den Schwermetallen sind die Leichtmetalle, also Metalle, deren Reingewicht < 5 g/cm3 ist (z.B. Natrium, Calcium, Magnesium, Aluminium) (RÖMPP 1996). Man unterscheidet lebensnotwendige (essentielle) Schwermetalle (z.B. Zink, Eisen, Mangan, Kupfer), die für uns Menschen als Spurenelemente in der Ernährung wichtig sind, von giftigen (z.B. Cadmium, Quecksilber, Blei). Schwermetalle sind natürliche Bestandteile der Erdkruste. Sie werden durch Verarbeitung oder Nutzung durch den Menschen als Emissionen, flüssiger oder fester Abfall (Klärschlamm) und mit Agrochemikalien der Umwelt zugeführt (Bioakkumulation), wodurch sie in die Nahrungskette gelangen. Beispiele für Schwermetallquellen aus der Industrie ist die Kunststoffverarbeitung (z.B. Cadmium), die Metallveredelung (z.B. Chrom, Cadmium) oder der Einsatz von Schwermetallen als Katalysatoren (z.B. Nickel). Schwermetalle werden z.B. von Pflanzen aus dem Boden aufgenommen, gelangen über die Nahrungskette direkt oder über Tiere zum Menschen und schließlich wieder in den Boden. Eine Reihe von Schwermetallen reichern sich an Stellen dieses Kreislaufes an und führen ab einer bestimmten Konzentration zur Kontamination von Boden und Vergiftung von Pflanze, Tier oder Mensch (MARQUARDT und SCHÄFER 2004). 2.2.2. Vorkommen Die Quellen für die erhöhte atmosphärische Belastung mit Metallen sind u.a. in der Verbrennung fossiler Brennstoffe, wie Kohle und Erdöl zu suchen. Diese Brennstoffe enthalten als Bestandteile der mineralischen Verunreinigungen auch Metalle. So wird ein großer Teil der Arsen-, Kupfer- und Quecksilberemissionen beim 12 Literaturübersicht Abbrand von Kohle freigesetzt. Eine andere wichtige Quelle für atmosphärische Emissionen stellen zum einen Herstellungsprozesse, Verhüttung und Gewinnung von Erzen in Eisenschmelzöfen, sowie in Zinkhütten dar. Zum anderen entstehen Stäube durch die Verbrennung von kommunalen Müllabfällen, was besonders bei der Belastung durch Quecksilber eine große Rolle spielt. Letztlich entsteht eine hohe Belastung durch Gehalte von Batterien in städtischen Abfällen, die am Ende zu quecksilberhaltigen Klärschlamm und, bei dessen Verbrennung, zu belastete Staub führen. Da die Substanzen Mn(CO)3 und MMT (Methylcyclopentadienyl-MnTricarbonyl) das Tetraethylblei als Antiklopfmittel im Benzin ersetzt haben, könnten auch diese in naher Zukunft toxikologisch relevant werden. Aus der Atmosphäre gelangen die Metalle direkt oder auf dem Umweg über Lebensmittel und Wasser in den Organismus, wo sie infolge zum Teil langfristiger Speicherung chronische Schäden hervorrufen können (MARQUARDT und SCHÄFER 2004). 2.2.3. Toxikologie Metalle haben von Alters her eine große toxikologische Bedeutung. Der Gebrauch von Blei z.B. geht etwa auf die Zeit 2000 v. Chr. zurück. Hippokrates hat schon 370 v. Chr. Symptome bei Erzarbeitern beschrieben, die einer Darmkolik entsprechen und vermutlich auf eine Bleivergiftung zurückgingen. Auch Arsen und Quecksilber sind im Altertum verwendet worden. In der Medizin waren ehemals Verbindungen des Arsens, Antimons und Quecksilber in Gebrauch. Metalle haben weiterhin große arbeitsmedizinische Bedeutung. Neuerdings findet der umwelttoxikologische Aspekt der Metalltoxikologie besondere Aufmerksamkeit, wobei Blei, Quecksilber und Cadmium im Vordergrund des Interesses stehen. Die allgemeinen Wirkungen der Metalltoxizität sind abhängig von der Verteilung im Organismus und spiegeln sich unterschiedlich wider. Je nach Schwermetall kommt es zur Anreicherung in einem oder mehreren Organen mit Störungen der Organfunktionen bzw. einzelner Zellstoffwechselvorgänge. 13 Literaturübersicht Beispiele hierfür sind im Folgenden aufgeführt: - Ätzwirkung (z.B. Hg²+ ) - Neurotoxizität (z.B. Pb²+ ) - Nierentoxizität (z.B. Hg²+ ) - Kanzerogenität (z.B. As³+ ) - Verdrängung essentieller, regulatorisch wirksamer Metallionen, wie z.B. Ca²+, Mg²+ und Zn²+ aus ihren Komplexen - Fe, Cr, Cu, V katalysieren durch Redoxzyklen die Bildung von ROS (Superoxidanionradikal und Hydroxylradikal) - Cd, Hg, Ni, Pb vermindern Glutathion und Protein-SH mit der Folge der ROS-Bildung - Störung von Signalwegen und Hemmung der DNA-Reparatur (AKTORIES et al. 2004; MARQUARDT und SCHÄFER 2004) Viele Metallionen können mit SH-Gruppen schwer lösliche Verbindungen eingehen. Darüber hinaus können sie mit sauerstoff- oder stickstoffhaltigen Gruppen in verschiedenen Molekülen Komplex-Verbindungen bilden (Chelate). Auf derartige Komplex-Bindungen beruhen viele physiologische Funktionen essentieller Metalle (Beispiel: Eisen im Hämoglobin); prinzipiell analog dürften auch die toxischen Metalle wirken, wobei essentielle Metalle aus ihrer Komplex-Bindung verdrängt werden oder neue Komplexe entstehen können. Trotz dieser grundsätzlichen Gemeinsamkeiten im Wirkungsmechanismus sind die von den einzelnen Metallen ausgelösten Vergiftungsbilder sehr unterschiedlich und weitgehend spezifisch für das jeweilige Agens (MARQUARDT und SCHÄFER 2004). 14 Literaturübersicht 2.3 Blei Blei (lat. plumbum) ist ein Element, das seinen Namen aus dem Indoeuropäischen hat und soviel wie schimmernd, leuchtend oder glänzend bedeutet. Im Periodensystem hat Blei das Symbol Pb, besitzt die Ordnungszahl 82 und befindet sich in der Hauptgruppe IVa mit der Periodenzahl 6. Die Dichte beträgt 11,34 g/cm3. Der Schmelzpunkt liegt bei 327,5 °C, der Siedepunkt bei 1750 °C. Pb 208 ist mit 52,4 % das häufigste stabile Blei-Isotop in der Natur, gefolgt von Pb 204 (24,1 %) und Pb 207 (22,1 %). Auf der Liste der Elementhäufigkeiten in der Erdhülle nimmt Blei Platz 35 ein (RÖMPP 1996). 2.3.1. Vorkommen Blei kommt in der Natur meist in Form von PbS (Bleiglanz) vor. Im industriellen Bereich findet man es als PbO oder Pb3O4 (Mennige) in Bleifarben, sowie als Oberflächenschutz in älteren Wasserrohren. Durch industrielle Emissionen gelangt es in die Natur und ist dadurch in geringen Konzentrationen in Pflanze und Tier nachweisbar. In der Medizin kommt Blei als Burow´sche Mischung vor, welche aus Bleiacetat, Alaun und Wasser hergestellt wird und der Behandlung von Phlegmonen, Wunden und Hautentzündung diente (HAPKE 1988). 2.3.2. Toxikokinetik Organische Bleiverbindungen, wie z.B. Bleitetraäthyl oder Bleitetramethyl, werden im Gegensatz zu anorganischen Bleiverbindungen wegen ihrer hohen Lipidlöslichkeit fast vollständig enteral resorbiert. Im Blut binden sie an Erythrozyten und Albumine und stören infolgedessen deren Funktionen. Bei der Inhalation wird je nach Partikelgröße und Löslichkeit 50-80% des Bleis aus der Luft resorbiert und wiederum im Blut gebunden. Die Hauptmengen (95%) des Bleis werden bei konstanten Bleiblutwerten (> 0,5 mg/L Blut) im Knochen als Bleiphosphat (Pb3(PO4)2) gebunden und insbesondere in den Verkalkungszonen gespeichert. Es wird mit einer Halbwertzeit 15 Literaturübersicht von ca. 30 Jahren wieder freigesetzt, jedoch kann dieser Vorgang bei Fieber oder Streßreaktionen beschleunigt werden und zu einer erneuten Intoxikation führen (sog. Bleikrise). Auch Zähne und Haare speichern Blei und können retrospektiv zur Feststellung einer Bleibelastung herangezogen werden. Unter Normalbedingungen besteht zwischen täglicher Aufnahme und Ausscheidung ein Gleichgewicht. Die Elimination von Blei erfolgt über die Nieren und mit dem Kot. Zur Übersicht siehe Abbildung 5 (HAPKE 1988). Nahrung Inhalation BLEI 98 % 2% Knochen andere Gewebe 95 % 5% 1% Leber Nieren 95 % 4% Abb. 5 Verteilung und Ausscheidung von Blei (in %) im Organismus (HAPKE, 1988) 2.3.3. Toxikologie Zufuhr größerer Bleimengen kann zu akuten Vergiftungen (Saturnismus) führen. Blei wirkt im akuten Geschehen wenig toxisch, doch kann es zu chronischen Vergiftungen durch die Aufnahme kleiner Mengen über einen längeren Zeitraum kommen. Die Halbwertzeit von Blei im Weichgewebe beträgt ca. 20 Tage, im Knochen hingegen 5-30 Jahre. Typische Krankheitsbilder einer chronischen Bleivergiftung sind Darmkoliken, Nierenschäden und Muskelschwäche, sowie 16 Literaturübersicht Kopfschmerzen, Müdigkeit, Abmagerung und Defekte der Blutbildung und des Nervensystems. Schwerere Symptome treten beim Erwachsenen bei einer Überschreitung des normalen Blutbleispiegel um etwa das 10-fache auf, jedoch sind erste Anzeichen, denen noch kein wesentlicher Krankheitswert zugeordnet werden kann, bereits bei geringfügiger Erhöhung der Werte zu verzeichnen. Der Provisional Tolerable Weekly Intake (PTWI) für Blei beim Menschen liegt bei 25 µg Pb/kg KM. Erste Symptome einer Bleiintoxikation beim Menschen erscheinen bei Blutbleigehalten von >15 µg/100ml Vollblut, chronische Enzephalopathien treten bei Konzentrationen ab einem Bleigehalt von 50 µg/100ml im Blut auf. Blei ist wahrscheinlich der Umweltschadstoff, bei dem der geringste Sicherheitsabstand zwischen der derzeitigen Belastung der Bevölkerung und krankmachenden Intoxikationen besteht (AKTORIES et al. 2004; MARQUARDT und SCHÄFER 2004). 2.4 Mangan Mangan (Mn) ist ein silbrig-metallisches Element und steht in der Elementhäufigkeit an 14. Stelle, womit es zu den relativ häufigen Elementen in der Erdkruste gehört. Es tritt in der Natur nicht elementar auf, kommt aber in zahlreichen Erzen in chemisch gebundener Form vor. Das wichtigste Manganerz ist der Pyrolusit (Mangandioxid, MnO2). Mangan hat die Ordnungszahl 25, der Schmelzpunkt liegt bei 1244 °C, der Siedepunkt bei 1962 °C und die Dichte beträgt 7,47 g/cm³ (RÖMPP 1996). 2.4.1.Vorkommen In der Natur kommt Mangan häufig in Verbindung mit Eisen in dessen Erzen vor. Industriell spielt Mangan eine Rolle bei der Herstellung von Stahl, Metall, Gläsern, Keramik und bei der Produktion von Ferrolegierungen. Es wird außerdem als Düngemittel eingesetzt und gelangt dadurch in die Natur. 17 Literaturübersicht 2.4.2. Toxikokinetik Gebundenes Mangan ist ein essentielles Spurenelement für alle Lebensformen. Es aktiviert Enzyme und steigert die Verwertung des Vitamin B1, außerdem ist es wichtig für die Insulinproduktion der Bauchspeicheldrüse. Der menschliche Körper enthält etwa 10- 40 mg Mangan, der größte Anteil (ca. 40%) befindet sich im Knochen. Täglich sollten ungefähr 4 mg aufgenommen werden. Manganreich sind Nüsse, Vollkornprodukte, Keimlinge, Erdbeeren und Kakao. Milch, Mineralwässer, und manche Trinkwässer hingegen sind manganarm (MARQUARDT und SCHÄFER 2004). Nachdem Mangan resorbiert wurde, wird es in der Leber und in den Nieren gespeichert. Die Ausscheidung erfolgt biliär, über den Harn werden nur Mengen um die 0,01 mg/L ausgeschieden (HAPKE 1988). 2.4.3. Toxikologie Neben Eisen, Kobalt, Kupfer, Zink, Selen, Molybdän und Jod handelt es sich bei Mangan um ein essentielles Spurenelement. Diese Bezeichnung trifft auf solche Substanzen zu, die in allen Geweben regelmäßig nachweisbar sind, zu Mangelerscheinungen nach Entzug führen und gleichzeitig biochemische Defekte auf molekularer Ebene verursachen können. In Tierversuchen wirkt Mangan in hohen Dosen verabreicht kanzerogen. Hierbei wird ein für die Kanzerogenese allgemeingültiger Mechanismus bei Metallen angenommen: durch die Metalle werden in Säugerzellen reaktive Sauerstoffe gebildet, die diverse DNA- Veränderungen zur Folge haben (Strangbrüche, oxidierte Basen). Zusätzlich sind Metalle in der Lage, durch Inhibition detoxifizierender Enzyme die Abwehrmechanismen der Zelle gegen oxidativen Streß zu schwächen, sowie die DNA-Reparaturen durch die Hemmung der dafür zuständigen Enzyme zu stören. Mangan hat im katalytischen Zentrum einiger Enzyme, wie z.B. Peptidasen, wichtige Funktionen (AKTORIES et al. 2004). Toxikologische Bedeutung erlangt Mangan im Bergbau oder bei der Produktion von Batterien oder Legierungen. Dieses kann zu einer erhöhten Aufnahme und zu unterschiedlichen Folgeerscheinungen führen. So kann es bei 18 Literaturübersicht Exposition über Monate oder Jahre zu einem „Manganismus“, einer parkinsonähnlichen Erkrankung kommen. Diese chronische Intoxikation führt zu einer zentralen Zerstörung von Neuronen. Hierbei kommt es durch Entstehung von freien Radikalen zu einer oxidativen Schädigung, die mit motorischen Störungen wie Ataxie, Rigidität und feinem Tremor einhergehen (AKTORIES et al. 2004). Dieses Krankheitsbild wird auch als „Mangan-Wahnsinn“ bezeichnet. Eine andere Erkrankung, die häufig bei Arbeitern im Erzbergbau auftrat, ist die „Manganpneumonie“. Sie ist charakterisiert durch hohes Fieber und kann im schlimmsten Fall auch tödlich enden. Eher selten kommt es zur akuten Intoxikation durch Mangan. Beschrieben ist die Vergiftung durch das Verschlucken von Kaliumpermanganat, das auch als Desinfektionsmittel Verwendung findet. Es kommt zu schweren Verätzungen und einer Gastroenteritis; die letale Dosis von KMnO4 beträgt 5-8 g für den Menschen. Die empfohlene maximale Arbeitsplatzkonzentration (MAK) für Mangan liegt bei 0,5 mg/m³ (MARQUARDT und SCHÄFER 2004). 19 Literaturübersicht 2.5 Schwermetalle und ihr Einfluss auf Immunreaktionen In der Literatur wird bei Untersuchungen mit Schwermetallen die Unterscheidung zwischen Irritantien und Allergenen getroffen (AIBA 1998). Hierbei werden solche Substanzen als Irritantien bezeichnet, die lediglich zu einem inflammatorischen Geschehen führen. Allergene, auch in Form von Haptenen, führen dagegen zu einer Sensibilisierung und bei erneutem Kontakt mit der gleichen Substanz zu einer Überempfindlichkeitsreaktion z.B. in Form einer Kontaktdermatitis (DE SMEDT et al. 2001). Die in dieser Arbeit zusammen mit Bleiacetat zur Anwendung gekommenen In-vivo-Untersuchungen mit TDI und DNCB stellen eine Art dieser Kontaktallergien dar und sollen daher im Anschluß erläutert werden. Es wird hierbei zwischen der Induktion einer Th1- und einer Th2-Antwort als Reaktion der unterschiedlichen Allergene unterschieden. 2.5.1. Allergische Kontaktdermatitis Es handelt sich hierbei um eine inflammatorische Hauterkrankung, die als Konsequenz einer gesteigerten Allergenexposition auftritt und durch das Zusammenwirken von DC, T-Zellen und Zytokinen vermittelt wird (NASORRI et al. 2002). Die Kontaktdermatitis tritt als Allergie vom Typ I (Soforttyp/ Anaphylaxie) und Typ IV (zellvermittelter/ verzögerter Typ) auf. Der Typ I ist charakterisiert durch eine Ig-E-vermittelte Reaktion auf das lösliche Allergen innerhalb von 15 Minuten. Hierbei werden inflammatorische Zytokine (z.B. Leukotrien C4) und Histamin aus in der Sensibilisierungsphase stimulierten Mastzellen und basophilen Granulozyten freigesetzt; dies führt zu einer Vasodilatation und zur Kontraktion glatter Muskulatur. Die Symptome zeigen sich lokal als Urtikaria, Ekzem, Asthma oder systemisch als Anaphylaxie (MARQUARDT und SCHÄFER 2004). Als Typ IV wird dagegen jene Hypersensitivität bezeichnet, die nach Allergenkontakt verzögert auftritt. Man unterteilt eine Allergie in die Sensibilisierungs- und die Auslösephase. In der Sensibilisierungsphase werden naive T-Zellen aktiviert und differenzieren zu 20 Literaturübersicht T-Gedächtnis-Zellen aus. In der anschließenden Auslösephase werden die ausdifferenzierten T-Gedächtniszellen lokal aktiviert und zu T-Effektorzellen umgewandelt; außerdem kommt es zur Ausschüttung diverser Zytokine und Chemokine. Sensibilisierungsphase: Haptene, die aufgrund ihrer geringen Größe nicht vom Immunsystem erkannt werden, binden an lösliche oder zellständige Proteine und bilden somit einen Antigen-Komplex. Ausgehend von der Haut werden Haptene von ansässigen dendritischen Zellen, den Langerhanszellen (LC), aufgenommen und durch gleichzeitige Interaktion mit Keratinozyten via afferenter Lymphbahnen zum regionalen Lympknoten transportiert. Die DC durchlaufen während dieser Wanderung eine Reifung und sind nach der Antigenaufnahme in der Lage, ihr Antigen naiven T-Zellen im Lymphknoten zu präsentieren. BECKER und KNOP (1992) konnten bei humanen DC in diesem Zusammenhang die Aktivierung intrazellulärer MAPKinasen (ERK1/2) durch Kontaktallergene (nicht aber durch Irritantien) nachweisen. Im regionalen Lymphknoten werden die T-Zellen durch zwei voneinander abhängige Signale aktiviert: zum einen werden entweder MHCI- oder MHCIIMoleküle exprimiert. Zum anderen muß es zur Expression costimulatorischer Moleküle wie B7.1, B7.2 (=CD 80/86) und ICAM 1 kommen. Nur beide Signale zusammen führen zu einer durch aktivierte T-Zellen resultierenden klonalen Expansion von T-Gedächtnis-Zellen. Der letzte Schritt der Sensibilisierungsphase besteht in dem Auswandern der T-Gedächtniszellen, was durch bestimmte exprimierte Oberflächen- und Adhäsionsmoleküle, sowie Chemokinrezeptoren ermöglicht wird. Auslösephase (Challenge): Bei sekundärem Antigenkontakt wird die Auslösephase eingeleitet. Hier wird zwischen einer Antigen-unspezifischen und einer Antigen-spezifischen Phase unterschieden. In ersterer kommt es zur Freisetzung entzündlicher Mediatoren durch Keratinozyten. Mastzellen werden aktiviert, Chemokine und andere Entzündungsmediatoren freigesetzt. Daraufhin kommt es zur Rekrutierung und Aktivierung von Granulozyten, Makrophagen und den dendritischen Zellen. Während die erste Phase anläuft, kommt es zur Aktivierung 21 Literaturübersicht haptenspezifischer T-Gedächtniszellen, die sich in T-Effektorzellen umwandeln, Mediatoren (z.B. IFN-γ) freisetzen und zytotoxisch wirken (RIEMANN et al. 2003). Durch eine erhöhte Gefäßpermeabilität und Plasmaexsudation kommt es zur Entstehung typischer Symptome der Kontaktdermatitis (Erythem, Ödem, Vesikulation), deren vollständige Ausbildung bis zu 72 Stunden dauern kann. Aus diesem Grund wird sie als verzögerter Typ bezeichnet (MARQUARDT und SCHÄFER 2004). 2.5.2. TDI-Kontaktallergie-Modell TDI (Toluen-2,4-diisocyanat) ist ein niedermolekulares Antigen, das im Tiermodell eine Hypersensitivitätsreaktion vom Soforttyp und vom verzögerten Typ auslöst. FUCHIBE et al. (2003) haben in einer Studie an haarlosen Mäusen mit TDI eine Sensibilisierung durch epicutane Applikation von 1% TDI erzeugen können. Den Tieren wurde TDI über fünf Tage auf die Bauchhaut gegeben, die Challenge erfolgte durch wiederholte Gabe von 0,1% TDI auf die zervikodorsale Haut alle zehn Tage. Nach der sechsten Challenge zeigte sich eine Allergie vom verzögerten Typ. 0,1% TDI allein hatte keinen Effekt bei nicht sensibilisierten Mäusen, von daher wurde eine Aktivierung von T-Gedächtniszellen beim Zweitkontakt in der Challenge angenommen. TOMINAGA et al. (1985) haben in einem anderen Versuchsansatz TDI auf die Ohrhaut von sensibilisierten Mäusen aufgetragen und nach 20 Stunden eine Ohrschwellung feststellen können. Zusätzlich kam es hier bei wiederholter TDIVerabreichung neben der Allergie vom verzögerten Typ auch zu einer Sofortreaktion in Form von einer Ohrschwellung, begleitet von einem Anstieg von TDI-spezifischen IgE im Serum. Dieses galt als Zeichen einer gleichzeitig stattfindenden zellulären und humoralen Immunausbildung (FUCHIBE et al. 2003). Dass TDI primär zu einer Th2induzierten Immunantwort führt, zeigten DEARMAN et al. (1996) anhand von Messungen erhöhter IgE-Spiegel im Blut und erhöhter IL-4- und IL-10-Produktion durch Lymphknotenzellen von TDI-sensibilisierten Mäusen. In Arbeiten von BÄUMER et al. (2004, 2005) ist das TDI-Modell, zum Teil auch zusammen mit dem DNCBModell (siehe dort), zum Einsatz gekommen. Hierbei wurde der Effekt von TDI anhand eines Mouse-Ear-Swelling-Tests (MEST), also einer Induktion einer 22 Literaturübersicht entzündlichen Ohrschwellung, durch das Allergen gezeigt. Weiterhin ist in einem Local-Lymphnode-Assay (LLNA) der Einfluss von TDI auf die lokalen Lnn. auriculares untersucht worden. Es zeigte sich eine gesteigerte Interaktion mit naiven T-Zellen in den lokalen Lymphknoten, sowie eine erhöhte Migrationsbereitschaft stimulierter DC. Diese Eigenschaft konnte ebenfalls in einem Skinmigrationsassay gezeigt werden, in dem die Anzahl ausgewanderter DC aus TDI-sensibilisierten Ohren bestimmt wurde (BÄUMER et al. 2005). 2.5.3. DNCB-Kontaktallergie-Modell Dieses Allergiemodell ist in etwa vergleichbar mit dem TDI-Modell. Es kommt allerdings, so HOPKINS et al. (2004), durch die Applikation von DNCB (2,4- Dinitrochlorobenzol) zu einer Th1-Antwort des Immunsystems mit dazugehörigem Zytokinmuster. Sie untersuchten an Balb/c-Mäusen die unterschiedlichen Reaktionen auf die Haptene DNCB, Dinitrofluorobenzen (DNFB), Fluorescein-isothiocyanat (FITC), TMA und Dinitrofluorobenzen-sulfonylchlorid (DNBSCl) und stellten dar, dass DNCB ebenso wie DNFB ein Zytokinmuster einer Th1-Antwort bestehend aus hohen Mengen IFN-γ hervorriefen. TMA, FITC oder DNBSCl hingegen induzierten eine Th2Induktion. DEARMAN et al. (2002) zeigten vergleichend in einer Studie mit Balb/cMäusen und Ratten die Reaktion auf das Hapten DNCB in Form einer Th1-Induktion. Sie verglichen außerdem die Zytokine, die nach DNCB-Kontakt produziert wurden, mit denen aus der Reaktion auf TMA. TMA führt auch hier zu einer Th2-Antwort mit der Induktion der Zytokine IL-10 und IL-13. Bei der Th1-Antwort durch DNCB werden die Zytokine IFN- γ und IL-12 produziert. In einer Untersuchung von BÄUMER et al. (2004) sind in TDI- und DNCB-Modellen die Effekte von RANTES und TARC untersucht worden. Hierbei konnte gezeigt werden, dass eine wiederholte Gabe von TDI und DNCB zu einem Anstieg der Ohrschwellung 6 und 24 Stunden nach Applikation führt. Hervorgehoben wird der unterschiedliche Effekt der Allergene auf die T-Zellpolarisierung, wobei TDI auch hier im Hautgewebe zu einer Th2- und DNCB zu einer Th1-Antwort mit dem dazugehörigen Zytokinmuster führen (BÄUMER et al. 2004). 23 Literaturübersicht 2.5.4. Th1-/Th2-Antwort Bei der Immunantwort kommt es je nach Antigenkontakt zur Proliferation unterschiedlicher Subtypen von T-Zellen, entweder den Th1- oder den Th2Lymphozyten. Dieses ist abhängig von den an der Immunantwort beteiligten Zellen. Wird ein Hapten über MHCI-Moleküle naiven CD8+-T-Zellen präsentiert, kommt es zur Induktion einer Th1-Antwort, wobei IL-12 produziert von den DC als eines der wichtigen Zytokine fungiert (CARTER und DUTON 1996). Eine Th2- und zugleich humorale Antwort wird eingeleitet, wenn ein Hapten an MHCII gebunden exprimiert wird und durch IL-4, Histamin und PGE2 CD4+-T-Zellen stimuliert werden (LANZAVECCHIA und SALLUSTO 2000). Beispiele für die unterschiedliche T-ZellPolarisierung sind zum einen DNCB und DNFB für Th1, TMA und TDI für Th2 (KRASTEVA et al. 1999; DEARMAN et al. 1996,2005; BÄUMER et al. 2004,2005). LANGENKAMP et al. (2000) beschreiben die Differenzierung der T-Zellen folgendermaßen: DC sind in der Lage, T-Gedächtniszellen in der Challengephase in eine bestimmte Richtung zu polarisieren. Eine hohe Antigen-Dosis und große Mengen an IL-12 von aktivierten DC führen zu einer Th1-Antwort (bei Infektionen mit Bakterien, Viren, aber nicht durch Parasiten), wohingegen gleiche DC zu einem späteren Zeitpunkt durch eine geringere Menge an Antigenen im Lymphknoten nur eine Th2-Antwort einleiten oder T-Zellen gar nicht erst polarisiert werden und den Pool an Gedächtniszellen auffüllen. Nicht nur die Art des Antigens, sondern auch die Dauer der Antigenbindung mit T-Zellen hat Einfluss auf die T-Zellpolarisierung. Kommt es nur zu einem kurzen Kontakt, führt dies zum Zelltod. Eine längere Bindung zwischen T-Zelle und DC und somit auch eine stärkere Sekretion von Zytokinen hat eine Differenzierung der T-Zellen in nichtpolarisierte-T-Zellen, die später immer noch aktiviert werden können, oder in Gedächtnis- und den daraus sich später entwickelnden Effektorzellen zur Folge. Eigenart der Effektorzellen ist, dass sie die Expression von CCR7 zugunsten von Rezeptoren für inflammatorische Chemokine reduzieren, da sie aus dem Lymphknoten in das periphere Gewebe wandern (LANZAVECCHIA und SALLUSTO 2000). 24 Literaturübersicht Die Differenzierung der T-Zellen ist also kein festgelegter Ablauf, sondern eher ein stochastischer Prozess, indem es bei Kontakt mit Allergenen, Haptenen, Bakterien, Viren, LPS oder nekrotischem Material zur Ausbildung von Th1-Lymphozyten kommt. Ausschlaggebend hierfür ist die Produktion von IL-12 (und IL-18, IFN-γ) durch DC (LANZAVECCHIA und SALLUSTO 2000). Dieser Zusammenhang ist schematisch in Abbildung 6 dargestellt. Gewebe Drainierender Lymphknoten Danger Signal 1 IL-12 Danger-Signal aktivierte DC (TNF-α, IL-1β) Zellvermittelte Th1 IFN-γ Fremd-Antigen Danger Signal 2 Humorale Th2 Kein IL-12 und/oder IL-10 Toleranz Kein Danger-Signal MHC II ruhige DC Selbst-Peptid MHC I Immunantwort Immunantwort IL-4/-5/-13 CD4 (TH) Anergie, Apoptose oder regulatorische T-Zelle CD8 Anergie,Apoptose Abb.6 Darstellung der Interaktion von DC und T-Zellen im drainierenden Lymphknoten einschließlich der möglichen Immunantworten (nach SHORTMAN und LIU 2002) 25 Literaturübersicht 2.5.5. In-vitro-Untersuchungen zur Beeinflussung der DC-Maturation und Immunreaktionen durch Schwermetalle Im Mittelpunkt diverser In-vitro-Untersuchungen stehen der Maturationsprozeß der DC und dessen Beeinflussung durch Kontaktallergene, Irritantien oder Schwermetalle. Nach Applikation von Kontaktallergenen kommt es zu einem Anstieg von TNF-α und IL-1β und einer erhöhten Expression von MHCII bei humanen DC (RYAN et al. 2005; ENK und KATZ 1992). Schwermetalle induzieren die Maturation von DC auf unterschiedliche Art und Weise. Nickel und Kobalt induzieren, wie auch LPS, die Formation reaktiver Sauerstoffradikale und stimulieren dadurch NF-κB, was zur Reifung der DC beiträgt (MANOME et al. 1999). CD40 gilt zusammen mit IL-12 als Aktivierungsmarker der DC. Durch die Bindung an CD40 wird eine intrazelluläre Kaskade ausgelöst und folglich IL-12 und IL-6, wichtige Zytokine für die T-Zellinteraktion, sezerniert. Nickel führt zu einer starken Erhöhung der beiden (VITAL et al. 2004). Ausgereifte DC werden anhand ihrer exprimierten Oberflächenmoleküle, wie z.B. CD40, CD54, CD80, CD86, MHCII, charakterisiert. Ist die Reifung der DC abgeschlossen, verlieren diese die Fähigkeit der Antigenaufnahme und -prozessierung, können aber stattdessen aufgenommenes Antigen naiven T-Zellen präsentieren. In einem Vergleich zwischen dem Einfluss von Haptenen, Bakterienprodukten und Zytokinen auf DC, in diesem Fall auf Langerhans-Zellen (LC), beschreiben AIBA et al. (2000) die zweiphasige Reifung der DC durch diese Stimuli. Da es schwierig ist, LC zu kultivieren, haben AIBA et al. (1997) in Anlehnung an SALLUSTO und LANZAVECCHIA (1994) DC aus humanen Blutmonozyten kultiviert und daran die Effekte unterschiedlicher Schwermetalle untersucht. Ein Teil ihrer Untersuchungen bezieht sich auf die Expression costimulatorischer Moleküle nach Inkubation mit Nickel, Mangan, Kobalt, Kupfer, TNCB und DNCB, sowie den Irritantien Zink, SLS (Sodiumlaurylsulfat) und BC (Benzalkoniumchlorid). Nach Inkubation der DC über zwei Tage mit den Substanzen sind anschließend die Expression der Oberflächenmoleküle mit Hilfe der Durchflußzytometrie ermittelt 26 Literaturübersicht worden. Nickel und DNCB führen zu einer signifikant gesteigerten Expression von CD54, CD86 und HLA-DR. Im Zusammenhang mit dieser Phänotypveränderung der DC ist eine gesteigerte Produktion der Zytokine IL-1β und TNF-α festzustellen. Auch die Stimulation von T-Zellen ist durch Nickel und DNCB im Vergleich zu Zink, SLS und BC gesteigert (AIBA 1998). Im Vergleich der Substanzen Nickel und DNCB wird ein Unterschied in dem Mechanismus der DC-Aktivierung festgestellt. DNCB stimuliert DC, die daraufhin IL-1β oder TNF-α sezernieren, was wiederum die CD86Expression induziert. Nickel hingegen kann die CD86-Expression direkt induzieren. Die zytotoxische Dosis für DC liegt bei DNCB bei über 100 µmol/l. Nickel und Mangan haben erst ab einer Konzentration von 1000 µmol/l zytotoxische Effekte (AIBA und TAGAMI 1999). AIBA et al. (2000) zeigen neben der Expression costimulatorischer Moleküle als Zeichen der DC-Reifung ebenfalls die gesteigerte Fähigkeit maturierter DC, auf chemotaktische Reize wie MIP-3β zu reagieren. DC, die mit Nickel in Kontakt gekommen sind, exprimieren infolgedessen eine erhöhte Anzahl an CCR7, dem Rezeptor, der es den DC ermöglicht, in die Peripherie auszuwandern. Nickel (100300 µmol/l) und SDS (0,1%) induzieren ebenfalls die Expression von CCR7 bei humanen CD34+ - DC (DE SMEDT et al. 2001). Zusätzlich kommt es zu einer gesteigerten Produktion von IL-12, der Gehalt an IL-1β bleibt unverändert. Die T-Zellstimulation in der allogenen Mixed Leucocyte Reaction (MLR) wird durch beide Substanzen induziert. ZELIKOFF und THOMAS (1998) untersuchten den Einfluss unterschiedlicher, umweltrelevanter Schwermetalle auf Immunzellen in vitro und in vivo. Th1-Zellen werden durch Blei (10 µmol/l PbCl2) inhibiert, B-Lymphozyten werden dagegen stimuliert. In der Durchflußzytometrie wird eine erhöhte Expression der MHCIIMoleküle auf B-Zellen nach Kontakt mit Blei festgestellt. KOWOLENKO et al. (1991) untersuchten den Einfluss von Blei auf murine Makrophagen und deren Auswirkungen auf B- und T-Zellen. Hierbei stehen Lymphozyten aus dem In-vivo-Versuch den Lymphozyten aus der Kultur gegenüber. Auffällig sind die je nach Versuchsaufbau unterschiedlichen Effekte des Bleis auf die Zellen des Immunsystems. Die Lymphozyten werden in vivo in ihrer Funktion als 27 Literaturübersicht Immunzelle durch Blei in Konzentrationen bis zu 10 µmol/l nicht beeinträchtigt (über das Trinkwasser für 10 Wochen verabreicht). Im Gegensatz dazu sind Lymphozyten, die in vivo gewonnen und in der nachfolgenden Kultur mit 10 µmol/l Blei versetzt werden, nicht in der Lage, eine Immunantwort einzuleiten. Die T-Zellaktivität wird weder in vitro, noch in vivo durch die verwendeten Bleikonzentrationen beeinträchtigt. SMITH und LAWRENCE (1988) führten erste Studien an Mäusen durch, die belegen, dass es durch Schwermetalle in Konzentrationen von 10 und 100 µmol/l zur Immunmodulation bei antigenpräsentierenden Zellen (Splenozyten, B-Zellen und Makrophagen) kommt. Durch die Produktion von IL-2 stellen sie die Aktivierung von T-Zellen durch das Schwermetall Nickel dar. Die Schwermetalle Cadmium, Kupfer, Zink und Blei zeigen eine hemmende Wirkung auf die IL-2-Produktion durch T-Zellen, wobei Blei als einzige Substanz in dem untersuchten Konzentrationsbereich nicht toxisch auf die Zellen wirkt. Obwohl keine gesteigerte IL-2-Antwort durch T-Zellen nach einer Bleiinkubation gezeigt werden kann, wird eine gesteigerte humorale Immunantwort in Form einer B-Zellproliferation beobachtet. Das bedeutet, dass Nickel und Blei eine Immunantwort durch unterschiedliche Mechanismen induzieren, Nickel über direkten T-Zellkontakt, Blei evtl. durch Bindung von Oberflächenproteinen und anschließender Stimulation von B-Zellen. Hierbei wird die Wechselwirkung von Blei mit Phospholipiden oder Histidinresten in der Zellmembran vermutet (SMITH und LAWRENCE 1988). KROCOVA et al. (2000) zeigen eine aktivierende Wirkung von Blei (PbNO3) und Cadmium (CdCl2) in Konzentrationen von 12-120 µmol/l auf murine peritoneale Makrophagen und auf Splenozyten. Im Zentrum der Untersuchungen stehen die NOund Zytokinproduktion, sowie die Vitalität und Proliferation der Zellen. Für beide Schwermetalle kann eine gesteigerte IL-4-Produktion sowohl in Monokulturen mit Lymphozyten als auch in Mischkulturen gezeigt werden. Sie sorgen bevorzugt für eine Differenzierung der T-Zellen in Richtung einer Th2-Antwort. In hohen Dosen (20-40 µg/ml) führen Blei und Cadmium zu einer verminderten Produktion von NO, was essentiell für die Interaktion der Makrophagen mit T-Zellen ist. Paradoxerweise kommt es bei geringen Dosen zu einer potenzierten Wirkung der Schwermetalle auf 28 Literaturübersicht die NO-Produktion durch Makrophagen. Die in hohen Dosen auftretende Wirkung der Schwermetalle auf Makrophagen wird als eine von vielen Ursachen der verminderten Immunabwehr gegenüber Infektionen bei gleichzeitiger Bleiexposition bei Mensch und Maus diskutiert (KROCOVA et al. 2000). 2.5.5.1. MAPKinase-Signalwege und die Wirkungen von Schwermetallen Sobald es zu einer Beeinflussung der DC in Form von Noxen kommt (LPS, TNF-α, u.a.), werden in den Zellen Signalwege aktiviert und eine Immunantwort eingeleitet. Einer dieser Signalwege ist die Aktivierung in Form der Phosphorylierung von mitogen-aktivierten Proteinkinasen, kurz MAPK. Hierbei handelt es sich um etwa 38 bis 110 kDa große Kinasen bestehend aus drei Subtypen: p38, ERK (extrazelluläre signalregulierte Proteinkinase) und JNK (c-jun N-terminale Kinase) (WU et al. 2001). Die Phosphorylierung der MAPK hat eine Aktivierung intrazellulärer Transkriptionsfaktoren zur Folge, wobei im weiteren Verlauf Oberflächenmoleküle (z.B. CD80, CD86, CD1a, MHCII) oder Rezeptoren (CCR7) bei DC gebildet werden (ARRIGHI et al. 2001, AIBA et al. 2003). Gehemmt werden können diese Signalwege durch spezifische Inhibitoren, z.B. durch den p38-Inhibitor SB203580 oder PD98059 als Inhibitor für ERK (WU et al. 2001). Die drei Subtypen der MAPK werden auf unterschiedliche Art und Weise und zum Teil gleichzeitig aktiviert, um eine optimale Immunantwort gewährleisten zu können. p38 und JNK reagieren auf Umweltstressoren oder inflammatorische Zytokine (TNF-α). ERK hingegen ist auf die Bindung von Tyrosinkinasenrezeptoren angewiesen (NAKAHARA et al. 2006). Bei Untersuchungen mit dem Inhibitor SB203580 an humanen DC wurde festgestellt, dass es durch Präinkubation mit dem Inhibitor und nachfolgender Stimulation mit TNF-α bzw. LPS zu einer verminderten Expression der Oberflächenmolekülen CD40, CD80, CD86, CD83 und MHCII kommt. Werden die DC anstatt mit TNF-α bzw. LPS mit Nickel oder DNCB stimuliert, bleibt auch hier die vorher beobachtete Expression von CD40L auf der Zelloberfläche aus. Ähnliche Untersuchungen erfolgten im Hinblick auf die Zytokinausschüttung durch stimulierte DC. Solange sie mit SB203580 behandelt werden, bleibt der Effekt der IL-12-, 29 Literaturübersicht TNF-α-, IL -1β- und IL-6-Produktion aus. Die MAPK p38 spielt demzufolge eine wichtige Rolle in dem Maturationsprozeß der DC, da ihre Aktivierung sowohl die Expression von Oberflächenmolekülen, als auch die Zytokinausschüttung beeinflusst (NAKAHARA et al. 2006). Nickel (100 µmol/l, 300 µmol/l und 1 mmol/l) aktiviert in humanen DC im Gegensatz zu primären Irritantien wie SDS alle drei MAPK; im Anschluß wird CD83 exprimiert (AIBA et al. 2003). Da es durch SB203580 zur Hemmung der CD83Expression kommt, wird für die Expression von CD83 die Phosphorylierung von p38 verantwortlich gemacht. Nickel induziert ebenfalls die Expression von CD80 und CD86, was als Zeichen der DC-Maturation gilt. Auch hier kann die Expression durch den p38-Inhibitor SB203580 gehemmt werden (ARRIGHI et al. 2001; BOISLEVE et al. 2005). 2.5.5.2. Einfluss der Schwermetalle auf die CCR7-Expression Essentiell für die Migration reifender DC vom Ort der Antigenaufnahme bis hin zum regionalen Lymphknoten ist die Expression des Chemokinrezeptors 7 (CCR7), der nur auf reifen DC, sowie B- und T-Zellen zu finden ist. Es gibt zwei Chemokine, die mit CCR7 interagieren: CCL19 (entspricht MIP-3β) und CCL21 (VANBERVLIET et al. 2002). RITTER et al. (2004) beschreiben die Expression von CCR7 als Zeichen der DC-Reifung und die Interaktion von CCL19 und CL21 als wichtigen Bestandteil der Migration der DC zum regionalen Lymphknoten. Es gibt unterschiedliche Wege, über die die DC durch Kontaktallergene aktiviert werden. Essentiell für die Expression von CCR7 scheint die Aktivierung der MAPKinasen p38 und JNK zu sein. Nach Inkubation humaner DC mit dem spezifischen p38-Inhibitor SB203580 konnte die Expression von CCR7 nach Nickelkontakt signifikant reduziert werden (BOISLEVE et al. 2004). DNCB ist auf die Aktivierung der MAPKinasen durch TNF-α angewiesen. Nickel hingegen ist in der Lage, direkt auf diesen Signalweg einzuwirken und führt so zu einer erhöhten CCR7-Expression. CCR7 ist nicht nur im Stande, chemotaktisch zu wirken, sondern durch die Expression wird auch die Geschwindigkeit, mit der die DC wandern, beeinflusst (RIOL-BLANCO et al. 2005). Durch die Expression von CCR7 kommt es zur Bindung 30 Literaturübersicht an CCL19 und CCL21, wodurch eine intrazelluläre, G1-abhängige Kaskade aktiviert wird. Letztlich steuert diese die Funktion von p38, ERK und JNK, wobei es primär zu einer Aktivierung von p38 und/ oder ERK kommt, JNK wird im Anschluß durch einer der beiden MAPKinasen stimuliert (RIOL-BLANCO et al. 2005). Werden alle drei Kinasen inhibiert, kommt es trotzdem zu einer CCR7-Expression, was bedeutet, dass es ein zusätzliches, bislang unbekanntes Molekül geben muß, was die Expression beeinflusst. Keine Wirkung besitzen die MAPKinasen auf die Migrations- geschwindigeit. Diese wird allein über die Moleküle GTPase Rho / Tyrosinkinase Pyk 2/ Cofilin nach Bindung von CCR7 reguliert (RIOL-BLANCO et al. 2005). 2.5.6. In-vivo-Untersuchungen zu immunmodulatorischen Effekten durch Schwermetalle Untersuchungen im Tiermodell sind hauptsächlich zur Darstellung der umweltrelevanten Schwermetallkonzentrationen und deren Auswirkungen für den Menschen durchgeführt worden. Es gibt einige Studien, die zeigen, dass Blei inhibitorisch auf das Immunsystem wirkt. In einer Langzeitstudie mit Ratten ist eine chronische Bleiexposition nachgestellt worden. Hierfür ist zum einen den weiblichen Tieren sieben Wochen ante partum und zum anderen den weiblichen Tieren und dem Nachwuchs sechs Wochen post partum Blei (0, 25 und 50 ppm) verabreicht worden. In den Versuchen an den Jungtieren zeigte sich, dass die Ausbildung von Hypersensitivitätsreaktionen vom verzögerten Typ durch die Bleiverabreichung vermindert ist (FAITH et al. 1979). Welcher Mechanismus hinter diesen Vorgängen steckt, bleibt unklar. Vermutet wird die Inhibition von Th1-Lymphozyten, die hauptsächlich für den verzögerten Typ der Hypersensitivitätsreaktion verantwortlich gemacht werden. In einer Langzeitstudie von KIMBER et al. (1986) ist Probanden Blei in einer nicht toxischen Dosis verabreicht worden. Im Vergleich zur Kontrollgruppe (11,8 µg/dl) lag der Bleiwert im Blut der Probanden bei 38,4 µg/dl. Die Bildung von Immunglobulinen (IgA, IgG, IgM) ist durch die Bleiexposition nicht gestört. Auch die Funktion der natürlichen Killerzellen oder der T-Zellen konnten durch Blei nicht 31 Literaturübersicht beeinträchtigt werden. LUSTER et al. (1978) haben hingegen eine geschwächte Immunabwehr bei Ratten in Form einer verminderten Immunglobulinbildung, sowie einer Schwächung der T-Zellfunktion beobachtet. Der Bleiwert der Versuchstiere lag im Blut bei 29,3 - 52,8 µg/dl nach Verabreichung von 25 ppm Bleiacetat. MULLER et al. (1977) führten über 30 Tage einen Versuch an Balb/c-Mäusen durch, wobei Bleiacetatkonzentrationen zwischen 0,025 bis 0,25 mg/Maus intraperitoneal verabreicht wurden. Um bei den Mäusen eine Hypersensitivitätsreaktion auszulösen, ist eine Sensibilisierung mit Schaferythrozyten intravenös und anschließender Challenge an den Hinterläufen durchgeführt worden. Nach 0, 24 und 48 Stunden konnte über eine zunehmende Pfotenschwellung bei den Mäusen eine Reaktion auf das Agens ermittelt werden. Sobald den Mäusen Blei zugefügt wurde, nahm diese Schwellung entgegengesetzt zum Bleivollblutgehalt ab. Die Überempfindlichkeitsreaktion vom verzögerten Typ scheint somit unterdrückt zu werden. Der Autor vermutet in diesem Zusammenhang, ob Blei einen direkten Einfluss auf die T-Zellaktivität, insbesondere der Th1-Aktivität, nimmt oder eher das lokale Entzündungsgeschehen hemmt. Da in dieser Arbeit der Effekt von Bleiacetat, das über das Trinkwasser verabreicht wurde, auf das Immungeschehen der TDI- bzw. DNCB-behandelten Mäuse untersucht werden sollte, ist der In-vivo-Versuch in Anlehnung an CARMOUCHE et al. (2005) durchgeführt worden. Hierbei wurden die Auswirkungen von Bleiacetat auf das Skelettsystem über einen Zeitraum von sechs Wochen getestet. Die Konzentrationen im Trinkwasser zwischen 0 und 5800 ppm ergaben nach dieser Zeit konstante Bleiwerte im Vollblut (Blutbleigehalt bei 230 ppm im Trinkwasser ca. 40 µg/dL, bei 2300 ppm ca. 100 µg/dL). Umweltrelevante Konzentrationen liegen zwischen 0 und 230 ppm. Die Tabelle 4 gibt einen Überblick der In-vitro- und In-vivo-Daten von Blei und Nickel und deren Wirkung auf DC wider. 32 Literaturübersicht Tab.4 Zusammenfassung der Wirkung von Nickel und Blei auf DC in vitro und in vivo Nickel Blei Literatur VITAL et al. (2004) AIBA et al. Zytokine/ROS ↑ IL-1β, TNF-α, IL-12, IL-6 ↑ ↑N-Oxid bei geringer (1997,2000) Dosis, bei hoher MANOME et al. Dosis↓ (1999) DE SMEDT et al. (2001) Oberflächen-/ Adhäsionsmoleküle ↑CD54, CD80, CD86,CD83, MHC II nicht untersucht AIBA et al. (1997) ↑ AIBA et al. Rezeptoren ↑ CCR7 nicht untersucht (2000), BOISLEVE et al. (2005) NAKAHARA et al. MAPK (p38, ERK, JNK) ↑ p38, ERK und JNK ↑ p38 (in vivo) (2006), BOISLEVE et al. (2004) Inhibition T-Zellstimulation ↑ (über IL-2 ermittelt) (gemessen an reduzierter IL-2Ausschüttung) SMITH und LAWRENCE (1988) Inhibition Th1 bei B- Th-Antwort nicht untersucht Zellen! ZELIKOFF und Induktion Th2 bei THOMAS (1998) Makrophagen gesteigerte humorale Sonstiges nicht untersucht Antwort, ZELIKOFF und ↑ IL-4 durch THOMAS (1998) Makrophagen 33 Material und Methoden 3 Material und Methoden 3.1 Geräte und Reagenzien 3.1.1. Geräte für Zellkulturversuche Kühlzentrifuge Zentrifuge 5804 R, Eppendorf, Hamburg Brutschrank US AutoFlow, Sarsted Mikroskop Axiovert 25, Zeiss, Jena Sterilfilter Minisart, Sartorius, Göttingen Polypropylen-Röhrchen (15 ml/50 ml) Greiner, Frickenhausen Petrischalen (100 mm x 20 mm) tissue culture dish cell+, Sarstedt, 6-,12-,24,-96-well-plates Greiner, Frickenhausen Pipettenspitzen (10 ml) Greiner, Frickenhausen 96-well-plates, round-bottom Greiner, Frickenhausen 6-well-plates mit Einsätzen (8.0 µm Porengröße) Greiner, Frickenhausen Einmalspritzen, 2/10 ml Omnifix, Braun, Melsungen Einmal-Injektions-Kanüle, Nr. 14 Terumo, Leuven, Belgien Einmal-Injektions-Kanüle, Nr. 20 Omnifix, Braun, Melsungen Feinwaage Sartorius 2002 MP1, Sartorius, Göttingen Neubauer Zählkammer Albert Sass, Sigma,Steinheim 34 Material und Methoden 3.1.2. Reagenzien für Zellkulturversuche RPMI-1640-Medium Biochrom, Berlin Penicillin Invitrogen GmbH, Karlsruhe Streptomycin Invitrogen GmbH, Karlsruhe 10 % FKS Biochrom, Berlin, Deutschland β-Mercaptoethanol Sigma, Steinheim GM-CSF R&D-Systems, Wiesbaden MIP-3β R&D-Systems, Wiesbaden Polyvidon-Iod-Lösung Braunol, Braun, Melsungen NH4Cl Merck, Darmstadt EDTA Aldrich, Steinheim KHCO3 Merck, Darmstadt LPS E. coli O127 B8, Sigma, Steinheim Na2-EDTA Merck, Darmstadt NaHCO3 Merck, Darmstadt Trypan-Blau Sigma, Steinheim 3 Hartmann Analytic, Braunschweig H-Thymidin (1 mCi) Phytohämagglutinin (PHA) Sigma, Steinheim 3.1.3. Schwermetalle Blei(II)-acetat-3-hydrat (MW = 379,34) Merck, Darmstadt Blei(II)chlorid (MW = 278,10) Merck, Darmstadt Manganchlorid (MW = 197,9) Sigma, Steinheim Kupfer(II)chlorid (MW = 170,48) Merck, Darmstadt Zinkchlorid (MW = 225,63) Merck, Darmstadt Cadmiumchlorid (MW = 201,32) Merck, Darmstadt 35 Material und Methoden 3.1.4. Geräte für ELISA DuoSet Mouse TNF-α - ELISA R&D-Systems, Wiesbaden DuoSet Mouse PGE2 - ELISA R&D-Systems, Wiesbaden CCL2 - ELISA R&D-Systems, Wiesbaden IL-4 – ELISA R&D-Systems, Wiesbaden IL-1β - ELISA R&D-Systems, Wiesbaden IFN-γ - ELISA e-Bioscience, Amersham, UK Polystyrol-Nunc-Immuno-Platte Nunc GmbH, Wiesbaden Biorad Protein Assay Biorad, München Photometer Microplate Reader MRX, Dynatech MTT-Test: CellTiter 96 AQueos One solution cell Proliferation Assay Promega, USA 3.1.5. Geräte für FACS-Analyse Coulter Epics XL Beckmann Coulter Company, EXPO 32 ADC Software Miami, USA 3.1.6. Reagenzien für FACS-Analyse CD 11c – Antikörper (Cat.No.:557401) Pharmingen, Hamburg MHCII – Antikörper (Clone2G9) Pharmingen, Hamburg CD80-Antikörper (Mat.No.:553768) Pharmingen, Hamburg CD86-Antikörper (Mat.No.:553691) Pharmingen, Hamburg CCR7-Antikörper (Clone 4B12) e-Bioscience, Amersham, UK FITC anti-rat IgG2a (Cat.No:553896) e-Bioscience, Amersham, UK 36 Material und Methoden 3.1.7. Geräte für Westernblot Powerpac 300 Power Suply Biorad, München Schwenkschüttler Typ 3005 GFL, Großburgwedel XCell Sure Lock Mini Cell Invitrogen, Karlsruhe 3.1.8. Reagenzien für Westernblot Cell extraction buffer (Art.No:FNN0011) Biosource Europe, Belgien Laemmli-Puffer (4-fach reduzierend) Roth, Karlsruhe Proteinstandard Low-Molecular Weight Biosciences, Amersham, UK PVDF-Blotmembran Immubolon-P Roth, Karlsruhe SDS ultra pure Roth, Karlsruhe PageRulerTM Prestained Protein Ladder plus Fermentas, St. Leon-Rot Rabbit anti-p38 phosphospecific antibody BioSource, Solingen Rabbit anti-p38 BioSource Europe, Belgien ECL Anti-rabbit IgG (sek. AK) Biosiences, Amersham, UK ECL Detektion (Enhanced Pierce, Rockford, USA Chemoluminescence) 37 Material und Methoden 3.2 Hergestellte Puffer und Lösungen Für die Zellkultur: DC – Medium: • RPMI 1640 • 10 % FKS • 50 µM β-Mercaptoethanol • 1 % Penicillin/Streptomycin PBS – Puffer: • 8g NaCl • 0,2 g KCl • 1,44 g Na2PO4 • 0,2 g • Aqua bidest. ad 1000 ml • pH 7,2 mit 1M HCl/1 M NaOH KH2PO4 Hämolyse – Puffer: • 8,29 g NH4CL • 0,037 g Na2 EDTA • 0,839 g NaHCO3 • Aqua bidest. ad 1000 ml • pH 7,3 38 Material und Methoden Für den Westernblot Lysepuffer: • 2 ml Cellextraction buffer • 20 µl Proteaseinhibitorcocktail • 10 µl PMSF • 2 µl Microcystin Elektrophoresepuffer: • 25 mM Tris • 192 mM Glycin • 0,1 % SDS Semi-Dry-Blotpuffer: • 25 mM Tris • 192 mM Glycin • 20 % Methanol Blockpuffer. • 1-5 % Magermilchpulver • TBST Trenngel: • 13,4 ml Acrylamid • 10 ml Tris HG1H (1,5 M) • 200 µl SDS (20 %) • 40 µl TEMED • 16 ml Aqua dest. • 400 µl ASP (10 %) 39 Material und Methoden Sammelgel: • 3,9 ml Acrylamid • 7,5 ml Tris (0,5 M) • 150 µl SDS (20 %) • 30 µl TEMED (0,2 %) • 300 µl APS (0,12 %) • 18 ml Aqua bidest. 3.3 Versuchstiere Der Tierversuch ist durch die Bezirksregierung Hannover genehmigt worden (Aktenzeichen 33-42502-06/1091). Für die In-vitro- und In-vivo-Untersuchungen wurden weibliche Mäuse des Stammes Balb/c, sowie für die allogene Mixed Leukocyte Reaction (MLR) NMRI-Mäuse verwendet. Die Mäuse waren acht Wochen alt, wogen ca. 20 g und waren zum Zeitpunkt der Versuche klinisch gesund. Gehalten wurden sie zu sechst je Gruppe bei Futter (Altromin1324) und Wasser ad libitum, sowie in einem 12stündigen Hell-Dunkel-Rhythmus. 40 Versuchsübersicht 3.4 Versuchsübersicht Da die DC eine wichtige Rolle im Immungeschehen spielen, ist in dieser Arbeit der Schwerpunkt auf die Beeinflussung ihrer Zellfunktion durch die Schwermetalle Blei und Mangan - sowie zusätzlich Zink, Kupfer und Cadmium in Vorversuchengelegt worden. In vitro ist zuerst die Vitalität von DC nach unterschiedlich langer Schwermetallinkubation gemessen worden. Versuche mit weiteren DC-Kulturen bestanden in der Gewinnung von Kulturüberständen zur Detektion unterschiedlicher Zytokine als Reaktion auf die Schwermetalle (TNF-α, IL-1β, CCL2, IFN-γ). Die Migrationsbereitschaft der DC nach Schwermetallkontakt ist in einem Migrationsassay ausgewertet worden. Im Anschluß sind die Zellen gezählt und in der FACSAnalyse auf die Expression des Chemokinrezeptors CCR7 untersucht worden. Die Mixed Leukocyte Reaction (MLR) gab Aufschluß über die Fähigkeit der DC, nach Schwermetallaufnahme naive T-Zellen zur Proliferation anzuregen. Da T-Zellen durch die Schwermetalle allein beeinflusst werden können, wurde im Vorfeld die Vitalität und Proliferationsrate der T-Zellen nach Kontakt mit den Schwermetallen gemessen. In der FACS-Analyse ist die Expression spezifischer Oberflächenmoleküle (CD11c, CD40, CD80, CD86, MHCII) auf DC untersucht worden, um eine etwaige Induktion einer DC-Maturation nach Schwermetallaufnahme feststellen zu können. Die Untersuchung in einem Westernblot wurde zur Darstellung einer Aktivierung der intrazellulären MAPKinase pp38 und ihrer inaktivierten, nicht phosphorylierten Form p38 genutzt. Im Anschluß erfolgten In-vivo-Studien im Allergiemodell mittels zweier Kontaktallergene (TDI und DNCB). Hierbei wurde der Effekt von Blei, welches ad libitum über das Trinkwasser angeboten wurde, auf das Allergiegeschehen an der Haut von Balb/c-Mäusen untersucht. Als lokale Reaktion der Mäuse auf die Allergene ist die entzündliche Ohrschwellung bestimmt worden. Im Mittelpunkt weiterer Untersuchungen standen der Bleigehalt im Vollblut, die Art und Anzahl ausgewanderter Zellen im regionalen Ohrlymphknoten und deren Charakterisierung in der FACS-Analyse. Außerdem ist anhand dieser Zellen eine Kultur angelegt worden, in der es zur erneuten Provokation durch TDI bzw. DNBS, dem 41 Versuchsübersicht wasserlöslichen DNCB-Analogon, gekommen ist. Aus Überständen dieser Kultur und Ohrhomogenaten ist der IL4-Gehalt im ELISA gemessen worden. Schließlich ist die Migration stimulierter DC in der Challengephase in einem mit der Dorsalhälfte der Ohren angelegten Assay beurteilt worden. 3.4.1. In-vitro-Untersuchungen 3.4.1.1. Generierung von DC Die DC-Vorläuferzellen werden nach LUTZ et al. (1999) aus dem Knochenmark von Balb/c-Mäusen gewonnen und für zehn Tage im Brutschrank bei 37°C kultiviert. Durch zervikale Dislokation wird die Maus getötet und der Femur nach Präparation von umliegender Muskulatur befreit. Der Femurknochen wird für 2-5 Minuten in 70%igem Alkohol desinfiziert und anschließend in PBS überführt. Nach dem Abtrennen beider Femurenden wird mit Hilfe von Kanüle und Spritze die Markhöhle mit sterilem PBS durchgespült und der Inhalt aufgefangen und anschließend zentrifugiert (220 g, 4 °C, 10 Minuten). Der Überstand wird verworfen und das Zellpellett mit 5 ml RPMI-Medium resuspendiert. Um die gewonnene Zellzahl bestimmen zu können, entnimmt man der Zellsuspension 100 µl und gibt sie zu 100 µl Erythrozyten-Lysepuffer. Nach ca. 5 Minuten wird Trypanblau hergestellt (Verdünnung 1:3) und die Zellen in der Neubauer-Kammer ausgezählt. Die Gesamtzellzahl ergibt sich nach folgender Gleichung: X 4 x 3 x 10.000 x 2 = Zellen/ ml Medium Für einen Ansatz benötigt man 2x106 Zellen pro Petrischale (cell+) in 10 ml Medium (RPMI 1640 + 50 µmol β-Mercaptoethanol). Dieser wird am ersten Tag mit 20 ng/ml GM-CSF versetzt; am Tag 3 der Kultur gibt man wiederum 10 ml Medium und 20 ng/ml GM-CSF hinzu. An den Tagen 6, 8 und 10 wird jeweils 10 ml Medium 42 Versuchsübersicht entnommen, das Zellpellett durch Zentrifugation gewonnen und nach Resuspension mit frischem Medium und GM-CSF zur Kultur zurückgegeben. 3.4.1.2. Gewinnung von T-Zellen Da es sich bei der MLR um eine heterologe Reaktion handelt, werden die T-Zellen für diesen Versuch nicht wie die DC von einer Balb/c- sondern von einer NMRI-Maus gewonnen. Hierfür wird das Tier ebenfalls durch zervikale Dislokation getötet und im Anschluß die Milz herauspräpariert und in steriles PBS gegeben. Mit Hilfe einer Kanüle und einer Spritze wird die Milzpulpa mit sterilem PBS ausgespült und der Inhalt aufgefangen. Es folgt die Zentrifugation (1000 g, 4 °C, 10 Minuten) und das Verwerfen des Überstandes. Das Zellpellett wird mit 5 ml Hämolysepuffer versetzt und der Vorgang nach 5 Minuten durch Zugabe von 45 ml PBS gestoppt. Die Zellsuspension wird erneut zentrifugiert (s.o.), das Zellpellett anschließend mit 10 ml DC-Medium resupendiert und für zwei Stunden in einer cell+-Petrischale bei 37 °C im Brutschrank inkubiert. Nicht adhärente Zellen bilden die T-Zellpopulation mit einer Reinheit von 60-70 %, die vorsichtig mit einer Pipette gewonnen und aufgefangen werden, um ausgezählt werden zu können. 3.4.1.3. Versuchsaufbau In Abbildung 7 ist ein Überblick der unterschiedlichen Versuche gegeben. Allen Versuchen ist gemeinsam, dass die DC zunächst für acht Tage kultiviert wurden (s.o.) und dann je nach Versuchsaufbau am gleichen Tag (Zytokinbestimmung, Migrationsassay, FACS) oder am Tag darauf (MLR) mit den Schwermetallen Blei bzw. Mangan in den Konzentrationen 1, 10 und 100 µmol/l inkubiert wurden. Für die Westernblotproben zum Nachweis von pp38 sind die Zellen am Tag 10 mit Blei (10 und 100 µmlol/l) inkubiert worden. Eine LPS-Stimulation erfolgte ggf. 24 Stunden nach der Schwermetallinkubation. Am Tag 10 der Zellkultur sind zum einen die Überstände für diverse Zytokinbestimmungen und zum anderen die DC für eine Analyse mittels FACS oder in einem Migrationsassay gewonnen worden. Weiterhin sind die DC für die Mixed 43 Versuchsübersicht Leukocyte Reaction mit T-Zellen einer NMRI-Maus inkubiert worden. Diese T-Zellen wurden ebenfalls auf ihre Proliferation sowie Vitalität untersucht. Tag 0: Gewinnung der DC-Vorläuferzellen Tag 3: Zugabe von 10 ml Medium +GM-CSF Tag 6: Mediumwechsel Tag 8: Mediumwechsel Tag 8: Tag 9: Tag 10: Tag 13: Schwermetall- ggf. LPS- Gewinnung der Inkubation DC Stimulation Tag 14: Tag 15: DC bzw. Kulturüberstände 2) Zytokin-………………..………………Messung (ELISA) bestimmung 3) Migrations-……..………………....... Transfer + Migration assay +Auswertung, ggf. CCR7-Färbung; SchwermetallInkubation DC Gewinnung von T-Zellen 1) MLR……………. Inkubation DC+TZ………………………. Thymidin- ………… .Ausmarkierung wertung 5) T-Zell-…………..……MTT-Test Vitalität 6) T-Zell-………………..Thymidin-……….......AusProliferation markierung SchwermetallInkubation DC 7) pp38 Westernblot Abb. 7 Übersicht zu dem zeitlichen Ablauf einzelner Versuche 44 wertung Versuchsübersicht 3.4.1.4. Zytokinbestimmung In dieser Arbeit sind Kulturüberstände der DC auf ihren Gehalt an unterschiedlichen Zytokinen untersucht worden (TNF-α, IL-4, IFN-γ, CCL2, IL-1β). Für den Nachweis wird ein Enzyme-linked Immunosorbent Assay (ELISA) verwendet, der ein immunologisches Nachweisverfahren basierend auf enzymatischen Farbreaktionen darstellt. Mit Hilfe des ELISA können verschiedenste biomolekulare Substanzen oder niedermolekulare Verbindungen in einer Probe nachgewiesen werden. Hierbei macht man sich die Eigenschaft spezifischer Antikörper zu Nutze, die an die nachzuweisenden Antigene binden. Hierfür werden Probe und Antikörper über eine definierte Zeit gemeinsam inkubiert. Durch unterschiedliche Wasch- und Trennungsschritte wird dann das gebundene Material (Antigen-Antikörper-Komplex) von dem ungebundenen Restmaterial der Probe getrennt. Mit Hilfe der an den Antikörper gekoppelten Enzyme wird anschließend eine Farbreaktion ausgelöst. Die Stärke der Farbreaktion ist mittels eines Photometers messbar und ihre Stärke proportional zur Konzentration in der Probe, die wiederum mit einem Standard verglichen wird. 3.4.1.5. Migrationsassay In Anlehnung an GUTZMER et al. (2004) ist am Tag 10 der Kultur ein Migrationsassay von DC durchgeführt worden, um die Auswanderungsbereitschaft der Zellen nach Schwermetallinkubation beurteilen zu können. Hierfür sind am Tag 8 der Kultur die DC mit Schwermetallen in unterschiedlichen Konzentrationen inkubiert und je nach Versuchsansatz die DC mit LPS (0,8 µg/ml) oder gar nicht stimuliert worden. Nach 48 Stunden erfolgte der Transfer von 200.000 DC in 300 µl Medium auf die Membran einer 6er Transwell-Platte (Porengröße 8 µm). Im Well wurde 1 ml Medium mit MIP-3β (50 ng/ml) als chemotaktische Substanz vorgelegt. Nach 90 Minuten Inkubation wurde die Membran entnommen, das Medium aus dem Well gewonnen und zentrifugiert (1000 g, 4 °C, 10 Minuten). Das Zellpellett wurde in neuem Medium (100 µl) aufgenommen und im Verhältnis 1:3 mit Trypan verdünnt, um anschließend die Zahl ausgewanderter DC mit folgender Gleichung bestimmen 45 Versuchsübersicht zu können: X 4 x 3 x 10.000 x 0,1 = ausgewanderte DC/ ml Im Anschluß an den Migrationsassay sind die ausgewanderten Zellen auf die Expression des Chemokinrezeptors CCR7 untersucht worden. Hierfür sind sie nach der Migration herunterzentrifugiert (s.o.), der Überstand verworfen und die DC in 200 µl PBS aufgenommen worden, um sie mit dem CCR7-Antikörper und nachfolgend mit dem sekundären Antikörper für die FACS-Analyse zu färben (siehe dort). 3.4.1.6. FACS-Analyse Das Prinzip der Durchflusszytometrie (Fluorescence activated cell sorting, FACS) beruht auf der Emission optischer Signale ausgehend von Zellen, die während des Verfahrens einen Laserstrahl passieren. Hierzu dienen zwei Parameter: das Vorwärtsstreulicht FSC (Forward Scatter) als Maß für die Zellgröße und das Seitwärtsstreulicht SSC (Side Scatter) als Maß für die Granularität (Größe und SSC (Granularität) Struktur des Zellkerns etc.) (siehe Abb. 8). FSC (Größe) Abb.8 Darstellung einer FACS-Analyse (repräsentatives Beispiel), Auftrennung der Zellen nach Granularität und Größe 46 Versuchsübersicht Die in einer Lösung befindlichen Zellen werden durch eine Kapillare gesaugt und passieren im Sensormodul einzeln einen Laserstrahl. Die Zelle emittiert dabei Licht und kann abhängig von Zellgröße, -struktur, intrazellulären Bestandteilen oder gebundenen Antikörpern sortiert und gezählt werden. Die verwendeten Antikörper, die hier zum Einsatz gekommen sind, sind an fluoreszierende Farbstoffe (FITC, PE) gekoppelt und gegen bestimmte Oberflächenmoledüle der DC (CD11c, CD40, CD80, CD86 oder CCR7) gerichtet. Nach der Markierung erfolgt die Sortierung nach diesen Merkmalen. Durch Einsatz verschiedenfarbiger Laser kann die Anzahl der einsetzbaren Farbstoffe und damit die Informationsdichte erhöht werden. In Tabelle 5 ist eine Übersicht zur Vorbereitung der DC und der anschließenden Färbung für die unterschiedlichen Versuchsansätze gegeben. Tab. 5 Übersicht zur Vorbereitung und Färbung der DC für die FACS-Analyse CD11c/CD86 CD11c/CD80 CD11c/CD40 CCR7 Zentrifugation der DC und Aufnahme des Zellpellets in sterilem PBS, Vorbereitung der DC Überführung in Roundbottom-wells Zweimaliges Waschen mit 0,1%igen FACS-Waschpuffer (10 mg BSA auf 10ml PBS) Aufnahme In 50µl PBS und anschließende Färbung Inkubation des primären CCR7- Zugabe des primären CD11cFärbung der DC Zugabe von je Antikörpers (6µl) und CD86- Siehe 25µl CD11c- und (eine Stunde) Antikörper CD11c/CD86- CD40-AK für 30 Inkubation des (je1:200) zu den Färbung Minuten zu den sekundären Proben Antikörpers Proben (30 Minuten) (0,5µl) (30 Minuten) 47 Versuchsübersicht 3.4.1.7. Untersuchung der MAPKinase pp38 mit Hilfe des Westernblots Die für den Westernblot benötigten DC-Proben werden mit einem Lysepuffer versetzt und mit Hilfe einer Proteinbestimmung (Biorad) auf eine gemeinsame Proteinmenge eingestellt (50 µg/30 µl). Die elektrophoretische Auftrennung der Proben erfolgt in der Sodiumdodecylsulfat-Polyacrylamidgelelektrophorese (SDSPAGE). Hierfür werden die Proben nach Zugabe des Ladepuffers bei 95°C für 8 Minuten in einem Thermoblock gekocht, um anschließend bei 200 V und 50 mA aufgetrennt zu werden (ca.10 cm Lauflänge). Als Marker für die Molekularmassen dient der Proteinstandard PageRulerTM Prestained Protein Ladder Plus (Fermentas). Der Transfer auf eine Nitrozellulosemembran der im SDS-Gel aufgetrennten Proteine erfolgt mit Hilfe einer Transferzelle bei einer angelegten Spannung von 25 V und einer Dauer von 60 Minuten. Danach können im Gel mittels Coomassie®–Blau die Proteinbanden sichtbar gemacht werden. Die Nitrozellulosemembran wird genutzt, um nach dem Blockierungsvorgang immunogene Proteine durch spezifische Antikörper nachzuweisen. Hierfür wird die Membran zuerst mit dem primären Antikörper (p38 bzw. pp38) beschickt, gewaschen und der sekundäre Antikörper (ECL Anti-rabbit IgG) aufgetragen. Durch die Enhanced chemoluminescence (ECL) werden zum Schluß die Proteine detektiert. In den Versuchen sind ca. 5-7 Mio. DC/Ansatz zum Einsatz gekommen. Den Proben ist für unterschiedliche Zeiten (15, 30 oder 60 Minuten) Blei in 10 oder 100 µmol/l oder LPS (0,8 µg/ml) zugesetzt worden, um die mögliche Aktivierung der MAPKinase p38 untersuchen zu können. Anschließend sind die Zellen zentrifugiert (220 g, 4 °C, 10 Minuten) und das Zellpellet gewonnen worden. Es ist eine Proteinbestimmung durchgeführt (siehe 3.4.2.8.) und Aliquots gebildet worden, die bei -80 °C eingefroren wurden. 3.4.1.8. T-Zellen: Mixed Leukocyte Reaction (MLR), Vitalität und Proliferation Bei der heterologen MLR werden T-Zellen einer NMRI-Maus mit DC einer Balb/c-Maus zusammengebracht und nach fünf Tagen mit ³H-Thymidin markiert, um 48 Versuchsübersicht die Proliferationsrate der T-Zellen als Reaktion auf die behandelten DC bestimmen zu können. Die dafür verwendeten DC werden zunächst für neun Tage kultiviert und für 24 Stunden mit einem Schwermetall inkubiert. Dann erfolgt die Zugabe der frisch gewonnenen T-Zellen aus der Milz. Dieser Versuch erfolgte zum einen als Präinkubation, d.h. die DC wurden vor der Zugabe zu den T-Zellen herunterzentifugiert und mit neuem Medium versetzt. Außerdem wurde eine Coinkubation, also ohne vorherigen Mediumwechsel, durchgeführt. Die Aufteilung der T-Zellen war mit 100.000 Zellen /well immer gleich; die der DC änderte sich von well zu well (312, 625, 1.250, 2.500, 5.000, 10.000 DC/ 100µl Medium). Der Ansatz erfolgte in einer Roundbottom-Platte. Am fünften Tag sind die Proben mit 10 µl 3HThymidin (0,005 mCi) markiert und nach 18 Stunden bei -20 °C eingefroren worden. Ausgewertet wurde die Proliferationsrate der T-Zellen anhand des Scintilationszählers, der die vom eingebauten Thymidin ausgehende β-Strahlung misst. Zusätzlich ist die Vitalität der T-Zellen und die Proliferation unabhängig von den DC gemessen worden, um darzustellen, dass die verwendeten Schwermetallkonzentrationen nicht toxisch für die T-Zellen sind. Für die Vitalitätsbestimmung sind die T-Zellen gleichmäßig zu 75.000 TZ bzw. 150.000 TZ/ well in einer Roundbottom-Platte verteilt worden. Als Stimulans diente PHA (5 µg/ml). Zusätzlich sind Schwermetalle in den Konzentrationen 1, 10 und 100 µmol/l für drei Tage zusammen mit den T-Zellen inkubiert worden. Im Anschluß erfolgte ein MTT-Test. Um die Proliferation der T-Zellen in Abwesenheit der DC bestimmen zu können, sind die T-Zellen in Anlehnung an DUGAN et al. (2004) in zwei unterschiedlichen Konzentrationen (75.000 und 150.000 TZ/200 µl Medium) aufgeteilt und in eine Roundbottom-Platte überführt worden. Nach Zugabe von unterschiedlichen Schwermetallkonzentrationen und PHA (5 µg/ml) sind die Zellen nach drei Tagen mit Thymidin markiert und 18 Stunden später bei -20 °C eingefroren worden. Die Auswertung erfolgt so wie bei der MLR mit dem Scintilationsgerät. 49 Versuchsübersicht 3.4.2. In-vivo-Untersuchungen Es wurden zwei unterschiedliche Allergiemodelle für diese Arbeit ausgesucht, um die möglichen Immunmodulationen durch Schwermetalle sowohl in einem Th1-, als auch in einem Th2-induzierten Allergiegeschehen untersuchen zu können. Insgesamt sind 42 Tiere auf sieben Gruppen verteilt worden (n=6). Neben einer Kontrollgruppe gab es sowohl für das TDI-, als auch für das DNCB-Modell eine Kontrolle. Außerdem wurde innerhalb der beiden Allergiemodelle jeweils eine Gruppe mit 230 bzw. 2300 ppm Bleiacetat behandelt. Das Bleiacetat ist den Tieren über das Trinkwasser ad libitum für insgesamt acht Wochen angeboten worden. Die Bleiacetatkonzentrationen 230 bzw. 2300 ppm entsprechen einem Bleigehalt von 0,126 bzw. 1,265 g/l. Somit ergibt sich eine tägliche Bleiaufnahme von 0,63 bzw. 6,325 mg pro Maus bei einer Wasseraufnahme von durchschnittlich 5 ml. 3.4.2.1. TDI-Kontaktallergiemodell Die Balb/c-Mäuse sind an vier aufeinander folgenden Tagen mit 5 %igen TDI sensibilisiert worden. Am ersten Tag ist ihnen 100 µl, an den Tagen 2 bis 4 50 µl auf die zuvor rasierte Bauchhaut aufgetragen worden. Für eine bessere Penetration des Allergens durch die Epidermis ist die Hornschicht der rasierten Bauchhaut zusätzlich mit Klebestreifen abgestrippt worden. Am Tag 21 des Versuches erfolgte die Challenge durch wiederholte Applikation von 0,5 %igen TDI (50 µl) auf die Bauchhaut. Am Tag 28 und 29 des Versuches erfolgte die zweite Challenge, allerdings an Ober- und Unterseite der Ohren (je 20 µl 0,5 % TDI) (BÄUMER et al. 2005). 3.4.2.2. DNCB-Kontaktallergiemodell Die Mäuse wurden zwei Tage lang im DNCB-Modell sensibilisiert. Zuerst ist ihnen 100 µl 1 %iges DNCB in Freundsches Adjuvans gelöst intracutan appliziert worden. Die Wiederholung am darauf folgenden Tag erfolgte mit nur 50 µl der Lösung. Die Challenge mit 0,5 %igem DNCB (je 20 µl) erfolgte 7 Tage später durch lokales Auftragen des Allergens auf die Ohrhaut (BÄUMER et al. 2005). In Abbildung 9 ist der Aufbau des Tierversuchs schematisch dargestellt. 50 Versuchsübersicht DNCB-Modell TDI-Modell Sensibilisierung: Sensibilisierung: Tag 1: Tag 1: 1% DNCB (100 µl), 5% TDI (100 µl), Bauchhaut Bauchhaut Tag 2-4: 5% TDI (50µl), Bauchhaut Tag 2: 1% DNCB (50µl), Challenge I: Tag 21: Bauchhaut 0,5% TDI (50µl), Bauchhaut Challenge I: Challenge II+III: Tag 29+30: 0,5% TDI (50µl), Tag 8: Ohren 0,5% DNCB (20µl), Ohren Abb. 9 Übersicht zum In-vivo-Versuchsablauf im TDI- und DNCB-Modell 3.4.2.3. Bleibestimmung im Vollblut Es wurde jeweils eine Sammelblutprobe einer Gruppe in der Atomabsorptionsspektroskopie (AAS) auf ihren Gehalt an Blei gemessen. Hierfür sind die Proben in mehreren Arbeitsschritten vorbereitet worden: 0,5 ml Vollblut ist mit HNO3 für sechs Stunden bei 60°C erwärmt worden. Im Anschluß erfolgte für vier Stunden die Erhitzung mit HNO3 und Salpetersäure bei Temperaturen zwischen 130 und 200 °C. Danach wurden die Proben in einen Glaskolben überführt und gemessen. 3.4.2.4. Untersuchung der allergischen Entzündungsreaktion anhand der Lnn. auriculares und der Ohrdickenmessung Prinzip der Methode nach EHLING et al. (2005) ist die Gewichtsbestimmung regionaler Lymphknoten nach stattgefundener Entzündungsreaktion. Den Mäusen sind nach der Tötung beide Lnn. auriculares entnommen worden, um deren Gewicht zu bestimmen. Dieses wird durch stimulierte und folglich proliferierte T-Zellen, deren 51 Versuchsübersicht Zahl ebenfalls bestimmt wurde, beeinflusst. Die T-Zellproliferation wiederum ist eine Folge der Stimulation durch ausgewanderte DC nach TDI- bzw. DNCB-Kontakt aus dem Entzündungsgeschehen in die regionalen Ohrlymphnoten. Als zusätzlicher Parameter einer durch die beiden Allergene induzierten, allergischen Entzündungsreaktion dient das Ausmessen der Ohrdicke vor und nach der Challenge mit Hilfe eines Cutimeters (Mitutoyo, Neuss). 3.4.2.5. Untersuchung von Lymphknotenzellen aus den Lnn. auriculares Die für den vorherigen Versuch gewonnenen Lymphknoten sind nach der Gewichtsbestimmung von jeder Maus gesammelt und zerkleinert worden. Im Anschluß ist die jeweilige Zellzahl bestimmt und die Zellen sind für die FACSAnalyse (CD11c/CD40) und die Zellkultur in zwei Gruppen zu je 1 Mio. DC aufgeteilt worden. In Anlehnung an CUMBERBATCH et al. (2005) sind die DC in der Zellkultur erneut mit TDI bzw. DNBS (dem wasserlöslichen Analogon zu DNCB) inkubiert worden: Im TDI-Modell sind die DC zunächst für eine Stunde mit 100 µg/ml TDI inkubiert worden (RPMI-Medium ohne Zusatz von FKS). Nach einem Waschvorgang wurde dieser Vorgang wiederholt (RPMI-Medium mit Zusatz von FKS). Es erfolgten ein Mediumwechsel und ein Transfer der Zellen in eine 96er-well-Platte, wo sie für drei Tage bei 37 °C inkubierten. Im Anschluß wurden die Zellen herunterzentrifugiert und der Überstand zur Bestimmung von IL-4 und IL-1β genutzt. Die Kultivierung der Zellen aus den DNCB-Gruppen erfolgte ähnlich. Nachdem die Zellen in RPMI-Medium (mit FKS und Pen/Strep) aufgenommen wurden, ist ihnen für drei Stunden DNBS (100 µg/ml) zugesetzt worden. Nach einem Mediumwechsel wurden sie für weitere zwei Tage im Brutschrank bei 37°C inkubiert. Die Zellen sind dann herunterzentrifugiert und die Überstände für die Bestimmung von IFN-γ gewonnen worden. 52 Versuchsübersicht 3.4.2.6. Migrationsassay In Anlehnung an ORTNER et al. (1996) ist in diesem Versuch die Auswanderungsbereitschaft der DC nach Bleiacetatverabreichung untersucht worden. Hierfür sind die Ohren der Mäuse unmittelbar nach deren Tötung abgetrennt und für 8-10 Minuten zur Desinfektion in 70 % Ethanol aufbewahrt worden. Anschließend wurden sie luftgetrocknet, um für den Migrationsassay in eine dorsale und ventrale Hälfte getrennt werden zu können. Die dorsale Ohrhälfte ist mit der Epidermis nach oben liegend auf ein dreibeiniges Stahlnetz gelegt und dieses wiederum in ein mit Medium (RPMI-Medium mit FKS, Pen/Strep und MIP-3β) vorbereitete 6well-Platte gestellt worden. Diese Kultur ist für drei Tage im Brutschrank bei 37 °C inkubiert worden, wobei an den Tagen 1 und 2 das Medium gewechselt und mit dem Medium des dritten Tages gepoolt wurden, um die Zahl der ausgewanderten DC bestimmen zu können. 3.4.2.7. Bestimmung von IL-4 aus dem Ohrhomogenat Zur Bestimmung der Zytokinproduktion in den behandelten Ohren der Mäuse sind diese nach der zervikalen Dislokation entnommen und bei -80 °C aufbewahrt worden. Für die Untersuchungen sind sie unter Flüssigstickstoff zerkleinert und danach in Eppendorfgefäße überführt worden. Nach Zugabe von 150 µl PBS wurden die Proben bei 4 °C für eine Stunde inkubiert und schließlich zentrifugiert, um die Überstände zu gewinnen. Diese wurden mit Hilfe einer Proteinbestimmung auf einen gemeinsamen Proteingehalt eingestellt, um dann die IL-4-Menge der einzelnen Proben im ELISA zu messen. 3.4.2.8. Proteinbestimmung Es wird zuvor gelöstes Protein in einer Mikrotiterplatte vorgelegt und anschließend mit einem Reaktionsreagenz vermischt. Abhängig vom Proteingehalt kommt es zu einem Farbumschlag der jeweiligen Probe, die durch die Bindung des Reagenz mit dem Protein zustande kommt. Die exakte Proteinmenge wird bei einer Wellenlänge von 595 nm photometrisch gemessen und kann durch eine ebenfalls 53 Versuchsübersicht gemessene Kalibrationsreihe, angesetzt mit BSA als Standard, in absolute Werte umgerechnet werden. Die Proteinbestimmung findet in dieser Arbeit zum einen Anwendung bei dem zuvor beschriebenen Ohrhomogenat-Versuch, als auch bei der Einstellung der Proben für den Westernblot. Die Tabelle 6 gibt einen Überblick über die für die einzelnen Tiergruppen durchgeführten Versuche. Tab. 6 Überblick der In-vivo-Versuche bei den einzelnen Tiergruppen Gruppen (Bleigehalt im Kontrolle TDI DNCB (0 g/l) (0/ 0,126/ 1,265 g/l) (0 /0,126/ 1,265 g/l) x x x Gewichtsbestimmung x x X Zellzahlbestimmung x x X x +TDI: Messung von IL-4 und IL-1β +DNBS: Messung von IFN-γ Trinkwasser, Durchgeführte g/l) Versuche (x) Bleibestimmung Im Vollblut Lnn. Auriculares Lymphozytenkultur FACS CD11c/CD40-Expression Ohren Ohrdickenmessung Skinmigrationsassay x x X x x X 54 Statistische Auswertung 3.5 Statistische Auswertung Die Darstellungen der Ergebnisse (DC- und T-Zellvitalität, T-Zellproliferation, TNF-α- und CCL2-ELISA, Migrationsassay, MLR, entzündliche Ohrschwellung, Lymphknotengewicht, -zellzahl, sowie CD11c/CD40-positivie Zellen) erfolgten unter Angabe der Mittelwerte (MW) + Standardabweichung (S.D.). Die statistische Auswertung der Ergebnisse erfolgte mit dem Programm GraphPadPrism. Die mit unterschiedlichen Schwermetallkonzentrationen behandelten Gruppen sind jeweils mit der Kontrollgruppe bzw. untereinander auf signifikante Differenzen untersucht worden. Hierfür wurde zuerst eine parametrische Varianzanalyse (One-way-Anova) und im Anschluß der Dunnetts Test als post-hocTest durchgeführt. Eine Irrtumswahrscheinlichkeit von 5% galt als schwach signifikant; lag sie bei 1%, wurde sie als signifikant bzw. bei 0,1% als hoch signifikant eingestuft. Diese statistischen Durchführungen gelten für alle aufgeführten In-vivoErgebnisse und z.T. für die In-vitro-Ergebnisse. Die Ausnahmen hierbei sind die Ergebnisse der MLR und T-Zellproliferation, bei denen ein ungepaarter T-Test als statistische Auswertung gewählt wurde. Die zugehörigen Einzelwerte aller durchgeführten Versuche sind in dem Anhangskapitel aufgeführt. 55 Ergebnisse 4 Ergebnisse 4.1 In-vitro-Untersuchungen 4.1.1. Einfluss der Schwermetalle auf die Vitalität der DC und T-Zellen, sowie auf die Proliferation der T-Zellen Als Vorraussetzung für die nachfolgenden Untersuchungen ist sowohl bei den DC, als auch bei den T-Zellen die Vitalität mittels MTT-Test gemessen worden (Abb. 4.1-a+b und 4.2). Im Vergleich zur Kontrolle (KO) ist keine signifikante Beeinträchtigung der DC oder T-Zellen durch Inkubation mit den Schwermetallen in unterschiedlichen Konzentrationen zu erkennen. Die Proliferationsrate der T-Zellen nach alleiniger Inkubation mit Schwermetallen sinkt bei beiden Metallen mit Optische Dichte zunehmender Konzentration (Abb.4.3). 1,8 1,6 1,4 1,2 1 0,8 0,6 0,4 0,2 0 KO LPS 1 10 100 Blei+LPS 1 10 100 µmol/l Mangan+LPS Abb.4.1-a Vitalität der DC (nach zusätzlicher LPS-Stimulation), Messung der Extinktion nach Durchführung eines MTT-Tests am Tag 10 der Kultur; Stimulation durch Schwermetalle am Tag 8 und durch LPS am Tag 9 der Kultur; die Probenanzahl beträgt n=4; die Versuche wurden dreimal durchgeführt; Einzelwerte siehe Tab.9-1 A und G im Anhang 56 Ergebnisse Optische Dichte 1,8 1,6 1,4 1,2 1 0,8 0,6 0,4 0,2 0 KO 10 1 100 1 Blei 10 100 µmol/l Mangan Abb.4.1-b Vitalität der DC, Messung der Extinktion nach Durchführung eines MTTTests am Tag 10 der Kultur; Stimulation durch Schwermetalle am Tag 8 der Kultur. Die Probenanzahl beträgt n=4; es handelt sich um ein repräsentatives Ergebnis von drei Versuchsdurchführungen. Einzelwerte siehe Tab.9-1 J und D im Anhang Optische Dichte 0,6 0,5 0,4 0,3 0,2 0,1 0 KO 1 10 100 1 10 100 µmol/l Mangan Blei Abb. 4.2 Vitalität der T-Zellen, Messung der Extinktion nach Durchführung eines MTT-Tests. Die T-Zellen (75.000 TZ/ 200 µl Medium) wurden mit Blei bzw. Mangan über drei Tage mit Zusatz von 5 µg/ml PHA als Stimulans inkubiert, die Probenanzahl beträgt n=6; es wurden drei Versuche durchgeführt. Einzelwerte siehe Tab.9-2 A und D im Anhang 57 ³H-Thymidin (cpm)x10³ Ergebnisse * 9.000 8.000 7.000 6.000 5.000 4.000 3.000 2.000 1.000 0 KO 1 10 100 Blei Abb.4.3 1 10 100 µmol/l Mangan ³H-Thymidin-Einbaurate (cpm) in T-Zellen bei Inkubation mit Blei bzw. Mangan. Die Proliferation der T-Zellen nimmt im Vergleich zur Kontrolle mit steigender Schwermetallkonzentration ab; ein signifikanter Unterschied besteht zwischen der Kontrolle und Blei 100 µmol/l (*p < 0,05), die Probenanzahl beträgt n=6, es wurden drei Versuche durchgeführt. Einzelwerte siehe Tab.9-3 A und D im Anhang 4.1.2. Einfluss von Blei und Mangan auf die TNF-α-Produktion Das proinflammatorische Zytokin TNF-α ist in diesem Versuch aus den Kulturüberständen zuvor stimulierter DC durch Schwermetalle bestimmt worden. Bei zusätzlicher LPS-Stimulation steigt die Zytokinmenge ebenso wie bei nur LPS-stimulierten DC. Fällt die LPS-Stimulation weg, liegt die Sekretion auf Kontrollniveau (Abb. 4.4a+b). 58 Ergebnisse 1,2 Optische Dichte 1 0,8 0,6 0,4 0,2 0 KO LPS 1 10 100 1 10 Blei 100 µmol/l Mangan Abb.4.4-a TNF-α-Produktion durch DC (nach zusätzlicher LPS-Stimulation) Dargestellt ist die Extinktion als optische Dichte. Ein Anstieg der Zytokinausschüttung findet nur im Zusammenhang mit einer LPS-Stimulation statt; die Probenanzahl beträgt n=4. Es handelt sich um repräsentatives Ergebnis von drei Durchführungen. Einzelwerte siehe Tab.9-4 C und H im Anhang 1,2 Optische Dichte 1 0,8 0,6 0,4 0,2 0 KO 1 10 100 Blei 1 10 100 µmol/l Mangan Abb.4.4-b TNF-α-Produktion durch DC Dargestellt ist die Extinktion als optische Dichte. Ein Anstieg der Zytokinausschüttung durch Blei oder Mangan findet nicht statt; die Probenanzahl beträgt n=4. Es handelt sich um repräsentatives Ergebnis von drei Durchführungen. Einzelwerte siehe Tab.9-4 E und K im Anhang 59 Ergebnisse 4.1.3. Beeinflussung der DC durch Schwermetalle im Migrationsassay In der Boyden Chamber ist das Auswanderverhalten der DC nach Schwermetallinkubation untersucht worden. Das Auswanderverhalten der DC nimmt nach Stimulation mit LPS nur leicht zu (Abb.4.5). Nach einer zusätzlichen Inkubation mit Blei 100 µmol/l kommt es zu einem signifikanten Anstieg der Migrationsbereitschaft gegenüber der Kontrolle (Abb.4.6-a). Innerhalb der Bleigruppe sieht man einen dosisabhängigen Anstieg bei der Migration. Bei der Inkubation mit Mangan (100 µmol/l) steigt das Auswanderverhalten der DC signifikant (Abb. 4.6-b). ausgewanderte DC/ml 30.000 25.000 20.000 15.000 10.000 5.000 0 Kontrolle LPS Abb.4.5 Migrationsassay unter LPS-Stimulation, kein signifikanter Unterschied zwischen der Kontrolle und LPS-stimulierten DC. Der Versuch ist mit einer Probenanzahl von n=4 dreimal durchgeführt worden. Einzelwerte siehe Tab.9-5 A im Anhang 60 Ergebnisse * ausgewanderte DC/ml 30.000 25.000 20.000 15.000 10.000 5.000 0 Kontrolle 10 1 µmol/l 100 Blei+LPS Abb.4.6-a Migrationsassay unter Bleiinkubation und LPS-Stimulation, signifikanter Unterschied zwischen der Kontrolle und Blei 100 µmol/l nach 90 Minuten Inkubation (*p < 0,05). Die Probenanzahl ist n=4; der Versuch wurde dreimal durchgeführt. Einzelwerte siehe Tab.9-5 A im Anhang ausgewanderte DC/ml 30.000 * 25.000 20.000 15.000 10.000 5.000 0 Kontrolle 1 10 100 µmol/l Mangan+LPS Abb.4.6-b Migrationsassay unter Manganinkubation und LPS-Stimulation, signifikanter Unterschied zwischen der Kontrolle und Mangan 100 µmol/l nach 90 Minuten Inkubation (*p < 0,05). Die Probenanzahl beträgt n=3; es ist ein repräsentatives Ergebnis von drei Durchführungen. Einzelwerte siehe Tab.9-5 D im Anhang 61 Ergebnisse 4.1.4. Untersuchung der Expression von Oberflächenmolekülen in der FACS- Analyse Der Rezeptor CCR7 auf reifenden DC wird für das Auswandern in den drainierenden Lymphknoten benötigt. In der Tab.4.1 sind zwei unterschiedliche Versuchsansätze mit ihren Ergebnissen dargestellt: zum einen der Anteil der DC, die CCR7 nach LPS-Stimulation bzw. Bleiinkubation exprimieren (A); zum anderen die DC, die im MIgrationsassay ausgewandert sind und in Folge der dadurch induzierten Maturation CCR7 exprimieren (B). Die Untersuchungen beschränken sich auf Blei und Mangan in jeweils einer Konzentration, da dieser Ansatz als orientierend anzusehen ist. Tab. 4.1 Expression von CCR7 durch DC nach LPS-/Bleikontakt, sowie Auswanderung im Migrationsassay nach Manganinkubation, repräsentatives Ergebnis von zwei Durchführungen; Einzelwerte siehe Tab.9-6 im Anhang; Anzahl der CCR7-exprimierenden DC (Zellzahl / %) A Kontrolle 8.500 / 1,7 LPS 30.900 / 6,18 Pb 100 µmol/l 46.600 / 9,32 Anzahl der CCR7exprimierenden DC (Zellzahl / %) B Anzahl CCR7exprimierenden DC im Migrationsassay (Zellzahl / %) Kontrolle 300 / 0,06 58.100 / 11,62 LPS 10.000 / 2 43.800 / 8,76 Mn 10 µmol/l 25.100 / 5,02 73.600/ 14,7 62 Ergebnisse Zum einen ist zu erkennen, dass allein durch das Schwermetall die DC eine stärkere Expression von CCR7 zeigen (A). Im Migrationsassay ist zum anderen die CCR7-Expression sowohl durch das Auswandern, als auch durch die zusätzliche Stimulation mit Mangan gesteigert (B). In den Abb. 4.7-a+b ist die Expression von CCR7 durch die DC anhand von Histogrammen gezeigt. Hierbei wird die gesteigerte CCR7-Expression von DC, die mit Mangan (10 µmol/l) inkubiert wurden, gegenüber der Kontrolle durch eine Rechtsverschiebung des Histogramms deutlich. Abb.4.7-a Histogramm CCR7-positiver DC, Abb.4.7-b Histogramm CCR7-positi- die unbehandelt sind und eine geringe ver DC, die mit Mangan (10 µmol/l) CCR7-Expression zeigen. inkubiert wurden und mit einer gesteigerten Expression reagieren. Die Expression der Oberflächenmoleküle CD11c als DC-Marker, sowie CD80 und CD86 als DC-Aktivierungsmarker ist nach Schwermetallinkubation im Vergleich zur Kontrolle und LPS-stimulierten DC gemessen worden. Die Darstellungen der Ergebnisse (CD11c/CD80) aus der FACS-Analyse erfolgen als Dotplots. Der Quadrant C2 spiegelt die doppeltpositiven DC wider. Es handelt sich um ein repräsentatives Ergebnis von zwei Durchführungen. Einzelwerte siehe Tab.9-6 im 63 Ergebnisse Anhang; Auf der x-Achse ist CD80, auf der y-Achse CD11c aufgetragen CD11c (Abb.4.8-a-e). CD80 Abb.4.8-a Dotplot unbehandelter DC, Abb.4.8-b Dotplot LPS-stimulierter DC, CD11c/CD80-positive DC sind im die Anzahl der CD11c/CD80-positiven Quadranten C2 dargestellt steigt im Gegensatz zur Kontrolle Abb. 4.8-c Dotplot bleistimulierter DC Abb. 4.8-d Dotplot bleistimulierter DC (1 µmol/l), erhöhte Expression von (10 µmol/l), erhöhte Expression von CD11c/CD80 durch DC CD11c/CD80 durch DC 64 Ergebnisse Abb. 4.8-e Dotplot bleistimulierter DC (100 µmol/l), die Anzahl CD11c/CD80-positiver DC geht auf Kontrollniveau zurück Zusammenfassend zeigt sich eine leichte Erhöhung von CD11c/CD80 bei den DC, die zuvor mit 1 bzw. 10 µmol/l Blei inkubiert wurden (Abb.4.8 c+d). Bei Blei 100 µmol/l sinkt die Expression unterhalb des Kontrollniveaus (Abb.4.8-e). Die Darstellungen der CD11c/CD86-Ergebnisse erfolgen ebenfalls als Dotplots; es handelt sich um ein repräsentatives Ergebnis von zwei Durchführungen. Einzelwerte siehe Tab.9-6 im Anhang; Auf der x-Achse ist CD86, auf der y-Achse CD11c CD11c aufgetragen (Abb.4.8-f-j). CD86 Abb. 4.8-f Dotplot unbehandelter DC, Abb. 4.8-g Dotplot LPS-stimulierter CD11c/CD86-positive DC sind im DC, starker Anstieg von Quadranten C2 dargestellt CD11c/CD86-positiven DC 65 Ergebnisse Abb. 4.8-h Dotplot bleistimulierter DC Abb. 4.8-i Dotplot bleistimulierter DC (1 µmol/l), Expression von CD11c/CD86 (10 µmol/l), Expression von CD11c/ sinkt auf Kontrollniveau CD86 ist auf Kontrollniveau Abb. 4.8-j Dotplot bleistimulierter DC (100 µmol/l) Expression von CD11c/CD86 ist auf Kontrollniveau Zusammenfassend lässt sich bei der Expression von CD11c/CD86 kein Unterschied zwischen der Kontrollgruppe und den bleistimulierten DC nachweisen. 66 Ergebnisse 4.1.5. Einfluss von Blei auf die MAPKinase p38 p38 zählt zu den MAPKinasen, die intrazellulär vorkommen und durch Noxen aktiviert (phosphoryliert) werden (p38 → pp38). Dargestellt sind die im Westernblot aufgetrennten und durch ECL-Detektion sichtbar gemachten Proteine der DCProben, die zuvor mit Blei inkubiert wurden. Die Proben sind zu unterschiedlichen Zeiten stimuliert worden, um eine zeitabhängige Aktivierung von p38 untersuchen zu können. In der Abb. 4.9 ist die p38 zusammen mit ihrer aktivierten Form pp38 dargestellt. Die stärkste Aktivierung erfolgt bei LPS nach 30 Minuten, bei Blei 10 µmol/l ist nach 60 Minuten eine ganz schwache Aktivierung zu sehen. Bei Blei 100 µmol/l ist erstmals bei 15 Minuten ein Signal zu erkennen. pp38 p38 15´ KO 30´ LPS 60´ 15´ 30´ 60´ Blei 10 µmol/l 15´ 15´ 30´ Blei 100 µmol/l Abb.4.9 Darstellung der Banden aus dem Westernblot, Gegenüberstellung von p38 ( ) und pp38 ( ) einzelner Proben; negatives Ergebnis bei der Kontrolle, stärkste Aktivierung bei LPS nach 30 Minuten, leichte Aktivierung bei Pb 10 µmol/l nach 60 Minuten, bei Pb 100 µmol/l ist bei 15 Minuten (hier zweimal aufgeführt) schon eine Aktivierung zu sehen. Es handelt sich um ein repräsentatives Ergebnis von zwei Durchführungen. 67 60´ Ergebnisse 4.1.6. Wirkung der Schwermetalle auf die T-Zellproliferation in der MLR In der MLR wird die Proliferationsrate der T-Zellen als Reaktion auf die Stimulation durch DC gemessen. Insgesamt wurden zwei unterschiedliche Versuchsansätze durchgeführt. Zum einen erfolgte die MLR anhand einer Inkubation der DC nach vorheriger Schwermetallinkubation (Abb.4.10-a-c). Als zweites ist aus den Überständen dieses Ansatzes die Konzentration des Chemokins CCL2 gemessen worden (Abb. 4.10-d+e). Es zeigt sich bei allen drei Bleikonzentrationen (1, 10 und 100 µmol/l) ein Anstieg der T-Zellproliferation proportional zur DC-Anzahl (siehe Abb. 4.9 a-c). Bei der Inkubation mit Mangan 1-100 µmol/l erfolgten ähnliche Ergebnisse; diese sind im ³H-Thymidin (cpm)x10³ Anhang aufgeführt. 50.000 45.000 40.000 35.000 30.000 25.000 20.000 15.000 10.000 5.000 0 *** * * 312 625 Kontrolle Pb 1 µmol/l * 1.250 2.500 5.000 10.000 Anzahl DC Abb.4.10-a ³H-Thymidin-Einbaurate (cpm) in T-Zellen bei Inkubation mit Blei (1 µmol/l); schwach signifikanter bzw. hoch signifikanter Unterschied zwischen der Kontrolle und Blei 1 µmol/l; dieser Versuch wurde dreimal reproduziert (Einzelwerte siehe Anhangstabelle), die Probenanzahl beträgt n=6; * p > 0,05, *** p<0,001; Einzelwerte siehe Tab.9-7 B im Anhang 68 ³H-Thymidin (cpm) x10³ Ergebnisse 50.000 *** 45.000 40.000 35.000 30.000 25.000 20.000 15.000 10.000 5.000 0 *** Kontrolle *** 312 625 1.250 Pb 10 µmol/l 2.500 5.000 10.000 Anzahl DC Abb.4.10-b ³H-Thymidin-Einbaurate (cpm) in T-Zellen bei Inkubation mit Blei (10 µmol/l); stark signifikanter Unterschied zwischen der Kontrolle und Blei 10 µmol/l, dieser Versuch wurde dreimal reproduziert (Einzelwerte siehe Anhangstabelle); die Probenanzahl beträgt n=6; *** p > 0,001; Einzelwerte siehe ³H-Thymidin (cpm)x10³ Tab.9-7 B im Anhang 50.000 45.000 40.000 35.000 30.000 25.000 20.000 15.000 10.000 5.000 0 *** *** *** 312 625 Kontrolle Pb 100 µmol/l * 1.250 2.500 5.000 10.000 Anzahl DC Abb.4.10-c ³H-Thymidin-Einbaurate (cpm) in T-Zellen bei Inkubation mit Blei (100 µmol/l); signifikanter Unterschied zwischen der Kontrolle und Blei 100 µmol/l, dieser Versuch wurde dreimal reproduziert (Einzelwerte siehe Anhangstabelle), die Probenanzahl beträgt n=4; ** p > 0,01, *** p < 0,001 ; Einzelwerte siehe Tab.9-7 B im Anhang 69 Ergebnisse Am Tag 4 der MLR sind vor der Thymidinmarkierung Überstände für die Bestimmung von CCL2 und TNF-α entnommen worden. In dem TNF-α-ELISA zeigten sich keine Unterschiede zwischen den einzelnen Gruppen, und deshalb sind sie nicht aufgeführt (Einzelwerte siehe Tab.9-9 im Anhang). Für die CCL2-Gewinnung erfolgte folgender Ansatz: in Abb.4.10-d+e sind Kontroll-DC solchen DC gegenübergestellt, die zuvor mit Blei (100 µmol/l) als Präoder Coinkubation stimuliert wurden. Hierbei zeigt sich ein signifikanter Rückgang des CCL2-Gehaltes sowohl bei der Prä-, als auch bei der Coinkubation der bleiinkubierten DC im Vergleich zur Kontrolle. * * 120 pg/ml CCL2 100 80 60 40 20 0 312 2.500 10.000 312 Kontrolle 2.500 10.000 Anzahl DC Blei 100 µmol/l Präinkubation Abb.4.10-d Bestimmung des CCL2-Gehalts aus Überständen der MLR mit Blei 100 µmol/l (Präinkubation), signifikante Reduktion jeweils in den zwei größeren DC-Gruppen (2.500 und 10.000 DC), repräsentatives Ergebnis von drei Durchführungen, die Probenanzahl beträgt n=4, * p < 0,05; Einzelwerte siehe Tab.9-8 B im Anhang 70 Ergebnisse * * 120 pg/ml CCL2 100 80 60 40 20 0 312 2.500 10.000 312 Kontrolle 2.500 10.000 Anzahl DC Blei 100 µmol/l Coinkubation Abb.4.10-e Bestimmung des CCL2-Gehalts aus Überständen der MLR mit Blei 100 µmol/l (Coinkubation), signifikante Reduktion jeweils in den zwei größeren DC-Gruppen (2.500 und 10.000 DC), repräsentatives Ergebnis von drei Durchführungen, die Probenanzahl beträgt n=4, * p < 0,05; Einzelwerte siehe Tab.9-8 B im Anhang 71 Ergebnisse 4.2 In-vivo-Untersuchungen 4.2.1. Bleiwerte im Vollblut In den beiden Kontaktallergiemodellen mit TDI und DNCB ist den Mäusen über einen Zeitraum von insgesamt sieben bzw. acht Wochen Bleiacetat in zwei Konzentrationen über das Trinkwasser verabreicht worden. Die Bleikonzentrationen im Vollblut sind aus den Blutproben, die unmittelbar nach der Tötung entnommen wurden, bestimmt worden. Die Abb. 4.11 zeigt die Werte der Kontrollgruppen (Kontrolle, TDI und DNCB), sowie der mit 230 ppm und 2300 ppm Bleiacetat behandelten TDI- und DNCB-Gruppen. Die Bleiacetatkonzentrationen 230 bzw. 2300 ppm entsprechen einer Bleikonzentration von 0,126 bzw. 1,265 g/l im Trinkwasser. Es ist ein dosisabhängiger Anstieg der Bleikonzentrationen im Vollblut zu den Mengen im Trinkwasser bei beiden Gruppen zu sehen. Die Bleibelastung der DNCBGruppe fällt insgesamt geringer aus; ihnen wurde im Gegensatz zur TDI-Gruppe nur sieben, anstatt acht Wochen Bleiacetat verabreicht. µg/dl Bleigehalt im Vollblut 100 90 80 70 60 50 40 30 20 10 0 0 0 0,126 1,265 0 0,126 1,265 g/l Blei im Trinkwasser Kontrolle TDI-Modell DNCB-Modell Abb. 4.11 Konzentrationen von Blei im Vollblut (µg/dl) der Mäuse aus den Kontroll-, TDI- und DNCB-Gruppen, Messung von je einer Sammelblutprobe pro Gruppe. Es stellt sich ein dosisabhängiger Anstieg innerhalb beider Kontaktallergiemodelle dar. Einzelwerte siehe Tab.9-10 im Anhang 72 Gruppen der Ergebnisse 4.2.2. Einfluss von Blei auf die entzündliche Ohrschwellung Die in diesem Versuch durch die Kontaktallergene TDI bzw. DNCB induzierte Ohrschwellung nimmt gegenüber der Kontrolle signifikant zu und konnte durch die zusätzliche Verabreichung von 1,265 g/l Blei im TDI-Modell signifikant gesteigert werden; bei 0,126 g/l Blei ist kein Effekt erkennbar (Abb. 4.12-a). Im DNCB-Modell haben keine der beiden Bleikonzentrationen eine Wirkung auf die Entzündungsreaktion (Abb. 4.12-b). * Ohrschwellung (µm) 140 *** 120 100 80 60 40 20 0 0 0 0,126 1,265 g/l Blei Kontrolle TDI Abb. 4.12-a Messung der Ohrschwellung (µm) 24 h nach der TDI-Challenge; Es kommt zu einer schwach signifikanten Steigerung der Ohrschwellung durch TDI + 1,265 g/l Blei, die Anzahl der Proben ist n=4, * p< 0,05, *** p< 0,001 Ohrschwellung (µm) 140 120 100 *** 80 60 40 20 0 0 0 0,126 Kontrolle 1,265 g/l Blei DNCB Abb. 4.12-b Messung der Ohrschwellung (µm) 24 h nach der DNCB-Challenge; Es kommt nicht zu einer signifikanten Änderung nach der Bleizugabe, aber zu einer stark signifikanten Steigerung von DNCB-behandelten Mäusen gegenüber unbehandelten Mäusen; die Probenanzahl beträgt n=6; *** p< 0,001; Einzelwerte siehe Tab.9-11 b) im Anhang 73 Ergebnisse 4.2.3. Einfluss von Blei auf die lokalen Lymphknoten (Lnn. auriculares) In den Abb.4.13-a+b ist das Lymphknotengewicht der TDI- bzw. DNCBsensibilisierten Tiere nach Verabreichung von Blei im Vergleich zu den Kontrollen (Kontrolle, TDI und DNCB) aufgeführt. Es wurden beide Lymphknoten einer Maus entnommen und gewogen. Die Ergebnisse sprechen für keine Beeinflussung des Gewichts durch Blei, lediglich die Sensibilisierung durch TDI und DNCB führen, wie erwartet, zu einer Gewichtszunahme in beiden Gruppen. ** Lymphknotengewicht (mg) 8 7 6 5 4 3 2 1 0 0 0 0,126 Kontrolle 1,265 g/l Blei TDI Abb.4.13-a Gewichte der Lnn. auriculares TDI-sensibilisierter Tiere bei gleichzeitiger Bleiverabreichung (0,126 und 1,265 g/l); es kommt zu keinen signifikanten Unterschieden innerhalb der TDI-Gruppe, aber TDI gegenüber Kontrolle; die Lymphknotengewicht (mg) Probenanzahl beträgt n=6; ** p < 0,01 8 7 6 5 4 3 2 1 0 0 0 0,126 Kontrolle 1,265 g/l Blei DNCB Abb.4.13-b Gewichte der Lnn. auriculares DNCB-sensibilisierter Tiere bei gleichzeitiger Bleiverabreichung (0,126 und 1,265 g/l), keine signifikanten Unterschiede innerhalb der DNCB-Gruppe oder gegenüber der Kontrolle, die Probenanzahl ist n=6. Einzelwerte siehe Tab.9-11 c) im Anhang 74 Ergebnisse Zusätzlich zu dem Gewicht ist die Zellzahl der isolierten Lnn. auriculares für die spätere FACS-Analyse bestimmt worden; analog zu dem Lymphknotengewicht ist auch hier kein signifikanter Unterschied in den beiden Gruppen zu sehen (Abb.4.14a+b). * * 9.000.000 8.000.000 Zellzahl/ml 7.000.000 6.000.000 5.000.000 4.000.000 3.000.000 2.000.000 1.000.000 0 0 0 0,126 Kontrolle 1,265 g/l Blei TDI Abb.4.14-a Zellzahl der Lnn. auriculares TDI-sensibilisierter Tiere bei gleichzeitiger Bleiverabreichung (0,126 und 1,265 g/l), keine signifikanten Unterschiede innerhalb der TDI-Gruppe, lediglich zwischen der Kontrolle und TDI+0,126 bzw. 1,265 g/l, die Probenanzahl beträgt n=6, * p < 0,05 9.000.000 8.000.000 Zellzahl/ml 7.000.000 6.000.000 5.000.000 4.000.000 3.000.000 2.000.000 1.000.000 0 0 0 0,126 Kontrolle Abb.4.14-b Zellzahl der Lnn. gleichzeitiger Bleiverabreichung 1,265 g/l Blei DNCB auriculares (0,126 und DNCB-sensibilisierter 1,265 g/l), keine Tiere bei signifikanten Unterschiede innerhalb der DNCB-Gruppe oder gegenüber der Kontrolle; die Probenanzahl ist n=6. Einzelwerte siehe Tab.9-11 d) im Anhang 75 Ergebnisse Im Anschluß an die Zellzahlbestimmung der Lymphknoten ist in der FACSAnalyse die Menge der CD11c- und CD40-positiven DC untersucht worden. Der Kontrollgruppe sind die beiden Gruppen der Kontaktallergene TDI und DNCB gegenübergestellt. Es kommt lediglich in der TDI-Gruppe bei zusätzlicher Bleistimulation (0,126 g/l) zu einer erhöhten Expression von CD11c/CD40. In der DNCB-Gruppe zeigt Blei keinen Effekt auf die Expression der untersuchten Oberflächenmoleküle. Die Ergebnisse sind als Dotplots dargestellt: In Abb. 4.15-a ist die Kontrollgruppe und in den folgenden Abbildungen je eine Darstellung aus den TDI-Gruppen (Abb.4.15-b-d) bzw. DNCB-Gruppen (Abb.4.15-e-g) aufgeführt. Es handelt sich hierbei um ein repräsentatives Ergebnisse von jeweils sechs aus den einzelnen Gruppen (Kontrolle, TDI/DNCB – 0/ 0,126/ 1,265 g/l Blei). Auf der x-Achse ist CD40, auf der y-Achse CD11c aufgetragen. Die CD11c CD11c/CD40-positiven DC befinden sich im oberen rechten Quadranten. CD40 Abb.4.15-a Dotplot von Lymphknoten- Abb.4.15-b Dotplot von Lymphknoten- zellen aus der Kontrollgruppe, die zellen von TDI-behandelten Mäusen, CD11c/CD40-positiven Zellen befinden leichter Anstieg der CD11c/CD40 – sich im Quadranten C2 positiven Zellen 76 Ergebnisse Abb. 4.15-c Dotplot von Lymphknoten- Abb.4.15-d Dotplot von Lymphknoten- zellen aus der TDI-Gruppe + 0,126 g/l zellen aus der Gruppe TDI + 1,265 g/l Blei, zunehmende Expression von Blei, Abnahme der Expression auf CD11c/CD40 Niveau der Zellen aus der TDI-Gruppe Auf der x-Achse ist CD11c, auf der y-Achse CD40 aufgetragen. Die CD40 CD11c/CD40-positiven DC befinden sich im oberen rechten Quadranten. CD11c Abb.4.15-e Dotplot von Lymphknoten- Abb.4.15-f Dotplot von Lymphknoten- zellen aus der DNCB-Gruppe, zellen aus der Gruppe DNCB + zunehmende Expression von 0,126 g/l Blei, Abnahme der Ex- CD11c/CD40 pression auf Kontrollniveau 77 Ergebnisse Abb. 4.15-g Dotplot von Lymphknotenzellen aus der Gruppe DNCB + 1,265 g/l Blei, keine gesteigerte Expression durch zusätzliche Bleistimulation 78 Ergebnisse In den Abb. 4.16-a+b sind die in der FACS-Analyse bestimmten DC auf die vorher bestimmte Zellzahl bezogen dargestellt. Hierbei ist ein signifikanter Unterschied zwischen der nicht stimulierten Kontrollgruppe und der CD11c/CD40-positive DC TDI-sensibilisierten Gruppe zu sehen. 450.000 400.000 * 350.000 300.000 250.000 200.000 150.000 100.000 50.000 0 0 0,126 0 Kontrolle 1,265 g/l Blei TDI Abb.4.16-a Analyse der Lymphknotenzellen im Durchflußzytometer, Darstellung der CD11c/CD40-positiven DC der Kontroll- und TDI-Gruppe, signifikanter Unterschied CD11c/CD40-positive DC zwischen KO und TDI, die Probenanzahl beträgt n=6; * p < 0,05 450.000 400.000 350.000 300.000 250.000 200.000 150.000 100.000 50.000 0 0 0 0,126 Kontrolle 1,265 g/l Blei DNCB Abb.4.16-b Analyse der Lymphknotenzellen im Durchflußzytometer, Darstellung der CD11c/CD40-positiven DC der DNCB-Gruppe, keine signifikanten Unterschiede innerhalb der DNCB-sensibilisierten Gruppe und gegenüber der Kontrolle, die Probenanzahl ist n=6; Einzelwerte siehe Tab.9-12 im Anhang 79 Ergebnisse 4.2.4. Ergebnisse der Migrationsassays Das Auswanderverhalten der Zellen aus den von den Versuchstieren gewonnenen Ohrhälften ist in diesem Versuch untersucht worden. In den Abb.4.17a+b erkennt man einen leichten Anstieg ausgewanderter DC abhängig vom Bleigehalt im Trinkwasser. Signifikante Unterschiede sind allerdings nicht festzustellen. ausgewanderte DC/ml 14.000 12.000 10.000 8.000 6.000 4.000 2.000 0 0 0 0,126 Kontrolle Abb.4.17-a 1,265 g/l Blei TDI Migrationsassay im TDI-Modell, keine signifikanten Unterschiede zwischen den einzelnen Gruppen, lediglich ein leichter Anstieg ausgehend von der Kontroll-, über die TDI- und die TDI- und bleibehandelte Gruppe, die Probenanzahl beträgt n=6. 80 ausgewanderte DC/ml Ergebnisse 14.000 12.000 10.000 8.000 6.000 4.000 2.000 0 0 0 0,126 Kontrolle 1,265 g/l Blei DNCB Abb.4.17-b Migrationsassay im DNCB-Modell, keine signifikanten Unterschiede zwischen den einzelnen Gruppen, die Probenanzahl beträgt n=6. Einzelwerte siehe Tab.9-11 a) im Anhang 4.2.5. Einfluss von Blei auf die Lymphknotenzellen Die aus den Lymphknoten gewonnenen Zellen sind in einer Zellkultur erneut mit TDI bzw. DNBS (DNCB-Analogon) inkubiert und die Überstände vor der Thymidinmarkierung gewonnen worden. Aus diesen Überständen ist der Gehalt an IL-4, IL-1β und IFN-γ bestimmt worden. Die Ergebnisse sind nicht aufgeführt, da in keinem der drei ELISA eine Änderung der Zytokinsekretion zu erkennen war (Einzelwerte siehe Tab.9-15 A-C im Anhang). In Abb. 4.18-a+b sind die Einbauraten des Thymidin durch DC als Zeichen der Proliferation dargestellt. Es kommt zu keinerlei Signifikanz bei der TDI- oder DNCBGruppe. 81 ³H-Thymidin (cpm)x10³ Ergebnisse 1.200 1.000 800 600 400 200 0 0 0 0,126 Kontrolle Abb.4.18-a 1,265 g/l Blei TDI ³H-Thymidin-Einbaurate in der Kontroll- und TDI-Zellkultur, kein signifikanter Unterschied durch die Verabreichung von Blei im Vergleich zur Kontrolle ³H-Thymidin (cpm)x10³ oder innerhalb der TDI-Gruppe, die Probenanzahl beträgt n=6. 1.200 1.000 800 600 400 200 0 0 0 0,126 Kontrolle Abb.4.18-b 1,265 g/l Blei DNCB ³H-Thymidin-Einbaurate in der DNCB-Zellkultur, kein signifikanter Unterschied durch die Verabreichung von Blei, die Probenanzahl beträgt n=6. Einzelwerte siehe Tab.9-13 im Anhang 82 Ergebnisse 4.2.6. Einfluss von Blei auf die IL4-Produktion im Kontaktallergiemodell Aus den Homogenaten der im Versuch gewonnenen sensibilisierten Mäuseohren ist der Gehalt an IL-4 gemessen worden. Die Abb.4.19 gibt einen Überblick aller sieben Gruppen, wobei nur bei TDI und TDI + 1,265 g/l Blei im Vergleich zur Kontrolle ein signifikant höherer IL4-Gehalt induziert wird. Innerhalb der TDI-Gruppe ist kein Unterschied zu sehen. Die IL4-Produktion durch die DNCBGruppe liegt auf Kontrollniveau und hat im Zusammenhang mit Blei keinerlei Wirkungen auf die IL4-Produktion durch die DC. * 300 * IL-4 (pg/ml) 250 200 150 100 50 0 0 0 Kontrolle 0,126 1,265 TDI 0 0,126 1,265 g/l Blei DNCB Abb.4.19 IL-4-Produktion aus in vivo gewonnenen Ohren und deren Homogenate, schwach signifikante Induktion der IL-4-Produktion durch TDI, sowie TDI+1,265 g/l Blei gegenüber der Kontrolle, in der DNCB-Gruppe ist keine IL4-Induktion erkennbar; die Probenanzahl beträgt n=6; * p< 0,01; Einzelwerte siehe Tab.9-14 im Anhang Zu allen aufgeführten Ergebnissen sind in dem Kapitel Anhang zusammen mit Ergebnissen aus weiteren Versuchen alle Einzelwerte dargestellt. 83 Diskussion 5 Diskussion Ziel dieser Arbeit war es, Erkenntnisse über die Beeinflussung der Zellfunktionen von murinen DC und T-Zellen durch Schwermetalle zu gewinnen. Als Schwermetalle sind Blei und Mangan, in den Vorversuchen zusätzlich Zink, Kupfer und Cadmium, zum Einsatz gekommen. Die In-vitro-Untersuchungen sind durch In-vivo-Untersuchungen anhand zweier Kontaktallergiemodelle ergänzt worden, in denen ein durch TDI bzw. DNCB induziertes Allergiegeschehen an bleibelasteten Mäusen untersucht wurde. 5.1 Einfluss der Schwermetalle auf die DC- und T-Zellfunktionen 5.1.1. Einfluss der Schwermetalle auf die Vitalität sowie auf die p38-Aktivierung Durch die Inkubation der DC und T-Zellen mit Mangan und Blei in den Konzentrationen 1, 10 und 100 µmol/l wird die Vitalität nicht beeinträchtigt. Dieses bestätigt die Ergebnisse von SMITH und LAWRENCE (1988), sowie KOWOLENKO et al. (1991). Es konnte gezeigt werden, dass es bei den DC zu einer zeit- und konzentrationsabhängigen Aktivierung der MAPKinase p38 durch Blei kommt. p38 wird zum einen durch LPS aktiviert, was als Positivkontrolle genutzt wurde, und andererseits durch Blei in den Konzentrationen 10 und 100 µmol/l. Diese Aktivierung der MAPKinasen ist ein Zeichen der DC-Maturation einhergehend mit einer Phänotypveränderung und Produktion diverser Zytokine (vor allem TNF-α). Es gibt insgesamt drei MAPKinasen, die durch Streßstimuli oder inflammatorische Zytokine (JNK und p38) bzw. Aktivierung von Tyrosinkinasen (ERK) phosphoryliert werden. Allen drei ist gemeinsam, dass sie über einen Signalweg aktiviert werden, bei dem es zur Phosphorylierung unterschiedlicher 84 Diskussion Substrate, u.a. Proteinkinasen, Phospholipasen und Transkriptionsfaktoren, kommt. Diese intrazelluläre Signalkaskade kann zur Zellproliferation, -differenzierung oder Apoptose führen. Studien mit dem p38-Inhibitor SB203580 an zuvor mit Nickel stimulierten DC zeigen, dass die Expression von CD83 und CD86, sowie die Induktion der Zytokine TNF-α, IL-6 und IL-12 durch diesen Inhibitor gehemmt werden können (AIBA et al. 2003). Dies lässt auf eine Abhängigkeit der p38-Aktivierung schließen. Insgesamt können alle drei MAPKinasen gleichzeitig aktiviert werden, was zur Expression verschiedener Oberflächenmoleküle und Produktion diverser Zytokine führt, die im Anschluß für eine Differenzierung der T-Zellantwort sorgen. In den eigenen Untersuchungen konnte gezeigt werden, dass Blei zur Phosphorylierung von p38 führt und nachfolgend eine intrazelluläre Kaskade ausgelöst wird. Aufgrund eigener Ergebnisse (siehe 5.1.3.+5.) lässt sich in diesem Zusammenhang die Vermutung stellen, dass durch die p38-Aktivierung eine CCR7und CD80-Expression induziert wird. Vermutlich ist die Expression von CD86 von der Aktivierung weiterer MAPKInasen abhängig, die wiederum auf bestimmte Stimuli in Form von Zytokinen angewiesen ist. Hier könnte ebenso die ausbleibende TNF-αSekretion eine größere Rolle spielen (siehe 5.1.2.). BOISLEVE et al. (2004) zeigen in diesem Zusammenhang eine Expression von CD86 der DC, die mit TNF-α stimuliert wurden, obwohl sie zuvor mit spezifischen Inhibitoren aller drei MAPKinasen behandelt wurden. Eine weitere Ursache für eine ausbleibende MAPKinasenAktivierung könnte die ausgewählte Schwermetallkonzentration sein. In eigenen Versuchen sind Konzentrationen von 10 und 100 µmol/l eingesetzt worden. BOISLEVE et al. (2004) sehen nach Inkubation mit 500 µmol/l Nickel eine Aktivierung aller drei MAPKinasen. 5.1.2. Einfluss von Blei und Mangan auf die TNF-α-Produktion durch DC Blei und Mangan führen nur in Verbindung mit LPS zu einer erhöhten TNF-αSekretion. Werden DC nur mit den Schwermetallen inkubiert, kommt es nicht zu einer gesteigerten TNF-α-Produktion. TNF-α spielt als proinflammatorisches Zytokin eine wichtige Rolle bei der Aktivierung und Maturation, sowie der Expression diverser 85 Diskussion Oberflächenmoleküle von DC (AIBA 1998). Neben den DC sind Keratinozyten, aktivierte Makrophagen und T-Zellen in der Lage, TNF-α zu produzieren, um im Entzündungsgeschehen weitere Zellen zu mobilisieren (SPIEKSTRA et al. 2005). Die zuvor beschriebene Aktivierung von p38 läßt eine erhöhte Produktion von TNF-α durch Schwermetalle vermuten. DE SMEDT et al. (2001) beschreiben ebenfalls eine TNF-α-Induktion durch Nickel in den Konzentrationen 10 und 100 µmol/l. Sie verweisen aber gleichzeitig auf Studien von ENK und KATZ (1992) sowie MANOME et al. (1999), die eine gesteigerte TNF-α-Produktion nach Inkubation mit höheren Konzentrationen (300 µmol/l) von Nickel bzw. Mangan feststellten. In den eigenen Untersuchungen wurden Konzentrationen im Bereich von 1 bis 100 µmol/l Blei bzw. Mangan verwendet. Damit liegen diese Werte unter den Konzentrationen, die von ENK und KATZ (1992), sowie MANOME et al. (1999) zum Einsatz kamen. Dies lässt die Vermutung zu, dass die Konzentration der Schwermetalle ausschlaggebend für eine TNF-α-Induktion ist. In einer Studie von SHI et al. (2005) wird außerdem eine TNF-α-Aktivierung auf RNA-Ebene ohne nachweisliche Proteinsynthese dargestellt. Es wäre zu klären, ob es bei eigenen Versuchsansätzen ebenfalls zu einer Aktivierung auf RNA-Ebene durch höhere Schwermetallkonzentrationen kommt, da eine nachweisbare TNF-α-Ausschüttung in Kulturüberständen bislang ausblieb. 5.1.3. Einfluss von Blei und Mangan auf die CCR7-Expression Mittels Durchflußzytometrie konnte gezeigt werden, dass es durch Inkubation mit Blei (100 µmol/l) bzw. Mangan (10 µmol/l) zu einer gesteigerten Expression von CCR7 kommt. Es sollte hier jedoch vielmehr die grundsätzliche Interaktion von Schwermetallen und DC gezeigt werden. Im Ergebnis zeigt sich lediglich die Tendenz einer steigenden CCR7-Expression durch Schwermetallinkubation. CCR7 gilt als ein Oberflächenmolekül, das nur von reifen DC nach Aktivierung von der MAPKinase p38 exprimiert wird. Dieser Rezeptor ermöglicht es den DC, nach Antigenaufnahme in den drainierenden Lymphknoten zu wandern, um dort über T-Zell-Interaktion eine Immunantwort zu initiieren (BOISLEVE et al. 2004; RIOL-BLANCO et al. 2005). 86 Diskussion Im Zusammenhang mit dem Migrationsassay (siehe 5.1.4.) konnte ein stimulierender Effekt der beiden Schwermetalle auf die DC gezeigt werden. Dieser wird durch die erhöhte CCR7-Expression nochmals unterstützt. BOISLEVE et al. (2004) beschreiben die Induktion von CCR7 nach Inkubation der DC mit 500 µmol/l Nickel, sowie mit TNF-α (500 U/ml). Der Schwerpunkt ihrer Untersuchungen liegt in der Beeinflussung der CCR7-Induktion durch die MAPKinase p38 (siehe 5.1.1.). RITTER et al. (2004) zeigen, dass CCR7 ein eindeutiger Hinweis für die Maturation der DC ist. Sie stimulieren DC mit LPS oder TNF-α und weisen die Expression von CCR7 neben den Aktivierungsmarkern CD86, CD40 und MHCII in der Durchflußzytometrie nach. Ein zusätzlicher Stimulus für die CCR7-Expression scheint die Migration per se zu sein. Vergleicht man den Anteil CCR7-positiver DC vor und nach der Migration in der Boyden Chamber, fällt auf, dass es zu einem Anstieg von CCR7 kommt. Vermutlich lässt sich dieser Effekt mit dem Zusatz von MIP-3β zur Kultur erklären. Diese Substanz ist der Ligand von CCR7 und wird in vivo von maturierten DC und von Stromazellen in der T-Zellregion im Lymphknoten sezerniert, um antigenführende DC zu naiven T-Zellen zu leiten (RIOL-BLANCO et al. 2005). Hieraus folgt, dass zunächst eine Induktion der DC-Maturation durch Schwermetalle erfolgt, und die DC schließlich auf die chemotaktische Substanz MIP-3β reagieren. Daraufhin wird der MIP-3β-Rezeptor CCR7 auf den DC exprimiert und die Zellen sind in der Lage auszuwandern. Die Bedeutung der DC-Maturation hinsichtlich der Migration, und damit einhergehend das Erzeugen eines proinflammatorischen Zustands, zeigt sich in Untersuchungen von VANBERVLIET et al. (2002). Hier wurde gezeigt, dass die beiden CCR7-Liganden MIP-3β und CCL21 keinerlei Wirkung auf das Migrationsverhalten immaturer DC haben. 5.1.4. Beeinflussung der DC-Migration durch Schwermetalle In einem Migrationsassay kann ein signifikanter Anstieg der Migrationsrate der DC nach Inkubation mit Blei bzw. Mangan in der jeweils höchsten Konzentration (100 µmol/l) im Vergleich zur Kontrolle gezeigt werden. AIBA et al. (2000) zeigen 87 Diskussion diesen Effekt anhand dendritischer Zellen, die zuvor mit Nickel (300 µmol/l) bzw. LPS stimuliert wurden. In einem Migrationsassay wird - ebenso wie in dieser Arbeit - eine erhöhte Migrationsbereitschaft auf das Chemokin MIP-3β dargestellt. Diese erhöhte DC-Migration findet in Abhängigkeit einer gesteigerten MIP-3β-Konzentration statt und nicht wie in der vorliegenden Arbeit von einer steigenden Blei- bzw. Mangankonzentration; die MIP-3β-Konzentration ist mit 50 ng/ml in allen Versuchsansätzen konstant. Voraussetzung für eine DC-Migration ist die Auslösung ihrer Maturation. Nachdem die DC Antigene entdeckt haben, werden diese gebunden und per rezeptorvermittelter Endozytose internalisiert. Es erfolgt eine Veränderung des DCPhänotyps einhergehend mit verstärkter Expression costimulatorischer Moleküle (CD80, CD86, MHCII, CD40) und Ausschüttung unterschiedlicher Zytokine (z.B. IL-6, IL-12, IL-1β, TNF-α, CCL2) (AIBA 1998). Die eigenen Ergebnisse lassen den Schluss zu, dass die Schwermetalle Blei und Mangan in höheren Konzentrationen einen Stimulus für die DC darstellen und die Maturation in Form einer gesteigerten Migrationsbereitschaft der DC beeinflussen. Die DC sind nun in der Lage, auf MIP-3β zu reagieren und antworten mit einer gesteigerten Migrationsbereitschaft. Es ist gezeigt worden, dass das Auswandern der DC zum drainierenden Lymphknoten in vivo im Zusammenhang mit der Expression des CCR7-Rezeptors steht (FORSTER et al. 1999; AIBA et al. 2000; BOISLEVE et al. 2004). Die geringe Migration der unbehandelten DC ist als Spontanmigration zu deuten und ist Ausdruck der physiologischen steady state migration. Diese DC weisen im Gegensatz zu den mit Schwermetallen behandelten Zellen eine deutlich geringere Expression an CCR7 auf (s. Abb.4.7-a). 5.1.5. Einfluss von Blei und Mangan auf die CD80/86-Expression durch DC Eine Expression von CD80 und CD86 ist ebenfalls Ausdruck einer stattgefundenen DC-Aktivierung, die möglicherweise zu einer Maturation führt. Ausgelöst wird sie z.B. durch TNF-α oder LPS (AIBA et al. 1998). Blei bewirkt nur in den Konzentrationen 1 und 10 µmol/l eine erhöhte Expression von CD80 gegenüber 88 Diskussion der Kontrolle. Bei der Untersuchung des DC-Aktivierungsmarkers CD86 kommt es lediglich bei der LPS-Stimulation zu einer erhöhten Expression von CD86 durch die DC, nicht jedoch durch Blei in unterschiedlichen Konzentrationen (1-100 µmol/l). In vergleichbaren Studien zeigt sich nach Inkubation von DC mit Nickel (100-300 µmol/l) eine erhöhte Expression von CD86. Dies geht einher mit einer gesteigerten Produktion der Zytokine TNF-α, IL-1β und IL-12. Außerdem kommt es durch die Inkubation mit Nickel zusätzlich zur Expression der Oberflächenmoleküle CD54 und MHCII (AIBA 1998; COUTANT et al. 1999; MANOME et al. 1999). DE SMEDT et al. (2001) sehen hingegen keinen Einfluss durch Nickel (100-300 µmol/) auf die Expression von CD80. Die durch Antigene stimulierten DC ändern im Laufe ihrer Maturation die Expression diverser Oberflächenmoleküle, um ihre antigenpräsentierende Funktion ausüben zu können. Sie benötigen die Rezeptoren CD80 und CD86 zur Interaktion mit naiven T-Zellen im drainierenden Lymphknoten. Für die Stimulation dieser T-Zellen bedarf es zwei voneinander abhängiger Signale: zum einen die Bindung von MHCII auf den DC mit dem T-Zellrezeptor und zum anderen die Bindung von CD80 und CD86 an CD28 auf den T-Zellen. Nachdem dies erfolgt ist, kommt es zur Auslösung einer intrazellulären Signalkaskade, was letztlich zur T-Zellproliferation führt (AIBA und TAGAMI 1999; DE SMEDT et al. 2001). Die Ergebnisse lassen die Vermutung zu, dass eine Expression von CD80 oder CD86 abhängig von der verwendeten Konzentration der Schwermetalle sein könnte. In den eigenen Untersuchungen sind Konzentrationen im Bereich von 1-100 µmol/l Blei verwendet worden. Dies liegt unter den von AIBA und TAGAMI (1999) sowie DE SMEDT et al. (2001) eingesetzten Schwermetallkonzentrationen, die Nickel im Bereich von 100-300 µmol/l eingesetzt haben und eine erhöhte CD86Expression durch die DC beobachteten. Im Gegensatz dazu ist in eigenen Untersuchungen eine erhöhte CD80-Expression nach Inkubation mit 1 und 10 µmol/l Blei festgestellt worden. DE SMEDT et al. (2001) aber zeigten durch eine Inkubation mit Nickel (100-300 µmol/l) keinen Einfluss auf CD80. Vermutlich spielt die Auswahl der Schwermetallkonzentration eine Rolle bei der Aktivierung von CD80 bzw. CD86. 89 Diskussion Auffällig ist ebenfalls das Zytokinmuster, das in den In-vitro-Studien der Autoren beschrieben wurde. Sie können eine gesteigerte TNF-α-, IL-1β- und IL-12Produktion messen. In Anbetracht eigener TNF-α-Messungen, bei denen kein Anstieg festzustellen ist (siehe 4.1.2.), liegt die Vermutung nahe, dass die CD80bzw. CD86-Expression in Abhängigkeit von einem bestimmten Zytokinmilieu erfolgt. AIBA (1998) zeigte in diesem Zusammenhang die Notwendigkeit vom Vorhandensein der Substanzen TNF-α und GM-CSF für die CD80-Expression, sowie zusätzlich IL-1β für die CD86-Expression, indem sie DC mit o.g. Zytokinen stimulierten und die Expression von CD80 bzw. CD86 auf den Zellen untersuchten. COUTANT et al. (1999) erklärten die generell unterschiedliche Expression von Oberflächenmolekülen auf DC nach Schwermetallinkubation mit einer unterschiedlichen Aktivierung intrazellulärer Signalwege. Hierzu zählen die MAPKinasen p38, ERK und JNK, die in Kapitel 5.1.1. schon erläutert wurden. 5.1.6. Wirkung von Blei und Mangan auf die T-Zellproliferation Es ist eine dosisabhängige Abnahme der T-Zellproliferation durch Mangan und Blei zu erkennen, wobei die Reduktion durch 100 µmol/l Blei signifikant ist. SMITH und LAWRENCE (1988) konnten zeigen, dass diese Bleikonzentrationen nicht zytotoxisch wirken, sondern lediglich die Proliferation inhibieren. Dieses zeigen ebenfalls eigene Untersuchungen der T-Zellvitalität mittels MTT-Test, bei denen die Zellzahl nach einer Blei- bzw. Manganinkubation konstant bleibt. Eine andere Ursache für eine abnehmende T-Zellproliferation kann damit begründet werden, dass die Zellen zuerst aufgrund einer Noxe, in diesem Fall das Schwermetall, proliferieren, aber aufgrund der immer stärker werdenden Noxe (der zunehmenden Konzentration) an der Proliferation gehemmt werden. In der Mixed Leukocyte Reaction (MLR) kommt es bei der Inkubation mit zuvor durch Blei- bzw. Mangan stimulierter DC mit T-Zellen zu einem deutlichen Anstieg der T-Zellproliferation. Es kommt in allen drei eingesetzten Konzentrationen (1, 10 und 100 µmol/l) zu signifikanten Unterschieden gegenüber der Kontrolle. Zusätzlich ist die Produktion des Chemokins CCL2, gemessen aus den Überständen eines DC-T-Zell-Ansatzes, der mit Blei (100 µmol/l) stimuliert wurde, deutlich reduziert. 90 Diskussion Die steigende T-Zellproliferation in der MLR durch Blei bestätigt die Ergebnisse von SMITH und LAWRENCE (1988). Mit den Ergebnissen von AIBA (1998) sowie von DE SMEDT et al. (2001) vergleichbar sind die T-Zellproliferationsraten durch nickelstimulierte DC (100-300 µmol/l). MANOME und AIBA (1999) beschreiben einen Zusammenhang zwischen einer erhöhten CD86Expression verbunden mit einer gesteigerten T-Zellproliferation in der MLR. Dieses kann jedoch in eigenen Untersuchungen nicht bestätigt werden (siehe 5.1.5.). Die T-Zellproliferation kommt im lebenden Organismus in der T-Zellzone des drainierenden Lymphknotens zustande, nachdem zuvor durch Antigenaufnahme maturierte DC mit naiven T-Zellen in Interaktion getreten sind und diesen prozessierte Antigene mittels MHC-Komplex präsentiert haben. Nach Bindung von CD80 und CD86 der DC mit CD28 der T-Zellen, sowie Interaktion von CD40 mit dem T-Zell-Liganden CD40L kommt es zu einer Aktivierung intrazellulärer Signalkaskaden. Die Folge ist eine Proliferation der T-Zellen und eine Polarisierung in Richtung Th1- bzw. Th2-Antwort. Der in der MLR gezeigte Anstieg der T-Zellproliferation steht also im direkten Zusammenhang mit der Antigenpräsentation durch maturierte DC. Sie sorgen für die Stimulation der T-Zellen, die infolgedessen proliferieren. Durch den gleichzeitigen Ansatz einer Prä- und Coinkubation der DC mit Blei (100 µmol/l) wird deutlich, dass es keinen Unterschied macht, ob die T-Zellen direkten Kontakt zu dem Schwermetall haben oder nicht. Allein die Präsentation durch die DC scheint ausschlaggebend für eine gesteigert T-Zellproliferation zu sein. CCL2 gilt neben CCL3, CCL4 und CCL5 als inflammatorisches Zytokin. Es wird von DC in der frühen Phase der Maturation produziert, um weitere immature DC und T-Zellen zu rekrutieren. Die CCL2-Produktion wird herunterreguliert, sobald DC über CD40 an T-Zellen binden oder wenn aufgrund des Pathogens eine T-Zellantwort in Richtung Th2 initiiert werden soll (LEBRE et al. 2005). Die Aufrechterhaltung eines CCL2-Spiegels erfolgt also nur im Zuge einer Th1-Antwort, indem T-Zellen, die mit dem CCL2-Rezeptor CCR2 ausgestattet sind, rekrutiert werden. Nickel führt in einer Studie mit Probanden zu einer gesteigerten CCL2Ausschüttung (VERHEYEN et al. 2004). 91 Diskussion Die in dieser Arbeit gezeigte Inhibition der CCL2-Produktion durch Blei (100 µmol/l) kann entweder auf die mit den T-Zellen stattgefundene CD40-Ligation und die sich anschließende CCL2-Herunterregulation zurückgeführt werden. Andererseits ist aber auch die Induktion einer Th2-Antwort möglich, bei der es zu einer Reduktion von CCL2 kommt. Wichtige Chemokine, die eine solche Th2-Antwort einleiten, sind CCL1, CCL11, CCL17 und CCL22. Um diese Hypothese zu bestätigen, bedarf es jedoch weiterer Untersuchungen (z.B. Zytokinbestimmung: CCL1, CCL11, CCL17 und CCL22) in Überständen einer MLR. 92 Diskussion 5.2 Einfluss von Blei im Allergiegeschehen Anhand der beiden Kontaktallergiemodelle sollte der Einfluss von Blei im Laufe einer Entzündung - induziert durch TDI bzw. DNCB – zum Zeitpunkt der Challenge verdeutlicht werden. Als funktionelle Parameter dienten in diesem Zusammenhang die Bestimmung der Ohrschwellung, sowie die Veränderungen im regionalen Lymphknoten (Gewicht, Zellzahl, Anzahl CD11c/CD40-positive Zellen). Weiterhin sind unterschiedlichen DC von den Versuchstieren Zellkulturversuchen die gewonnen Wirkung von worden, Bleiacetat um auf in die T-Zellproliferation, die Ausschüttung von Zytokinen (IL-4, IL-1β und IFN-γ) und die IL4-Produktion (aus Ohrhomogenaten) untersuchen zu können. Die In-vivo-Studie erfolgte an zwei Modellen, um die Wirkung von Bleiacetat in einem Th1-dominierten Entzündungsgeschehen (DNCB) sowie in einer durch TDI induzierten Th2-Antwort feststellen zu können. Die Bleikonzentrationen im Vollblut der einzelnen Versuchsgruppen entsprechen mit ungefähr 30 µg/dl nach Verabreichung von 0,126 g/l bzw. 60-87 µg/dl nach Verabreichung von 1,265 g/l Blei den Angaben von CARMOUCHE et al. (2005). 5.2.1. Einfluss von Blei auf die entzündliche Ohrschwellung Die durch TDI induzierte Ohrschwellung kann durch Blei in der Konzentration von 1,265 g/l im Trinkwasser nach acht Wochen Verabreichung signifikant erhöht werden. Im DNCB-Modell hat Blei nach sieben Wochen Verabreichung keinerlei Auswirkungen auf die inflammatorische Ohrschwellung. In beiden Modellen kommt es zu der durch TDI bzw. DNCB induzierten und erwarteten Ohrschwellung (BÄUMER et al. 2004). Diese Ohrschwellung ist ein Zeichen stattgefundener Stimulation von DC, die in der Folge maturieren und mit T-Zellen interagieren. Hierfür ist es notwendig, dass die DC sich aus dem Zellverband lösen und aus der Epidermis auswandern. Die Schwellung ist das Resultat einer Challengephase. 93 allergischen Immunreaktion in der Diskussion Das Ergebnis lässt die Vermutung zu, dass Blei die durch TDI induzierte Th2Antwort des Immunsystems verstärkt. Bei dieser Form der Immunreaktion kommt es zur Präsentation von MHCII-gebundenen Antigenen durch DC. Zielzellen sind CD4+T-Zellen, die mit einer Ausschüttung diverser Zytokine, hauptsächlich IL-4, reagieren. Dies geht einher mit den Ergebnissen eigener Untersuchungen (siehe 5.2.5.). Wie auch schon in vitro gezeigt werden konnte, nehmen die T-Zellproliferation (siehe 5.1.6.) und die damit verbundene Ohrschwellung durch die Bleistimulation zu. In dem Th1-dominierenden Geschehen durch DNCB spielen CD8+-T-Zellen eine zentrale Rolle. Ihnen wird über MHCI Antigen präsentiert, was zu einer Aktivierung der T-Zellen und Produktion der Zytokine IL-1, IL-2, IFN-γ und TNF-α führt (KIMBER et al. 1986; KAPSENBERG et al. 1992; LANZAVECCHIA und SALLUSTO 2000). Die durch DNCB vorgegebene Richtung der Immunantwort kann durch Blei nicht beeinflusst werden. 5.2.2. Einfluss von Blei auf die lokalen Lymphknoten (Lnn. auriculares) Die im Vergleich zur Kontrolle höheren Lymphknotengewichte der mit TDI bzw. DNCB behandelten Tiere lassen eine DC-Stimulation und –Maturation mit anschließender T-Zellproliferation vermuten. Die Zellzahl der Lnn. auriculares oben genannter Gruppen bestätigen diese Hypothese: in der FACS-Analyse konnte ein signifikanter Anstieg der CD11c/CD40-positiven DC von TDI-behandelten Tieren gezeigt werden. Der Anteil CD11c/CD40-positiver DC im Lymphknoten der DNCBbehandelten Tiere liegt leicht über der Anzahl der DC aus der Kontrollgruppe. Die zunehmende Ohrschwellung einhergehend mit zunehmenden Lymphknoten- gewichten nach Provokation entspricht den Ergebnissen einer klassischen Kontaktallergie (BÄUMER et al. 2005). Auffällig ist, dass Blei in allen drei Versuchsansätzen (Lymphknotengewicht, -zellzahl und CD11c/CD40-positive DC) nur Einfluss auf die durch TDI hervorgerufene Reaktionen hat. Dieses kommt besonders deutlich bei der Lymphknotenzellzahl (signifikanter Anstieg durch 0,126 und 1,265 g/l Blei gegenüber der Kontrolle) und bei der Analyse der CD11c/CD40-positiven DC (Anstieg durch 94 Diskussion 0,126 g/l Blei) zum Ausdruck. Innerhalb der DNCB-Gruppen zeigt Blei auch hier keinen Einfluss. Die Veränderungen in den regionalen Lymphknoten beschreiben den physiologischen Vorgang einer Immunreaktion in der Challengephase nach erneutem Antigenkontakt: DC maturieren und verändern ihren Phänotyp. Es wird vermehrt CD40 für die spätere Interaktion mit T-Zellen exprimiert, so dass die Anzahl CD11c/CD40-positiver DC im Lymphknoten zunimmt. Im Laufe des inflammatorischen Geschehens wandern mehr und mehr maturierte DC in den drainierenden Lymphknoten ein, um T-Gedächtniszellen zur Proliferation anzuregen. Die Folgen sind eine gesteigerte Zellzahl und eine Zunahme des Lymphknotengewichts. Die Ursache einer erhöhten DC-Reaktion durch TDI im Zusammenhang mit Blei kann erneut ein Hinweis darauf sein, dass das Schwermetall in der Lage ist, eine bereits durch TDI induzierte Th2-Antwort zusätzlich zu verstärken. Es sei in diesem Kontext ebenso auf die zuvor beschriebene CCL2-Inhibition hingewiesen (siehe 5.1.6.), die die These einer verstärkten Th2-Induktion durch Blei noch einmal unterstreicht. 5.2.3. Einfluss von Blei im Migrationsassay Bei dem Migrationsmodell TDI- bzw. DNCB-behandelter Tiere ist kein signifikanter Unterschied feststellbar, allerdings erkennt man einen leichten Anstieg abhängig vom Bleigehalt. Die größte Anzahl ausgewanderter DC wird in beiden Modellen durch Blei in der Konzentration 1,265 g/l hervorgerufen. Die Migration der DC aus in der In-vivo-Studie gewonnenen Ohrhälften resultiert aus der zuvor stattgefundenen Sensibilisierung und anschließender Challenge. Hierdurch kommt es zu einem akuten Entzündungsgeschehen vermittelt durch lokalisierte Immunzellen (dermale DC und Langerhans-Zellen), die durch den erneuten Allergenkontakt (TDI bzw. DNCB) aktiviert werden. Durch diesen Prozeß verändern die DC die Expression ihrer Oberflächenmoleküle, vor allem CCR7, und sind in der Lage auszuwandern und aufgenommenes Antigen über MHCII T-Zellen zu präsentieren. 95 Diskussion Eine weitere Ursache für eine gesteigerte Migration stellt die Beeinflussung der Versuchstiere durch Blei dar. Wie bereits in eigenen In-vitro-Untersuchungen gezeigt (siehe 5.1.4), kommt es zumindest bei dem TDI-Modell zu einem konzentrationsabhängigen Anstieg der DC-Migration durch Blei. Das bedeutet, dass zum einen das Kontaktallergen TDI zur Maturation der DC mit anschließender Expression von Oberflächenmolekülen (CCR7) zur Migration führt und dieser Vorgang zusätzlich durch die Verabreichung von Blei verstärkt wird. Im DNCB-Modell kann dieser Effekt nicht beobachtet werden. 5.2.4. Einfluss von Blei auf Lymphknotenzellen in der Zellkultur Eine erneute Provokation (mit TDI bzw. DNBS) der Lymphknotenzellen – gewonnen aus den Lnn. auriculares der Versuchstiere - führt nicht zu einer Erhöhung der Zytokinspiegel. Untersucht wurde der Gehalt an IL-4, IL-1β und IFN-γ in den Überständen der Kultur. Die ebenfalls untersuchte Proliferation der Zellen von TDI- bzw. DNCB-behandelten Tieren nimmt im Gegensatz zur Kontrollgruppe leicht zu, wird aber nicht zusätzlich durch die Bleigabe beeinflusst. Als Reaktion der Zellen auf den erneuten Kontakt mit den Allergenen TDI bzw. DNBS (dem wasserlöslichen DNCB-Analogon) in der Challengephase hätte man ein für die jeweilige Th-Antwort typisches Zytokinmuster erwartet. TDI als Inducer einer Th2-Antwort führt zur Ausschüttung der Zytokine IL-4, IL-1β, IL-5 und IL-13. DNBS hingegen sorgt für eine Th1-Antwort mit einer Produktion der hierfür charakteristischen Zytokine IFN-γ und IL-12. In einer Studie von CUMBERBATCH et al. (2005) ist ein vergleichbarer Ansatz durchgeführt worden. Hierbei ist es nach Stimulation der Zellen mit Concanavalin A, einem Metalloprotein, und einer längeren Inkubationsdauer zu der oben beschriebenen, zu erwartenden Zytokinsekretion gekommen. Vermutlich scheint eine fehlende Stimulation der Zellen im eigenen Versuchansatz ein Grund für die völlig ausbleibende Zytokinausschüttung zu sein. 5.2.5. Einfluss von Blei auf die IL-4-Produktion im Kontaktallergiemodell Die aus den Ohrhomogenaten gewonnenen Überstände der behandelten Tiere wurden auf ihren Gehalt an IL-4 untersucht und zeigen einen signifikanten 96 Diskussion Anstieg der TDI-Gruppe gegenüber der Kontrolle. Die IL-4-Produktion durch die DNCB-Gruppe liegt im Bereich der durch die unbehandelte Kontrollgruppe produzierten IL-4-Konzentration. Innerhalb der TDI-Gruppe kommt es zu einer zusätzlichen leichten IL-4-Erhöhung durch Blei 1,265 g/l. IL-4 gilt als wichtiges Zytokin einer Th2-Antwort. Es wird als Folge einer erneuten Antigenpräsentation in der Challenge u.a. durch DC von CD4+-T-Zellen sezerniert. Im Anschluss erfolgt die Differenzierung von T-Zellen in T-Helferzellen (Th2) und eine Aktivierung der während der Sensibilisierung gebildeten T-Gedächtniszellen. Diese produzieren wiederum IL-4, sowie IL-1β, IL-5 und IL-13, um eine weitere T-Zellpolarisierung in Richtung Th2-Antwort und schließlich eine T-Zellproliferation zu bewirken (LANZAVECCHIA und SALLUSTO 2000). Die durch Blei (1,265 g/l) innerhalb der TDI-Gruppe leicht erhöhte IL4-Konzentration steht im direkten Zusammenhang mit den zuvor diskutierten Ergebnissen (siehe 5.1.6. und 5.2.1.). Auch hier zeigt sich erneut, dass Blei eine bereits durch TDI-induzierte Th2-Antwort, in diesem Falle durch eine zusätzliche IL4-Produktion, verstärkt. Für die Konzentration von 0,126 g/l Blei kann dieser Effekt nicht gezeigt werden. TDI führt, wie in Studien von BÄUMER et al. (2005) beschrieben, zu einer Aktivierung von CD4+-T-Zellen. Diese sezernieren u.a. IL4 und initiieren dadurch eine Th2-Antwort, bei der es letztlich zur Ausbildung einer humoralen Immunität kommt. In Studien von SMITH und LAWRENCE (1988) konnte gezeigt werden, dass Blei in Konzentrationen von 10 µmol/l einen stimulierenden Effekt auf die B-Zellproliferation hat. Die Ausbildung einer Th1-Antwort hingegen wird inhibiert, was im Einklang mit den eigenen Untersuchungen steht. Abschließend kann festgestellt werden, dass Blei in den Kontaktallergiemodellen lediglich zusammen mit TDI zu einer Immunmodulation in Form einer verstärkten Th2-Antwort des Immunsystems führt. Auf die durch DNCB zustande kommende Th1-Antwort nimmt Blei keinen Einfluss. Die kürzere Verabreichungsdauer von Blei im DNCB-Modell könnte ein Grund für diesen Effekt sein. 97 Zusammenfassung 6 Zusammenfassung Karoline Hünermann Untersuchung zur Beeinflussung der Funktion dendritischer Zellen durch Schwermetalle In der vorliegenden Arbeit ist die Beeinflussung dendritischer Zellfunktionen durch Schwermetalle untersucht worden. Es sind bei In-vitro-Studien die Schwermetalle Blei und Mangan, und in einem Kontaktallergiemodell mit Balb/cMäusen Bleiacetat zum Einsatz gekommen. Die In-vitro-Untersuchungen erfolgten an DC, die aus dem murinen Knochenmark gewonnen und kultiviert wurden. Als Voraussetzung für die sich anschließenden Versuche sind die Vitalität der DC und der T-Zellen, sowie die Proliferation der T-Zellen untersucht worden. Die verwendeten Konzentrationen von Blei und Mangan (1, 10 und 100 µmol/l) zeigten keinerlei Beeinträchtigungen der Vitalität; die Proliferation wurde nur in der höchsten Konzentration durch Blei bzw. Mangan inhibiert. Im Anschluss erfolgte die Messung des proinflammatorischen Zytokins TNF-α aus Kulturüberständen, wobei keine Induktion weder durch Blei, noch Mangan festzustellen war. In einem Migrationsassay konnte die durch Blei und Mangan gesteigerte Auswanderungsbereitschaft der DC gezeigt werden. In der Konzentration 100 µmol/l bei Blei bzw. Mangan nimmt die Migration signifikant zu. Voraussetzung für diese Migration ist die Induktion der DC-Maturation einhergehend mit einer Aktivierung intrazellulärer MAPKinasen (ERK, JNK, p38). Die in eigenen Untersuchungen dargestellte Aktivierung von p38, insbesondere durch Blei in der Konzentration 100 µmol/l, ist unerlässlich für die Expression diverser Oberflächenmoleküle (CCR7, CD80, CD86 etc.). Eine erhöhte Expression des Rezeptors CCR7, der in vivo von stimulierten DC für die Wanderung in den drainierenden Lymphknoten benötigt wird, konnte in der FACS-Analyse durch Inkubation mit Blei (100 µmol/l) und Mangan (10 µmol/l) gezeigt werden. Nachdem 98 Zusammenfassung die DC aktiviert sind, wandern sie zu naiven T-Zellen und nehmen u.a. über die costimulatorischen Oberflächenmoleküle CD80 und CD86 Kontakt zu diesen auf. Die Folge ist eine T-Zell-Stimulation und für die Induktion einer Immunantwort die Proliferation der T-Zellen. Es konnte die Expression von CD80 durch Blei (1 und 10 µmol/l) als Zeichen der DC-Maturation festgestellt werden. Auf die CD86-Expression hat Blei in den hier verwendeten Konzentrationen keinen Effekt. Die Mixed Leukocyte Reaction (MLR) spiegelt die Proliferationsrate stimulierter T-Zellen wider. Blei und Mangan führen in allen drei Konzentrationen zu einem signifikanten Anstieg der T-Zellproliferation. Der aus Kulturüberständen der MLR bestimmte CCL2-Gehalt wird durch die Inkubation mit Blei signifikant inhibiert, was ein Zeichen für eine Bindung zwischen T-Zellen und DC, oder aber eine Induktion einer Th2-Antwort sein kann. Abschließend kann in Anbetracht der Ergebnisse von einem immunmodulatorischen Effekt durch Blei bzw. Mangan gesprochen werden. Die gewählten Schwermetallkonzentrationen wirken stimulierend auf die DC und führen zu deren Maturation einhergehend mit Veränderungen des Phänotyps und Stimulation der T-Zellen. Dieses kann im Bezug auf Blei durch die In-vivo-Studie bestätigt werden. Hierbei ist in einem Kontaktallergiemodell mit TDI bzw. DNCB der Einfluss von Blei in zwei unterschiedlichen Konzentrationen untersucht worden. Als funktionelle Parameter dienten zum einen die Ohrschwellung, das Lymphknotengewicht sowie die Anzahl und Art der Zellen des regionalen Lymphknotens. Zum anderen ist die Migration aus der Ohrhaut und die Zytokinproduktion von DC untersucht worden. Blei zeigt einen stimulierenden Effekt auf die durch TDI induzierte Th2-Antwort: Es kommt in der Challengephase zu einer signifikanten Steigerung der Ohrschwellung durch Blei (1,265 g/l), sowie zu einem signifikanten Anstieg der Lymphknotenzellzahl durch beide Bleikonzentrationen. Auch die Anzahl CD11c/CD40-positiver DC im Lymphknoten wird durch Blei (0,126 g/l) erhöht. Im Skin-Migration-Assay und bei der IL4-Produktion gemessen im Ohrhomogenat kommt es zu einem leichten Anstieg durch Blei. Die Zytokine IL-4, IL-1β und IFN-γ aus Überständen der Zellkulturen von Lymphknotenzellen zeigen keinerlei Effekte des Schwermetalls. Im DNCB-Modell wird die durch das Allergen induzierte Th1-Antwort nicht durch Blei beeinflusst. 99 Summary 7 Summary Karoline Hünermann Studies of heavy metals and their influence on dendritic cell function We here investigated the influence of heavy metals on dendritic cell (DC) function. Lead and manganese has been used for in vitro studies, whereas lead acetate has been brought in for a contact allergy model using Balb/c mice. For in vitro studies DC were obtained from murine bone marrow and cultured afterwards. As heavy metals are required not to influence viability or proliferation of DC and T cells these parameters were investigated first. None of the used concentrations (1, 10 and 100 µmol/l) of lead or manganese affected viability of DC or T cells; there was a slight inhibition of T cellproliferation using the highest lead or manganese concentration (100 µmol/l). Next the amount of the proinflammatory cytokine TNF-α was measured in culture supernatant; there was no reduction neither through lead nor manganese. In a migration assay the increased migration after heavy metal incubation could be shown. There was a significant increase using 100 µmol/l lead or manganese respectively. The migration of DC depends on the induction of their maturation which again is related to an activation of intracellular MAPK (ERK, JNK, p38). As shown in own studies activation of p38 is necessary for the expression of several surface molecules (CCR7, CD80, CD86); after lead exposure p38 was activated in DC (100 µmol/l). In FACS analyses an increased CCR7-expression, which stimulated DC need in vivo to migrate to the draining lymph node, could be shown after treatment with lead (100 µmol/l) and manganese (10 µmol/l) respectively. After DC have 100 Summary been stimulated they migrate to the lymph node to interact with naïve T cells via CD80 and CD86 in order to induce T cell-mediated immunity. We observed an increased CD80-expression after lead exposure (1 and 10 µmol/l) as a sign of DC-maturation. Despite of that there was no effect of lead in any used concentrations on CD86-expression. The Mixed-Leukocyte-Reaction (MLR) represents the proliferation rate of stimulated T cells. For lead and manganese we saw a significant increase of T cell proliferation in every concentration used. Next culture supernatant from the MLR was used for determination of the CCL2-content. We discovered an inhibited amount of CCL2 as either a sign of DC and T cell interaction or induction of Th2 response. The current findings suggest that lead and manganese have modulatory influences on the immune system. The chosen concentrations stimulate DC leading to maturation as well as changed phenotype and T cell stimulation. These results could be confirmed by in vivo studies. Therefore the effect of lead acetate in two different concentrations was analysed in a contact allergy model using TDI and DNCB as contact allergens. The mouse ear swelling as well as weight of lymph nodes and the number and the kind of cells from the lymph node was used as functional parameter. Another priority was the migration and the cytokine production by DC. Lead acetate has an activating influence on Th2 response which is initially induced by TDI: mouse ear swelling can significantly be increased by lead (1.265 g/l) in the phase of challenge. Both concentrations lead to an increased number of lymph node cells just as the number of CD11c/CD40 positive DC who rose after lead acetate exposure. There has also been a slight increase of DC migration in the migration assay and of IL4-production measured in homogenized mouse ear tissue. Cytokines as IL-4, IL-1β or IFN-γ detected in culture supernatants from lymph node cells have not been influenced by lead acetate at all. In the contact allergy model where DNCB induces a Th1 response lead acetate has no remarkable effect. 101 Literaturverzeichnis 8 Literaturverzeichnis AIBA,S., A.TERUNUMA, H.MANOME und H.TAGAMI (1997) Dendritic cells differently respond to haptens and irritants by their production of cytokines and expression of co-stimulatory molecules. Eur. J. Immunol. 27, 3031-3038 AIBA,S. (1998) Maturation of dendritic cells induced by cytokines and haptens. Tohoku J. Exp. Med. 184, 159-172 AIBA,S. und H.TAGAMI (1999) Dendritic cells play a crucial role in innate immunity to simple chemicals. J Investig. Dermatol. Symp. Proc. 4, 158-163 AIBA,S., H.MANOME, Y.YOSHINO und H.TAGAMI (2000) In vitro treatment of human transforming growth factor-beta1-treated monocytederived dendritic cells with haptens can induce the phenotypic and functional changes similar to epidermal Langerhans cells in the initiation phase of allergic contact sensitivity reaction. Immunology 101, 68-75 AIBA,S., H.MANOME, S.NAKAGAWA, Z.U.MOLLAH, M.MIZUASHI, T.OHTANI, Y.YOSHINO und H.TAGAMI (2003) p38 Mitogen-activated protein kinase and extracellular signal-regulated kinases play distinct roles in the activation of dendritic cells by two representative haptens, NiCl2 and 2,4-dinitrochlorobenzene. J. Invest. Dermatol. 120, 390-399 102 Literaturverzeichnis AKTORIES,K., U.FÖRSTERMANN, F.B.HOFMANN und K.STARKE (2004) Allgemeine und spezielle Pharmakologie und Toxikologie 9.Auflage Urban & Fischer Verlag ARRIGHI,J.F., M.REBSAMEN, F.ROUSSET, V.KINDLER und C.HAUSER (2001) A critical role for p38 mitogen-activated protein kinase in the maturation of human blood-derived dendritic cells induced by lipopolysaccharide, TNF-alpha, and contact sensitizers. J. Immunol. 166, 3837-3845 BÄUMER,W., U.SEEGERS, M.BRAUN, T.TSCHERNIG und M.KIETZMANN (2004) TARC and RANTES, but not CTACK, are induced in two models of allergic contact dermatitis. Effects of cilomilast and diflorasone diacetate on T-cell-attracting chemokines. Br. J. Dermatol. 151, 823-830 BÄUMER,W.,B.SÜLZLE,H.WEIGT,V.C.DE VRIES,M.HECHT,T.TSCHERNIG und M.KIETZMANN (2005) Cilomilast, tacrolimus and rapamycin modulate dendritic cell function in the elication phase of allergic contact dermatitis. Br. J. Dermatol. 153, 136-144 BECKER,D. und J.Knop (1992) Mechanism in allergic contact dermatitis. Exp. Dermatol. 2, 63-69 103 Literaturverzeichnis BOISLEVE,F., S.KERDINE-ROMER, N.ROUGIER-LARZAT und M.PALLARDY (2004) Nickel and DNCB induce CCR7 expression on human dendritic cells through different signalling pathways: role of TNF-alpha and MAPK. J. Invest. Dermatol. 123, 494-502 BOISLEVE,F., S.KERDINE-ROMER und M.PALLARDY (2005) Implication of the MAPK pathways in the maturation of human dendritic cells induced by nickel and TNF-alpha. Toxicology 206, 233-244 CARMOUCHE,J.J., J.E.PUZAS, X.ZHANG, P.TIYAPATANAPUTI, D.A.CORYSLECHTA, R.GELEIN, M.ZUSCIK, R.N.ROSIER, B.F.BOYCE, R.J.O'KEEFE und E.M.SCHWARZ (2005) Lead exposure inhibits fracture healing and is associated with increased chondrogenesis, delay in cartilage mineralization, and a decrease in osteoprogenitor frequency. Environ. Health Perspect. 113, 749-755 CARTER,L.L. und R.W.DUTON (1996) Type 1 and type 2: a fundamental dichotomy for all T cell subsets. Curr. Opin. Immunol. 8, 336-342 CAUX,C., S.AIT-YAHIA, K.CHEMIN, O.DE BOUTEILLER, M.C.DIEU-NOSJEAN, B.HOMEY, C.MASSACRIER, B.VANBERVLIET, A.ZLOTNIK und A.VICARI (2000) Dendritic cell biology and regulation of dendritic cell trafficking by chemokines. Springer Semin. Immunopathol. 22, 345-369 104 Literaturverzeichnis COUTANT,K.D., A.B.DE FRAISSINETTE, A.CORDIER und P.ULRICH (1999) Modulation of the activity of human monocyte-derived dendritic cells by chemical haptens, a metal allergen, and a staphylococcal superantigen. Toxicol.Sci. 52, 189-198 CUMBERBATCH,M., K.CLELLAND, R.J.DEARMAN und I.KIMBER (2005) Impact of cutaneous Il-10 resident epidermal Langerhans´ cells and the development of polarized immune response. The Journal of Immunolgy 175, 43-50 DEARMAN, R.J., D.A.BASKETTER UND I.KIMBER (1996) Characterization of chemical allergens as a function of divergent cytokine secretion profiles induced in mice. Toxicol. Appl. Pharmacol. 138, 308-316 DEARMAN, R.J., E.V.WARBRICK, R.A.SKINNER und I.KIMBER (2002) Cytokine fingerprinting of chemical allergens: species comparisons and statistical analyses. Food and Chemical Toxicology 40, 1881-1892 DEARMAN,R.J., N.HUMPHREYS, R.A.SKINNER und I.KIMBER (2005) Allergen-induced cytokine phenotypes in mice: role of CD4+ and CD8+ T cell populations. Clin. Exp. Allergy 35, 498-505 DE SMEDT,A.C., R.L.VAN DEN HEUVEL, B.N.ZWI und G.E.SCHOETERS (2001) Modulation of phenotype, cytokine production and stimulatory function of CD34+derived DC by NiCl(2) and SDS. Toxicol.In Vitro 15, 319-325 105 Literaturverzeichnis DUGAN,A.L., S.SCHWEMBERGER, G.F.BABCOCK, D.BUCKLEY, A.R.BUCKLEY, C.K.OGLE und N.D.HORSEMAN (2004) Effects of prolactin level on burn-induced aberrations in myelopoiesis. Shock 21, 151-159 EHLING,G. M.HECHT und A.HEUSENER (2005) An European inter-laboratory validation of alternative endpoints of the murine local lymph node assay: First round. Toxicology 212, 60-68 ENK,A.H. und S.I.KATZ (1992) Early molecular events in the induction phase of contact sensitivity. Proc. Natl. Acad. Sci. U.S.A 89, 1398-1402 FAITH,R.E., M.I.LUSTER und C.A.KIMMEL (1979) Effect of chronic developmental lead exposure on cell-mediated immune functions. Clin. Exp. Immunol. 35, 413-420 FORSTER,R., A.SCHUBEL, D.BREITFELD, E.KREMMER, I.RENNER-MULLER, E.WOLF und M.LIPP (1999) CCR7 coordinates the primary immune response by establishing functional microenvironments in secondary lymphoid organs. Cell 99, 23-33 FUCHIBE,K., T.NABE, M.FUJII, N.MIZUTANI, K.DANNO, A.KODA und S.KOHNO (2003) Delayed type allergic itch-associated response induced by toluene-2,4-diisocyanate in hairless mice. J. Pharmacol. Sci. 93, 47-54 106 Literaturverzeichnis GUTZMER,R., M.LISEWSKI, J.ZWIRNER, S.MOMMERT, C.DIESEL, M.WITTMANN, A.KAPP und T.WERFEL (2004) Human monocyte-derived dendritic cells are chemoattracted to C3a after upregulation of the C3a receptor with interferons. Immunology 111, 435-443 HAPKE, H.-J. (1988) Toxikologie für Veterinärmediziner 3.Auflage Enke Verlag Stuttgart HOPKINS, J.E., D.J.NAISBITT, N.R.KITTERINGHAM, R.J.DEARMAN, I.KIMBER und B.K.PARK (2004) Selective haptenation of cellular or extracellular protein by chemical allergens: association with cytokine polarization. Chem. Res. Toxicol. 18, 375-381 INABA,K., M.INABA, N.ROMANI, H.AYA, M.DEGUCHI, S.IKEHARA, S.MURAMATSU und R.M.STEINMAN (1992) Generation of large numbers of dendritic cells from mouse bone marrow cultures supplemented with granulocyte/macrophage colony-stimulating factor. J. Exp. Med. 176, 1693-1702 JANEWAY, C.A. und P.TRAVERS (1997) Immunologie 2. Auflage Spektrum Akademischer Verlag 107 Literaturverzeichnis KAPSENBERG,M.L., E.A.WIERENGA, F.E.STIEKEMA, A.M.TIGGELMANN und J.D.BOS (1992) Th1 lymphokine production profiles of nickel-specific CD4+-T-lymphocytes clones from nickel contact allergic and non-allergic individuals. J. Invest. Dermatol. 98, 59-63 KIMBER,I., M.D.STONARD, D.A.GIDLOW und Z.NIEWOLA (1986) Influence of chronic low-level exposure to lead on plasma immunoglobulin concentration and cellular immune function in man. Int. Arch. Occup. Environ. Health 57, 117-125 KOWOLENKO,M., L.TRACY und D.LAWRENCE (1991) Early effects of lead on bone marrow cell responsiveness in mice challenged with Listeria monocytogenes. Fundam. Appl. Toxicol. 17, 75-82 KRASTEVA,M., J.KEHREN, M.-T.DUCLUZEAU, M.SAYAG, M.CACCIAPUOTI, H.AKIBA, J.DESCOTES und J.-F.NICOLAS (1999) Contact dermatitis. Eur. J. Dermatol. 1, 65-77 KROCOVA,Z., A.MACELA, M.KROCA und L.HERNYCHOVA (2000) The immunomodulatory effect(s) of lead and cadmium on the cells of immune system in vitro. Toxicol. In Vitro 14, 33-40 LANGENKAMP,A., M.MESSI, A.LANZAVECCHIA und F.SALLUSTO (2000) Kinetics of dendritic cell activation: impact on priming of TH1, TH2 and nonpolarized T cells. Nature Immunology 4, 311-316 108 Literaturverzeichnis LANZAVECCHIA,A. und F.SALLUSTO (2000) Dynamics of T lymphocyte responses: intermediates, effectors, and memory cells. Science 290, 92-97 LEBRE,M.C., T.BURWELL, P.L.VIEIRA, J.LORA, A.J.COYLE, M.L.KAPSENBERG, B.E.CLAUSEN und E.C.DE JONG (2005) Differential expression of inflammatory chemokines by Th1- and Th2-cell promoting dendritic cells: a role for different mature dendritic cell populations in attracting appropriate effector cells to peripheral sites of inflammation. Immunol. Cell Biol. 83, 525-535 LUSTER, M.I., R.E.FAITH und C.A. KIMMEL (1978) Depression of humoral immunity in rats following chronic developmental lead exposure. J. Environ. Pathol. Toxicol. 1, 397-402 LUTZ,M.B., N.KUKUTSCH, A.L.OGILVIE, S.ROSSNER, F.KOCH, N.ROMANI und G.SCHULER (1999) An advanced culture method for generating large quantities of highly pure dendritic cells from mouse bone marrow. J. Immunol. Methods 223, 77-92 LUTZ,M.B. und G.SCHULER (2002) Immature, semi-mature and fully mature dendritic cells: which signals induce tolerance or immunity? Trends Immunol. 23, 445-449 MANOME,H., S.AIBA und H.TAGAMI (1999) Simple chemicals can induce maturation and apoptosis of dendritic cells. Immunology 98, 481-490 109 Literaturverzeichnis MARQURDT, H. und S.SCHÄFER (2004) Lehrbuch der Toxikologie 2.Auflage Wissenschaftliche Verlagsgesellschaft mbH Stuttgart MCCOLL,S.R. (2002) Chemokines and dendritic cells: a crucial alliance. Immunol. Cell Biol. 80, 489-496 MULLER,S., K.E.GILLERT, C.KRAUSE, U.GROSS, J.L.AGE-STEHR und T.DIAMANTSTEIN (1977) Suppression of delayed type hypersensitivity of mice by lead. Experientia 33, 667-668 NAIRN, R. (2004) Immunology For Medical Students. 2. Auflage, Mosby NAKAHARA,T., Y.MOROI, H.UCHI und M.FURUE (2006) Differential role of MAPK signaling in human dendritic cell maturation and Th1/Th2 engagement. J. Dermatol. Sci. 42, 1-11 NASORRI,F., S.SEBASTIANI, V.MARIANI, O.DE PITA, P.PUDDU, G.GIROLOMONI und A.CAVANI (2002) Activation of nickel-specific CD4+ T lymphocytes in the absence of professional antigen-presenting cells. J. Invest. Dermatol. 118, 172-179 110 Literaturverzeichnis ORTNER,U., K.INABA, F.KOCH, M.HEINE, M.MIWA, G.SCHULER und N.ROMANI (1996) An improved isolation method for murine migratory cutaneous dendritic cells. Journal of Immunological Methods 193, 71-79 RIEMANN,H., T.SCHWARZ und S.GRABBE (2003) [Pathomechanisms of the elicitation phase of allergic contact dermatitis]. J. Dtsch. Dermatol. Ges. 1, 613-619 RIOL-BLANCO,L., N.SANCHEZ-SANCHEZ, A.TORRES, A.TEJEDOR, S.NARUMIYA, A.L.CORBI, P.SANCHEZ-MATEOS und J.L.RODRIGUEZFERNANDEZ (2005) The chemokine receptor CCR7 activates in dendritic cells two signaling modules that independently regulate chemotaxis and migratory speed. J. Immunol. 174, 4070-4080 RITTER,U., F.WIEDE, D.MIELENZ, Z.KIAFARD, J.ZWIRNER und H.KORNER (2004) Analysis of the CCR7 expression on murine bone marrow-derived and spleen dendritic cells. J. Leukoc. Biol. 76, 472-476 RYAN,C.A., G.F.GERBERICK, L.A.GILDEA, B.C.HULETTE, C.J.BETTS, M.CUMBERBATCH, R.J.DEARMAN und I.KIMBER (2005) Interactions of contact allergens with dendritic cells: opportunities and challenges for the development of novel approaches to hazard assessment. Toxicol.Sci. 88, 4-11 111 Literaturverzeichnis RÖMPP Chemielexikon (1996-1999) 10.Auflage Georg Thieme Verlag, Stuttgart SALLUSTO, F. und A.LANZAVECCHIA (1994) Efficient presentation of soluble antigen by cultured human dendritic cells is maintained by granulocyte/macrophage colony-stimulating factor plus interleukin 4 and downregulated by tumor necrosis factor alpha. J. Exp. Med. 179, 1109-1118 SHI,S, A.BLUMENTHAL, C.M.HICKEY, S.GANDOTRA, D.LEVY und S.EHRT (2005) Expression of many immunologically important genes in M.tuberculosis-infected macrophages is independent of both TLR2 and TLR4 but dependent on IFN-αβ receptor and STAT. The Journal of Immunology 175, 3318-3328 SHORTMAN,K. und Y.J.LIU (2002) Mouse and human dendritic cell subtypes. Nat. Rev. Immunol. 2, 151-161 SIXT,M., N.KANAZAWA, M.SELG, T.SAMSON, G.ROOS, D.P.REINHARDT, R.PABST, M.B.LUTZ und L.SOROKIN (2005) The conduit system transports soluble antigens from the afferent lymph to resident dendritic cells in the T cell area of the lymph node. Immunity 22, 19-29 SMITH,K.L. und D.A.LAWRENCE (1988) Immunomodulation of in vitro antigen presentation by cations. Toxicol. Appl. Pharmacol. 96, 476-484 112 Literaturverzeichnis SPIEKSTRA,S.W., M.J.TOEBAK, S.SAMPAT-SARDJOEPERSAD, P.J.VAN BEEK, D.M.BOORSMA, T.J.STOOF,B.M.VON BLOMBERG, R.J.SCHEPER, D.P.BRUYNZEEL, T.RUSTEMEYER und S.GIBBS (2005) Induction of cytokine (interleukin-1-alpha and tumor necrosis factor-alpha) and chemokine (CCL20, CCL27 and CXCL) alarm signals after allergen and irritant exposure. Exp. Dermatol. 14, 109-116 STEINMAN,R.M., G.KAPLAN, M.D.WITMER und Z.A.COHN (1973) Identification of a novel cell type in peripheral lymphoid organs of mice. V. Purification of spleen dendritic cells, new surface markers, and maintenance in vitro. J. Exp. Med. 149, 1-16 STEINMAN,R.M., D.HAWIGER und M.C.NUSSENZWEIG (2003a) Tolerogenic dendritic cells. Annu. Rev. Immunol. 21, 685-711 STEINMAN,R.M. (2003b) Some interfaces of dendritic cell biology. APMIS 111, 675-697 TOMINAGA, M., S.KOHNO, K.TANAKA und K.OHATA (1985) Studies on toluene-diisocyanate (TDI)-induced delayed type hypersensitivity. Jpn. J. Pharmacol. 39, 163-171 113 Literaturverzeichnis VANBERVLIET,B., B.HOMEY, I.DURAND, C.MASSACRIER, S.AIT-YAHIA, O.DE BOUTEILLER, A.VICARI und C.CAUX (2002) Sequential involvement of CCR2 and CCR6 ligands for immature dendritic cell recruitment: possible role at inflamed epithelial surfaces. Eur. J. Immunol. 32, 231-242 VERHEYEN, G.R., E.SCHOETERS, J.-M.NUIJTEN, R.L.v.d.HEUVEL, I.NELISSEN, H.WITTERS, V.v.TENDELOO, Z.N.BERNEMANN und G.E.R.SCHOETERS (2004) Cytokine transcript profiling in CD34+-progenitor derived dendritic cells exposed to contact allergens and irritants. Toxicology Letters 155, 187-194 VITAL,A.L., M.GONCALO, M.T.CRUZ, A.FIGUEIREDO, C.B.DUARTE und L.M.CELESTE (2004) The sensitizers nickel sulfate and 2,4-dinitrofluorobenzene increase CD40 and IL-12 receptor expression in a fetal skin dendritic cell line. Biosci. Rep. 24, 191-202 WALLET,M.A., P.SEN und R.TISCH (2005) Immunoregulation of dendritic cells. Clin. Med. Res. 3, 166-175 WU,W., J.M.SAMET, A.J.GHIO und R.B.DEVLIN (2001) Activation of the EGF receptor signaling pathway in airway epithelial cells exposed to Utah Valley PM. Am. J. Physiol. Lung Cell Mol. Physiol. 281, L483-L489 ZELIKOFF,J.T. und P.T.THOMAS (1998) Immunotoxicology of Environmental and occupational Metals Taylor and Francis Ltd 1998, London 114 Anhang 9 Anhang Tab. 9-1 Vitalität DC MTT-Test (90 min. Inkubation) von zuvor mit Blei bzw. Mangan stimulierten DC (mit bzw. ohne LPS-Stimulation), Angaben in Optischer Dichte (OD), der Versuch wurde dreimal durchgeführt, n=4 bzw. 6; Blei (1,10 und 100 µmol/l) mit LPS-Stimulation A Versuch 1 Kontrolle LPS Pb1 µmol/l Pb10 µmol/l Pb100 µmol/l 1,466 1,356 1,431 1,208 1,471 1,389 1,356 1,329 1,228 1,471 1,561 1,325 1,316 1,273 1,406 1,343 1,364 1,291 1,439 1,351 Kontrolle LPS Pb1 µmol/l Pb10 µmol/l Pb100 µmol/l 0,617 0,614 0,556 0,541 0,572 0,745 0,687 0,583 0,608 0,583 0,725 0,647 0,609 0,567 0,59 0,685 0,688 0,58 0,531 0,59 Kontrolle LPS Pb1 µmol/l Pb10 µmol/l Pb100 µmol/l 0,459 0,481 0,327 0,379 0,461 0,374 0,407 0,323 0,364 0,453 0,373 0,415 0,326 0,363 0,453 0,376 0,407 0,328 0,37 0,458 0,387 0,413 0,333 0,368 0,453 0,381 0,405 0,549 0,362 0,448 B Versuch 2 C Versuch 3 115 Anhang Blei (1, 10 und 100 µmol/l) ohne LPS-Stimulation D Versuch 1 Kontrolle Pb1 µmol/l Pb10 µmol/l Pb100 µmol/l 0,663 0,725 0,751 0,963 0,606 0,704 0,725 0,993 0,766 0,642 0,683 0,637 0,61 0,701 0,9 0,733 0,805 0,511 0,743 0,7 0,651 0,612 0,646 0,606 Kontrolle Pb1 µmol/l Pb10 µmol/l Pb100 µmol/l 0,617 0,842 0,925 0,958 0,745 0,885 1,002 1,099 0,725 0,836 1,042 1,0559 0,685 0,81 1,054 1,044 Kontrolle Pb1 µmol/l Pb10 µmol/l Pb100 µmol/l 0,485 0,662 0,6 0,603 0,528 0,62 0,625 0,576 0,563 0,58 0,617 0,531 0,492 0,529 0,31 0,453 E Versuch 2 F Versuch 3 116 Anhang Mangan (1,10 und 100µmol/l) mit LPS-Stimulation G Versuch 1 Kontrolle LPS 1,466 1,356 1,389 Mn1 µmol/l Mn10 µmol/l Mn100 µmol/l 1,184 1,489 1,287 1,365 1,17 1,474 1,255 1,561 1,325 1,19 1,43 1,212 1,343 1,364 1,39 1,381 1,31 Mn10 µmol/l Mn100 µmol/l H Versuch 2 Kontrolle LPS Mn1 µmol/l 0,617 0,614 0,551 0,542 0,494 0,745 0,687 0,579 0,573 0,5 0,725 0,647 0,572 0,559 0,489 0,685 0,688 0,543 0,578 0,504 Mn10 µmol/l Mn100 µmol/l I Versuch 3 Kontrolle LPS Mn1 µmol/l 0,533 0,273 0,131 0,116 0,177 0,538 0,304 0,129 0,111 0,173 0,508 0,284 0,144 0,111 0,188 0,449 0,278 0,137 0,114 0,182 117 Anhang Mangan (1, 10 und 100 µmol/l) ohne LPS-Stimulation J Versuch 1 Kontrolle Mn1 µmol/l Mn10 µmol/l Mn100 µmol/l 1,466 1,265 1,35 1,245 1,389 1,285 1,33 1,25 1,561 1,254 1,366 1,292 1,343 1,51 1,318 1,32 Mn10 µmol/l Mn100 µmol/l K Versuch 2 Kontrolle Mn1 µmol/l 0,617 0,901 0,862 0,723 0,745 0,89 0,871 0,771 0,725 0,983 0,887 0,778 0,685 0,881 0,889 0,787 Mn10 µmol/l Mn100 µmol/l L Versuch 3 Kontrolle Mn1 µmol/l 0,485 0,468 0,483 0,433 0,528 0,509 0,456 0,435 0,563 0,034 0,45 0,427 0,492 0,037 0,458 0,422 118 Anhang Tab. 9-2 Vitalität T-Zellen (TZ) Messung mit dem MTT-Test, Angaben in Optischer Dichte (OD), der Versuch wurde dreimal durchgeführt, n= 3 bzw. 6; Blei (1,10 und 100 µmol/l) A Versuch 1 Kontrolle Kontrolle Pb1 Pb 1 Pb10 Pb10 Pb100 Pb100 75.000 150.000 µmol/l µmol/l µmol/l µmol/l µmol/l µmol/l T-Zellen T-Zellen 75.000TZ 150.000TZ 75.000TZ 150.000TZ 75.000TZ 150.000TZ 0,233 0,297 0,272 0,317 0,293 0,345 0,333 0,313 0,226 0,299 0,256 0,297 0,249 0,319 0,278 0,329 0,254 0,305 0,259 0,321 0,262 0,334 0,278 0,343 0,226 0,289 0,256 0,330 0,263 0,315 0,289 0,311 0,243 0,317 0,269 0,318 0,276 0,324 0,290 0,339 0,224 0,305 0,260 0,301 0,250 0,316 0,307 0,316 B Versuch 2 Kontrolle Kontrolle Pb1 Pb 1 Pb10 Pb10 Pb100 Pb100 75.000 150.000 µmol/l µmol/l µmol/l µmol/l µmol/l µmol/l T-Zellen T-Zellen 75.000TZ 150.000TZ 75.000TZ 150.000TZ 75.000TZ 150.000TZ 0,361 0,445 0,435 0,627 0,37 0,39 0,69 0,6 0,367 0,649 0,432 0,466 0,348 0,485 0,486 0,456 0,418 0,54 0,429 0,578 0,441 0,379 0,619 0,56 0,421 0,464 0,497 0,63 0,391 0,51 0,479 0,563 0,421 0,593 0,446 0,6 0,44 0,624 0,41 0,812 0,378 0,581 0,434 0,56 0,386 0,6 0,485 0,681 119 Anhang C Versuch 3 Kontrolle Kontrolle Pb1 Pb 1 Pb10 Pb10 Pb100 Pb100 75.000 150.000 µmol/l µmol/l µmol/l µmol/l µmol/l µmol/l T-Zellen T-Zellen 75.000TZ 150.000TZ 75.000TZ 150.000TZ 75.000TZ 150.000TZ 0,356 0,421 0,338 0,369 0,551 0,569 0,66 0,724 0,348 0,389 0,393 0,375 0,559 0,581 0,635 0,704 0,344 0,442 0,41 0,39 0,578 0,59 0,629 0,689 0,386 0,395 0,409 0,385 0,572 0,586 0,636 0,685 0,348 0,434 0,355 0,372 0,594 0,607 0,635 0,694 0,357 0,355 0,312 0,332 0,571 0,54 0,61 0,612 Mangan (1,10 und 100 µmol/l) D Versuch 1 Mn1 Mn1 Mn10 Mn10 Mn100 Mn100 µmol/l µmol/l µmol/l µmol/l µmol/l µmol/l 75.000TZ 150.000TZ 75.000TZ 150.000TZ 75.000TZ 150.000TZ 0,515 0,305 0,444 0,352 0,475 0,296 0,38 0,488 0,513 0,452 0,672 0,426 0,63 0,308 0,39 0,421 0,050 0,383 0,615 0,446 0,55 0,313 0,366 0,429 0,569 0,439 0,514 0,387 0,562 0,31 0,338 0,371 0,646 0,497 0,613 0,381 0,63 0,305 0,436 0,376 0,609 0,413 0,612 0,426 0,51 0,314 0,41 Kontrolle Kontrolle Mn1µmol/l Mn1µmol/l Mn10µmol/l Mn10µmol/l Mn100µmol/l Mn100µmol/l 100.000TZ 200.000TZ 100.000TZ 200.000TZ 100.000TZ 200.000TZ 100.000TZ 200.000TZ 0,208 0,283 0,261 0,259 0,336 0,327 0,238 0,297 0,174 0,22 0,215 0,201 0,2 0,253 0,191 0,237 0,177 0,207 0,195 0,199 0,204 0,292 0,19 0,495 Kontrolle Kontrolle 75.000TZ 150.000TZ 0,266 E Versuch 2 120 Anhang F Versuch 3 Kontrolle Kontrolle Mn1 Mn1 Mn10 Mn10 Mn100 Mn100 100.000 200.000 µmol/l µmol/l µmol/l µmol/l µmol/l µmol/l T-Zellen T-Zellen 100.000TZ 200.000TZ 100.000TZ 200.000TZ 100.000TZ 200.000TZ 0,176 0,187 0,22 0,225 0,176 0,185 0,211 0,195 0,176 0,162 0,201 0,19 0,197 0,163 0,194 0,205 0,161 0,166 0,217 0,225 0,175 0,167 0,183 0,165 Tab. 9-3 Proliferation T-Zellen Messung nach Zugabe von Blei und 5 µg/ml PHA für drei Tage, 18 Stunden vor Ende Zugabe von ³H-Thymidin (10µl), Angaben des ³H-Thymidin-Einbaus in (cpm); Blei (1,10 und 100 µmol/l) A Versuch 1 Kontrolle Pb1 µmol/l Pb10 µmol/l Pb100 µmol/l 4557 3679 3762 4131 4188 4369 5183 1337 2778 7059 4089 2548 2211 8183 4967 1827 5003 4694 2843 2505 4822 2368 1653 1434 121 Anhang B Versuch 2 Kontrolle Pb1 µmol/l Pb10 µmol/l Pb100 µmol/l 107 73 68 99 181 159 104 430 93 130 241 647 154 96 155 580 144 155 144 575 143 233 139 308 Kontrolle Pb1 µmol/l Pb10 µmol/l Pb100 µmol/l 142 137 236 144 139 174 168 303 102 96 254 341 119 118 193 219 233 229 228 113 186 136 156 397 C Versuch 3 Mangan 1, 10 und 100 µmol/l D Versuch 1 Kontrolle Mn1 µmol/l Mn10 µmol/l Mn100 µmol/l 7078 3710 4077 3092 4716 7060 4122 2037 7021 5344 5256 3651 8050 6129 3167 3091 5523 3530 4722 2160 7807 4054 3090 2114 122 Anhang E Versuch 2 Kontrolle Mn 1 µmol/l Mn 10 µmol/l Mn 100 µmol/l 51 158 241 204 168 238 144 187 118 216 334 189 79 199 481 150 169 298 375 115 124 240 226 41 Kontrolle Mn 1 µmol/l Mn 10 µmol/l Mn 100 µmol/l 483 181 899 15 452 287 906 67 604 230 818 20 925 285 589 22 430 203 481 44 635 223 777 19 F Versuch 3 123 Anhang Tab. 9-4 TNF-α Messung mit Hilfe eines kommerziellen ELISAs nach Inkubation der DC mit Blei bzw. Mangan über 48 h und LPS-Stimulation nach der Hälfte dieser Zeit. Blei (1, 10 und 100 µmol/l) mit LPS-Stimulation A Versuch 1 TNF-α (pg/ml) Kontrolle LPS Pb1 µmol/l +LPS Pb 10 µmol/l Pb 100 µmol/l +LPS +LPS 35,2903338 580,708123 653,006962 569,942454 528,87055 74,5950961 607,866333 622,644354 509,292677 535,305995 21,3856553 549,627253 569,942454 507,642245 530,483559 105,043661 754,978998 898,227643 619,705788 824,397633 0 870,1552 807,104477 836,602513 778,146014 38,698529 825,623565 650,152903 681,135405 730,012351 B Versuch 2 TNF-α (pg/ml) Kontrolle LPS Pb1 µmol/l +LPS Pb 10 µmol/l Pb 100 µmol/l +LPS +LPS 615,384615 3692,30769 3730,76923 442,307692 3673,07692 403,846154 3403,84615 3769,23077 365,384615 3769,23077 2865,38462 3711,53846 3673,07692 307,692308 3365,38462 326,923077 3269,23077 3230,76923 307,692308 3288,46154 C Versuch 3 TNF-α (OD) Kontrolle LPS Pb1 µmol/l +LPS Pb 10 µmol/l Pb 100 µmol/l +LPS +LPS 0,301 0,91 0,893 0,711 1,039 0,274 0,893 0,841 0,971 0,993 0,271 0,969 0,907 0,823 1,01 0,258 0,957 0,9 0,934 0,899 124 Anhang Blei (1, 10 und 100 µmol/l) ohne LPS-Stimulation D Versuch 1 TNF-α (pg/ml) Kontrolle Pb1 µmol/l Pb 10 µmol/l Pb 100 µmol/l 65 57,5 55 82,5 67,5 82,5 85 77,5 95 90 105 105 145 97,5 187,5 72,5 E Versuch 2 TNF-α (OD) Kontrolle Pb1 µmol/l Pb 10 µmol/l Pb 100 µmol/l 0,317 0,195 0,25 0,26 0,236 0,194 0,251 0,256 0,238 0,172 0,264 0,176 0,222 0,178 0,305 0,2 Mangan (1,10 und 100 µmol/l) mit LPS-Stimulation F Versuch 1 TNF-α (pg/ml) Kontrolle LPS Mn 1 µmol/l +LPS Mn 10 µmol/l Mn 100 µmol/l +LPS +LPS 35,29 580,70 565,29 420,929793 501,010474 74,59 607,86 628,496436 377,826145 433,609025 21,38 549,62 591,357556 497,676331 413,596422 105,04 754,97 686,67418 668,568753 549,627253 0 870,15 752,376277 864,228668 546,463367 38 825,62 851,091927 683,908312 601,894438 125 Anhang G Versuch 2 TNF-α (pg/ml) Kontrolle LPS Mn 1 µmol/l Mn 10 µmol/l +LPS Mn 100 µmol/l +LPS +LPS 153,767921 1622,43156 435,994143 903,26354 1210,53013 171,266969 1504,21859 582,350179 1223,60411 1114,02779 75 1600 752,5 612,5 1397,5 292,5 1835 842,5 855 1510 H Versuch 3 TNF-α (OD) Kontrolle LPS Mn 1 µmol/l Mn 10 µmol/l +LPS Mn 100 µmol/l +LPS +LPS 0,317 0,918 0,703 0,949 0,806 0,236 0,966 0,775 0,908 0,819 0,238 1,008 0,734 0,85 0,817 0,222 0,899 0,77 0,861 0,832 Mangan (1, 10 und 100 µmol/l) ohne LPS-Stimulation I Versuch 1 TNF-α (pg/ml) Kontrolle Mn1 µmol/l Mn10 µmol/l Mn100 µmol/l 65 87,5 77,5 115 67,5 207,5 120 372,5 95 305 145 365 145 345 145 352,5 126 Anhang J Versuch 2 TNF-α (pg/ml) Kontrolle Mn1 µmol/l Mn10 µmol/l Mn100 µmol/l 22,22 211,11 33,33 200,00 44,44 211,11 0 511,11 977,78 288,89 0 611,11 200,00 411,11 22,22 433,33 K Versuch 3 TNF-α (OD) Kontrolle Mn1 µmol/l Mn10 µmol/l Mn100 µmol/l 0,317 0,216 0,207 0,185 0,236 0,191 0,19 0,183 0,238 0,177 0,18 0,182 0,222 0,211 0,189 0,243 Tab. 9.5 Migrationsassay Anzahl ausgewanderter DC/ml nach 90 Minuten, Inkubation mit Blei (1, 10 und 100 µmol/l) für 48h, LPS-Stimulation nach 24 h, dieser Versuch wurde dreimal durchgeführt, n=4 bzw. 5; A Versuch 1 Kontrolle LPS Pb 1 µmol/l Pb 10 µmol/l Pb 100 µmol/l +LPS +LPS +LPS 1500 2250 3000 10500 27750 3750 6000 1500 7500 27750 3750 4500 1500 14250 22500 3750 3750 1500 14250 21000 127 Anhang B Versuch 2 (50.000DC/200 µl) Kontrolle LPS Pb 1 µmol/l Pb 10 µmol/l Pb 100 µmol/l +LPS +LPS +LPS 1500 2250 3000 4500 4500 2250 0 0 6000 4500 1500 1500 3000 4500 9000 1500 0 3750 6000 9000 LPS Pb 1 µmol/l Pb 10 µmol/l Pb 100 µmol/l +LPS +LPS +LPS C Versuch 3 Kontrolle 5250 11250 15750 30000 28500 5250 34500 15000 25500 41250 6750 22500 24750 15000 36000 6000 10500 24000 17250 28500 Anzahl ausgewanderter DC/ml nach 90 Minuten, Inkubation mit Mangan (1, 10 und 100 µmol/l) für 48h, LPS-Stimulation nach 24 h, dieser Versuch wurde dreimal durchgeführt, n=3; D Versuch 1 Kontrolle LPS Mn 1 µmol/l Mn 10 µmol/l Mn 100 µmol/l +LPS +LPS +LPS 6000 3750 6750 9750 10500 4500 11250 5250 7500 14250 3750 5250 8250 6750 12000 128 Anhang E Versuch 2 Kontrolle LPS Mn 1 µmol/l Mn 10 µmol/l Mn 100 µmol/l +LPS +LPS +LPS 12000 8250 13500 7500 21750 11250 1200 6750 15750 15000 15000 4500 14250 11250 27750 LPS Mn 1 µmol/l Mn 10 µmol/l Mn 100 µmol/l +LPS +LPS +LPS F Versuch 3 Kontrolle 6000 19500 11250 19500 13500 3750 20250 4500 16500 16500 2250 12750 12000 6750 21750 Tab. 9-6 FACS-Analyse (tabellarisch) dendritischer Zellen Untersuchung der DC auf Expression unterschiedlicher Oberflächenmoleküle (CD11c, CD80, CD86 und CCR7) nach Blei- und Mangan- bzw. LPS-Stimulation; % % % % CD11c/CD80 CD11c/CD86 CCR7 CCR7 Kontrolle 7,34 5,1 2,64 2,64 LPS 27,12 34,3 5,82 2 Blei 1 µmol/l -- 14,6 Blei 10 µmol/l -- 7,3 Blei 100 µmol/l 9,02 4,3 6,18 5,02 Mangan100µmol/l 129 Anhang Tab. 9.-7 Mixed Leukocyte Reaction ³H-Thymidineinbau (cpm) in T-Zellen nach allogener Stimulation durch DC und Inkubation mit Schwermetallen für fünf Tage; Blei (1 (a), 10 (b) und 100 (c) µmol/l) A Versuch 1 a) Anzahl DC / 100.000 T-Zellen 625 1250 2500 5000 10000 595 3787 3592 5883 3819 5427 920 6097 3597 5353 6002 7679 628 3021 3621 3847 8595 6430 361 4090 2889 6011 6451 4591 430 5226 1855 2300 3728 8215 1836 5099 4005 7683 4121 7066 Pb 1 µmol/l ³H-Thymidin (cpm) Kontrolle 312 629 4986 8113 13221 8649 23389 3304 6062 3765 10460 4948 13897 2701 7104 3429 9283 6128 16476 3313 9257 5804 13131 4961 16889 6483 6337 7577 5131 7607 12995 2632 4186 4254 6894 9474 18529 b) Anzahl DC / 100.000 T-Zellen 625 1250 2500 5000 10000 577 2263 3072 4743 6798 10546 1462 3244 3767 9614 6292 8422 1617 4188 2244 6611 7681 6672 1396 8491 3919 4379 7100 6128 901 3026 3848 6094 7370 7283 1705 Pb 10 µmol/l ³H-Thymidin (cpm) Kontrolle 312 3493 2599 6766 6555 9297 1974 9062 8611 12981 10797 12567 5395 5732 11134 18885 9689 10859 3220 6197 7410 10127 7658 12820 8294 3856 5342 15674 12694 11249 6652 62925 9670 9201 7943 17025 3732 9616 9939 15873 14749 23151 130 Anhang c) Anzahl DC / 100.000 T-Zellen 625 1250 2500 5000 10000 8847 2735 7381 4633 8936 237 4865 3485 6244 5576 8179 553 6423 2894 6408 7699 6466 1173 5097 4172 5478 9596 10210 1515 5918 5512 6094 5920 10787 1887 5866 2806 6385 4619 11704 Pb 100 µmol/l ³H-Thymidin (cpm) Kontrolle 312 887 1244 8522 8210 10328 10345 14431 4354 3472 9350 15193 11211 20394 9098 5844 6754 13907 10831 15064 4392 3515 8736 13774 9279 18445 8162 12848 11183 11473 11179 10345 2812 5401 6613 17946 13371 18158 B Versuch 2 a) Anzahl DC / 100.000 T-Zellen Kontrolle 625 620 1250 2500 5000 3594 646 4361 3529 7715 21898 4998 971 1893 10247 20800 10874 9438 3027 4116 14438 10000 2400 Pb1 µmol/l ³H-Thymidin (cpm) 312 4660 21483 6266 9817 14393 21341 2509 2007 4552 15451 11347 44748 2441 2407 4052 10242 25245 32288 4703 2802 1703 19096 16098 34577 1505 2237 1387 3949 4786 35890 b) Anzahl DC / 100.000 T-Zellen Kontrolle Pb10 µmol/l ³H-Thymidin (cpm) 312 625 1250 2500 5000 10000 700 2210 2274 4972 12516 22768 812 6165 1361 7023 21976 27417 834 1338 3727 5773 11585 18617 962 1563 9546 1854 7267 6532 22786 10752 3172 40611 26972 58864 9035 8979 16485 15933 22820 39245 3509 13869 2660 9399 35231 40510 3477 4870 4505 7206 39664 58828 131 Anhang c) Anzahl DC / 100.000 T-Zellen Kontrolle 625 1250 2500 5000 10000 806 2098 21743 15262 15991 308 4539 6861 12630 19432 30824 775 3080 6740 20647 17567 13465 381 1442 3359 14442 18169 19174 Pb100 µmol/l ³H-Thymidin (cpm) 312 400 3848 3364 6412 13451 11417 48625 3741 7144 6472 25963 23071 42334 3812 5349 7420 12836 11292 44412 2009 6161 1269 4789 17511 31469 C Versuch 3 a) Anzahl DC / 100.000 T-Zellen Kontrolle 625 1250 2500 5000 10000 2044 3248 6896 6948 11138 4169 1832 12368 4317 14186 6739 7098 618 2439 7759 13054 4343 4412 2468 1443 Pb1 µmol/l ³H-Thymidin (cpm) 312 17170 8179 8895 4301 3357 4686 3604 7642 8703 18401 2684 3989 7993 12453 11289 16198 2829 7881 8265 9785 6694 9942 1984 7305 2867 8532 14149 15677 b) Anzahl DC / 100.000 T-Zellen Kontrolle 625 1250 2500 5000 10000 2345 1886 3649 6988 13146 9081 1017 4126 9860 5655 9270 5890 3458 3305 5395 12105 6995 7428 798 Pb10 µmol/l ³H-Thymidin (cpm) 312 3046 10655 11895 8789 4505 8466 6170 8564 22928 23973 5853 2619 3557 3485 13436 13168 20895 1985 5370 7757 16844 7905 18793 2085 4445 1988 13556 8063 17172 132 Anhang c) Anzahl DC / 100.000 T-Zellen Kontrolle 625 1250 2500 5000 10000 4693 5969 12200 2678 11464 1608 1885 6909 16986 5521 6932 1205 3664 2952 16267 8247 6678 861 1458 4014 11442 8326 5073 Pb100 µmol/l ³H-Thymidin (cpm) 312 2339 10411 7365 4347 41013 24199 45407 18982 17019 15301 30242 24060 34591 22574 5325 27036 31217 20472 31340 5938 6463 21747 10322 11368 19790 Mangan (1 (a),10 (b) und 100 (c) µmol/l) D Versuch 1 a) Anzahl DC / 100.000 T-Zellen 312 625 Kontrolle 1250 1636 2500 2933 5000 5724 10000 11822 14531 960 2073 6305 4359 15049 20266 1179 3359 3578 5012 10302 12149 980 2319 Mn1 µmol/ ³H-Thymidin (cpm) 1892 5443 9751 10589 9973 7608 9901 6477 15673 16172 20270 4628 13260 6008 15788 9122 17136 7610 9546 3458 12024 5247 24166 4256 10447 4289 11250 11883 26076 b) Anzahl DC / 100.000 T-Zellen Kontrolle Mn10 µmol/l ³H-Thymidin (cpm) 312 625 1250 335 1168 832 778 657 3374 909 1344 4437 2500 1796 5000 10000 6792 12154 15329 3200 13284 10433 8423 7251 8012 7336 5906 7841 6300 17228 1759 584 2822 4476 5528 24486 2513 2018 2024 4545 3689 13588 2042 1295 2326 3170 1218 15791 2684 2871 3678 7532 2508 31665 133 Anhang c) Anzahl DC / 100.000 T-Zellen Kontrolle 625 1250 2500 5000 10000 1138 2472 12147 12060 14167 826 1524 2387 6170 10188 11410 1201 3000 4538 11583 11335 11244 691 1854 4042 10303 12003 13313 Mn100 µmol/l ³H-Thymidin (cpm) 312 202 6264 1718 3576 9429 7657 14517 2658 3922 7192 4842 3560 11488 6793 2001 4260 9293 12702 18943 3907 11625 6752 9931 8913 26068 Tab. 9-8 CCL2 Messung mit Hilfe eines kommerziellen ELISAs aus den Überständen der MLR am Tag 14 der Zellkultur; Blei 100 µmol/l A Versuch 1 (Präinkubation) Kontrolle Kontrolle Kontrolle Pb 100 µmol/l Pb 100 µmol/l Pb 100 µmol/l 312DC/100.000TZ 2.500DC/100.000TZ 10.000DC/100.000TZ 312DC/100.000TZ 2.500DC/100.000TZ 10.000DC/100.000TZ 5,38 26,53 112,05 5,38 8,54 105,29 5,68 15,39 81,63 5,07 25,05 40,15 134 Anhang B Versuch 2 (Co- und Präinkubation) Kontrolle Kontrolle Kontrolle CO Pb100 µmol/l CO Pb100 µmol/l CO Pb100 µmol/l 312DC/100.000TZ 2.500DC/100.000TZ 10.000DC/100.000TZ 312DC/100.000TZ 2.500DC/100.000TZ 10.000DC/100.000TZ 18,6829268 76,9756098 99,4146341 23,0731707 23,3170732 48,195122 30,3902439 54,5365854 89,1707317 15,5121951 31,6097561 53,804878 34,5365854 58,9268293 111,609756 9,41463415 12,3414634 70,6341463 32,5853659 65,2682927 109,902439 25,5121951 27,2195122 69,902439 PRÄ Pb100 µmol/l PRÄ Pb100 µmol/l PRÄ Pb100 µmol/l 2 312DC/100.000TZ .500DC/100.000TZ 10.000DC/100.000TZ 11,6097561 33,804878 90,3902439 9,17073171 25,5121951 69,4146341 9,65853659 35,5121951 50,8780488 10,8780488 19,6585366 43,0731707 C Versuch 3 (Co- und Präinkubation) Kontrolle Kontrolle Kontrolle CO Pb100 µmol/l CO Pb100 µmol/l CO Pb100 µmol/l 312DC/100.000TZ 2.500DC/100.000TZ 10.000DC/100.000TZ 312DC/100.000TZ 2.500DC/100.000TZ 10.000DC/100.000TZ 21.2962963 113.240741 261.759259 38.0555556 32.5 137.777778 29.6296296 82.037037 249.814815 32.962963 20.9259259 138.888889 21.2962963 60.7407407 238.981481 33.5185185 16.9444444 131.574074 16.4814815 40.2777778 195.833333 16.9444444 12.6851852 161.759259 PRÄ Pb100 µmol/l PRÄ Pb100 µmol/l PRÄ Pb100 µmol/l 312DC/100.000TZ 2.500DC/100.000TZ 10.000DC/100.000TZ 8.33333333 66.1111111 80.8333333 8.24074074 77.7777778 65 4.25925926 48.4259259 34.1666667 5.74074074 48.9814815 40.2777778 135 Anhang Tab. 9-9 TNF-α aus Überständen der MLR Messung mittels ELISA am fünften Tag der Kultur, n=4; Kontrolle Kontrolle Kontrolle Kontrolle Kontrolle Kontrolle 312 DC 625 DC 1.250 DC 2.500 DC 5.000 DC 10.000 DC 0,067 0,07 0,067 0,066 0,067 0,066 0,092 0,086 0,068 0,074 0,069 0,067 0,071 0,071 0,068 0,068 0,065 0,07 0,073 0,073 0,07 0,07 0,074 0,073 Pb 100 µmol/l Pb 100 µmol/l Pb 100 µmol/l Pb 100 µmol/l Pb 100 µmol/l Pb 100 µmol/l 312 DC 625 DC 1.250 DC 2.500 DC 5.000 DC 10.000 DC 0,066 0,079 0,065 0,068 0,064 0,068 0,07 0,069 0,067 0,067 0,068 0,071 0,066 0,242 0,071 0,068 0,065 0,069 0,09 0,075 0,066 0,071 0,064 0,075 136 Anhang In-vivo-Ergebnisse Tab.9-10 Bleiwerte im Vollblut Bestimmung des Bleigehaltes im Vollblut der Balb/c-Mäuse nach Verabreichung von Bleiacetat über das Trinkwasser für 7-8 Wochen; die Werte beziehen sich auf eine Sammelblutprobe je Gruppe a´ 6Tiere. µg/dl Blei im Vollblut Kontrolle 2 TDI 1 TDI + 0,126 g/l 28,4 TDI + 1,265 g/l 86,4 DNCB 2,1 DNCB + 0,126 g/l 27,2 DNCB + 1,265 g/l 60,6 Tab. 9- 11 a) Migrationsassay und b) Ohrdickenmessung, sowie c) Gewicht und d) Zellzahl der regionalen Lymphknoten (Lnn.) (Kontrolle/TDI / DNCB (n=6)) a) Migrationsassay b)Ohrdicke (Zellen/ml) (µm) MW STABW KO 3500 707,106781 0 6,64580068 TDI 3750 1724,81883 62,5 25,2487623 TDI 0,126 g/l 4583,33333 1393,437 65 32,7108545 TDI 1,265 g/l 5583,33333 2498,33278 102,5 18,0969611 DNCB 5375 1376,13589 6,25 1,60468065 DNCB 0,126 g/l 5892,85714 3659,62527 4,41666667 0,91742393 DNCB 1,265 g/l 6150 6653,47653 5,83333333 0,87559504 137 MW STABW Anhang c) Gewicht Lnn. (mg) d) Zellzahl Lnn. (pro ml) MW STABW MW STABW KO 2,25 0,39051248 1.540.000 351.096,497 TDI 5,93333333 0,98775841 4.541.250 2.017.685,4 TDI 0,126 g/l 5,01666667 0,78655366 6.641.250 1.519.309,67 TDI 1,265 g/l 5,18333333 0,7540999 5.921.666,67 831.695,056 DNCB 2,51183333 0,94763266 2.51183333 0.94763266 DNCB 0,126 g/l 2,49791667 0,55334984 2.49791667 0.55334984 DNCB 1,265 g/l 2,53208333 0,61637533 2.53208333 0.61637533 Tab. 9-12 CD11c/CD40-positive Zellen der regionalen Lymphknoten Analyse der Lymphknotenzellen im Durchflußzytometer, n=6 TDI + TDI + DNCB + DNCB + 0,126 g/l 1,265 g/l 0,126 g/l 1,265 g/l 466537,5 245025 197120 147465 41625 33187,5 40425 168990 245025 141817,5 77212,5 38880 31065 8745 150285 159417,5 159280 63900 63602,5 57427,5 -- 116790 150727,5 362230 93150 38250 55315 -- 117990 541695 128535 13428 20520 64410 -- 163200 296780 113382,5 39600 32625 53077,5 Kontrolle TDI 14850 138 DNCB Anhang Tab. 9-13 Zellkultur TDI und DNCB, erneute TDI-/DNBS- Zugabe und Thymidinmarkierung) ³H-Thymidin-Einbaurate durch Lymphknotenzellen nach erneuter Zugabe von TDI bzw. DNBS, n=6 ³H-Thymidin (cpm) KO 233.333333 TDI 564.055556 TDI 0,126 g/l 363.527778 TDI 1,265 g/l 556.5 KO 676,666667 DNCB 342,466667 DNCB 0,126 g/l 298,333333 DNCB 1,265 g/l 389 Tab. 9-14 IL4-Produktion (Ohrhomogenat) Mit Hilfe eines ELISAs ist die Menge an IL-4 im Ohrhomogenat gemessen worden, n=6; IL-4 (pg/mg) KO 65.6481481 TDI 177.654321 TDI 0,126 g/l 121.975309 TDI 1,265 g/l 200.37037 DNCB 93.2098765 DNCB 0,126 g/l 74.6296296 DNCB 1,265 g/l 69.7530864 139 Anhang Tab. 9-15 Zellkulturüberstände Die aus den Lymphknoten gewonnenen Zellen sind in einer Zellkultur erneut mit TDI bzw. DNBS (DNCB-Analogon) inkubiert und die Überstände vor der Thymidinmarkierung gewonnen worden. Aus diesen Überständen ist der Gehalt an IL-4, IL-1β und IFN-γ bestimmt worden, n=6; A IL-4 aus der TDI-behandelten Zellkultur TDI + TDI + 0,126 g/l 1,265 g/l 0.081 0.080 0.075 0.081 0.079 0.077 0.074 0.074 0.077 0.077 0.077 0.075 0.078 0.079 0.075 0.075 0.081 0.082 0.079 0.075 0.079 0.076 0.081 Kontrolle TDI 0.078 B IL-1β aus der TDI-behandelten Zellkultur TDI + TDI + 0,126 g/l 1,265 g/l 0,0668 0,097 0,104 0,098 0,071 0,067 0,069 0,116 0,138 0,075 0,068 0,078 0,070 0,066 0,066 0,074 0,073 0,085 0,068 0,067 0,086 0,080 0,073 Kontrolle TDI 0,067 140 Anhang C IFN-γ aus der DNBS-behandelten Zellkultur DNCB + DNCB+ 0,126 g/l 1,265 g/l 0,069 0,063 0,054 0,113 0,069 0,064 0,056 0,067 0,066 0,061 0,055 0,061 0,076 0,062 0,060 0,063 0,067 0,068 0,057 0,062 0,066 0,063 0,061 Kontrolle DNCB 0,062 141 Anhang 142 Hiermit erkläre ich, dass ich die Dissertation „Untersuchung zur Beeinflussung der Funktion dendritischer Zellen durch Schwermetalle“ selbständig verfasst habe. Bei der Anfertigung wurden folgende Hilfen Dritter in Anspruch genommen: Frau S.Schild, Fraunhofer-Gesellschaft Hannover. Ich habe keine entgeltliche Hilfe von Vermittlungs- bzw. Beratungsdiensten (Promotionsberater oder andere Personen) in Anspruch genommen. Niemand hat von mir unmittelbar oder mittelbar entgeltlich Leistungen für Arbeiten erhalten, die im Zusammenhang mit dem Inhalt der vorgelegten Dissertation stehen. Ich habe die Dissertation am folgenden Institut angefertigt: Institut für Pharmakologie, Toxikologie und Pharmazie der Stiftung Tierärztliche Hochschule Hannover Bünteweg 17, 30559 Hannover. Die Dissertation wurde bisher nicht für eine Prüfung oder eine Promotion oder für einen ähnlichen Zweck zur Beurteilung eingereicht. Ich versichere, dass ich die vorstehenden Angaben nach bestem Wissen vollständig und der Wahrheit entsprechend gemacht habe. 143 Danksagung An erster Stelle bedanke ich mich recht herzlich bei Herrn Prof. Dr. Manfred Kietzmann, zum einen für die Überlassung des interessanten Themas sowie die stets freundliche Unterstützung bei der Anfertigung dieser Arbeit. Zum anderen aber auch für die abwechslungsreichen Unternehmungen und Konversationen innerhalb seiner Arbeitsgruppe. Ganz herzlich gedankt sei Herrn Dr. Wolfgang Bäumer, der mir jederzeit bei kleineren oder auch größeren toxikologischen Problemen mit Rat und Tat zur Seite stand. Durch seine hervorragende und humorvolle Betreuung war es immer wieder ein Vergnügen, die Arbeit im Labor aufzunehmen. In diesem Zusammenhang sei auch den immer hilfsbereiten Mitarbeitern des Labors - Viktoria, Jana, Caro, Grazyna und Hans-Herbert – für die freundliche und meist auch kulinarische Unterstützung gedankt. Dem Fraunhofer Institut, allem voran Sabine Schild, und der Vogelklinik, hier Dunja Koball, der TiHo Hannover danke ich für die Auswertung der MLR bzw. Blutproben. Bei Tina Basler und Herrn Dr. Goethe aus dem Institut für Mikrobiologie möchte ich mich herzlich für die Unterstützung bei der Durchführung der Westernblots bedanken. Meinen Mitdoktoranden Barbara, Julia, Anke, Jessica, Nat und Steffi sowie Frank, Wolle und Braunie danke ich für eine abwechslungsreiche und lustige Zeit im Institut. Der Kleintierpraxis Dr. Volker Stock danke ich dafür, dass sie es möglich gemacht haben, Doktorarbeit und Praxis unter einen Hut zu bekommen und auch für kurzfristig geplante Urlaubstage für die Doktorarbeit Verständnis zu haben. 144 Zum Schluß sei besonders meinen lieben Eltern, meiner Familie und Boris gedankt, dass sie mir in all der Zeit stets Rückhalt und Unterstützung gegeben haben. 145