09 Die chemische Reaktion
Werbung

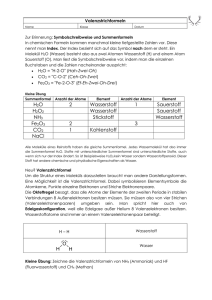
Jahrgangsstufe 09 Die chemische Reaktion Datum: (Musterlösung) zu Aufgabe 1: chemische Reaktionen: - Eisen rostet an feuchter Luft - Kerze brennt ab physikalische Vorgänge: - Schmelzen von Eisen - Gefrieren von Wasser bei 0°C - Gas wird durch hohen Druck verflüssigt - Zucker löst sich in heißem Wasser zu Aufgabe 2: a) Bei der Verteilung des Parfüm-Duftes handelt es sich um einen physikalischen Vorgang der als Diffusion bezeichnet wird. Der Grund für Diffusion ist in der Braun’schen Molekularbewegung der Gasteilchen der Luft zu finden. Treibende Kraft für die Diffusion ist ein Konzentrationsunterschied. b) Bei der Reaktion von Wasserstoff mit Sauerstoff spricht man von der so genannten Knallgasprobe, bei der Wasser entsteht. Die Knallgasprobe dient zum Nachweis von elementarem Wasserstoff (2H2 + O2 ? 2H2O). zu Aufgabe 3: a) Wie schon aus Aufgabe 2b hervorgeht ist die Knallgasprobe ein geeigneter Nachweis für elementaren Wasserstoff. In organischen Verbindungen kann man den Wasserstoff nur indirekt nachweisen. Dazu muss die Verbindung verbrannt werden und die entstehenden Gase aufgefangen werden. Enthält die Substanz Wasserstoff, so entsteht Wasser, welches mit Hilfe von farblosem Kaliumsulfat nachgewiesen werden kann. Zeigt das Kupfersulfat eine Blaufärbung, so ist dies ein Hinweis auf Wasser in der organischen Verbindung. b) Kohlenstoffdioxid kann mit Hilfe von Kalkwasser nachgewiesen werden. Trübt sich das Wasser, so deutet dies auf die Bildung von Calciumcarbonat hin und es handelt sich bei dem Gas um Kohlenstoffdioxid: CO2 + H2O ? H2CO3; H2CO3 + 2 H2O? 2H3O+ + CO32-; CO32- + Ca2+ ? CaCO 3) zu Aufgabe 4: Wird Calcium in Wasser gegeben, so ist die Entwicklung eines farblosen und geruchlosen Gases zu beobachten, welches eine positive Knallgasprobe zeigt. In Anwesenheit des Indikators Phenolphtalein ist außerdem eine rosa-Färbung der Lösung zu beobachten. Ca + 2H2O ? Ca(OH) 2 + H2 Der Indikator ist im basischen Bereich rosa gefärbt. Aufgrund der entstehenden HydroxidIonen färbt sich somit die Lösung rosa. zu Aufgabe 5: Schwefel reagiert zusammen mit Sauerstoff zu Schwefeldioxid. S + O2 ? SO2 zu Aufgabe 6: a) C + O2 ? CO2 b) Man erhält 24g Kohlenstoffdioxid bei der Reaktion. c) Gesetz der Erhaltung der Masse. zu Aufgabe 7: Die Waage zeigt beim zweiten Wiegen eine höhere Masse an. Das heißt die Eisenwolle ist schwerer geworden. Grund dafür ist, dass man nun neben dem Eisen auch noch Sauerstoff mit wiegt der bei der chemischen Reaktion an das Eisen gebunden worden ist: 4Fe + 3O 2 ? 2Fe2O3 bei Fragen wenden Sie sich bitte an: [email protected] Quelle: www.chempage.de